ZusammensetzungWirkstoffe
C1-Esterase-Inhibitor aus Humanplasma.
Hilfsstoffe
Glycin, Natriumchlorid und Natriumcitrat (entspricht ≤0,8 mmol oder ≤19 mg Natrium).
Lösungsmittel: Aqua ad iniect.: 4 ml.
Indikationen/AnwendungsmöglichkeitenRoutineprävention akuter Schübe bei hereditärem Angioödem (HAE) bei jugendlichen und erwachsenen Patienten.
Dosierung/AnwendungBerinert SC ist zur Selbstanwendung durch subkutane Injektion bestimmt. Der Patient oder eine Pflegeperson sollten eine entsprechende Einweisung in die Anwendung von Berinert SC erhalten.
Übliche Dosierung
Die empfohlene Dosis Berinert SC beträgt 60 I.E. pro kg Körpergewicht (KG) zweimal wöchentlich (alle 3-4 Tage).
Um die Rückverfolgbarkeit von Arzneimitteln biologischen Ursprungs sicherzustellen, wird empfohlen Handelsname und Chargennummer bei jeder Behandlung zu dokumentieren.
Kinder und Jugendliche
Kinder
Keine Daten vorhanden.
Jugendliche (ab 12 Jahre)
Die Dosierung bei Jugendlichen ist die gleiche wie bei Erwachsenen.
Art der Anwendung
Ausschliesslich subkutane Injektion.
Als Injektionsstelle für Berinert SC wird der Bauchbereich vorgeschlagen. In den klinischen Studien wurde die Berinert SC-Injektion an einer einzigen Stelle verabreicht.
Die fertig zubereitete Lösung sollte durch subkutane Injektion mit einer für den Patienten verträglichen Geschwindigkeit injiziert werden.
Das Produkt sollte mit der mitgelieferten subkutanen Nadel und dem subkutanen Injektionsset verabreicht werden.
Selbstbehandlung (subkutane Anwendung)
Bei einer häuslichen Behandlung sind insbesondere die Risiken einer Überempfindlichkeitsreaktion zu beachten. Die Entscheidung hinsichtlich einer häuslichen Behandlung ist in jedem Einzelfall vom behandelnden Arzt zu treffen. Der Arzt sollte sicherstellen, dass eine entsprechende Unterweisung erfolgt und die richtige Anwendung regelmässig überprüft wird.
Der Patient ist vom Arzt in der sicheren Anwendung von Berinert SC zu instruieren. Sobald er die Selbstbehandlung erlernt hat, soll er der Anleitung unter «Hinweise für die Handhabung» folgen.
KontraindikationenPatienten, bei denen es zu lebensbedrohlichen Überempfindlichkeitsreaktionen, einschliesslich Anaphylaxie, auf C1-Esterase-Inhibitor-Präparate oder auf einen der Hilfsstoffe gekommen ist.
Warnhinweise und VorsichtsmassnahmenÜberempfindlichkeitsreaktionen
Wenn schwere allergische Reaktionen auftreten, muss die Behandlung mit Berinert SC sofort abgesetzt werden (d.h. keine weiteren Injektionen), und eine entsprechende medizinische Behandlung muss eingeleitet werden.
Im Falle eines akuten hereditären Angioödem (HAE) Schubs ist eine individuelle Behandlung einzuleiten.
Berinert SC 2000 I.E. enthält weniger als 1 mmol (23 mg) Natrium pro Flasche, das heisst, es ist nahezu «natriumfrei».
Thromboembolische Ereignisse (TEEs)
Bei der empfohlenen subkutanen Dosis konnte kein kausaler Zusammenhang zwischen thromboembolischen Ereignissen und der Anwendung von C1-Esterase-Inhibitor-Konzentrat hergestellt werden.
Eine Thrombose trat in Therapieversuchen mit hochdosierter Gabe von C1-Esterase-Inhibitor i. v. zur Prophylaxe oder zur Behandlung des Kapillarleck Syndroms vor, während oder nach einer Herzoperation unter extrakorporaler Zirkulation auf (nicht zugelassene Indikation und Dosierung).
Virale Sicherheit
Zu den Standardmassnahmen zur Vermeidung von Infektionen infolge der Anwendung von aus menschlichem Blut oder Plasma hergestellten Arzneimitteln zählen die Auswahl der Spender, die Überprüfung des jeweils gespendeten Materials und der Plasmapools auf spezifische Infektionsmarker sowie die Umsetzung effektiver Produktionsschritte zur Inaktivierung / Entfernung von Viren. Trotz dieser Massnahmen kann bei der Anwendung von Arzneimitteln, die aus menschlichem Blut oder Plasma hergestellt wurden, die Möglichkeit der Übertragung von Infektionserregern nicht vollständig ausgeschlossen werden. Dies gilt auch für unbekannte oder neu auftretende Viren und andere Pathogene.
Die getroffenen Massnahmen werden als wirksam gegen umhüllte Viren wie das Humane Immundefizienz-Virus (HIV), das Hepatitis-B-Virus (HBV) und das Hepatitis-C-Virus (HCV) sowie gegen nicht umhüllte Viren wie das Hepatitis A-Virus (HAV) und das Parvovirus B19 betrachtet.
Bei Patienten, die regelmässig / wiederholt humane Plasmaderivate erhalten, wird ein angemessener Hepatitis-Impfschutz (Hepatitis A und B) empfohlen.
InteraktionenEs wurden keine Interaktionsstudien durchgeführt.
Schwangerschaft, StillzeitSchwangerschaft
Es liegen nur begrenzte Daten vor, aus denen sich kein Hinweis auf ein erhöhtes Risiko bei der Anwendung von allgemeinen C1-Inhibitor-Produkten bei schwangeren Frauen ergibt. C1-Inhibitor ist ein physiologischer Bestandteil von menschlichem Plasma. Es wurden keine tierexperimentellen Studien zur Fertilitäts- und Entwicklungstoxizität mit Berinert SC durchgeführt. Beim Menschen sind keine unerwünschten Wirkungen auf die Fertilität, die prä- und postnatale Entwicklung zu erwarten. Berinert SC sollte nur dann bei Schwangeren angewendet werden, wenn eine klare Indikation dafür vorliegt.
In drei Studien mit insgesamt 344 Patienten wurden Daten von 36 Frauen (50 Schwangerschaften) erfasst. Es waren keine unerwünschten Wirkungen mit der-C1-Inhibitor-Behandlung vor, während oder nach der Schwangerschaft assoziiert und die Frauen brachten gesunde Babys zur Welt.
Stillzeit
Es liegen keine Information über die Ausscheidung von Berinert SC in die Muttermilch, die Auswirkungen auf gestillte Säuglinge und die Auswirkungen auf die Milchproduktion vor. Der Nutzen bezüglich Entwicklung und Gesundheit des Stillens sollte zusammen mit der klinischen Notwendigkeit für Berinert SC und potenziellen unerwünschten Ereignissen von Berinert SC auf den gestillten Säugling bzw. von der zugrundeliegenden mütterlichen Erkrankung in Betracht gezogen werden.
Fertilität
C1-Inhibitor ist ein physiologischer Bestandteil von menschlichem Plasma. Es wurden keine tierexperimentellen Studien zur Fertilität mit Berinert SC durchgeführt.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenBerinert SC hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Unerwünschte WirkungenUnerwünschte Wirkungen wurden im Rahmen der Placebo-kontrollierten Zulassungstudie 3001 bei Patienten (n = 86) mit hereditärem Angioödem (HAE) erfasst, die Berinert SC subkutan erhielten. Geeignete Patienten konnten zudem an der offenen Verlängerungsstudie 3002 für bis zu 140 Wochen (n = 126) teilnehmen. Die Häufigkeit der Nebenwirkungen basiert auf den Ereignissen, die im Zusammenhang mit der Gabe von Berinert SC auftraten. Sie wird pro Patient geschätzt und wie folgt kategorisiert:
Sehr häufig: ≥1/10;
häufig: ≥1/100 und < 1/10;
gelegentlich: ≥1/1000 und < 1/100;
selten: ≥1/10'000 und < 1/1000;
sehr selten: < 1/10'000.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort:
Sehr häufig: Reaktionen an der Injektionsstelle a (31 %).
Infektionen und parasitäre Erkrankungen:
Sehr häufig: Nasopharyngitis (11 %).
Erkrankungen des Immunsystems:
Häufig: Überempfindlichkeit (Überempfindlichkeit, Juckreiz, Hautausschlag und Urtikaria).
Erkrankungen des Nervensystems:
Häufig: Schwindelgefühl.
a Bluterguss, Kältegefühl, Flüssigkeitsaustritt, Erythem, Hämatom, Blutung, Induration, Ödem, Schmerzen, Juckreiz, Hautausschlag, Reaktion, Narbe, Schwellung, Urtikaria, Wärmegefühl an der Einstichstelle.
Für Informationen zum Infektionsrisiko s. auch „Warnhinweise und Vorsichtsmassnahmen“.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Berinert SC wurden in einer Untergruppe mit 11 Patienten im Alter von 8 bis <17 Jahren sowohl in einer randomisierten, doppelblinden, placebokontrollierten Crossover-Studie zur Routineprophylaxe (Studie 3001) als auch in einer offenen Verlängerungsstudie (Studie 3002) evaluiert. Die Ergebnisse der Subgruppenanalyse nach Alter entsprachen den Gesamtergebnissen der Studie.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungEs wurden keine Fälle von Überdosierung berichtet. In einer klinischen Studie mit konstanter Dosierung wurden bis zu 117 I.E./kg KG zweimal wöchentlich subkutan verabreicht und gut vertragen.
Eigenschaften/WirkungenATC-Code
B06AC01
Pharmakotherapeutische Gruppe: C1-Inhibitor, Plasmaderivat
Wirkungsmechanismus
C1-Esterase-Inhibitor ist ein Plasmaglykoprotein mit einem Molekulargewicht von 105 kD und einem Kohlenhydratanteil von 40 %. Seine Konzentration im menschlichen Plasma liegt bei ca. 240 mg/l. Neben dem menschlichen Plasma enthalten auch die Plazenta, die Leberzellen, die Monozyten und die Thrombozyten C1-Esterase-Inhibitor.
C1-Esterase-Inhibitor gehört zu dem Serin-Protease-Inhibitor-(Serpin) -System des menschlichen Plasmas wie z.B. auch Antithrombin III, Alpha-2-Antiplasmin, Alpha-1-Antitrypsin und andere Proteine.
Unter physiologischen Bedingungen blockiert C1-Esterase-Inhibitor den klassischen Signalweg der Komplementkaskade durch Inaktivierung der enzymatisch aktiven Komponente C1s und C1r. Die aktiven Enzyme bilden einen Komplex mit dem Inhibitor in einem Verhältnis von 1:1.
Darüber hinaus stellt C1-Esterase-Inhibitor den wichtigsten Inhibitor der Kontaktaktivierung der Blutgerinnung dar, indem er Faktor XIIa und seine Fragmente hemmt. Ferner dient er neben Alpha-2-Makroglobulin als Hauptinhibitor von Plasma Kallikrein.
Die therapeutische Wirkung von Berinert SC bei hereditärem Angioödem wird dadurch erzielt, dass die fehlende C1-Esterase-Inhibitor-Aktivität ersetzt wird.
Pharmakodynamik
Siehe Abschnitt Wirkungsmechanismus.
Klinische Wirksamkeit
Die Wirksamkeit, Sicherheit, Pharmakokinetik von und die Lebensqualität durch Berinert SC als Prophylaxebehandlung zur Vorbeugung akuter Schübe bei hereditärem Angioödem (HAE) wurde in zwei klinischen Studien der Phase III gezeigt. Bei der ersten Studie handelte es sich um eine multizentrische, randomisierte, doppelblinde, Placebo kontrollierte Crossover-Studie (COMPACT-Studie 3001). In der Studie wurden 90 erwachsene und jugendliche Patienten mit symptomatischem HAE Typ I oder Typ II untersucht. Das mediane Alter (Bereich) der Patienten betrug 40 (12 bis 72) Jahre; 60 Patienten waren weiblich und 30 männlich. Die Patienten wurden randomisiert und erhielten entweder 60 I.E./kg KG oder 40 I.E./kg KG Berinert SC subkutan in einer 16-wöchigen Behandlungsphase und Placebo in der anderen 16-wöchigen Behandlungsphase. Die Patienten verabreichten sich Berinert SC oder Placebo selbst 2 Mal pro Woche. Die Wirksamkeit wurde für 14 Wochen jeder Behandlungsphase beurteilt.
Geeignete Patienten konnten zudem bis zu 140 Wochen lang an einer offenen Verlängerungsstudie (Studie 3002) teilnehmen. Ungefähr die Hälfte der in die Verlängerungsstudie aufgenommenen Patienten nahm an Studie 3001 teil (64/126, 50,8 %), was zu den Ähnlichkeiten zwischen Studienpopulationen beigetragen hat.
Studie 3001:
Die subkutane Dosis von 60 I.E./kg KG bzw. 40 I.E./kg KG zweimal wöchentlich resultierte in einem signifikanten Unterschied in der zeitnormalisierten Anzahl von HAE-Schüben (Schubrate) im Vergleich zu Placebo (Tabelle 1). Die mittlere zeitnormalisierte Anzahl von HAE-Schüben bei Patienten mit einer Dosis von 60 I.E./kg KG betrug 0,5 Schübe pro Monat verglichen mit 4,0 Schüben pro Monat unter Placebo (p < 0,001). Die mittlere zeitnormalisierte Anzahl von HAE-Schüben bei Patienten mit einer Dosis von 40 I.E./kg KG betrug 1,2 Schübe pro Monat verglichen mit 3,6 Schüben pro Monat unter Placebo (p < 0,001).
Die maximale Anzahl von HAE-Schüben pro Monat betrug 3,1 unter 60 I.E./kg KG und 12,5 unter 40 I.E./kg KG.
Insgesamt waren 40,0 % der mit 60 I.E./kg KG behandelten Patienten und 37,8 % der mit 40 I.E./kg KG behandelten Patienten schubfrei, und die mediane Anzahl von HAE-Schüben pro Monat betrug 0,3 bei beiden Dosen.
Tabelle 1: Zeitnormalisierte Anzahl von HAE-Schüben (Anzahl/Monat)
|
|
60 I.E./kg KG
Behandlungssequenzen
(N = 45)
|
40 I.E./kg KG
Behandlungssequenzen
(N = 45)
| |
Berinert SC
|
Placebo
|
Berinert SC
|
Placebo
| |
n
|
43
|
42
|
43
|
44
| |
Mittelwert (SD)
|
0,5 (0,8)
|
4,0 (2,3)
|
1,2 (2,3)
|
3,6 (2,1)
| |
Min, Max
|
0,0; 3,1
|
0,6; 11,3
|
0,0; 12,5
|
0,0; 8,9
| |
Median
|
0,3
|
3,8
|
0,3
|
3,8
| |
LS Mittelwert (SE)*
|
0,5 (0,3)
|
4,0 (0, 3)
|
1,2 (0,3)
|
3,6 (0,3)
| |
95 % KI für LS Mittelwert*
|
(0,0; 1,0)
|
(3,5; 4,6)
|
(0,5; 1,9)
|
(3,0; 4,3)
| |
Behandlungsunterschied
(intraindividuell)
|
60 I.E./kg KG Berinert SC– Placebo
|
40 I.E./kg KG Berinert SC– Placebo
| |
LS Mittelwert* (95 % KI)
|
-3,5 (-4,2, -2,8)
|
-2,4 (-3,4, -1,5)
| |
p-Wert*
|
< 0,001
|
< 0,001
|
KI = Konfidenzintervall; HAE = hereditäres Angioödem; N = Anzahl der randomisierten Patienten; n = Anzahl der Patienten mit Daten; SD = Standardabweichung; LS = kleinste Quadrate; SE = Standardfehler.
* Aus einem gemischten Modell.
Der mediane (25., 75. Perzentil) prozentuale Rückgang der zeitnormalisierten Anzahl von HAE-Schüben im Vergleich zu Placebo betrug 95% (79; 100) bei 60 I.E./kg KG und 89 % (70; 100) bei 40 I.E./kg KG bei den Patienten mit auswertbaren Daten in beiden Behandlungsphasen
Der prozentuale Anteil von Patienten mit einer Abnahme von ≥50 % ≥70 % bzw. ≥90 % der zeitnormalisierten HAE-Schüben (sogenannte Responder) ist für jede Dosis Berinert SC in Tabelle 2 dargestellt.
Tabelle 2: Prozentualer Anteil der Patienten mit einer Abnahme der HAE-Schübe
|
|
Prozentualer Anteil der Patienten mit einer Abnahme von ≥50 %, ≥70 % bzw. ≥90 % der zeitnormalisierten HAE-Schübe unter Berinert SC im Vergleich zu Placebo
| |
|
≥50 %
|
≥70 %
|
≥90 %
| |
Responder (%)a
| |
60 I.E./kg KG (n=40)
|
90
|
83
|
58
| |
40 I.E./kg KG (n=42)
|
76
|
67
|
43
| |
≥40 I.E./kg KG (95 % KI) (n=82)
|
83 (73; 90)
|
74 (64; 83)
|
50 (39; 61)
|
a Die Prozentangaben basieren auf der Anzahl der in die Analyse aufgenommenen Patienten.
n=Anzahl der Patienten mit Daten; KI=Konfidenzintervall
Der Anteil von Patienten, die einen oder mehr HAE-Schübe pro 4-Wochen unter Placebo und weniger als einen HAE-Schub pro 4-Wochen unter Berinert SC hatten betrug 71,1 % bei einer Dosis von 60 I.E./kg KG und 53,3 % bei einer Dosis von 40 I.E./kg KG.
Berinert SC führte zu einem signifikanten Unterschied bei der zeitnormalisierten Anzahl der Anwendungen von Notfallmedikamenten im Vergleich zu Placebo. Unter der 60 I.E./kg KG-Dosis sind im Mittel0,32 Anwendungen von Notfallmedikamenten pro Monat im Vergleich zu 3,89 Anwendungen pro Monat unter Placebo erfolgt. Die 40 I.E./kg KG-Dosis führte im Mittel zu 1,13 Anwendungen von Notfallmedikamenten pro Monat im Vergleich zu 5,55 Anwendungen pro Monat unter Placebo.
Die Ergebnisse verschiedener Altersgruppen (12 bis < 17, 17 bis < 65 und ≥65 Jahre) waren im Einklang mit den Gesamtergebnissen der Studie.
Die Post-hoc-Analyse der explorativen Endpunkte zeigte, dass sich die Therapiezufriedenheit und die Lebensqualität unter Berinert SC im Vergleich zu Placebo verbesserte, wobei es signifikante Verbesserungen ab Studienbeginn im TSQM (Treatment Satisfaction Questionnaire for Medication) -Fragebogen, Bereich: Effektivität und Gesamtzufriedenheit, und im WPAI (Work Productivity and Activity Impairment) -Fragebogen, Bereich: Präsenz am Arbeitsplatz, Produktivitätsverlust und –beeinträchtigung gab.
Die Ergebnisse der von den Patienten berichteten Zielparameter zeigen, dass die routinemässige Prophylaxe mit subkutanem Berinert SC wirksam war, den Patienten mit HAE ermöglichte, aktiver und produktiver zu sein und die Gesamtzufriedenheit durch die Behandlung erhöhte. Berinert SC kann daher die Belastung durch HAE massgeblich reduzieren, wie in einer veröffentlichten Patientenumfrage gezeigt.
Studie 3002:
Bei der zweiten klinischen Studie der Phase III (COMPACT-Erweiterungsstudie) handelte es sich um eine multizentrische, randomisierte, offene Parallelgruppenstudie, die langfristige Wirksamkeits- und Sicherheitsdaten liefert (und die Behandlungsfortsetzung für Patienten ermöglichte, die die COMPACT-Studie abgeschlossen hatten). Die COMPACT-Erweiterungsstudie umfasste Patienten im Altersbereich von 8-72 Jahren (Median 41,0 Jahre) darunter 10 Patienten < 18 Jahren (3 davon < 12 Jahre) und 10 Patienten ≥65 Jahren. In der Studie wurden 126 Patienten mit symptomatischem HAE Typ I oder Typ II hinsichtlich Wirksamkeit, Sicherheit, PK und Lebensqualität untersucht; 76 Patienten waren weiblich und 50 männlich. Patienten mit einer monatlichen Rate von 4,3 Schüben in den 3 Monaten vor Eintritt in die Studie wurden aufgenommen und durchschnittlich 1,5 Jahre lang behandelt. Die Patienten wurden randomisiert und erhielten entweder 60 I.E./kg KG oder 40 I.E./kg KG Berinert SC subkutan für bis zu 140 Wochen. Patienten mit häufigen HAE-Schüben kamen für Dosissteigerungen in Frage.
91,7 % (95 % KI 81,9 %, 96,4 %) unter 60 I.E./kg und 93,5 % (95 % KI 84,6 %, 97,5 %) der Patienten unter 40 I.E./kg und hatten mindestens eine 50 %ige Reduktion der zeitnormalisierten HAE-Schübe gegenüber dem Referenzwert. Darüber hinaus hatten 85,7% unter 60 I.E./kg und 79,4% der Patienten unter 40 I.E./kg weniger als einen zeit-normalisierten HAE-Schub pro 4 Wochen.
PharmakokinetikDie pharmakokinetischen (PK) Eigenschaften von Berinert SC wurden hauptsächlich anhand von Populations-PK-Methoden aus gepoolten Daten aus 3 klinischen Studien (1001, 2001 und 3001) mit gesunden Teilnehmern und Patienten mit hereditärem Angioödem (HAE) abgeleitet. Dieses Populations-PK-Modell wurde auch zur Charakterisierung und Beurteilung der funktionellen C1-INH-Aktivität bei HAE-Patienten in Studie 3002 verwendet, welche über alle Studien hinweg und nach Verabreichung von sowohl 40 I.E./kg als auch 60 I.E. /kg ähnlich war.
Absorption
Bei zweimal wöchentlicher subkutaner Dosierung wird Berinert SC langsam resorbiert, mit einer medianen (95 % Konfidenzintervall, KI) Zeit bis zur maximalen Konzentration (tmax) von ca. 59 Stunden (23, 134 Std.). Die mittlere (95 % KI) relative Bioverfügbarkeit (F) von Berinert SC nach subkutaner Anwendung wurde auf ca. 43 % (35,2; 50,2 %) geschätzt.
Distribution
Basierend auf einer medianen (95 % KI) offensichtlichen Plasmahalbwertszeit von 69 Stunden (24, 250 Std.), wird der Steady State für C1-Esterase-Inhibitor innerhalb von 3 Wochen der Dosierung erwartet. Ein mittlerer (95 % KI) Steady-State-Talspiegel von funktionalem C1-Esterase-Inhibitor von 48 % (25,1; 102) wird nach Anwendung von 60 I.E./kg KG Berinert SC subkutan zweimal wöchentlich erwartet.
Das offensichtliche Distributionsvolumen von Berinert SC wurde auf 4,33 l (3,51; 5,15 l) geschätzt.
Die Steady State PK von Berinert SC subkutan zeigte sich bei HAE-Patienten als unabhängig von der Dosis zwischen 20–80 I.E./kg KG.
Metabolismus
Keine Daten vorhanden.
Elimination
Die mittlere (95 % KI) Clearance der Population wurde auf ca. ca. 83 ml/Std. (72,7; 94,2 ml/Std.) geschätzt. Die C1-Esterase-Inhibitor-Clearance korrelierte positiv mit dem Gesamtkörpergewicht.
Kinetik spezieller Patientengruppen
Zur Beurteilung der PK von C1-Esterase-Inhibitor in spezifischen nach Geschlecht, ethnischer Zugehörigkeit, Alter oder dem Vorliegen von Nieren- oder Leberschädigungen stratifizierten Patientenpopulationen wurden keine Studien durchgeführt. Die Populationsanalyse, die das Alter (8 bis 72 Jahre) beurteilte, zeigte keinen Einfluss auf die PK des C1-Esterase-Inhibitors.
Präklinische DatenBasierend auf konventionellen Studien zur Sicherheitspharmakologie, Toxizität bei Einzel- und Mehrfachdosierungen und zur lokalen Verträglichkeit weisen präklinische Daten auf kein besonderes Risiko für Menschen hin.
In-vivo-Thrombogenitätstests bei Kaninchen zeigen kein Thromboserisiko nach der intravenösen Anwendung von C1-Esterase-Inhibitor.
Es wurden keine Studien zur Karzinogenität und Reproduktionstoxizität durchgeführt.
Sonstige HinweiseInkompatibilitäten
Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Berinert SC darf nach Ablauf des auf der Packung und Behältnis angegebenen Verfalldatums nicht mehr angewendet werden.
Besondere Lagerungshinweise
Nicht über 30 °C lagern. Nicht einfrieren. Ausser Reichweite von Kindern aufbewahren!
Die Flasche in der geschlossenen Faltschachtel aufbewahren um den Inhalt vor Licht zu schützen! Haltbarkeit der verwendungsfertigen Zubereitung: siehe «Hinweise für die Handhabung».
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den lokalen Anforderungen zu entsorgen.
Hinweise für die Handhabung
Herstellung der Lösung:
Allgemeine Hinweise:
·Die rekonstituierte Lösung Berinert SC sollte farblos und klar bis leicht opalisierend sein.
·Die Rekonstitution ist in der Regel innerhalb von 5 Minuten abgeschlossen, kann aber bis zu 10 Minuten dauern.
·Das rekonstituierte Produkt sollte nach der Filtration/dem Aufziehen der Lösung in die Spritze (siehe unten) und vor der Anwendung auf Partikel und Verfärbungen visuell überprüft werden.
·Trübe Lösungen oder Lösungen mit Rückständen sind nicht zu verwenden.
·Die Rekonstitution und das Aufziehen der Spritze müssen unter aseptischen Bedingungen erfolgen.
Zubereitung:
Erwärmen Sie das Lösungsmittel und die Produktflasche auf Raumtemperatur. Vor dem Öffnen der Filter Transfer Set-Packung 20/20 (Mix2Vial™) die Flip-Off-Kappen der Lösungsmittel- und Produktflaschen entfernen und die Stopfen mit einer antiseptischen Lösung behandeln und anschliessend trocknen lassen.
|
|
1
|
1. Entfernen Sie das Deckpapier von der «Mix2Vial» Packung. Das Mix2Vial nicht aus dem Blister entnehmen!
| |
|
2
|
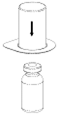
2. Die Lösungsmittelflasche auf eine ebene, saubere Fläche stellen und festhalten. Das «Mix2Vial» Set mit dem Blister greifen und die blaue Seite des Adapters voran senkrecht in den Stopfen der Lösungsmittelflasche einstechen.
| |
|
3
|
3. Vorsichtig die Verpackung vom «Mix2Vial» Set entfernen, indem man den Blister am Siegelrand fasst und ihn senkrecht nach oben abzieht. Dabei ist darauf zu achten, dass nur der Blister und nicht das «Mix2Vial» entfernt wird.
| |
|

4
|
4. Die Produktflasche auf eine ebene und feste Unterlage stellen. Die Lösungsmittelflasche mit dem aufgesetzten «Mix2Vial» Set herumdrehen und analog den Dorn der transparenten Seite senkrecht in den Stopfen der Produktflasche einstechen. Das Lösungsmittel läuft automatisch in die Produktflasche über.
| |
|

5
|
5. Mit der einen Hand die Produktseite und mit der anderen Hand die Lösungsmittelseite des «Mix2Vial» greifen und das Set vorsichtig im Gegenuhrzeigersinn auseinanderschrauben. Entsorgen Sie die Lösungsmittelflasche mit dem blauen «Mix2Vial» Adapter.
| |
|

6
|
6. Die Produktflasche mit dem transparenten Adapter vorsichtig schwenken, bis das Produkt vollständig gelöst ist (In der Regel innerhalb von 5 Minuten, kann aber bis zu 10 Minuten dauern). Nicht schütteln.
| |
|

7
|
7. Luft in eine leere, sterile Spritze aufziehen. Hierfür nur die der Packung beigefügte Spritze verwenden. Die Produktflasche aufrecht halten, die Spritze mit dem Luer Lock Anschluss des «Mix2Vial» Set im Uhrzeigersinn verbinden und die Luft in die Produktflasche injizieren.
|
Aufziehen der Lösung in die Spritze
|
|

8
|
8. Den Stempel der Spritze gedrückt halten, das gesamte System herumdrehen und die Lösung durch langsames Zurückziehen der Kolbenstange in die Spritze aufziehen.
| |
|

9
|
9. Nachdem die Lösung vollständig in die Spritze überführt ist, den Spritzenzylinder fassen (dabei die Kolbenstange in ihrer Position halten) und die Spritze vom transparenten «Mix2Vial»-Adapter im Gegenuhrzeigersinn abdrehen.
|
Instruktionen zur Selbstbehandlung mit Berinert SC:
|
Schritt 1: Zubehör zusammenstellen
Legen Sie alle benötigten Hilfsmittel für die subkutane Anwendung bereit:
·Subkutane Nadel oder subkutanes Injektionsset
·Sterile, silikonfreie Spritze (Benutzen Sie die beigepackte Einmalspritze)
·Alkoholtupfer
·Handschuhe (falls eine entsprechende Empfehlung Ihres Arztes vorliegt)
·Entsorgungsbehälter für gebrauchte Nadeln
·Behandlungstagebuch
|
| |
Schritt 2: Reinigen der Arbeitsfläche
·Desinfizieren Sie eine geeignete Arbeitsfläche mit Desinfektionstüchern.
|
| |
Schritt 3: Hände waschen
·Waschen und trocknen Sie sich gründlich Ihre Hände.
·Wenn Sie Handschuhe tragen sollen, um sich die Injektion zu verabreichen, dann ziehen Sie diese an.
|
| |
Schritt 4: Vorbereitung der Injektionsstelle
·Wählen Sie eine Stelle der Bauchhaut für die Injektion, ausser Sie haben eine Anweisung Ihres Arztes bekommen, in eine andere Region zu injizieren (Abbildung 1).
·Wählen Sie eine andere Stelle als bei der letzten Injektion; Sie sollten die Injektionsstellen wechseln.
·Neue Injektionsstellen sollten mindestens 5 cm von der letzten Injektionsstelle entfernt sein.
·Geben Sie sich niemals eine Injektion an eine Stelle, an der die Haut juckt, geschwollen, schmerzhaft, geprellt oder rot ist.
·Vermeiden Sie Injektionen an Stellen mit Narben oder Dehnungsstreifen.
·Reinigen Sie die Haut an der Injektionsstelle mit einem Alkoholtupfer und lassen Sie sie trocknen (Abbildung 2).
|
|
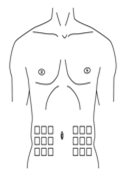
Abbildung 1
|
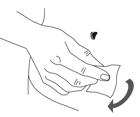
Abbildung 2
| |
Schritt 5: Injektionen unter die Bauchhaut
Wie von Ihrem Arzt instruiert:
·Stecken Sie die subkutane Nadel oder das subkutane Injektionsset (Butterfly) fest auf die Spritze auf.
Bereiten Sie die Nadel oder das Injektionsset wie benötigt gemäss den Anweisungen Ihres Arztes vor.
Injektion mit einer subkutanen Nadel:
·Stechen Sie die Nadel in eine Hautfalte (Abbildung 3).
|
|
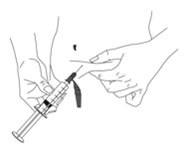
Abbildung 3
| |
Injektion mit einem subkutanen Injektionsset:
·Stechen Sie die Nadel in eine Hautfalte (Abbildung 4).
|
|
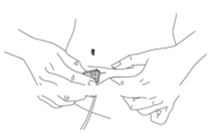
Abbildung 4
| |
Schritt 6: Aufräumen
·Nach der Injektion der benötigten Menge von Berinert SC entfernen Sie die Nadel.
·Nicht verwendete Lösung und das komplette Verabreichungsmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
|
| |
Schritt 7: Aufzeichnung der Behandlung
·Schreiben Sie bei jeder Anwendung von Berinert SC die Chargennummer des Etikettes der Berinert SC Flasche, mit dem Datum und der Zeit der Injektion in Ihr Behandlungstagebuch oder Ihr Protokollbuch.
|
|
Nach der Rekonstitution blieb die physikochemische Stabilität 48 Stunden bei Raumtemperatur (max. 30 °C) erhalten. Da Berinert SC kein Konservierungsmittel enthält, sollte das zubereitete Produkt aus mikrobiologischer Sicht sofort verwendet werden. Wenn es nicht sofort angewendet wird, darf es nicht länger als 8 Stunden bei Raumtemperatur aufbewahrt werden. Das gelöste Produkt darf nur in der Flasche aufbewahrt werden.
Zulassungsnummer67519 (Swissmedic)
PackungenBerinert SC 2000 (B)
1 Flasche mit Trockensubstanz (2000 I.E.)
1 Flasche mit 4 ml Wasser für Injektionszwecke
1 Filter Transfer Set 20/20
1 Verabreichungsset (beigepackter Zusatzkarton):
1 subkutane Nadel
1 subkutanes Injektionsset
2 Alkoholtupfer
1 nicht steriles Pflaster
1 Einmalspritze (5 ml)
ZulassungsinhaberinCSL Behring AG, Bern
Stand der InformationMai 2021
|













