ZusammensetzungWirkstoffe
Cannabidiol.
Hilfsstoffe
Ethanol (wasserfrei) 79 mg/ml.
Alkoholgehalt: 7,9% w/v entspricht 10% v/v wasserfreiem Alkohol.
Sesamöl (raffiniert) 736 mg/ml.
Benzylalkohol 0,0003 mg/ml.
Sucralose (E955).
Aromastoff (Erdbeergeschmack).
Indikationen/AnwendungsmöglichkeitenEpidyolex wird als Zusatztherapie bei Krampfanfällen, die bei Patienten ab 2 Jahren mit Lennox-Gastaut-Syndrom (LGS), Dravet-Syndrom (DS) oder der Tuberösen Sklerose (TSC) einhergehen, angewendet.
Dosierung/AnwendungBei LGS und DS
Therapieeinleitung
Die empfohlene Anfangsdosis von Epidyolex beträgt zweimal täglich 2,5 mg/kg (5 mg/kg/Tag) über eine Woche.
Erhaltungstherapie
Nach einer Woche sollte die Dosis auf eine Erhaltungsdosis von zweimal täglich 5 mg/kg (10 mg/kg/Tag) erhöht werden.
Je nach individuellem klinischem Ansprechen und der Verträglichkeit kann jede Dosis in wöchentlichen Schritten von zweimal täglich 2,5 mg/kg (5 mg/kg/Tag) verabreicht bis zu einer empfohlenen Maximaldosis von zweimal täglich 10 mg/kg (20 mg/kg/Tag) weiter erhöht werden.
Jede Dosiserhöhung über 10 mg/kg/Tag bis zur empfohlenen Maximaldosis von 20 mg/kg/Tag sollte unter Berücksichtigung des individuellen Nutzens und Risikos und unter Einhaltung des vollständigen Überwachungsplans erfolgen (siehe Rubrik «Warnhinweise und Vorsichtsmassnahmen»).
Bei TSC
Therapieeinleitung
Die empfohlene Anfangsdosis von Epidyolex beträgt zweimal täglich 2,5 mg/kg (5 mg/kg/Tag) über eine Woche.
Erhaltungstherapie
Nach einer Woche sollte die Dosis auf eine Erhaltungsdosis von zweimal täglich 5 mg/kg (10 mg/kg/Tag) erhöht werden und das klinische Ansprechen sowie die Verträglichkeit bewertet werden.
Je nach individuellem klinischem Ansprechen und der Verträglichkeit kann jede Dosis in wöchentlichen Schritten von zweimal täglich 2,5 mg/kg (5 mg/kg/Tag) verabreicht bis zu einer empfohlenen Maximaldosis von zweimal täglich 12,5 mg/kg (25 mg/kg/Tag) weiter erhöht werden.
Jede Dosiserhöhung über 10 mg/kg/Tag bis zur empfohlenen Maximaldosis von 25 mg/kg/Tag sollte unter Berücksichtigung des individuellen Nutzens und Risikos und unter Einhaltung des vollständigen Überwachungsplans erfolgen (siehe Rubrik «Warnhinweise und Vorsichtsmassnahmen»).
Die jeweils empfohlene Dosierung bei LGS, DS und TSC ist in der folgenden Tabelle 1 zusammengefasst:
Tabelle 1: Empfohlene Dosen
|
|
LGS und DS
|
TSC
| |
Anfangsdosis – erste Woche
|
zweimal täglich 2,5 mg/kg (5 mg/kg/Tag)
| |
Zweite Woche
|
Erhaltungsdosis
zweimal täglich 5 mg/kg
(10 mg/kg/Tag)
|
zweimal täglich 5 mg/kg
(10 mg/kg/Tag)
| |
Weitere Titration nach Bedarf (Schrittgrösse)
|
wöchentliche Schritte von zweimal täglich 2,5 mg/kg
(5 mg/kg/Tag)
| |
Empfohlene Maximaldosis
|
zweimal täglich 10 mg/kg (20 mg/kg/Tag)
|
zweimal täglich 12,5 mg/kg (25 mg/kg/Tag)
|
Jeder Epidyolex-Faltschachtel wird geliefert mit:
·zwei 1ml-Spritzen, in 0,05 ml Schritten abgestuft (0,05 ml entspricht jeweils 5 mg Epidyolex)
·zwei 5ml-Spritzen, in 0,1 ml Schritten abgestuft (0,1 ml entspricht jeweils 10 mg Epidyolex)
Wenn die berechnete Dosis 100 mg (1 ml) oder weniger beträgt, sollte die kleinere 1-ml-Dosierspritze für die orale Verabreichung verwendet werden.
Wenn die berechnete Dosis mehr als 100 mg (1 ml) beträgt, sollte die grössere 5ml-Dosierspritze für die orale Verabreichung verwendet werden.
Die berechnete Dosis sollte auf den nächsten Teilstrich aufgerundet werden.
Absetzen
Wenn Epidyolex abgesetzt werden muss, sollte die Dosis schrittweise verringert werden. In klinischen Studien wurde das Absetzen von Epidyolex durch eine Verringerung der Dosis um etwa 10% pro Tag über 10 Tage durchgeführt (siehe Rubrik «Warnhinweise und Vorsichtsmassnahmen» unter «Hepatozelluläre Schädigung» und «Erhöhte Anfallshäufigkeit»). Eine klinisch langsamere oder schnellere Titration kann nach Ermessen des behandelnden Arztes erforderlich sein.
Kombinationstherapie
Dosisanpassungen anderer Arzneimittel, die in Kombination mit Epidyolex angewendet werden:
Ein Arzt, der Erfahrung mit der Behandlung von Patienten hat, die gleichzeitig Antiepileptika erhalten, sollte die Notwendigkeit einer Dosisanpassung von Epidyolex oder des/der begleitenden Arzneimittel(s) prüfen, um mögliche Arzneimittelwechselwirkungen handhaben zu können (siehe Rubriken «Warnhinweise und Vorsichtsmassnahmen» und «Interaktionen»).
Spezielle Dosierungsanweisungen
Patienten mit Leberfunktionsstörungen
Epidyolex erfordert keine Dosisanpassung bei Patienten mit leichter Leberfunktionsstörung (Child-Pugh A).
Bei Anwendung von Epidyolex bei Patienten mit mässiger Leberfunktionsstörung (Child-Pugh B) ist Vorsicht geboten. Anfangs- / Erhaltungs- / und Maximaldosis müssen im Vergleich zu lebergesunden Patienten circa halbiert werden. Eine Maximaldosis von mehr als 10 mg/kg/Tag bei LGS und DS und von mehr als 12,5 mg/kg/Tag bei TSC wird bei diesen Patienten nicht empfohlen.
Die Anwendung von Epidyolex bei Patienten mit schwerer Leberfunktionsstörung (Child-Pugh C) wird nicht empfohlen.
Siehe auch Rubriken «Warnhinweise und Vorsichtsmassnahmen» und «Pharmakokinetik».
Patienten mit Nierenfunktionsstörungen
Epidyolex kann Patienten mit leichter, mittelschwerer oder schwerer Nierenfunktionsstörung ohne Dosisanpassung verabreicht werden (siehe Rubrik «Pharmakokinetik»). Es liegen keine Erfahrungen bei Patienten mit Nierenerkrankung im Endstadium vor. Es ist nicht bekannt, ob Epidyolex dialysierbar ist.
Ältere Patienten
Die klinischen Studien mit Epidyolex zur Behandlung von LGS, DS und TSC umfassten keine ausreichende Anzahl von Patienten über 55 Jahre, sodass nicht festgestellt werden konnte, ob diese Patienten anders ansprechen als jüngere Patienten.
Im Allgemeinen sollte bei der Dosisauswahl für einen älteren Patienten in Anbetracht der grösseren Häufigkeit verminderter Leber-, Nieren- und Herzfunktion und von Begleiterkrankungen oder anderen gleichzeitig verabreichten Medikamenten (siehe Rubrik «Warnhinweise und Vorsichtsmassnahmen» unter «hepatozellulärer Schädigung») vorsichtig vorgegangen werden, üblicherweise am unteren Ende des Dosierungsbereichs beginnend.
Kinder und Jugendliche
Bei LGS und DS
Es gibt keinen relevanten Nutzen von Epidyolex bei Kindern im Alter bis zu 6 Monaten.
Die Sicherheit und Wirksamkeit von Epidyolex bei Kindern im Alter von 6 Monaten bis 2 Jahren ist bisher noch nicht erwiesen.
Bei TSC
Es gibt keinen relevanten Nutzen von Epidyolex bei Kindern im Alter unter 1 Monat.
Die Sicherheit und Wirksamkeit von Epidyolex bei Kindern im Alter von 1 Monat bis 2 Jahren ist bisher noch nicht erwiesen.
Verspätete Dosisgabe / Versäumte Dosis
Bei einer oder mehreren versäumten Dosen sollten die versäumten Dosen nicht kompensiert werden. Die Dosierung sollte entsprechend des bestehenden Behandlungsplans wieder aufgenommen werden. Wenn die Einnahme über mehr als 7 Tagen versäumt wurde, sollte eine erneute Titration auf die therapeutische Dosis vorgenommen werden.
Art der Anwendung
Zum Einnehmen.
Nahrungsmittel können zu einer Erhöhung der Epidyolex-Konzentration führen, deshalb sollte es in Bezug auf Nahrungsmittel, einschliesslich der ketogenen Ernährung, konsequent entweder mit oder ohne Nahrungsaufnahme eingenommen werden. Bei Einnahme mit Nahrung sollte soweit wie möglich eine ähnliche Nahrungszusammensetzung beibehalten werden.
Die orale Einnahme wird empfohlen; falls erforderlich ist die enterale Anwendung über nasogastrale und gastrostomische Sonden akzeptabel. Sonden aus Polyvinylchlorid und Polyurethan sollten nicht verwendet werden. Siehe Rubrik «Sonstige Hinweise, Hinweise für die Handhabung».
KontraindikationenÜberempfindlichkeit gegen den Wirkstoff oder einen unter «Zusammensetzung» aufgelisteten Hilfsstoff.
Wenn bei einem Patienten im Rahmen der Behandlung mit Epidyolex Überempfindlichkeitsreaktionen auftreten, sollte das Arzneimittel abgesetzt werden.
Patienten mit erhöhten Transaminasewerten, die das Dreifache der oberen Normgrenze (ULN) übersteigen, und deren Bilirubinwerte das Zweifache der ULN übersteigen (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Warnhinweise und VorsichtsmassnahmenHepatozelluläre Schädigung
Epidyolex kann dosisbezogene Erhöhungen der Lebertransaminasen (Alaninaminotransferase [ALT] bzw. Aspartataminotransferase [AST]) verursachen (siehe Rubrik «Unerwünschte Wirkungen»). Die Erhöhungen treten typischerweise in den ersten zwei Monaten nach Behandlungsbeginn auf; es wurden jedoch bis zu 18 Monate nach Behandlungsbeginn entsprechende Fälle beobachtet, insbesondere bei Patienten, die gleichzeitig Valproat einnahmen.
In klinischen Studien traten die meisten ALT-Erhöhungen bei Patienten auf, die gleichzeitig Valproat einnahmen. Die gleichzeitige Anwendung von Clobazam erhöhte das Vorkommen erhöhter Transaminasewerte ebenfalls, wenn auch in geringerem Masse als Valproat. Wenn es zu erhöhten Transaminasewerten kommt, sollte eine Dosisanpassung oder das Absetzen von Valproat oder Clobazam in Betracht gezogen werden.
In etwa zwei Drittel der Fälle kam es nach dem Absetzen von Epidyolex oder einer Verringerung der Epidyolex- bzw. gleichzeitig eingenommenen Valproat-Dosen zu einem Rückgang der erhöhten Transaminasewerte auf die Ausgangswerte. In etwa einem Drittel der Fälle bildeten sich die erhöhten Transaminasewerte während der fortgesetzten Behandlung mit Epidyolex ohne Dosisverringerung zurück.
Bei Patienten, deren Transaminasewerte am Ausgangszeitpunkt über dem ULN lagen, fielen die Transaminasenanstiege bei der Einnahme von Epidyolex höher aus. Bei einigen Patienten führte ein Synergieeffekt einer gleichzeitigen Behandlung mit Valproat im Falle von erhöhten Transaminasewerten am Ausgangszeitpunkt zu einem erhöhten Risiko für erhöhte Transaminasewerte.
In einer unkontrollierten Studie an Patienten mit einer anderen Nichtepilepsie-Indikation traten bei 2 älteren Patienten erhöhte alkalische Phosphatasewerte auf, die in Kombination mit Transaminaseerhöhungen über dem Doppelten des ULN-Werts lagen. Nach dem Absetzen von Epidyolex normalisierten sich die Werte wieder.
Überwachung
Im Allgemeinen sind erhöhte Transaminasewerte von mehr als dem 3-fachen des ULN bei erhöhten Bilirubinwerten ohne alternative Erklärung ein wichtiger Prädiktor für schwere Leberschäden. Die frühzeitige Erkennung erhöhter Transaminasewerte kann das Risiko eines schwerwiegenden unerwünschten Ereignisses verringern. Patienten mit erhöhten Transaminasewerten, die am Ausgangszeitpunkt über dem 3-fachen des ULN-Werts lagen, oder mit erhöhten Bilirubinwerten, die über dem Doppelten des ULN-Werts lagen, sollten vor Beginn der Behandlung mit Epidyolex evaluiert werden.
Bevor die Behandlung mit Epidyolex eingeleitet wird, müssen die Serumtransaminasewerte (ALT und AST), die alkalische Phosphatase und die Gesamtbilirubinwerte ermittelt werden.
Serumtransaminasen (ALT, AST), alkalische Phosphatase und Gesamtbilirubinwerte sollen 2 Wochen, 1 Monat, 2 Monate, 3 Monate und 6 Monate nach Beginn der Behandlung mit Epidyolex und danach periodisch oder wie klinisch angezeigt ermittelt werden.
Bei Änderungen der Epidyolex-Dosis auf mehr als 10 mg/kg/Tag oder bei Änderungen der Arzneimittel (Dosisänderungen oder –addition), von denen bekannt ist, dass sie Auswirkungen auf die Leber haben, soll dieser Überwachungsplan wieder aufgenommen werden.
Wenn ein Patient klinische Anzeichen oder Symptome entwickelt, die auf eine Funktionsstörung der Leber hindeuten, sollen die Serumtransaminasen und das Gesamtbilirubin unverzüglich gemessen werden, wobei die Behandlung mit Epidyolex gegebenenfalls unterbrochen oder beendet werden soll. Epidyolex soll bei allen Patienten abgesetzt werden, bei denen der Transaminasewert das 3-fache des ULN-Werts und der Bilirubinwert das 2-fache des ULN-Werts übersteigt. Bei Patienten mit anhaltend erhöhten Transaminasewerten von mehr als dem 5fachen des ULN soll die Behandlung ebenfalls beendet werden. Patienten mit anhaltend überhöhten Serumtransaminasewerten sollen auf andere mögliche Ursachen untersucht werden. Eine Dosisanpassung eines gleichzeitig verabreichten Arzneimittels, von dem bekannt ist, dass es Auswirkungen auf die Leber hat, soll in Betracht gezogen werden (z.B. Valproat und Clobazam) (siehe Rubrik «Interaktionen»).
Patienten mit mässiger und schwerer Einschränkung der Leberfunktion (Child-Pugh B und C)
Patienten mit eingeschränkter Leberfunktion wurden nicht in den pivotalen klinischen Studien untersucht.
Die Anwendung von Epidyolex bei Patienten mit mässiger Einschränkung der Leberfunktion (Child-Pugh B) soll nur nach sorgfältiger Abwägung des Nutzen-Risikos sowie unter strenger Kontrolle der Leberfunktionsparameter und mit reduzierter Dosierung erfolgen (siehe Rubrik «Dosierung/Anwendung»).
Die Anwendung von Epidyolex bei Patienten mit schwerer Einschränkung der Leberfunktion (Child-Pugh C) wird nicht empfohlen.
Somnolenz und Sedierung
Epidyolex kann Schläfrigkeit und Sedierung verursachen, die häufiger zu Beginn der Behandlung auftreten und bei fortgesetzter Behandlung nachlassen können. Das Auftreten war bei Patienten, die gleichzeitig Clobazam erhalten, höher (siehe Rubrik «Interaktionen» und «Unerwünschte Wirkungen»). Andere ZNS-Beruhigungsmittel, einschliesslich Alkohol, können die Somnolenz und den Sedierungseffekt verstärken.
Pneumonie
Bei der Anwendung von Epidyolex wurde ein erhöhtes Risiko für Pneumonie beobachtet. In den kontrollierten klinischen Studien bei Patienten mit LGS oder DS hatten 6% der mit Epidyolex behandelten Patienten eine Pneumonie im Vergleich zu 1% der Patienten unter Placebo. In der kontrollierten klinischen Studie bei Patienten mit TSC hatten 4% der mit Epidyolex behandelten Patienten eine Pneumonie im Vergleich zu 1% der Patienten unter Placebo. Die Häufigkeit von Pneumonie schien nicht dosisabhängig zu sein: 5% der mit Epidyolex 20 mg/kg/Tag behandelten Patienten entwickelten eine Pneumonie im Vergleich zu 9% der mit Epidyolex 10 mg/kg/Tag behandelten Patienten. Die Häufigkeit von Pneumonie war bei Patienten mit gleichzeitiger Einnahme von Clobazam höher. Verschreibende Ärzte sollten die Patienten auf Anzeichen und Symptome einer Pneumonie, einschliesslich signifikanter Somnolenz und Sedierung, überwachen.
Erhöhte Anfallshäufigkeit
Wie bei anderen Antiepileptika kann es unter der Behandlung mit Epidyolex zu einer klinisch relevanten Erhöhung der Anfallshäufigkeit kommen, was möglicherweise eine Dosisanpassung von Epidyolex bzw. den gleichzeitig eingenommenen Antiepileptika oder ein Absetzen von Epidyolex erforderlich macht, falls das Nutzen-Risiko-Verhältnis negativ ist.
Suizidales Verhalten und Selbstmordgedanken
Bei Patienten, die mit Antiepileptika behandelt wurden, wurde bei mehreren Indikationen von suizidalem Verhalten und Selbstmordgedanken berichtet. Eine Metaanalyse randomisierter placebokontrollierter Studien mit Antiepileptika hat ein leicht erhöhtes Risiko für Selbstmordverhalten und gedanken gezeigt. Der ursächliche Mechanismus für dieses Risiko ist nicht bekannt, und die verfügbaren Daten schliessen die Möglichkeit eines erhöhten Risikos bei Epidyolex nicht aus.
Die Patienten sollten auf Anzeichen von Selbstmordverhalten und gedanken überwacht werden und eine geeignete Behandlung sollte in Betracht gezogen werden. Patienten und Angehörigen von Patienten sollte angeraten werden, ärztlichen Rat einzuholen, falls sich Anzeichen für Selbstmordverhalten und gedanken abzeichnen.
Ethanol in der Zusammensetzung
Dieses Arzneimittel enthält 7,9% w/v Ethanol (Alkohol) (79 mg/ml Ethanol entsprechend 10% v/v wasserfreies Ethanol), d.h. bis zu 691 mg Ethanol pro Epidyolex Dosis (12,5 mg/kg für einen Erwachsenen mit einem Gewicht von 70 kg). Dies entspricht 17 ml Bier oder 7 ml Wein pro Dosis).
Die geringe Alkoholmenge in diesem Arzneimittel hat keine wahrnehmbaren Auswirkungen.
Benzylalkohol
Dieses Arzneimittel enthält 0,0003 mg/ml Benzylalkohol entsprechend 0,0026 mg pro Epidyolex Dosis (Epidyolex 12,5 mg/kg pro Dosis bei einem Erwachsenen mit einem Gewicht von 70 kg.
Benzylalkohol kann allergische Reaktionen auslösen.
Bei Kleinkindern besteht aufgrund von Akkumulation ein erhöhtes Risiko.
Grosse Mengen sollten wegen des Risikos der Akkumulation und Toxizität («metabolische Azidose») nur mit Vorsicht und wenn absolut nötig angewendet werden, insbesondere bei Personen mit eingeschränkter Leber- oder Nierenfunktion, bei schwangeren oder stillenden Patientinnen.
Raffiniertes Sesamöl
Epidyolex enthält raffiniertes Sesamöl, das selten schwere allergische Reaktionen verursachen kann.
InteraktionenIn vitro Daten
Cannabidiol ist ein Substrat für CYP3A4, CYP2C19, UGT1A7, UGT1A9 und UGT2B7.
Invitro-Daten legen nahe, dass Cannabidiol ein Inhibitor der durch CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, UGT1A9 und UGT2B7 induzierten Aktivität bei klinisch relevanten Konzentrationen ist. Der Metabolit 7-Carboxycannabidiol (7-COOH-CBD) hemmt die Aktivität von UGT1A1, UGT1A4 und UGT1A6 in vitro in klinisch relevanten Konzentrationen.
Cannabidiol induziert die mRNA Expression von CYP1A2 und CYP2B6 in klinisch relevanten Konzentrationen.
Eine Hemmung des P-Glykoprotein- oder BCRP-vermittelten Efflux durch Cannabidiol im Darm kann nicht ausgeschlossen werden.
Der Metabolit 7-COOH-CBD ist ein Pgp/MDR1-Substrat und hat das Potential BCRP, OATP1B1, OATP1B3 und OAT3 zu hemmen.
Cannabidiol und der Metabolit 7-OH-CBD sind keine Substrate von Pgp, BCRP, OATP1B1 oder OATP1B3.
Der Metabolit 7-OH-CBD ist kein Inhibitor der wichtigsten renalen und hepatischen Aufnahmetransporter OAT1, OAT3, OCT1, OCT2, MATE1, MATE2K, OATP1B1 und OATP1B3.
Cannabidiol ist kein Substrat oder Inhibitor der Hirnaufnahmetransporter OATP1A2 und OATP2B1.
Cannabidiol und 7-OH-CBD sind bei klinisch relevanten Plasmakonzentrationen keine Inhibitoren des Effluxtransporters BSEP.
Die Pharmakokinetik von Epidyolex ist komplex und kann beim Patienten zu Interaktionen mit gleichzeitig eingenommenen Antiepileptika führen. Die Dosis von Epidyolex und/oder die der gleichzeitig eingenommenen Antiepileptika sollte(n) deshalb im Rahmen der regelmässigen ärztlichen Überwachung eingestellt und der Patient sollte engmaschig auf unerwünschte Arzneimittelwirkungen überwacht werden. Darüber hinaus sollte die Überwachung der Plasmakonzentrationen in Betracht gezogen werden.
Das Potenzial für Arzneimittelinteraktionen mit anderen gleichzeitig verabreichten Antiepileptika wurde für Clobazam, Valproat, Stiripentol und Everolimus bei gesunden Probanden und Patienten (750 mg, 2mal täglich bei gesunden Probanden und 20 mg/kg/Tag bei Patienten) mit Epilepsie untersucht.
Obwohl keine formalen Arzneimittelinteraktionsstudien für andere Antiepileptika durchgeführt wurden, werden Phenytoin und Lamotrigin auf der Grundlage von in-vitro-Daten abgehandelt. Interaktionen und Dosierungsempfehlungen mit Antiepileptika und anderen Arzneimitteln sind in der nachfolgenden Tabelle 2 zusammengefasst.
Tabelle 2: Interaktionen mit anderen Arzneimitteln
|
Begleitmedikation
|
Auswirkung auf den Plasmaspiegel
Geometrische mittlere Verhältnisse (90% CI)
|
Hinweise und Empfehlungen
| |
Antiepileptika (AEDs)
| |
Valproat
|
Gesunde Probanden
CBD AUCtau: 1.05 (0.90, 1.24)
CBD Cmax: 0.74 (0.58, 0.93)
7-OH-CBD AUCtau: 1.22 (0.96, 1.55)
7-OH-CBD Cmax: 0.97 (0.67, 1.41)
Valproat AUCtau: 0.99 (0.90, 1.08)
Valproat Cmax: 1.01 (0.95, 1.07)
Patienten
Valproat AUCtau: 0.83 (0.75, 0.92)
Valproat Cmax: 0.87 (0.79, 0.95)
4-ene-VPA AUCtau: 0.70 (0.62, 0.80)
4-ene-VPA Cmax: 0.77 (0.66, 0.90)
|
Die gleichzeitige Anwendung von Epidyolex und Valproat erhöht das Vorkommen erhöhter Transaminaseenzymwerte (siehe «Warnhinweise und Vorsichtsmassnahmen»). Der Mechanismus dieser Interaktion bleibt unbekannt. Bei einem Auftreten klinisch signifikanter Anstiege der Transaminasen sollten Cannabidiol und/oder Valproat bei allen Patienten gleichzeitig verringert oder abgesetzt werden, bis ein Abklingen der erhöhten Transaminasewerte beobachtet wird (siehe «Warnhinweise und Vorsichtsmassnahmen»). Es liegen nicht genügend Daten vor, anhand derer das Risiko einer gleichzeitigen Anwendung von Cannabidiol mit anderen hepatotoxischen Arzneimitteln beurteilt werden könnte (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Die gleichzeitige Anwendung von Epidyolex und Valproat erhöht die Inzidenz von Diarrhoe und Ereignisse von vermindertem Appetit. Der Mechanismus dieser Interkation ist unbekannt.
Es gibt keine klinisch bedeutenden pharmakokinetischen Veränderungen, weder für CBD noch für VPA oder ihrer Metaboliten.
| |
Clobazam
|
CBD AUCtau: 1.30 (1.00, 1.70)
CBD Cmax: 1.34 (0.93, 1.95)
7-OH-CBD AUCtau: 1.47 (1.26, 1.70)
7-OH-CBD Cmax: 1.73 (1.36, 2.20)
Clobazam AUCtau: 1.06 (0.90, 1.24) bis 1.21 (1.05, 1.39)
Clobazam Cmax: 1.00 (0.83, 1.19) bis 1.20 (1.05, 1.38)
N-CLB AUCtau: 2.64 (1.95, 3.58) bis 3.38 (2.62, 4.36)
N-CLB Cmax: 2.22 (1.42, 3.46) bis 3.39 (2.61, 4.39)
|
Die gleichzeitige Anwendung von Epidyolex und Clobazam erhöht die Inzidenz von Schläfrigkeit und Sedierung (siehe «Warnhinweise und Vorsichtsmassnahmen» und «Unerwünschte Wirkungen»). Eine Dosisreduktion von Clobazam sollte erwogen werden, falls Schläfrigkeit oder Sedierung auftreten, wenn Clobazam gleichzeitig mit Epidyolex verabreicht wird.
Bei gleichzeitiger Gabe von Epidyolex und Clobazam gibt es keine Auswirkungen auf die Cannabidiol- oder Clobazam-Plasmaspiegel. Jedoch treten bi-direktionale PK Interaktionen auf, die ihre aktiven Metaboliten beeinträchtigen (N-desmethylclobazam und 7-hydroxy cannabidiol).
Erhöhte systemische Plasmaspiegel dieser Wirkstoffe können zu verstärkten pharmakologischen Wirkungen und zu vermehrten unerwünschten Arzneimittelreaktionen führen. Deshalb können Dosisanpassungen von Epidyolex oder Clobazam erforderlich sein.
| |
Stiripentol
|
Gesunde Probanden
CBD AUCtau: 1.03 (0.94, 1.14)
CBD Cmax: 1.13 (0.96, 1.33)
7-OH-CBD AUCtau: 0.72 (0.61, 0.85)
7-OH-CBD Cmax: 0.71 (0.51, 0.99)
Stiripentol AUCtau: 1.55 (1.42, 1.69)
Stiripentol Cmax: 1.28 (1.08, 1.52)
Patienten
Stiripentol AUCtau: 1.30 (1.09, 1.55)
Stiripentol Cmax: 1.17 (1.03, 1.33)
|
Bei kombinierter Gabe von Epidyolex mit Stiripentol gab es einen geringen Anstieg der Stiripentol Plasmaspiegel. Die klinische Relevanz ist unbekannt, aber der Patient sollte engmaschig auf unerwünschte Arzneimittelwirkungen überwacht werden.
Es gibt keine Auswirkung auf die Cannabidiol Plasmaspiegel. Die Interaktion führte in Studien bei gesunden Probanden zu einer Abnahme (ungefähr 30%) von Cmax und AUC des aktiven Metaboliten, 7-OH-CBD.
| |
Phenytoin
|
Eine mögliche Arzneimittelinteraktion wurde nicht untersucht.
|
Die Phenytoin-Exposition kann bei gleichzeitiger Verabreichung mit Epidyolex erhöht sein, da Phenytoin weitgehend über CYP2C9 metabolisiert wird, was durch Cannabidiol in vitro gehemmt wird. Phenytoin hat eine enge therapeutische Breite; deshalb sollte die Kombination von Epidyolex mit Phenytoin mit Vorsicht eingeleitet werden und falls Verträglichkeitsprobleme auftreten, sollte eine Dosisreduktion von Phenytoin erwogen werden.
| |
Lamotrigin
|
Eine mögliche Arzneimittelinteraktion wurde nicht untersucht.
|
Lamotrigin ist ein Substrat für UGT Enzyme, einschliesslich UGT2B7, das in vitro durch Cannabidiol gehemmt wird. Lamotrigin Plasmaspiegel können bei gleichzeitiger Gabe mit Epidyolex erhöht sein.
| |
Everolimus
|
Everolimus AUC0-∞: 2.45 (2.15, 2.80)
Everolimus Cmax: 2.50 (2.12, 2.94)
|
Bei gleichzeitiger Anwendung von Epidyolex (12,5 mg/kg zweimal täglich) und Everolimus (5 mg), ein P-glycoprotein (P-gp) und CYP3A4 Substrat, kam es zu einer erhöhten Everolimus-Exposition. Die Halbwertszeit von Everolimus war nicht betroffen.
Bei Behandlungsbeginn mit Epidyolex bei Patienten, die Everolimus einnehmen, sind die therapeutischen Wirkstoffkonzentrationen von Everolimus im Blut zu überwachen und die Dosierung entsprechend anzupassen. Bei Behandlungsbeginn mit Everolimus bei Patienten, die eine stabile Dosis von Epidyolex einehmen, wird eine niedrigere Anfangsdosis von Everolimus empfohlen, mit Überwachung der Wirkstoffkonzentration im Blut,
Erhöhte Exposition gegenüber anderen oral verabreichten P-gp Substraten (z.B. Sirolimus, Tacrolimus, Digoxin) kann bei gleichzeitiger Anwendung mit Epidyolex erwartet werden. Bei oraler und gleichzeitiger Verabreichung mit Epidyolex sollten Überwachung der therapeutischen Wirkstoffkonzentration im Blut und Dosisreduktion der anderen P-gp Substraten erwogen werden.
Die Dosierungsempfehlungen in den Fachinformationen der jeweiligen Präparate sind zu beachten.
| |
CYP2C19 Substrate / Inhibitoren
| |
Fluconazol
|
CBD AUCt: 1.21 (1.08, 1.36)
CBD Cmax:
1.24 (1.05, 1.47)
7-OH-CBD AUCt: 0.71 (0.61, 0.82)
7-OH-CBD Cmax: 0.59 (0.48, 0.72)
Die Wirkung auf Fluconazol wurde nicht untersucht.
|
Fluconazol, ein potenter CYP2C19 Inhibitor, hat einen nur geringen Effekt auf die CBD Exposition und bewirkt eine geringe Abnahme der 7-OH-CBD Exposition. Keine dieser Veränderungen werden als klinisch bedeutsam angesehen.
Epidyolex kann erhöhte Plasmakonzentrationen von Arzneimitteln, die durch CYP2C19 metabolisiert werden, z.B. Omeprazol und Clobazam (siehe oben), bewirken. Eine Dosisreduktion sollte für gleichzeitig verabreichte Arzneimittel, die sensitive CYP2C19 Substrate sind, oder die eine enge therapeutische Breite aufweisen, in Betracht gezogen werden.
| |
CYP2C19 Induktoren
| |
Rifampicin
|
CBD AUCt: 0.68 (0.61, 0.75)
CBD Cmax: 0.66 (0.56, 0.78)
7-OH-CBD AUCt: 0.37 (0.33, 0.41)
7-OH-CBD Cmax: 0.33 (0.29, 0.38)
Die Auswirkung auf Rifampicin wurde nicht untersucht.
|
Rifampicin und andere starke Induktoren von CYP2C19 können die Plasmakonzentration von Cannabidiol herabsetzen und deshalb die Wirksamkeit von Epidyolex vermindern.
| |
CYP3A4 Substrate / Inhibitoren
| |
Midazolam
|
Midazolam AUCt: 0.92 (0.78, 1.09)
Midazolam Cmax: 0.80 (067, 0.96)
1'-hydroxymidazolam AUCt: 1.68 (1.41, 2.01)
1'-hydroxymidazolam Cmax: 1.12 (0.93, 1.34)
Die Auswirkung auf Cannabidiol wurde nicht untersucht.
|
Epidyolex hat keine Auswirkung auf die Clearance von Midazolam und es wird nicht erwartet, dass es die Clearance von anderen sensitiven CYP3A4 Substraten beeinflusst.
| |
Itraconazol
|
CBD AUCt: 1.05 (0.96, 1.15)
CBD Cmax: 1.01 (0.82, 1.25)
7-OH-CBD AUCt: 1.17 (1.07, 1.27)
7-OH-CBD Cmax: 1.06 (0.90, 1.25)
Die Auswirkung auf Itraconazol wurde nicht untersucht.
|
Itraconazol, ein potenter CYP3A4 Inhibitor, hat keinen Einfluss auf die CBD Exposition und bewirkt einen sehr geringen, klinisch unbedeutenden Anstieg der 7-OH-CBD Exposition.
| |
CYP3A4 Induktoren
| |
z.B. Rifampicin,
Carbamazepin, Enzalutamid, Mitotan, Johanniskraut
|
Siehe Rifampicin Studiendaten (CYP2C19 Induktoren)
|
Starke Induktoren von CYP3A4 können die Plasmakonzentration von Cannabidiol herabsetzen und deshalb die Wirksamkeit von Epidyolex vermindern. Eine Dosisanpasung kann erforderlich sein.
| |
CYP2C8 und CYP2C9 Substrate / Inhibitoren
| |
z.B. Repaglinid, Warfarin
|
Eine mögliche Arzneimittelinteraktion wurde nicht untersucht.
|
Eine Dosisreduktion der Substrate von CYP2C8 und CYP2C9 sollte klinisch angemessen berücksichtigt werden, wenn bei gleichzeitiger Verabreichung mit Epidyolex unerwünschte Wirkungen auftreten.
| |
CYP1A2 Substrate / Inhibitoren
| |
z.B. Theophyllin, Koffein
|
Koffein AUCt: 1.88 (1.56, 2.27)
Koffein Cmax: 1.15 (1.04, 1.26)
|
Die Daten weisen darauf hin, dass Epidyolex ein schwacher CYP1A2-Hemmer ist. Ähnlich geringe Zunahmen der Exposition lassen sich auch bei anderen empfindlichen CYP1A2-Substraten (z.B. Theophyllin oder Tizanidin) erwarten.
Eine Dosisanpassung der Substrate von CYP1A2 sollte klinisch angemessen berücksichtigt werden.
Die Dosierungsempfehlungen in den Fachinformationen der jeweiligen Präparate sind zu beachten.
| |
CYP2B6 Substrate / Inhibitoren
| |
z.B. Bupropion, Efavirenz
|
Eine mögliche Arzneimittelinteraktion wurde nicht untersucht.
|
Eine Dosisanpassung der CYP2B6 Substrate sollte klinisch angemessen berücksichtigt werden.
| |
UGT1A7, UGT1A9 und UGT2B7 Substrate / Inhibitoren
| |
z.B. Diflunisal, Propofol, Fenofibrat, Gemfibrozil, Morphin, Lorazepam
|
Eine mögliche Arzneimittelinteraktion wurde nicht untersucht.
|
Eine Dosisreduktion der Substrate von UGT1A7, UGT1A9 und UGT2B7 oder von Epidyolex sollte klinisch angemessen berücksichtigt werden, wenn bei gleichzeitiger Verabreichung mit Epidyolex unerwünschte Wirkungen auftreten.
| |
UGT1A1, UGT1A4 und UGT1A6 Substrate / Inhibitoren
| |
z.B. Lamotrigin, Olanzepin, Paracetamol
|
Eine mögliche Arzneimittelinteraktion wurde nicht untersucht.
|
Der Metabolit 7-COOH-CBD ist in vitro ein Inhibitor der UGT1A1, UGT1A4 und UGT1A6-vermittelten Wirkung. Eine Dosisreduktion der Substrate kann bei gleichzeitiger Verabreichung von Substraten mit diesen UGTs erforderlich sein.
| |
P-gp Substrate / Inhibitoren (oral verabreicht)
| |
z.B. Sirolimus, Tacrolimus, Everolimus, Digoxin
|
Siehe AEDs, Everolimus
|
| |
Oral Kontrazeptiva
| |
z.B. Ethinylestradiol, Levonorgestrel
|
Eine mögliche Arzneimittelinterkation wurde nicht untersucht
|
Cannabidiol ist kein Induktor von CYP3A4; es wird deshalb nicht erwartet, dass es die Pharmakokinetik von hormonalen Kontrazeptiva verändert.
|
Schwangerschaft, StillzeitSchwangerschaft
Bisher liegen nur sehr begrenzte Erfahrungen mit der Anwendung von Epidyolex bei Schwangeren vor. Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt (siehe Rubrik «Präklinische Daten»).
Epidyolex sollte während der Schwangerschaft nicht angewendet werden, es sei denn, der potenzielle Nutzen für die Mutter überwiegt das potenzielle Risiko für den Fötus eindeutig.
Stillzeit
Es gibt keine klinischen Daten zum Vorkommen von Epidyolex oder seiner Metaboliten in der Muttermilch, zu den Auswirkungen auf den gestillten Säugling oder den Auswirkungen auf die Milchproduktion.
Tierexperimentelle Studien zeigten toxikologische Veränderungen bei laktierenden Tieren, wenn das Muttertier mit Cannabidiol behandelt wurde (siehe Rubrik «Präklinische Daten»).
Da Cannabidiol stark an Proteine gebunden ist und wahrscheinlich ungehindert von Plasma in die Milch übergeht, sollte das Stillen während der Behandlung unterbrochen werden.
Fertilität
Es liegen keine Daten zu Auswirkungen von Epidyolex auf die Fertilität beim Menschen vor.
Bei einer oralen Dosis von bis zu 150 mg Cannabidiol/kg/Tag wurde kein Einfluss auf die Fortpflanzungsfähigkeit von männlichen oder weiblichen Ratten festgestellt (siehe Rubrik «Präklinische Daten»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEpidyolex hat einen grossen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen, da es Somnolenz und Sedierung verursachen kann (siehe Rubrik «Warnhinweise und Vorsichtsmassnahmen»). Die Patienten sollten angewiesen werden, keine Fahrzeuge bzw. Maschinen zu fahren oder zu bedienen, bis sie ausreichende Erfahrung gesammelt haben, so dass sie abschätzen können, ob dadurch ihre entsprechenden Fähigkeiten beeinträchtigt werden (siehe Rubrik «Unerwünschte Wirkungen»).
Unerwünschte WirkungenZusammenfassung des Sicherheitsprofils
Nebenwirkungen, die mit Epidyolex im empfohlenen Dosisbereich von 10 bis 25 mg/kg/Tag berichtet wurden, sind unten aufgeführt.
Die häufigsten Nebenwirkungen sind Somnolenz, verminderter Appetit, Diarrhö, Fieber, Müdigkeit und Erbrechen.
Die häufigste Ursache für Behandlungsabbrüche war die Erhöhung der Transaminase.
Die mit Epidyolex aus placebokontrollierten klinischen Studien gemeldeten Nebenwirkungen sind in der nachstehenden Auflistung nach Systemorganklassen und Häufigkeit aufgeführt.
Die Häufigkeit ist wie folgt definiert: sehr häufig (≥1/10), häufig (≥1/100 bis < 1/10), gelegentlich (≥1/1'000 bis < 1/100). Innerhalb jeder Häufigkeitsgruppe werden die Nebenwirkungen in absteigender Reihenfolge dargestellt.
Auflistung der unerwünschten Wirkungen (inkl. Häufigkeiten)
Infektionen und parasitäre Erkrankungen
Häufig: Pneumoniea, Harnwegsinfektion.
Stoffwechsel- und Ernährungsstörungen
Sehr häufig: Verminderter Appetit (21%).
Psychiatrische Erkrankungen
Häufig: Reizbarkeit, Aggression.
Erkrankungen des Nervensystems
Sehr häufig: Somnolenza (26%).
Häufig: Lethargie, Krampfanfälle.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Häufig: Husten.
Erkrankungen des Gastrointestinaltrakts
Sehr häufig: Diarrhö (24%), Erbrechen (13%).
Häufig: Übelkeit.
Leber- und Gallenerkrankungen
Häufig: AST erhöht, ALT erhöht, GGT erhöht.
Erkrankungen der Haut und des Unterhautzellgewebes
Häufig: Hautausschlag.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Sehr häufig: Fieber (16%), Müdigkeit (10%).
Untersuchungen
Häufig: vermindertes Gewicht.
a Gruppierte Begriffe: Pneumonie: Pneumonie, Pneumonie RSV, Mykoplasmen-Pneumonie, Adenovirus-Pneumonie, virale Pneumonie, Aspirationspneumonie; Somnolenz: Somnolenz, Sedierung.
Beschreibung ausgewählter Nebenwirkungen
Hepatozelluläre Schädigung
Epidyolex kann zu dosisbezogenen Erhöhungen der ALT- und AST-Werte führen (siehe Rubrik «Warnhinweise und Vorsichtsmassnahmen»).
In kontrollierten Studien zu LGS, DS (verabreichte Dosis 10 bzw. 20 mg/kg/Tag) und TSC (verabreichte Dosis 25 mg/kg/Tag) lag die Inzidenz von ALT-Erhöhungen über dem 3-fachen des ULN bei Patienten mit Epidyolex-Behandlung bei 12%, verglichen mit ≤1% bei Placebo-Patienten. Bei weniger als 1% der mit Epidyolex behandelten Patienten lagen die ALT- bzw. AST-Werte bei mehr als dem 20fachen des ULN. Bei Patienten, die Epidyolex nahmen, gab es Fälle von erhöhten Transaminasewerten bei Krankenhausaufenthalten.
Risikofaktoren für hepatozelluläre Schädigung
Gleichzeitige Gabe von Valproat und Clobazam, Epidyolex Dosis und Base-line Transaminase Erhöhungen.
Gleichzeitige Gabe von Valproat und Clobazam
Bei mit Epidyolex behandelten Patienten, die Dosen von 10, 20 sowie 25 mg/kg/Tag erhielten, lag die Inzidenz von ALT-Erhöhungen über dem 3-fachen des ULN bei Patienten, die gleichzeitig Valproat und Clobazam erhielten, bei 23%, bei Patienten, die gleichzeitig Valproat (ohne Clobazam) einnahmen, bei 19%, bei Patienten, die gleichzeitig Clobazam einnahmen (ohne Valproat), bei 3%, und bei Patienten, die keines der Medikamente einnahmen, bei 3%.
Dosis
ALT-Erhöhungen von über dem 3-fachen des ULN wurden bei 15% der Patienten, die 20 oder 25 mg Epidyolex/kg/Tag einnahmen, verglichen mit 3% bei Patienten, die 10 mg Epidyolex/kg/Tag einnahmen, gemeldet.
Das Risiko ansteigender ALT-Werte war bei höheren Dosierungen als den 25 mg/kg/Tag in der kontrollierten Studie bei TSC höher.
Erhöhte Transaminasewerte am Ausgangszeitpunkt
In kontrollierten Studien (siehe Rubrik “Eigenschaften/Wirkungen”, «Pharmakodynamik») an Patienten, die 20 oder 25 mg Epidyolex/kg/Tag einnahmen, lag die Häufigkeit von ALT-Erhöhungen über dem 3-fachen des ULN bei 29% (80% von diesen waren unter Valproat), wenn die ALT zu Studienbeginn über dem ULN lag, im Vergleich zu 12% (89% von diesen waren unter Valproat), wenn der ALT-Wert zu Studienbeginn im Normbereich lag. Bei 5% der Patienten (alle unter Valproat), die 10 mg Epidyolex/kg/Tag einnahmen, kam es zu ALT-Erhöhungen über dem 3-fachen des ULN, wenn der ALT-Wert zu Studienbeginn über dem ULN-Wert lag, verglichen mit 3% der Patienten (alle unter Valproat), bei denen der ALT-Wert zu Studienbeginn im Normbereich lag.
Somnolenz und Sedierung
In kontrollierten Studien zu LGS, DS und TSC mit Epidyolex wurden Somnolenz- und Sedierungsereignisse (einschliesslich Lethargie) beobachtet, darunter bei 29% der mit Epidyolex behandelten Patienten (30% der Patienten, die 20 oder 25 mg Cannabidiol/kg/Tag einnahmen und 27% der Patienten, die 10 mg Cannabidiol/kg/Tag einnahmen). Diese unerwünschten Wirkungen wurden in der kontrollierten Studie zu TSC mit grösserer Häufigkeit bei Dosierungen über 25 mg/kg/Tag beobachtet. Die Häufigkeit von Somnolenz und Sedierung (einschliesslich Lethargie) war bei Patienten, die gleichzeitig Clobazam einnahmen, höher (43% bei mit Epidyolex behandelten Patienten, die Clobazam einnahmen, verglichen mit 14% bei mit Epidyolex behandelten Patienten, die kein Clobazam erhielten).
Vermindertes Gewicht
Epidyolex kann zu Gewichtsverlust bzw. zu einer verminderten Gewichtszunahme führen. Bei Patienten mit LGS, DS bzw. TSC erscheint die Gewichtsverminderung dosisbezogen, da bei 21% der Patienten, die 20 bzw. 25 mg Cannabidiol/kg/Tag erhielten, eine Gewichtsverminderung von ≥5% auftrat, verglichen mit 7% bei Patienten, die 10 mg Cannabidiol/kg/Tag erhielten, und mit 8% der Patienten unter Placebo. In einigen Fällen wurde das verminderte Gewicht als unerwünschtes Ereignis berichtet (siehe Auflistung oben). Verminderter Appetit und Gewichtsverlust können zu einem geringfügig verringerten Grössenwachstum führen.
Bei einem anhaltenden Gewichtsverlust/mangelnder Gewichtszunahme sollte regelmässig überprüft werden, ob die Behandlung mit Epidyolex fortgesetzt werden sollte.
Hämatologische Anomalien
Epidyolex kann zu einer Verringerung der Hämoglobin- und Hämatokritwerte führen. In Patienten mit LGS, DS bzw. TSC betrug die mittlere Abnahme des Hämoglobins vom Behandlungsbeginn bis zum Ende der Behandlung -0,36 g/dl bei Patienten, die mit 10, 20 oder 25 mg Cannabidiol/kg/Tag behandelt wurden und 0,20 g/dl bei Patienten unter Placebo. Eine entsprechende Abnahme des Hämatokrits wurde ebenfalls beobachtet, mit einer mittleren Veränderung von -1,3% bei Patienten, die mit Epidyolex behandelt wurden, und -0,3% bei Patienten unter Placebo.
Es gab keine Auswirkungen auf die Erythrozytenindizes. Bei siebenundzwanzig Prozent (27%) der LGS- und DS-Patienten sowie 38% der TSC-Patienten, die mit 25 mg Cannabidiol/kg/Tag behandelt wurden, trat im Verlauf der Studie eine neue, im Labor bestätigte Anämie auf (definiert als normale Hämoglobinkonzentration zu Beginn der Studie, mit einem Messwert, der zu einem späteren Zeitpunkt unterhalb der unteren Normalgrenze lag) gegenüber 14% der Patienten mit LGS oder DS unter Placebo, und 15% der Patienten mit TSC unter Placebo.
Erhöhte Kreatininwerte
Epidyolex kann zu einer Erhöhung des Serumkreatinins führen. Der Mechanismus wurde noch nicht bestimmt. In kontrollierten Studien an gesunden Erwachsenen und bei Patienten mit LGS, DS bzw. TSC wurde innerhalb von 2 Wochen nach Beginn der Behandlung mit Epidyolex ein Anstieg des Serumkreatinins um etwa 10% beobachtet. Bei gesunden Erwachsenen war der Anstieg reversibel. Die Reversibilität wurde in Studien mit LGS, DS bzw. TSC nicht bewertet.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungAnzeichen und Symptome
Erfahrungen mit höheren Dosen als der empfohlenen therapeutischen Dosis sind begrenzt. Bei gesunden erwachsenen Probanden, die eine Einzeldosis von 6'000 mg erhielten, wurde von leichter bis mässiger Diarrhö und Somnolenz berichtet. Dies entspricht einer Dosis von über 85 mg/kg für einen 70 kg schweren Erwachsenen. Diese Nebenwirkungen bildeten sich nach dem Ende der Studie zurück.
Behandlung
Im Falle einer Überdosierung sollte der Patient beobachtet werden und eine geeignete symptomatische Behandlung, einschliesslich der Überwachung der Vitalfunktionen, sollte durchgeführt werden.
Eigenschaften/WirkungenATC-Code
N03AX24
Wirkungsmechanismus
Die genauen Mechanismen der antikonvulsiven Wirkung von Cannabidiol beim Menschen sind nicht bekannt.
Cannabidiol übt seine antikonvulsive Wirkung nicht durch Wechselwirkungen mit Cannabinoidrezeptoren aus.
Cannabidiol reduziert die neuronale Übererregbarkeit mittels der Modulation von intrazellulärem Kalzium über den G-Proteingekoppelten Rezeptor 55 (GPR55) und der transienten Rezeptor-Potential-Kationenkanäle der Unterfamilie V1 (TRPV1) sowie der Modulation der Adenosinvermittelten Signalgebung durch Hemmung der intrazellulären Aufnahme von Adenosin über den equilibrativen Nucleosidtransporter 1 (ENT1).
Kardiale Elektrophysiologie
In einer randomisierten, placebo- und positiv kontrollierten, parallelen Mehrfachdosis-Studie, in der gesunde erwachsene Probanden auf eine Dosis titriert wurden, die dem 3- bis 4-fachen der empfohlenen Höchstdosis entsprach (40 mg/kg, verabreicht nach Nahrungsaufnahme), verlängerte Cannabidiol, orale Lösung das QTc-Intervall bei der erwarteten therapeutischen Exposition nicht in klinisch relevantem Ausmass. Bei supratherapeutischer Exposition kann eine Verlängerung des QTc Intervalls nicht ausgeschlossen werden.
Pharmakodynamik
Keine spezifischen Angaben.
Klinische Wirksamkeit
Zusatztherapie bei Patienten mit Lennox-Gastaut-Syndrom (LGS)
Die Wirksamkeit von Epidyolex als Zusatztherapie bei Krampfanfällen im Zusammenhang mit dem Lennox-Gastaut-Syndrom (LGS) wurde in zwei randomisierten, doppelblinden, placebokontrollierten Parallelgruppenstudien (GWPCARE3 und GWPCARE4) untersucht. Jede Studie bestand aus einem 4wöchigen Ausgangszeitraum, einem 2wöchigen Titrationszeitraum und einem 12wöchigen Erhaltungszeitraum. Das Durchschnittsalter der Studienpopulation betrug 15 Jahre, und 94% der Patienten nahmen 2 oder mehr Antiepileptika gleichzeitig während der Studie ein. Die in beiden Studien am Häufigsten verwendeten gleichzeitig eingenommenen Antiepileptika (> 25% der Patienten) waren Valproat, Clobazam, Lamotrigin, Levetiracetam und Rufinamid.
Der primäre Endpunkt war die prozentuale Veränderung der Sturzanfälle pro 28 Tage über den Behandlungszeitraum in der Epidyolex-Gruppe im Vergleich zu Placebo gegenüber dem Ausgangswert. Sturzanfälle sind als atonische, tonische oder tonischklonische Anfälle definiert. Sekundäre Hauptendpunkte waren der Anteil der Patienten, bei denen die Häufigkeit der Sturzanfälle um mindestens 50% gesunken war, die prozentuale Veränderung der Gesamtkrampfanfallshäufigkeit gegenüber dem Ausgangswert und der allgemeine Veränderungseindruck des Patienten/der Pflegeperson bei ihrer letzten Visite. Diese Ergebnisgrössen sind in Tabelle 3 zusammengefasst.
Tabelle 3: Primäre und sekundäre Hauptendpunktmessungen in LGS-Studien
|
|
Studie GWPCARE3
|
Studie GWPCARE4
| |
Epidyolex
20 mg/kg/Tag
(n = 76)
|
Epidyolex
10 mg/kg/Tag
(n = 73)
|
Placebo
(n = 76)
|
Epidyolex
20 mg/kg/Tag
(n = 86)
|
Placebo
(n = 85)
| |
Primärer Endpunkt - prozentuale Verringerung der Häufigkeit der Sturzanfalle
| |
Sturzanfälle
| |
Mediane Verringerung in %
|
41,9
|
37,2
|
17,2
|
43,9
|
21,8
| |
Vergleich mit Placebo
|
|
|
|
|
| |
Unterschied
|
21,6
|
19,2
|
|
17,2
|
| |
95% KI
|
6,7; 34,8
|
7,7; 31,2
|
|
4,1; 30,3
|
| |
p-Wert
|
0,005
|
0,002
|
|
0,014
|
| |
Sekundäre Hauptendpunkte
| |
50% Responderanteila
|
39,5%
|
35,6%
|
14,5%
|
44,2%
|
23,5%
| |
p-Wert
|
0,001
|
0,003
|
|
0,004
|
| |
Krampfanfälle insgesamt
| |
Mediane %
Verringerung
|
38,4
|
36,4
|
18,5
|
41,2
|
13,7
| |
Vergleich mit Placebo
|
|
|
|
|
| |
Unterschied
|
18,8
|
19,5
|
|
21,1
|
| |
95% KI
|
4,4; 31,8
|
7,5; 30,4
|
|
9,4; 33,3
|
| |
p-Wert
|
0,009
|
0,002
|
|
0,001
|
| |
Mittlere Ergebnisse des allgemeinen Veränderungseindrucks des Patienten/der Pflegeperson (letzte Visite)
|
3,2
(l. verbessert)
|
3,0
(l. verbessert)
|
3,6
(keine Änderung)
|
3,0
(l. verbessert)
|
3.7
(keine Änderung)
| |
p-Wert
|
0,044
|
0,002
|
|
0,001
|
|
CI = 95% Konfidenzintervall; Differenz = Behandlungsunterschied (12 Wochen);
a = Anteil der Patienten mit einer mindestens 50% reduzierten Häufigkeit der Sturzanfälle; l. = leicht.
Abbildung 1: Kumulativer Anteil der Patienten unter Cannabidiol und Placebo nach Kategorie des Anfallsverhaltens im Behandlungszeitraum bei Patienten mit Lennox-Gastaut-Syndrom (GWPCARE3 und GWPCARE4)
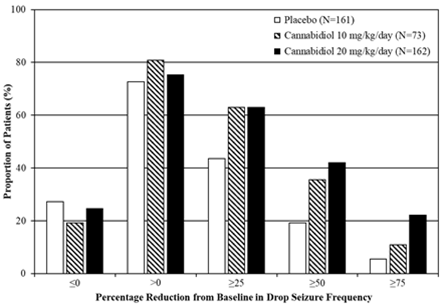
Prozentuale Verringerung der Häufigkeit der Sturzanfälle im Vergleich zum Ausgangswert
Placebo (n=161)
Cannabidiol 10 mg/kg/Tag (n=73)
Cannabidiol 20 mg/kg/Tag (n=162)
Anteil der Patienten (%)
Epidyolex ging während des Behandlungszeitraums in jeder Studie mit einer Zunahme der Anzahl Sturzanfall-freier Tage einher; dies entspricht 3 – 5 Tage pro 28 Tage mehr als bei Placebo (20 mg/kg/Tag) bzw. 3 Tage pro 28 Tage mehr als bei Placebo (10 mg/kg/Tag).
Zusatztherapie bei Patienten mit Dravet-Syndrom
Die Wirksamkeit von Epidyolex als Zusatztherapie bei Krampfanfällen im Zusammenhang mit dem Dravet-Syndrom (DS) wurde in zwei randomisierten, doppelblinden, placebokontrollierten Parallelgruppenstudien (GWPCARE2 und GWPCARE1) bewertet. Jede Studie bestand aus einem 4wöchigen Ausgangszeitraum, einem 2wöchigen Titrationszeitraum und einem 12wöchigen Erhaltungszeitraum. Das Durchschnittsalter der Studienpopulation betrug 9 Jahre und 94% nahmen während der Studie 2 oder mehr Antiepileptika gleichzeitig ein. Die in beiden Studien am Häufigsten verwendeten gleichzeitig eingenommenen Antiepileptika (> 25% der Patienten) waren Valproat, Clobazam, Stiripentol und Levetiracetam.
Der primäre Endpunkt war die Veränderung der Häufigkeit von konvulsiven Krampfanfällen während des Behandlungszeitraums (1. Tag bis zum Ende des auswertbaren Zeitraums) im Vergleich zum Ausgangswert (GWPCARE2) und die mediane prozentuale Veränderung an konvulsiven Krampfanfällen pro 28 Tage über den Behandlungszeitraum in der Epidyolex-Gruppe im Vergleich zu Placebo (GWPCARE1). Als konvulsive Krampfanfälle wurden alle zählbaren atonischen, tonischen, klonischen und tonischklonischen Anfälle definiert. Sekundäre Hauptendpunkte bei GWPCARE2 waren der Anteil der Patienten, bei denen die Häufigkeit der konvulsiven Krampfanfälle um mindestens 50% gesunken war, die Änderung der Häufigkeit der Krampfanfälle insgesamt, sowie der Allgemeine Veränderungseindruck der Pflegeperson bei der letzten Visite. Der sekundäre Hauptendpunkt bei GWPCARE1 war der Anteil der Patienten mit einer Verringerung der Häufigkeit der konvulsiven Krampfanfälle um mindestens 50%. Diese Ergebnisse sind in Tabelle 4 zusammengefasst.
Tabelle 4: Primäre und sekundäre Hauptendpunktmessungen in DS-Studien
|
|
Studie GWPCARE2
|
Studie GWPCARE1
| |
Epidyolex
20 mg/kg/Tag
(n = 67)
|
Epidyolex
10 mg/kg/Tag
(n = 66)
|
Placebo
(n = 65)
|
Epidyolex
20 mg/kg/Tag
(n = 61)
|
Placebo
(n = 59)
| |
Primärer Endpunkt
|
Verringerung der Häufigkeit der konvulsiven Krampfanfälle
|
Prozentuale Verringerung der Häufigkeit der konvulsiven Krampfanfälle
| |
Konvulsive Krampfanfälle
| |
Mediane prozentuale Verringerung/
% Verringerung
|
45,7
|
48,7
|
26,9
|
38,9
|
13,3
| |
Vergleich mit Placebo
|
|
|
|
|
| |
% Verringerung
|
25,7
|
29,8
|
|
22,8
|
| |
Unterschied
95% KI
|
2,9; 43,2
|
8,4; 46,2
|
|
5,4; 41,1
|
| |
p-Wert
|
0,030
|
0,010
|
|
0,012
|
| |
Sekundäre Hauptendpunkte
| |
50% Responderanteila
|
49,3%
|
43,9%
|
26,2%
|
42,6%
|
27,1%
| |
p-Wert
|
0,007
|
0,033
|
|
0,078
|
| |
Krampfanfälle insgesamt
Mediane prozentuale Verringerung/
% Verringerung
|
47,3
|
56,4
|
29,7
|
*
|
| |
Vergleich mit Placebo
|
|
|
|
|
| |
% Verringerung
|
25,1
|
38,0
|
|
|
| |
Unterschied
95% KI
|
3,5; 41,9
|
20,1; 51,9
|
|
|
| |
p-Wert
|
0,026
|
<0,001
|
|
|
| |
Mittlere Ergebnisse des Allgemeinen Veränderungseindrucks des Patienten/der Pflegeperson (letzter Besuch)
|
3.1 (l. verbessert)
|
2.8 (l. verbessert)
|
3.6
(keine Änderung)
|
*
|
| |
p-Wert
|
0,028
|
0,001
|
|
|
|
CI = 95% Konfidenzintervall; Differenz = Behandlungsunterschied (12 Wochen);
a = Anteil der Patienten mit einer mindestens 50% reduzierten Häufigkeit der konvulsiven Krampfanfälle; l. = leicht.
* In der Studie GWPCARE1 wurden die Gesamtanfälle und CGIC-Endpunkte nicht in die Überprüfung der formalen Hypothesen einbezogen, deshalb werden keine Ergebnisse gezeigt.
Abbildung 2: Kumulativer Anteil der Patienten unter Epidyolex und Placebo nach Kategorie des Anfallsverhaltens im Behandlungszeitraum bei Patienten mit Dravet-Syndrom (GWPCARE2 und GWPCARE1)
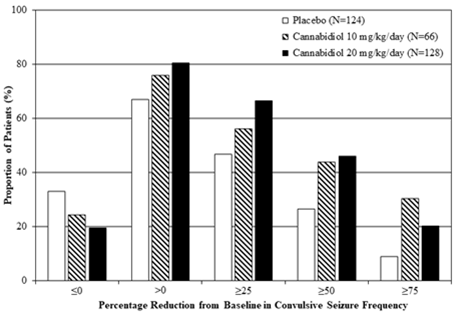
Prozentuale Verringerung der Häufigkeit der konvulsiven Krampfanfälle im Vergleich zum Ausgangswert
Placebo (n=124)
Cannabidiol 10 mg/kg/Tag (n=66)
Cannabidiol 20 mg/kg/Tag (n=128)
Anteil der Patienten (%)
Epidyolex ging während des Behandlungszeitraums in jeder Studie mit einer Zunahme der Anzahl Tage ohne konvulsive Krampfanfälle einher; dies entspricht 1,3 bis 1,4 Tage pro 28 Tage mehr als bei Placebo (20 mg/kg/Tag) bzw. 2,4 Tage pro 28 Tage mehr als bei Placebo (10 mg/kg/Tag).
Erwachsene
Die Population mit Dravet Syndrom in den Studien GWPCARE2 und GWPCARE1 bestand überwiegend aus pädiatrischen Patienten, mit nur 5 erwachsenen Patienten im Alter von 18 Jahren (1,6%). Daher wurden nur begrenzte Daten zur Wirksamkeit und Sicherheit in der erwachsenen DS-Population erhoben.
Dosis-Wirkung
Angesichts dessen, dass es keine konsistente Dosis-Wirkung zwischen 10 mg/kg/Tag und 20 mg/kg/Tag in den LGS- und DS-Studien gibt (siehe Abbildung 1 und 2), sollte Epidyolex anfänglich bis zur empfohlenen Erhaltungsdosis von 10 mg/kg/Tag hochtitriert werden (siehe Rubrik «Dosierung/Anwendung»). Bei individuellen Patienten kann unter Berücksichtigung des Nutzen-Risikos eine Titration bis zur Maximaldosis von 20 mg/kg/Tag in Erwägung gezogen werden (siehe Rubrik «Dosierung/Anwendung»).
Ergebnisse aus offenen Studien
In beiden randomisierten LGS-Studien wurden 99,5% der Patienten, die bis zum Ende an der Studie teilgenommen hatten, in die Langzeit-Open-Label-Verlängerungsstudie (GWPCARE5) aufgenommen. In dieser Studie betrug die mediane prozentuale Abnahme der Häufigkeit von Sturzanfällen bei Patienten mit LGS, die 37 bis 48 Wochen lang behandelt wurden (n = 299), von der 1. bis 12. Woche 55% gegenüber dem Ausgangswert, was bis zur 37. bis 48. Woche aufrechterhalten wurde (60%).
In beiden randomisierten DS-Studien wurden 97,7% der Patienten, die bis zum Ende an der Studie teilgenommen hatten, in GWPCARE5 aufgenommen. In dieser Studie betrug bei Patienten mit DS, die 37 bis 48 Wochen lang behandelt wurden (n = 214), die mittlere prozentuale Verringerung der Häufigkeit der konvulsiven Krampfanfälle gegenüber dem Ausgangswert in der 1. bis 12. Woche 56%, was bis zur 37. bis 48. Woche aufrechterhalten wurde (54%).
Zusatztherapie bei Patienten mit Tuberöser Sklerose (TSC)
Die Wirksamkeit von Epidyolex (25 und 50 mg/kg/Tag) als Zusatztherapie bei Krampfanfällen im Zusammenhang mit TSC wurde in einer randomisierten, doppelblinden, placebokontrollierten Parallelgruppenstudie (GWPCARE6) untersucht. Die Studie bestand aus einem 4-wöchigen Ausgangszeitraum, einem 4-wöchigen Titrationszeitraum sowie einem 12-wöchigen Erhaltungszeitraum (16-wöchiger Behandlungs- und Hauptauswertungszeitraum).
Das Durchschnittsalter der Studienpopulation betrug 14 Jahre und alle Patienten ausser einem nahmen während der Studie ein oder mehrere Antiepileptika gleichzeitig ein. Die am häufigsten eingenommenen Antiepileptika (> 25% der Patienten) waren Valproat (45%), Vigabatrin (33%), Levetiracetam (29%) und Clobazam (27%).
Der primäre Endpunkt war die prozentuale Veränderung der Anzahl der Krampfanfälle im Zusammenhang mit TSC über den Behandlungszeitraum (Erhaltung und Titration) in der Epidyolex-Gruppe im Vergleich zu Placebo jeweils gegenüber dem Ausgangswert. Krampfanfälle im Zusammenhang mit TSC wurden als fokale motorische Anfälle ohne Beeinträchtigung des Bewusstseins oder der Wahrnehmung, fokale Anfälle mit Beeinträchtigung des Bewusstseins oder der Wahrnehmung, fokale Anfälle, die sich zu beidseitigen generalisierten krampfartigen Anfällen entwickeln, und generalisierte Anfälle (tonisch-klonische, tonische, klonische oder atonische Anfälle) definiert. Wichtige sekundäre Endpunkte waren der Anteil der Patienten mit einer mindestens 50-prozentigen Verringerung der Häufigkeit von Krampfanfällen im Zusammenhang mit TSC, der allgemeine Eindruck der eingetretenen Veränderungen des Patienten/der Pflegeperson (Subject/Caregiver Global Impression of Change / S/CGIC) bei ihrem letzten Besuch sowie die prozentuale Veränderung der Gesamtkrampfanfallshäufigkeit gegenüber dem Ausgangswert.
Es wurde gezeigt, dass 50 mg Cannabidiol/kg/Tag die Anfallshäufigkeit in einem ähnlichen Mass verringert wie 25 mg Cannabidiol/kg/Tag. Allerdings ging diese Dosis im Vergleich zu 25 mg Cannabidiol/kg/Tag mit mehr Nebenwirkungen einher, weshalb die empfohlene Höchstdosis 25 mg/kg/Tag beträgt.
In Tabelle 5 sind die Ergebnisse für die empfohlene Höchstdosis von 25 mg/kg/Tag zusammengefasst.
Tabelle 5: Primäre und sekundäre Hauptendpunktmessungen in der TSC-Studie (Gesamtpatientenpopulation)
|
|
Studie GWPCARE6
| |
Epidyolex 25 mg/kg/Tag
(n= 75)
|
Placebo
(n= 76)
| |
Primärer Endpunkt –Prozentuale Verringerung der Krampfanfälle im Zusammenhang mit TSCa
| |
Krampfanfälle im Zusammenhang mit TSC
| |
% Verringerung gegenüber dem Ausgangswert
|
48,6%
|
26,5%
| |
% Verringerung gegenüber Placebo
|
30,1%
|
| |
95% KI
|
13,9%, 43,3%
|
| |
p-Wert
|
0,0009
|
| |
Wichtige sekundäre Endpunkte
| |
% Anteil der Patienten mit einer ≥50% Verringerung
|
36%
|
22,4%
| |
p-Wertb
|
0,0692
|
| |
Krampfanfälle total
|
|
| |
% Verringerung gegenüber dem Ausgangswert
|
48,1%
|
26,9%
| |
% Verringerung gegenüber Placebo
|
29,1%
|
| |
95% KI
p-Wert
|
12,7%, 42,4%
0,0013
|
| |
Mittlere Ergebnisse des Allgemeinen Veränderungseindrucks des Patienten/der Pflegeperson (S/CGIC) (letzter Besuch)
|
3,0 (l. verbessert)
|
3,5 (keine Änderung)
| |
p-Wert
|
0,027
|
|
KI=95% Konfidenzintervall.
a Die Daten für die Studie GWPCARE6 werden als prozentuale Verringerung gegenüber dem Ausgangswert angegeben, die aus einer negativen binomialen Regressionsanalyse geschätzt wurden.
b Der Gesamt-p-Wert basiert auf einem Cochran-Mantel-Haenszel-Test.
Abbildung 3: Kumulativer Anteil der Patienten unter Epidyolex und Placebo nach Kategorie des Anfallsverhaltens im Behandlungszeitraum bei Patienten mit Tuberöser Sklerose (GWPCARE6)
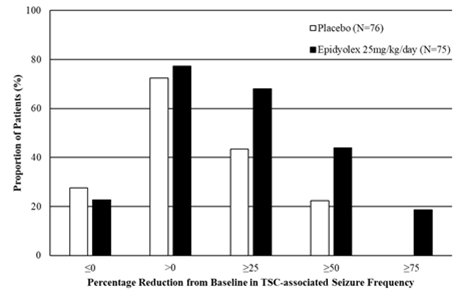
«Prozentuale Verringerung der Häufigkeit von TSC-assoziierten Anfällen im Vergleich zum Ausgangswert»
Im Vergleich zu Placebo ging Epidyolex während des Behandlungszeitraums mit einer Zunahme der Anzahl der Tage einher, an denen keine Krampfanfälle im Zusammenhang mit TSC auftraten, was 2,82 Tagen pro 28 Tagen entsprach.
Die Auswirkung von Epidyolex auf infantile/epileptische Spasmen im Zusammenhang mit TSC wurde nicht vollumfänglich untersucht.
Open-Label-Daten
Von den 201 Patienten, die bis zum Ende an der GWPCARE6-Studie teilnahmen, wurden 99,0% (199 Patienten) in die OLE-Studie aufgenommen. In der OLE-Studie betrug die mediane prozentuale Verringerung der Häufigkeit von Krampfanfällen im Zusammenhang mit TSC gegenüber dem Ausgangswert 61% in der 1. bis 12. Woche (n = 199), was bis zur 37. - 48. Woche mit einer medianen prozentualen Verringerung der Häufigkeit von Krampfanfällen im Zusammenhang mit TSC von 68% gegenüber dem Ausgangswert beibehalten wurde.
Behandlung mit Clobazam
Basierend auf den Ergebnissen von exploratorischen Subgruppenanalysen können sich additive krampflösende Wirkungen von Epidyolex bei Anwesenheit von Clobazam ergeben, die mit einem erhöhten Risiko für Somnolenz und Sedierung, Pneumonie und hepatozelluläre Schädigung einhergehen (siehe Rubriken ”Warnhinweise und Vorsichtsmassnahmen”, «Interaktionen» und «Unerwünschte Wirkungen»).
Die gleichzeitige Anwendung von Epidyolex und Clobazam erfordert eine klinische Bewertung des Einzelfalls und mögliche Dosisanpassungen eines oder beider Arzneimittel entsprechend der Wirksamkeit, Verträglichkeit und Unbedenklichkeit.
Sicherheit und Wirksamkeit bei pädiatrischen Patienten
Die Europäische Arzneimittel-Agentur hat für Epidyolex eine Zurückstellung von der Verpflichtung zur Vorlage von Ergebnissen zu Studien in einer oder mehreren pädiatrischen Altersklassen bei der Behandlung von Anfällen im Zusammenhang mit DS, LGS und TSC gewährt. Siehe Rubrik «Dosierung/Anwendung», bzgl. Angaben zur Anwendung bei Kindern und Jugendlichen.
Weitere Informationen
Missbrauch
In einer Studie zu möglichem Missbrauchspotential führte die akute Verabreichung von Epidyolex an nicht abhängige erwachsene gelegentliche Drogenkonsumenten in therapeutischen und supratherapeutischen Dosen zu geringen Antworten auf positive subjektive Messgrössen wie «Verlangen» und «Wunsch nach Wiederholung». Verglichen mit Dronabinol (synthetisches THC) und Alprazolam weist Epidyolex ein geringes Missbrauchspotenzial auf.
PharmakokinetikAbsorption
Cannabidiol erscheint im Steady-State rasch im Plasma, wobei die Zeit bis zur maximalen Plasmakonzentration 2,5 bis 5 Stunden beträgt.
Steady-state Plasmakonzentrationen auf der Grundlage der Konzentrationen vor Dosierung (CMin) wurden innerhalb von 2-4 Tagen bei einer zweimal täglichen Einnahme erreicht. Das schnelle Erreichen des Steady-state hängt mit dem mehrphasigen Eliminierungsprofil des Arzneimittels zusammen, bei dem die terminale Elimination nur einen kleinen Bruchteil der Clearance des Arzneimittels darstellt.
Die gleichzeitige Einnahme von Epidyolex mit einer Mahlzeit mit hohem Fett- /Kaloriengehalt erhöhte bei einer Studie mit gesunden Probanden die Geschwindigkeit und das Ausmass der Resorption (5fache Erhöhung von Cmax und 4fache Erhöhung der AUC) und verringerte die Gesamtvariabilität der Exposition im Vergleich zum nüchternen Zustand bei gesunden Probanden.
Obwohl die Auswirkung bei einer fettarmen/kalorienarmen Mahlzeit etwas geringer ist, ist die Erhöhung der Exposition immer noch deutlich (Cmax um das 4-fache, AUC um das 3-fache).
Ausserdem erhöhte die Einnahme von Epidyolex zusammen mit Kuhmilch die Exposition bei Cmax um etwa das 3-fache und die AUC um das 2,5-fache. Die Einnahme von Epidyolex mit Alkohol führte ebenfalls zu einer erhöhten Exposition von Cannabidiol (Cmax um das 1,9-fache, AUC um das 1,6-fache).
Distribution
In vitro waren > 94% von Cannabidiol und dessen Metaboliten der Phase I an Plasmaprotein gebunden. Die bevorzugte Bindung erfolgt mit humanem Serumalbumin.
Das scheinbare Verteilungsvolumen nach oraler Verabreichung war bei gesunden Probanden hoch mit 20'963 l bis 42'849 l und höher als im gesamten Körperwasser, was auf eine breite Verteilung von Epidyolex schliessen lässt.
Metabolismus
Cannabidiol wird hauptsächlich in der Leber über CYP450-Enzyme und die UGT-Enzyme metabolisiert. Die wichtigsten CYP450-Isoformen, die für den Phase-I-Metabolismus von Cannabidiol zuständig sind, sind CYP2C19 und CYP3A4. Die für die Phase-II-Konjugation von Cannabidiol verantwortlichen UGT-Isoformen sind UGT1A7, UGT1A9 und UGT2B7.
Die in Standardinvitro-Assays identifizierten Phase-I-Metaboliten waren 7-COOH-CBD, 7-OH-CBD und 6-OH-CBD (ein eher unbedeutender zirkulierender Metabolit).
Nach Mehrfachgabe von Epidyolex zirkuliert der 7-OH-CBD-Metabolit (aktiv in einem präklinischen Anfallsmodell) im menschlichen Plasma in niedrigeren Konzentrationen als der Ausgangswirkstoff Cannabidiol (~ 40% der CBD-Exposition), bezogen auf die AUC. Der zirkulierende Metabolit mit den höchsten Plasmakonzentrationen ist 7-COOH-CBD mit rund 50mal höherer Steady-State Exposition als CBD. Dieser Metabolit hat vermutlich keine intrinsische Aktivität.
Elimination
Die Halbwertszeit von Epidyolex im Plasma betrug nach zweimal täglicher Verabreichung über 7 Tage an gesunde Probanden 56 – 61 Stunden.
Die Plasma-Clearance von Cannabidiol nach einer einmaligen Dosis von 1'500 mg Cannabidiol beträgt etwa 1'111 l/h.
Linearität/Nicht Linearität
Nach einer einmaligen nüchternen Verabreichung nimmt die Cannabidiol Exposition über den Bereich von 750 – 6'000 mg weniger als dosisproportional zu.
Kinetik spezieller Patientengruppen
Leberfunktionsstörungen
Nach der Verabreichung einer Einzeldosis von 200 mg Epidyolex an Patienten mit leichter Leberfunktionsstörung wurden keine Auswirkungen auf die Exposition von Cannabidiol oder Metaboliten beobachtet.
Patienten mit mittelschwerer und schwerer Leberfunktionsstörung wiesen höhere Plasmakonzentrationen von Cannabidiol (etwa 2,5 – 5,2-fach höhere AUC im Vergleich zu gesunden Probanden mit normaler Leberfunktion) auf.
Nierenfunktionsstörungen
Nach der Verabreichung einer Einzeldosis von 200 mg Epidyolex an Patienten mit leichter, mittelschwerer oder schwerer Nierenfunktionsstörung wurden im Vergleich zu Patienten mit normaler Nierenfunktion keine Auswirkungen auf die Cmax oder AUC von Cannabidiol beobachtet. Patienten mit Nierenerkrankung im Endstadium wurden nicht untersucht.
Kinder und Jugendliche
Die Pharmakokinetik von Cannabidiol wurde bei Kindern unter 2 Jahren nicht untersucht.
Einer kleinen Anzahl von Patienten < 2 Jahren mit behandlungsresistenter Epilepsie (einschliesslich TSC, LGS und DS) wurde in klinischen Studien und in einem erweiterten Zugangsprogramm Epidyolex verabreicht.
Präklinische DatenGenotoxizität
Studien zur Genotoxizität haben keine mutagene oder klastogene Wirkung nachgewiesen.
Kanzerogenität
In einer Studie zur Kanzerogenität bei Mäusen erhöhte die orale Gabe von Epidyolex (30, 100 oder 300 mg/kg/Tag) über 2 Jahre die Inzidenz von gutartigen hepatozellulären Adenomen in allen geprüften Dosierungen bei männlichen Mäusen und in der höchsten Dosierung bei weiblichen Mäusen. Bei der höchsten geprüften Dosis war die Plasmaexposition (AUC) bei den Mäusen ungefähr 7-mal höher als die erwartete Exposition beim Menschen bei einer Dosis von 25 mg/kg/Tag.
Eine Studie zum kanzerogenen Potential von Cannabidiol bei Ratten ist noch nicht abgeschlossen.
Reproduktionstoxizität
Es wurden keine unerwünschten Effekte auf die männliche und weibliche Fertilität oder Fortpflanzungsleistung bei Ratten bei Dosen bis zu 250 mg/kg/Tag (bei einer Exposition die ungefähr 34-mal höher als die erwartete Exposition beim Menschen bei einer Dosis von 25 mg/kg/Tag) beobachtet.
In einer Studie zur embryo-foetalen Entwicklung (EFD) durchgeführt bei Kaninchen wurden Dosen von 50, 80 oder 125 mg/kg/Tag untersucht. Ein vermindertes fötales Körpergewicht und erhöhte fötale strukturelle Variationen verbunden mit maternaler Toxizität wurden bei einer Dosis von 125 mg/kg/Tag beobachtet. Die maternalen Plasma-Cannabidiol-Expositionen bei NOAEL-Werten lagen unter der bei einer Dosis von 25 mg/kg/Tag beim Menschen.
In der Studie zur EFD bei Ratten wurden Dosen von 75, 150 oder 250 mg/kg/Tag untersucht. Es wurde eine embryofötale Mortalität bei der hohen Dosis beobachtet, wobei es keine behandlungsbedingten Auswirkungen auf den Implantationsverlust bei niedrigen oder mittleren Dosen gab. Der untersuchte NOAEL-Wert lag bei einer maternalen Plasmaexposition (AUC), die etwa 9mal höher war als die erwartete Exposition beim Menschen bei einer Dosis von 25 mg/kg/Tag.
Eine Studie zur prä- und postnatalen Entwicklung wurde bei Ratten in Dosierungen von 75, 150 oder 250 mg/kg/Tag durchgeführt. Verringertes Wachstum, verzögerte sexuelle Reifung, Verhaltensänderungen (verminderte Aktivität) und unerwünschte Wirkungen auf die männlichen Fortpflanzungsorgane (kleine Hoden bei erwachsenen Nachkommen) und Fruchtbarkeit wurde bei den Nachkommen bei Dosen von ≥150 mg/kg/Tag beobachtet. Der NOAEL-Wert war mit einer Exposition von maternalen Plasma-Cannabidiol um das 5fache über der des Menschen bei einer Dosis von 25 mg/kg/Tag verbunden.
Toxizitätsprüfungen mit juvenilen Tieren
Bei juvenilen Ratten führte die Verabreichung von Cannabidiol während 10 Wochen (subkutane Dosen von 0 oder 15 mg/kg an den postnatalen Tagen 4 - 6, gefolgt von der oralen Verabreichung von 0, 100, 150 oder 250 mg/kg an den postnatalen Tagen 7 - 77) zu einem erhöhten Körpergewicht, einer verzögerten männlichen Geschlechtsreifung, neurologischen Verhaltensweisen, einer erhöhten Knochendichte und einer Leberhepatozytenvakuolierung.
Eine No-Effect-Dosis konnte nicht festgelegt werden. Die Exposition bei der niedrigsten Dosis, die Entwicklungstoxizität bei juvenilen Ratten (15 mg/kg subkutan / 100 mg/kg oral) verursachte, lag bei der etwa 8fachen der Cannabidiol-Exposition bei Menschen bei 25 mg/kg/Tag.
Weitere Daten
In nicht-klinischen Prüfungen auf ein Missbrauchspotential wurde gezeigt, dass Cannabidiol keine cannabinoidartigen Verhaltensreaktionen hervorruft, einschliesslich der Verallgemeinerung von Δ-9-Tetrahydrocannabinol (THC) in einer Drogendiskriminierungsstudie. Cannabidiol führt bei Tieren auch nicht zu einer Selbstverabreichung, was darauf hindeutet, dass es keine Belohnungswirkungen hervorruft und nicht zu einer physischen Abhängigkeit oder einer Entzugserscheinung führt.
Sonstige HinweiseInkompatibilitäten
Enterale Anwendung: es dürfen keine Sonden aus Polyvinylchlorid und Polyurethan verwendet werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Haltbarkeit nach Anbruch
Haltbarkeit nach erstmaligem Öffnen: Innerhalb von 12 Wochen nach dem Öffnen der Flasche verwenden.
Besondere Lagerungshinweise
Nicht über 30°C lagern.
Nicht einfrieren.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Es können nasogastrale Sonden aus Silikon mit einer Länge von mindestens 50 cm und höchstens 125 cm und einem Durchmesser von mindestens 5 Ch und höchstens 12 Ch verwendet werden.
Magensonden aus Silikon mit einer Länge von 0,8 bis 4 cm und einem Durchmesser von 12 Ch bis 24 Ch können verwendet werden.
Nach der Anwendung sollte die enterale Ernährungssonde mindestens einmal mit Wasser, das Raumtemperatur hat, gespült werden. Wenn mehr als ein Arzneimittel angewendet wird, sollte die Sonde zwischen den einzelnen Arzneimittel-Gaben gespült werden. Es wird empfohlen, dass das Spülvolumen etwa das 5-fache des Vorfüllvolumens der Sonde beträgt.
Bei Patienten mit Flüssigkeitsrestriktion muss das Spülvolumen unter Umständen angepasst werden.
Für die maximale Verwendungsdauer der Sonden und zugehörigen Spritzen sollen die Vorgaben des Herstellers beachtet werden.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Zulassungsnummer67590 (Swissmedic)
PackungenBraune Glasflasche (Typ III) mit einem kindersicheren und manipulationssicheren Schraubdeckel (Polypropylen).
1ml-Dosierspritze für die orale Verabreichung (Graduierung in 0,05 ml Schritten) (Kolben HDPE und Spritzenzylinder Polypropylen) und Flaschenadapter (LDPE).
5ml Dosierspritze für die orale Verabreichung (Graduierung in 0,1 ml Schritten) (Kolben HDPE und Spritzenzylinder Polypropylen) und Flaschenadapter (LDPE).
Jede Packung enthält:
Eine 100 ml Flasche
Zwei 1 ml Dosierspritzen für die orale Verabreichung und ein Flaschenadapter
Zwei 5 ml Dosierspritzen für die orale Verabreichung und ein Flaschenadapter
Abgabekategorie: A
ZulassungsinhaberinJazz Pharmaceuticals Switzerland GmbH, Zug
Stand der InformationSeptember 2023
|



