ZusammensetzungWirkstoffe
Perampanel.
Hilfsstoffe
Filmtabletten: Lactosum, Excip. pro compr. obduct. 10 mg und 12 mg: Color. E132.
Suspension zum Einnehmen: Sorbitol-Lösung kristallisierend (enthält Sorbitol (E420) 175 mg), Cellulose mikrokrist., Carmellose-Natrium (enthält weniger als 23 mg Natrium), Poloxamer 188, Dimeticon, Polysorbat 65, Methylcellulose, Silikagel, Macrogolstearat, Benzoesäure (E210) 0.005 mg, Sorbinsäure (E 200), Schwefelsäure, Citronensäure, Natriumbenzoat (E211) 1.10 mg, gereinigtes Wasser pro 1 ml.
Indikationen/AnwendungsmöglichkeitenFycompa ist angezeigt als:
Zusatztherapie fokaler Anfälle mit oder ohne sekundäre Generalisierung bei Epilepsiepatienten ab 12 Jahren.
Zusatztherapie bei primär generalisierten tonisch-klonischen Anfällen bei Epilepsiepatienten ab 12 Jahren.
Dosierung/AnwendungErwachsene und Jugendliche ab einem Alter von mindestens 12 Jahren
Fycompa muss entsprechend dem individuellen Ansprechen des Patienten titriert werden, um das Verhältnis von Wirksamkeit und Verträglichkeit zu optimieren.
Zwischen den Dosiserhöhungen sollte immer jeweils ein Zeitintervall von mindestens einer oder mindestens zwei Wochen liegen in Abhängigkeit von der Basis- bzw. Begleitmedikation (siehe untenstehende Empfehlungen sowie auch Abschnitt «Interaktionen») sowie dem individuellen Nutzen-Risiko Verhältnis.
Fokale Anfälle:
Perampanel ist in der Behandlung fokaler Anfälle in Dosen von 4 bis 12 mg/Tag wirksam. Jedoch sollte aufgrund der dosisabhängig zunehmenden Nebenwirkungen primär eine Dosis zwischen 4 bis 8 mg/Tag gewählt werden.
Die Behandlung mit Fycompa sollte mit einer Dosis von 2 mg/Tag (entspricht 4 ml Suspension pro Tag) begonnen werden. Die Dosis kann je nach klinischem Ansprechen und der Verträglichkeit in jeweils 2 mg (4 ml) Schritten (gemäss unten stehenden Empfehlungen in Intervallen von einer respektive zwei Wochen) bis auf eine Erhaltungsdosis von 4 mg/Tag (8 ml/Tag) bis 8 mg/Tag (16 ml/Tag) erhöht werden. In Einzelfällen kann im Falle einer mit dieser Dosis nicht ausreichenden Anfallskontrolle, in Abhängigkeit von der individuellen Verträglichkeit, eine weitere Aufdosierung in 2 mg (4 ml) Schritten in den oben bzw. auch unten genannten Zeitintervallen bis maximal 12 mg/Tag (24 ml/Tag) erfolgen, immer unter sorgfältiger Abwägung des Nutzen-Risiko-Verhältnisses.
Primär generalisierte tonisch-klonische Anfälle:
Perampanel ist bei primär generalisierten tonisch-klonischen Anfällen in Dosen von bis zu 8 mg/Tag wirksam.
Die Behandlung mit Fycompa sollte mit einer Dosis von 2 mg/Tag (entspricht 4 ml Suspension pro Tag) begonnen werden. Die Dosis kann je nach klinischem Ansprechen und Verträglichkeit in jeweils 2 mg (4 ml) Schritten (gemäss unten stehenden Empfehlungen in Intervallen von einer respektive zwei Wochen) bis auf eine Erhaltungsdosis von 8 mg/Tag (16 ml/Tag) erhöht werden. In Abhängigkeit vom individuellen klinischen Ansprechen und der Verträglichkeit kann eine weitere schrittweise Aufdosierung bis maximal 12 mg/Tag (24 ml/Tag) erfolgen, was bei einzelnen Patienten wirksam sein kann (siehe «Eigenschaften/Wirkungen», Abschnitt «Klinische Wirksamkeit – primär generalisierte tonisch-klonische Anfälle»).
Intervalle der Aufdosierung
Bei Patienten, die gleichzeitig Arzneimittel einnehmen, welche die Halbwertszeit von Perampanel nicht verkürzen (siehe Abschnitt «Interaktionen»), sollte nicht früher als in 2-wöchigen Abständen titriert werden.
Bei Patienten, die gleichzeitig Arzneimittel einnehmen, welche die Halbwertszeit von Perampanel verkürzen (siehe Abschnitt «Interaktionen»), sollte nicht früher als in 1-wöchigen Abständen titriert werden.
Dosierungsempfehlung bei CYP3A-induzierender Begleitmedikation
Die Ansprechraten nach zusätzlicher Gabe von Perampanel in fixen Dosen waren geringer, wenn die Patienten gleichzeitig CYP 3A-induzierende Antiepileptika (Carbamazepin, Phenytoin, Oxcarbazepin) erhielten, als bei Patienten, die gleichzeitig mit nicht-enzyminduzierenden Antiepileptika behandelt wurden. Das Ansprechen der Patienten ist zu überwachen, wenn diese von gleichzeitig angewendeten nicht-enzyminduzierenden Antiepileptika auf enzyminduzierende Substanzen oder umgekehrt umgestellt werden. Je nach individuellem klinischem Ansprechen und der Verträglichkeit kann die Dosis um jeweils 2 mg erhöht oder reduziert werden.
Art der Anwendung
Fycompa sollte beim Schlafengehen eingenommen werden. Fycompa kann unabhängig von den Mahlzeiten eingenommen werden (siehe «Pharmakokinetik»). Ein Wechsel von der Behandlung mit Tabletten zur Suspension bzw. umgekehrt sollte mit Vorsicht erfolgen (siehe «Pharmakokinetik»).
Filmtabletten:
Die Filmtablette ist als Ganzes mit einem Glas Wasser einzunehmen; sie sollte weder zerkaut, noch zerstossen oder geteilt werden. Die Filmtabletten haben keine Bruchrille und können nicht halbiert werden.
Suspension:
Zum Abmessen Ihrer Dosis verwenden Sie bitte die mitgelieferte Dosierspritze. Nachfolgend finden Sie die Anleitung zur Verwendung von Adapter und Spritze:
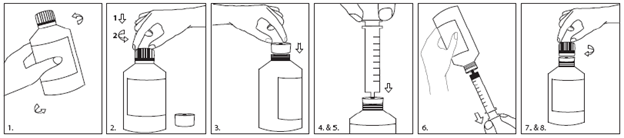
1.Vor Gebrauch mindestens 5 Sekunden schütteln.
2.Zum Öffnen der Flasche die Verschlusskappe herunterdrücken und aufdrehen.
3.Flaschenadapter in den Flaschenhals einsetzen, sodass er dicht abschliesst.
4.Spritzenkolben ganz hinunterdrücken.
5.Die Spritze so weit wie möglich in die Adapteröffnung einführen.
6.Flasche umdrehen und die vorgeschriebene Menge Fycompa aus der Flasche in die Spritze aufziehen.
7.Flasche wieder umdrehen und die Spritze abnehmen.
8.Flaschenadapter in der Flasche lassen und die Verschlusskappe wieder aufsetzen. Die Spritze unter sauberem Wasser abspülen und gut abtrocknen.
Absetzen von Fycompa
Zur Minimierung einer möglichen Gefahr von Rebound-Anfällen wird ein ausschleichendes Absetzen empfohlen. Aufgrund seiner langen Halbwertszeit und des nachfolgend langsamen Rückgangs der Plasmakonzentrationen kann Perampanel jedoch auch abrupt abgesetzt werden, falls dies absolut notwendig ist.
Absetzten der Begleitmedikation
Beim Absetzen von gleichzeitig eingenommenen Enzyminduktoren kann die Perampanel-Plasmakonzentration erhöhen und eine Dosisanpassung erforderlich sein.
Vergessene Einnahme
Bei einmalig vergessener Einnahme sollte der Patient warten und seine nächste Dosis wie vorgesehen einnehmen, da Perampanel eine lange Halbwertszeit besitzt.
Wenn mehr als eine Dosis über einen zusammenhängenden Zeitraum von weniger als 5 Halbwertszeiten vergessen wurde (3 Wochen bei Patienten, die keine den Perampanel-Metabolismus induzierende Antiepileptika einnehmen, 1 Woche bei Patienten, die den Perampanel-Metabolismus induzierende Antiepileptika einnehmen (siehe «Interaktionen»), ist zu erwägen, die Behandlung von der letzten Dosisstufe ausgehend neu zu beginnen.
Wenn ein Patient Perampanel über einen zusammenhängenden Zeitraum von mehr als 5 Halbwertszeiten nicht mehr eingenommen hat, wird empfohlen, die weiter oben für die Behandlungseinleitung gegebenen Empfehlungen zu befolgen.
Jugendliche
Bei Jugendlichen ist auf Anzeichen von Veränderungen im Verhalten zu achten (siehe «Warnhinweise und Vorsichtsmassnahmen» zu Suizidalität und Aggression).
Kinder unter 12 Jahren
Die Sicherheit und Wirksamkeit von Fycompa bei Kindern unter 12 Jahren ist nicht gezeigt, es liegen keine Daten vor. Die Anwendung dieses Arzneimittels in dieser Altersgruppe wird nicht empfohlen (siehe «Warnhinweise und Vorsichtsmassnahmen» zu Suizidalität und Aggression).
Ältere Patienten (ab 65 Jahren)
In klinischen Studien mit Fycompa bei Epilepsie wurde keine ausreichende Zahl von Patienten ab 65 Jahren eingeschlossen, um feststellen zu können, ob diese anders als jüngere Patienten ansprechen. Das Nutzen-Risiko Verhältnis bzw. die Notwendigkeit der Anwendung von Perampanel bei älteren Patienten muss sehr sorgfältig abgewogen werden, da insbesondere bei polymedizierten, älteren Patienten zusätzlich das Potential für Arzneimittelinteraktionen in besonderer Weise zu berücksichtigen ist. Darüber hinaus siehe bitte auch «Warnhinweise und Vorsichtsmassnahmen», insbesondere zu Gleichgewichts- und Koordinationsstörungen sowie Sturzrisiko.
Patienten mit eingeschränkter Nierenfunktion
Bei Patienten mit leicht eingeschränkter Nierenfunktion ist keine Dosisanpassung erforderlich. Die Anwendung von Fycompa bei Patienten mit mittelschwerer bis schwerer Nierenfunktionsstörung oder bei Hämodialysepatienten ist kontraindiziert (siehe auch Abschnitt «Kontraindikationen» sowie «Präklinische Daten»).
Patienten mit eingeschränkter Leberfunktion
Bei Patienten mit leicht und mässig eingeschränkter Leberfunktion sollten Dosiserhöhungen anhand des klinischen Ansprechens und der Verträglichkeit vorgenommen werden in einem Zeitintervall von mindestens zwei Wochen. Die Behandlung kann mit 2 mg (4 ml) begonnen und sollte in Dosisstufen von 2 mg (4 ml) jeweils im Abstand von mindestens 2 Wochen je nach Verträglichkeit und Wirksamkeit auftitriert werden bis auf höchstens 8 mg (16 ml). Die Perampanel-Dosis sollte bei Patienten mit leichter und mittelschwerer Leberfunktionsstörung 8 mg (16 ml) nicht überschreiten. Die Anwendung bei Patienten mit schwerer Leberfunktionsstörung ist kontraindiziert (siehe Abschnitt «Kontraindikationen» sowie «Präklinische Daten»).
KontraindikationenBekannte Überempfindlichkeit gegenüber Perampanel oder einem der Hilfsstoffe.
Mittelschwere oder schwere Nierenfunktionsstörung und bei Hämodialysepatienten.
Schwere Leberfunktionsstörung.
Warnhinweise und VorsichtsmassnahmenKlinische Verschlechterung, Suizidrisiko und Verhaltensänderungen: Notwendigkeit von engmaschigem Monitoring und bei Bedarf rechtzeitigen Änderungen der Therapiestrategie
Es gibt Hinweise, dass bei Epileptikern ein erhöhtes Risiko für Suizidalität besteht. Eine im Januar 2008 veröffentlichte Analyse der FDA (USA) bzgl. der Daten aus 199 placebokontrollierten klinischen Studien mit insgesamt 11 Antiepileptika fand für Patienten mit Epilepsie unter diesen Präparaten ein 3,6-fach höheres Risiko für Suizidalität als unter Placebo. Die einzelnen untersuchten Substanzen unterschieden sich dabei nicht in relevanter Weise bezüglich ihres Risikos für Suizidalität. In dieser Analyse war die Risikoerhöhung bei Patienten mit Epilepsie sogar stärker ausgeprägt als bei Patienten mit psychiatrischen Erkrankungen (wie z.B. bipolaren Störungen), wo eine Risikoerhöhung auf das 1,6-fache gefunden wurde. Insgesamt wurden unter den Antiepileptika in allen Indikationen Suizidgedanken oder suizidales Verhalten bei 0,43% der Behandelten beobachtet, unter Placebo hingegen nur in 0,22%.
Deshalb sollten Patienten auf Anzeichen von Veränderungen im Verhalten, z.B. erhöhte Irritierbarkeit, Gereiztheit, Veränderungen in der Stimmung, Feindseligkeit, neues Auftreten oder Verstärkung von aggressivem Verhalten bis hin zu Drohungen und fremdaggressiven Handlungen, sowie auf Anzeichen für das Auftreten von suizidalen Gedanken sehr gut und engmaschig überwacht werden.
Die bisher verfügbaren Daten können die Möglichkeit eines erhöhten Risikos für Fycompa nicht ausschliessen.
Patienten, die Fycompa zur Behandlung einer Epilepsie erhalten, sollten daher insbesondere zu Beginn eines neuen Behandlungszyklus oder bei einer Dosisbzw. Plasmaspiegeländerungen (Eintitrierung, Dosiserhöhungen, aber auch Ausschleichen sowie bei möglichen Veränderungen der Plasmaspiegel durch Veränderungen der Begleitmedikationen) hinsichtlich einer klinischen Verschlechterung (einschliesslich der Entwicklung von neuen Symptomen) und Suizidalität engmaschig überwacht werden.
Bestimmte Patientengruppen, wie Patienten mit suizidalem Verhalten oder Suizidgedanken in der Anamnese und junge Erwachsene, scheinen ein höheres Risiko für Suizidgedanken oder Suizidversuche aufzuweisen und sollten daher während der Behandlung streng überwacht werden. Dies gilt insbesondere auch für Patienten, bei welchen solche Symptome unmittelbar vor Einleitung der Therapie beobachtet wurden.
Bei Patienten mit einer klinischen Verschlechterung des Zustands (einschliesslich der Entwicklung von neuen Symptomen) und/oder dem Auftreten von Suizidalität ist ein Wechsel der Therapie in Erwägung zu ziehen, insbesondere wenn diese Symptome ausgeprägt sind, abrupt auftreten oder nicht zur ursprünglichen Symptomatik des Patienten gehörten. In solchen Fällen kann auch ein Absetzen der Medikation erforderlich werden.
Es muss in jedem Fall umgehend eine angemessene Therapie in Betracht gezogen werden. Patienten und deren Betreuer sollten angewiesen werden, sofort fachärztlichen Rat einzuholen, wenn sich Anzeichen von suizidalen Gedanken oder suizidalem Verhalten oder auch fremdaggressiven Verhaltensweisen ergeben.
Dies gilt in besonderer Weise für die Gruppe der adoleszenten Patienten. Für Jugendliche (12 bis 18 Jahre) zeigte sich eine höhere Inzidenz neuropsychiatrischer Ereignisse, insbesondere ein vermehrtes Auftreten von Aggressionen, von psychotischen Störungen, von verstärkter Irritierbarkeit und suizidalem Verhalten.
Patienten (und deren Betreuer) sollten auf die Notwendigkeit einer Überwachung im Hinblick auf das Auftreten von Suizidgedanken, suizidalem Verhalten oder selbst – bzw. fremdschädigenden Absichten hingewiesen werden. Im Falle des Auftretens derartiger Symptome sollte sofort der Arzt konsultiert werden.
Arzneimittelreaktion mit Eosinophilie und systemischer Implikation (Drug Reaction with Eosinophilia and Systemic Symptoms, DRESS) / Multiorgan Hypersensitivität
Arzneimittelreaktion mit Eosinophilie und systemischer Implikation wurde bei Patienten, die Antiepileptika, einschliesslich Perampanel einnehmen, beobachtet. DRESS kann tödlich oder lebensgefährlich sein. DRESS äussert sich in einem Hautausschlag mit Eosinophilie zusammen mit einem oder mehreren der folgenden Merkmale: Fieber, Lymphadenopathie, Gesichtsödem, Organbeteiligung (Leber, Niere, Lunge). DRESS kann durch eine lange Latenzzeit (von 2 bis 8 Wochen) zwischen Arzneimittelexposition und dem Auftreten der Krankheit charakterisiert sein. Sollten Anzeichen oder Symptome von DRESS auftreten, muss der Patient sofort untersucht werden und Perampanel sollte abgesetzt werden, sofern keine andere Ursache für die Symptome gefunden wird.
Erkrankungen des Nervensystems
Perampanel kann Schwindel und Somnolenz hervorrufen und deshalb die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen stark beeinträchtigen (siehe Abschnitt «Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen»).
Aggression
Über Fälle von Aggression wurde berichtet. Es liegt eine Dosisabhängigkeit vor, da unter höheren Dosen häufiger darüber berichtet wurde. Diese wurden häufiger bei Jugendlichen als bei Erwachsenen beobachtet. Daher sollte die Dosis titriert werden und bei anhaltender Aggressionssymptomatik eine Dosisreduktion und ggf. Therapiebeendigung erwogen werden (siehe Abschnitt «Dosierung/Anwendung»). Diese Fälle und die Massnahmen sind vorab mit einem Facharzt zu besprechen und zu planen.
Die meisten dieser Ereignisse waren in den klinischen Studien leicht oder mässig ausgeprägt und bildeten sich entweder spontan oder nach Dosisanpassung wieder zurück. In einigen Fällen wurde aber über eine stark ausgeprägte Aggression berichtet, die zum Therapieabbruch führte. Es wird empfohlen, Patienten (und Betreuer) zu Behandlungsbeginn über das mögliche Auftreten erhöhter Reizbarkeit, Aggression und depressiver Verstimmungen zu informieren (siehe entsprechenden Abschnitt «Klinische Verschlechterung, Suizidrisiko und Verhaltensänderungen: Notwendigkeit von engmaschigem Monitoring und bei Bedarf rechtzeitigen Änderungen der Therapiestrategie»).
Sturzrisiko
Es besteht ein erhöhtes Sturzrisiko, insbesondere bei älteren Patienten. Die Ursache ist unklar, Gleichgewichtsstörungen, Schwindel und Benommenheit als mögliche Nebenwirkungen könnten beteiligt sein. Patienten und Betreuer müssen diesbezüglich aufmerksam sein, insbesondere zu Beginn der Behandlung und bei Änderungen der Dosis und/oder der Begleitmedikation (inklusive Änderungen der Dosis der Begleitmedikation).
Gleichzeitig angewendete Cytochrom P450-Induktoren oder -Inhibitoren
Wenn Cytochrom P450-Induktoren oder -Inhibitoren zusätzlich angewendet oder abgesetzt werden, sollten die Patienten hinsichtlich Verträglichkeit und klinischem Ansprechen engmaschig überwacht werden, da die Perampanel-Plasmaspiegel abfallen bzw. ansteigen können; die Perampanel-Dosis ist gegebenenfalls entsprechend anzupassen (siehe «Dosierung/Anwendung» und «Interaktionen»).
Orale Kontrazeptiva
Aufgrund der nachgewiesenen Interaktion mit Levonorgestrel kann die Wirksamkeit gestagenhaltiger oraler Kontrazeptiva grundsätzlich herabgesetzt sein (siehe Abschnitt «Interaktionen»). Dies ist zu berücksichtigen und es wird empfohlen eine zusätzliche, nicht-hormonelle Verhütungsmethode (Intrauterinpessar (IUP), Kondom) anzuwenden.
Missbrauchspotential
Bei Patienten mit Suchtmittelmissbrauch in der Vorgeschichte ist Vorsicht geboten. Der Patient sollte auf Symptome eines Missbrauchs von Perampanel überwacht werden.
Inhaltsstoffe von speziellem Interesse
Fycompa Filmtabletten:
Lactose: Patienten mit der seltenen hereditären Galactose-Intoleranz, völligem Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten die Filmtabletten nicht anwenden.
Fycompa Suspension:
Sorbitol: Die Fycompa Suspension enthält 175 mg Sorbitol pro ml, das eine Quelle für Fructose ist. Patienten mit hereditärer Fructoseintoleranz (HFI) dürfen dieses Arzneimittel nicht einnehmen. Sorbitol kann Magen-Darm-Beschwerden hervorrufen und kann eine leicht abführende Wirkung haben.
Bei gleichzeitiger Anwendung von Fycompa Suspension mit anderen Antiepileptika, die Sorbitol enthalten, ist Vorsicht geboten, da die Einnahme von insgesamt mehr als 1 Gramm Sorbitol die Resorption bestimmter Arzneimittel beeinflussen kann.
Benzoesäure/Benzoate: Die Fycompa Suspension enthält Benzoesäure und Natriumbenzoat.
Natrium: Die Fycompa Suspension enthält weniger als 1 mmol Natrium (23 mg) pro ml, d.h. sie ist nahezu «natriumfrei».
InteraktionenPharmakokinetischen Interaktionen
In-vitro Daten
Arzneimittelmetabolismus Enzyminhibition
In humanen Lebermikrosomen hatte Perampanel (30 µmol/l) bei den wichtigsten hepatischen CYP- und UGT-Enzymen eine schwach hemmende Wirkung auf CYP2C8 und UGT1A9.
Arzneimittelmetabolismus Enzyminduktion
Verglichen mit Positivkontrollen (einschliesslich Phenobarbital, Rifampicin), wurde für Perampanel bei den wichtigsten hepatischen CYP und UGT-Enzymen eine schwach induzierende Wirkung auf CYP2B6 (30 µmol/l) und CYP3A4/5 (≥3 µmol/l) in gezüchteten humanen Hepatozyten gefunden.
In-vivo Daten
CYP3A-Substrate
Bei gesunden Probanden bewirkte Fycompa (6 mg/Tag über 20 Tage) eine Abnahme der AUC von Midazolam um 13%. Eine grössere Abnahme der Exposition gegenüber Midazolam (oder anderen sensitiven CYP3A-Substraten) kann bei höheren Fycompa-Dosen nicht ausgeschlossen werden.
Cytochrom P450-Induktoren
Bei starken Induktoren von Cytochrom P450 wie Rifampicin und Hypericum ist mit einer Abnahme der Perampanel-Konzentrationen zu rechnen und die Möglichkeit von erhöhten Plasmakonzentrationen reaktiver Metaboliten ist in ihrer Gegenwart nicht auszuschliessen. Felbamat vermindert nachweislich die Konzentrationen bestimmter Arzneistoffe und könnte auch die Perampanel-Konzentrationen vermindern.
Cytochrom P450-Inhibitoren
Bei gesunden Probanden erhöhte der CYP3A4-Inhibitor Ketoconazol (400 mg/Tag über 10 Tage) die AUC von Perampanel um 20% und verlängerte die Halbwertszeit von Perampanel um 15% (67,8 h gegenüber 58,4 h). Stärkere Wirkungen können nicht ausgeschlossen werden, wenn Perampanel mit einem CYP3A-Inhibitor mit längerer Halbwertszeit als Ketoconazol kombiniert wird oder wenn der Inhibitor über eine längere Behandlungsdauer angewendet wird. Starke Inhibitoren anderer Cytochrom P450 Isoformen könnten die Perampanel Konzentrationen möglicherweise ebenfalls erhöhen.
Levodopa
Bei gesunden Probanden hatte Fycompa (4 mg/Tag über 19 Tage) keinen Einfluss auf die Cmax oder die AUC von Levodopa.
Antiepileptika
Mögliche Wechselwirkungen zwischen Fycompa (bis zu 12 mg/Tag) und anderen Antiepileptika (AED) wurden in klinischen Studien untersucht und in der populations-pharmakokinetischen Analysen von vier gepoolten Phase-3-Studien, mit Patienten mit fokalen sowie primär generalisierten tonisch-klonischen Anfällen, beurteilt. Die Auswirkungen dieser Wechselwirkungen auf die durchschnittliche Steady-State-Konzentration werden in der folgenden Tabelle zusammengefasst (die in der Tabelle angegebenen Werte basieren auf populationskinetischen Modellen).
|
Gleichzeitig angewendetes AED
|
Einfluss des AED auf die Perampanel-Konzentration
|
Einfluss von Perampanel auf die AED-Konzentration
| |
Carbamazepin
|
Abnahme auf ein Drittel
|
<10% Abnahme
| |
Clobazam
|
kein Einfluss
|
<10% Abnahme
| |
Clonazepam
|
kein Einfluss
|
kein Einfluss
| |
Lamotrigin
|
kein Einfluss
|
<10% Abnahme
| |
Levetiracetam
|
kein Einfluss
|
kein Einfluss
| |
Oxcarbazepin
|
Abnahme auf die Hälfte
|
35% Zunahme1)
| |
Phenobarbital
|
kein Einfluss
|
kein Einfluss
| |
Phenytoin
|
Abnahme auf die Hälfte
|
kein Einfluss
| |
Topiramat
|
20% Abnahme
|
kein Einfluss
| |
Valproinsäure
|
kein Einfluss
|
<10% Abnahme
| |
Zonisamid
|
kein Einfluss
|
kein Einfluss
|
1) Der aktive Metabolit Monohydroxycarbazepin wurde nicht untersucht.
Für einige als Enzyminduktoren bekannte Antiepileptika (Carbamazepin, Phenytoin, Oxcarbazepin) wurde gezeigt, dass sie die Perampanel-Clearance erhöhen und folglich die Plasmakonzentrationen von Perampanel vermindern.
Umgekehrt kann das Absetzen von begleitenden Enzyminduktoren die Perampanel-Plasmakonzentration erhöhen und eine Dosisanpassung kann erforderlich sein. Carbamazepin, ein bekanntermassen potenter Enzyminduktor, führte in einer bei gesunden Probanden durchgeführten Studie zu einer Abnahme der Perampanelspiegel um zwei Drittel.
Ein ähnliches Ergebnis fand sich in einer populations-pharmakokinetischen Analyse von Patienten mit fokalen Anfällen und Patienten mit primär generalisierten tonisch-klonischen Anfällen, die in placebokontrollierten klinischen Studien Perampanel in einer Dosierung von bis zu 12 mg/Tag erhielten. Die Gesamtclearance von Fycompa war erhöht, wenn es zusammen mit Carbamazepin (3-fach), Phenytoin (2-fach) und Oxcarbazepin (2-fach), bekannte Induktoren von Metabolisierungsenzymen, angewendet wurde (siehe Abschnitt «Pharmakokinetik»). Dieser Effekt ist bei der zusätzlichen Anwendung bzw. beim Absetzen dieser Antiepileptika im Rahmen des Therapieschemas eines Patienten zu berücksichtigen und bei der Therapieführung zu beachten.
In einer populationspharmakokinetischen Analyse von Patienten mit fokalen Anfällen, die in placebokontrollierten klinischen Studien Perampanel in einer Dosierung von bis zu 12 mg/Tag erhielten und Patienten mit primär generalisierten tonisch-klonischen Anfällen mit bis zu 8 mg/Tag, hatte Fycompa in der höchsten untersuchten Perampaneldosis (8 resp. 12 mg/Tag) keinen klinisch relevanten Einfluss auf die Clearance von Clonazepam, Levetiracetam, Phenobarbital, Phenytoin, Topiramat, Zonisamid, Carbamazepin, Clobazam, Lamotrigin und Valproinsäure.
Die an der Epilepsie-Patientenpopulation durchgeführte pharmakokinetische Analyse zeigte, dass Perampanel die Clearance von Oxcarbazepin um 26% vermindert. Oxcarbazepin wird von der zytosolischen Reduktase rasch in den aktiven Metaboliten Monohydroxycarbazepin umgewandelt. Der Einfluss von Perampanel auf die Monohydroxycarbazepin-Konzentrationen ist nicht bekannt.
Perampanel wird unabhängig von anderen AED entsprechend der klinischen Wirkung dosiert.
Orale Kontrazeptiva
Aufgrund der nachgewiesenen Interaktion mit Levonorgestrel kann die Wirksamkeit gestagenhaltiger oraler Kontrazeptiva grundsätzlich herabgesetzt sein. Es wird empfohlen eine zusätzliche, nicht-hormonelle Verhütungsmethode (Intrauterinpessar (IUP), Kondom) anzuwenden.
Bei gesunden Frauen bewirkte Fycompa in einer kontrollierten klinischen Studie bei Gabe von 12 mg (jedoch nicht bei 4 oder 8 mg/Tag) über 21 Tage zusammen mit einem kombinierten oralen Kontrazeptivum nachweislich eine Abnahme der Levonorgestrel-Exposition (die mittleren Cmax- und AUC-Werte nahmen um jeweils 40% ab). Die AUC-Werte von Ethinylestradiol wurden von Fycompa 12 mg nicht beeinflusst, während die Cmax um 18% abnahm. Die Möglichkeit einer verminderten Wirksamkeit gestagenhaltiger oraler Kontrazeptiva ist bei Mädchen oder Frauen im gebärfähigen Alter, die Fycompa benötigen, generell in angemessener Weise zu berücksichtigen (siehe Abschnitt «Warnhinweise und Vorsichtsmassnahmen»).
Pädiatrische Population
Studien zur Erfassung von Wechselwirkungen wurden nur mit Erwachsenen durchgeführt. Die diesbezügliche Datenlage in der pädiatrischen Population ist begrenzt: In einer populations-pharmakokinetischen Analyse jugendlicher Patienten in den klinischen Studien der Phase 3 wurden keine nennenswerten Unterschiede zwischen dieser Population und der Gesamtpopulation gefunden.
Pharmakodynamische Interaktionen
Alkohol
Die Wirkungen von Perampanel auf Tätigkeiten, die Aufmerksamkeit und Vigilanz erfordern, waren zu den Eigenwirkungen von Alkohol additiv oder sogar supraadditiv. Die Mehrfachdosierung von Perampanel 12 mg/Tag verstärkte die Wirkungen von Alkohol auch bezüglich Wachsamkeit und Aufmerksamkeit und erhöhte das Niveau von Wut, Verwirrtheit und Depression (siehe Abschnitt «Eigenschaften/Wirkungen»). Diese Wirkungen können auch beobachtet werden, wenn Fycompa in Kombination mit anderen, das Zentralnervensystem (ZNS) dämpfenden Substanzen, verwendet wird.
Schwangerschaft/StillzeitFrauen im gebärfähigen Alter und Kontrazeption
Die Anwendung von Fycompa bei Frauen im gebärfähigen Alter, die keine Kontrazeption anwenden, wird nicht empfohlen. Aufgrund der nachgewiesenen Interaktion mit Levonorgestrel kann die Wirksamkeit gestagenhaltiger oraler Kontrazeptiva herabgesetzt sein (siehe Abschnitte «Warnhinweise und Vorsichtsmassnahmen» und «Interaktionen»).
Fertilität
Die Wirkung von Perampanel auf die Fertilität wurde beim Menschen nicht untersucht. In Tierstudien beobachtete Effekte hatten keine Auswirkungen auf die Fertilität (siehe «Präklinische Daten»).
Schwangerschaft
Bisher liegen nur begrenzte Erfahrungen (weniger als 300 Schwangerschafts-Ausgänge) über die Anwendung von Perampanel bei Schwangeren vor. Tierexperimentelle Studien ergaben keine Hinweise auf teratogene Wirkungen bei Ratten oder Kaninchen, jedoch wurde bei Ratten bei Gabe maternal-toxischer Dosen Embryotoxizität beobachtet (siehe «Präklinische Daten»).
Stillzeit
Studien mit säugenden Ratten zeigten, dass Perampanel und/oder seine Metaboliten in die Milch übergehen (für Details siehe «Präklinische Daten»). Es ist nicht bekannt, ob Perampanel bei Menschen in die Muttermilch übergeht. Ein Risiko für das Neugeborene/Kleinkind kann nicht ausgeschlossen werden. Unter Abwägung des Nutzens des Stillens für das Kind und des Therapievorteils für die Frau muss entschieden werden, ob abgestillt oder die Therapie mit Fycompa abgebrochen wird.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenFycompa hat einen starken Einfluss auf die Fahrtüchtigkeit oder die Fähigkeit, Maschinen zu bedienen. Perampanel kann unter anderem Benommenheit, Schwindel, Schläfrigkeit, Übelkeit, verstärkte Reizbarkeit und Irritierbarkeit hervorrufen und kann daher die Fahrtüchtigkeit oder die Fähigkeit, Maschinen zu bedienen, stark beeinträchtigen. Die Patienten sind anzuweisen, so lange kein Fahrzeug zu führen, keine Maschinen zu bedienen und keine sonstigen potenziell gefährlichen Aktivitäten zu betreiben bzw. Tätigkeiten zu verrichten, bis untersucht bzw. bekannt ist, ob Perampanel ihre Fähigkeit zur Verrichtung dieser beeinflusst.
Unerwünschte WirkungenInsgesamt erhielten in allen kontrollierten und nicht-kontrollierten Studien mit Patienten mit fokalen Anfällen 1639 Patienten Perampanel, wovon 1'147 während 6 Monaten und 703 länger als 12 Monate behandelt wurden. In den kontrollierten und nicht-kontrollierten Studien mit Patienten mit primär generalisierten tonisch-klonischen Anfällen erhielten 114 Patienten Perampanel, davon 68 während 6 Monaten und 36 länger als 12 Monate.
Fokale Anfälle:
Unerwünschte Wirkungen, die zum Abbruch der Behandlung führten: In kontrollierten klinischen Studien der Phase 3 lag die Abbruchrate aufgrund von unerwünschten Wirkungen bei Patienten, die randomisiert wurden, um Perampanel in den empfohlenen Dosen von 4 mg, 8 mg und 12 mg/Tag zu erhalten bei 2,9%, 7,7% und 19,2% und bei 4,8% bei Patienten der Placebogruppe. Schwindel und Somnolenz waren die häufigsten unerwünschten Wirkungen (>10% in der gesamten Perampanel Gruppe und häufiger unter Placebo), die zum Therapieabbruch führten.
Primär generalisierte Anfälle:
In der kontrollierten Phase 3 Studie der primär generalisierten tonisch-klonischen Anfälle betrug die Abbruchrate in der für die Perampanel-Gruppe (bis 8 mg/d) aufgrund von unerwünschten Wirkungen 4,9%, in der Placebo-Gruppe 1,2%. Schwindel war die häufigste unerwünschte Wirkung, die zum Therapieabbruch führte (>2% in der gesamten Perampanel Gruppe und häufiger unter Placebo).
In der nachfolgenden Liste sind die unerwünschten Wirkungen nach Organklasse und Häufigkeit geordnet. Die folgenden Häufigkeitsangaben wurden für die Klassifizierung der unerwünschten Wirkungen verwendet: sehr häufig: ≥1/10, häufig: ≥1/100, <1/10, gelegentlich: ≥1/1'000, <1/100, selten: ≥1/10'000, <1/1'000, nicht bekannt: Häufigkeit aufgrund der verfügbaren Daten nicht abschätzbar.
Stoffwechsel und Ernährungsstörungen
Häufig: verminderter Appetit, erhöhter Appetit.
Psychiatrische Erkrankungen
Häufig: Angst, Aggressivität, Wutgefühle, Verwirrtheit, Entwicklung depressiver Symptomatik.
Gelegentlich: Suizidalität, Risiko für Eigen- und Fremdgefährdung.
Erkrankungen des Nervensystems
Sehr häufig: Schwindel (32%), Somnolenz (15%).
Häufig: Ataxie, Gleichgewichtsstörungen, Dysarthrie, Reizbarkeit.
Augenerkrankungen
Häufig: Diplopie, verschwommenes Sehen.
Erkrankungen des Ohrs und des Labyrinths
Häufig: Vertigo.
Erkrankungen des Gastrointestinaltrakts
Häufig: Übelkeit.
Erkrankungen der Haut und des Unterhautgewebes
Nicht bekannt: Arzneimittelreaktion mit Eosinophilie und systemischen Symptomen (Drug Reaction with Eosinophilia and Systemic Symptoms [DRESS]).
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Häufig: Rückenschmerzen.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Fatigue, Gangstörungen.
Verletzung, Vergiftung und durch Eingriffe bedingte Komplikationen
Häufig: Stürze.
Untersuchungen
Häufig: Gewichtszunahme.
Pädiatrische Population
Basierend auf den klinischen Studiendaten von 196 Jugendlichen (12 bis 18 Jahre) unter Perampanel in Doppelblindstudien bei fokalen Anfällen und primär generalisierten tonisch-klonischen Anfällen ist das Sicherheitsprofil bei Jugendlichen vergleichbar mit dem von Erwachsenen, ausser betreffend Aggressivität, die bei Jugendlichen häufiger auftrat als bei Erwachsenen (siehe auch «Warnhinweise und Vorsichtsmassnahmen»).
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch
ÜberdosierungEs besteht nur eine limitierte klinische Erfahrung bezüglich Überdosierung von Perampanel bei Menschen. In einem Bericht über eine absichtliche Überdosierung, bei der eventuell bis zu 264 mg Fycompa eingenommen wurden, wies der Patient Bewusstseinstrübung, gesteigerte Erregbarkeit/Agitiertheit und aggressives Verhalten auf. Er konnte ohne Folgeerscheinungen wiederhergestellt werden.
Es gibt kein spezifisches Antidot für Perampanel. Allgemeine unterstützende Massnahmen inklusive Überwachung der Vitalzeichen und Beobachtung des klinischen Status des Patienten sind indiziert. Angesichts der langen Halbwertszeit könnten die durch Perampanel hervorgerufenen Wirkungen verlängert sein. Aufgrund der niedrigen renalen Clearance sind spezielle Massnahmen wie forcierte Diurese, Dialyse oder Hämoperfusion wahrscheinlich nicht von Nutzen.
Eigenschaften/WirkungenATC-Code: N03AX22
Wirkungsmechanismus
Perampanel ist ein first-in-class, selektiver, nicht-kompetitiver Antagonist des ionotropen α-Amino-3-hydroxy-5-methyl-4-isoxazol-propionsäure (AMPA) Glutamat-Rezeptors auf post-synaptischen Neuronen. Glutamat ist der primäre exzitatorische Neurotransmitter im zentralen Nervensystem. Es wird angenommen, dass die Aktivierung von AMPA-Rezeptoren durch Glutamat für die meisten schnellen exzitatorischen synaptischen Übertragungen im Gehirn verantwortlich ist. In in-vitro Studien hemmte Perampanel die AMPA-induzierte Erhöhung von intrazellulärem Calcium.
Der exakte Mechanismus, durch welchen Perampanel in Menschen seine antiepileptische Wirkung entfaltet, ist noch nicht vollständig aufgeklärt.
Pharmakodynamische Wirkungen
Basierend auf den zusammengefassten Daten der 3 Wirksamkeitsstudien über fokale Anfälle wurde eine pharmakokinetisch-pharmakodynamische (Wirksamkeits-) Analyse durchgeführt. Eine solche wurde ebenfalls mit der Studie zu den primär generalisierten tonisch-klonischen Anfällen durchgeführt. In beiden Analysen korreliert die Perampanel-Exposition mit der Abnahme der Anfallshäufigkeit.
Psychomotorische Leistungsfähigkeit
In einer Studie mit gesunden Probanden wurden Standardbewertungsmethoden inklusive simuliertes Fahren verwendet, um die Wirkungen von Perampanel auf die psychomotorische Leistungsfähigkeit zu beurteilen. Einfache psychomotorische Aufgaben, die Fahrfähigkeit oder die sensorisch-motorische Koordination wurden durch tägliche Einzel- und Mehrfachdosen von 4 mg Perampanel nicht beeinträchtigt. Einzel- und Mehrfachdosen von 8 mg und 12 mg beeinträchtigten dosisabhängig die psychomotorische Leistungsfähigkeit. Die Fähigkeit ein Auto zu lenken, war nach Dosierung von 12 mg Perampanel vermindert, aber die Haltungsstabilität wurde nicht signifikant beeinträchtigt. Innerhalb von 2 Wochen nach Absetzen der Behandlung mit Perampanel erreichte die Leistungsfähigkeit wieder den Ausgangswert. Nachdem gesunden Probanden in der gleichen Studie Alkohol verabreicht wurde, um eine Blutkonzentration von 80 - 100 mg/100 ml zu erreichen, beeinträchtigte Perampanel die einfache psychomotorische Leistungsfähigkeit durchwegs nach Einzeldosen von 4 bis 12 mg (n=35) sowie nach 21 Tagen mit Mehrfachdosen von 12 mg/Tag (n=24). Die Wirkungen von Perampanel auf komplexe Tätigkeiten wie auf die Fahrtüchtigkeit waren additiv oder supraadditiv zu den beeinträchtigenden Wirkungen des Alkohols.
Kognitive Funktion
In einer Studie mit gesunden Probanden wurden Standardbewertungsmethoden verwendet, um die Wirkungen von Perampanel auf die Wachsamkeit und das Gedächtnis zu beurteilen. Nach einzelnen und mehrfachen Dosen von bis zu 12 mg Perampanel pro Tag wurde keine Beeinträchtigung gefunden.
In einer placebokontrollierten Studie bei jugendlichen Patienten zeigten Messungen anhand des Global Cognition Scores des Cognitive Drug Research (CDR) System keine signifikanten Veränderungen der Kognition für Perampanel gegenüber Placebo. In der offenen Verlängerungsphase dieser Studie wurden nach 52 Wochen Perampanel-Behandlung keine signifikanten Veränderungen des globalen CDRSystem-Scores beobachtet (siehe Abschnitt «Kinder und Jugendliche» weiter unten).
Aufmerksamkeit und Stimmung
Bei gesunden Probanden nahm der Grad der Aufmerksamkeit (Reaktionsbereitschaft) unter Perampanel in Dosierungen von 4 bis 12 mg/Tag dosisabhängig ab. Die Stimmung verschlechterte sich bei gesunden Probanden nur nach Dosen von 12 mg/Tag; die Stimmungsveränderungen waren gering und widerspiegelten eine allgemeine generelle Dämpfung. Die wiederholte Verabreichung von Perampanel 12 mg/Tag verstärkte auch die Wirkungen von Alkohol bezüglich Wachsamkeit und Aufmerksamkeit sowie die Intensität von Wutgefühlen, Verwirrtheit und Depression.
Kardiale Elektrophysiologie
Elektrokardiographische Wirkungen von Perampanel wurden in einer doppelblinden, randomisierten, Placebo- und mit Moxifloxazin kontrollierten klinischen Pharmakologiestudie bei gesunden Probanden bestimmt. Perampanel wurde in täglichen Dosen von bis zu 12 mg/Tag während 7 Tagen appliziert. Perampanel verlängerte das QTc Intervall nicht und es hatte keinen dosisabhängigen oder klinisch bedeutsamen Effekt auf die QRS-Dauer.
Klinische Wirksamkeit - fokale Anfälle
Der Nachweis der Wirksamkeit von Perampanel als Zusatztherapie bei fokalen Anfällen wurde in drei 19-wöchigen, randomisierten, doppelblinden, placebokontrollierten, multizentrischen Studien mit erwachsenen und jugendlichen Patienten bestimmt. Die Patienten wiesen fokale Anfälle mit oder ohne sekundäre Generalisierung auf und konnten mit einem bis drei gleichzeitig verabreichten Antiepileptika nicht angemessen kontrolliert werden.
Während einer 6-wöchigen Baseline-Periode mussten die Patienten mehr als fünf Anfälle und keine anfallsfreie Periode über 25 Tagen aufweisen. In diesen drei Studien betrug die mittlere Epilepsiedauer der Patienten ungefähr 21,06 Jahre. Zwischen 85,3% und 89,1% der Patienten nahmen zwei bis drei gleichzeitig verabreichte Antiepileptika in Kombination mit oder ohne gleichzeitiger Vagus-Stimulation ein.
Zwei Studien verglichen Perampanel in Dosen von 8 und 12 mg/Tag mit Placebo und die dritte Studie verglich Dosen von 2, 4 und 8 mg/Tag mit Placebo. Nach einer 6-wöchigen Baseline-Phase zur Ermittlung der Anfallshäufigkeit vor der Randomisierung wurden die Patienten in allen drei Studien randomisiert und bis zur randomisierten Dosis titriert. Während der Titrationsphase wurde in allen drei Studien die Behandlung mit 2 mg/Tag begonnen und in wöchentlichen Schritten von 2 mg/Tag bis zur Zieldosis erhöht. Patienten, welche nicht tolerierbare unerwünschte Wirkungen hatten, konnten bei der gleichen Dosis bleiben oder ihre Dosis auf die vorher verträgliche Dosis reduzieren. In allen drei Studien folgte nach der Titrationsphase eine 13-wöchige Erhaltungsphase, während derer Patienten auf einer stabilen Dosis von Perampanel bleiben sollten.
Die gepoolten 50%-Responderraten lagen unter Placebo bei 19%, unter 4 mg bei 29%, unter 8 mg bei 35% und unter 12 mg bei 35%. Eine statistisch signifikante Wirkung hinsichtlich der Reduktion der Anfallshäufigkeit pro 28 Tage (von der Baseline- zur Behandlungsphase) im Vergleich zur Placebogruppe wurde unter der Behandlung mit Fycompa für die Dosierungen 4 mg/Tag (Studie 306), 8 mg/Tag (Studien 304, 305 und 306) und 12 mg/Tag (Studien 304 und 305) beobachtet. Diese Studien zeigen, dass die einmal tägliche Gabe von Perampanel in Dosen von 4 mg bis 12 mg in dieser Population als Zusatztherapie signifikant wirksamer war als Placebo.
Daten aus placebokontrollierten Studien belegen, dass bei einmal täglicher Gabe von Fycompa 4 mg eine Verbesserung der Anfallskontrolle beobachtet wird und dass dieser Nutzen bei Steigerung der Dosis auf 8 mg/Tag noch verstärkt wird. Im Gesamtkollektiv wurde für die 12 mg-Dosis im Vergleich zur 8 mg-Dosis kein Wirksamkeitsnutzen beobachtet. Ein Nutzen wurde unter der 12 mg-Dosis bei manchen Patienten beobachtet, welche die 8 mg-Dosis vertrugen und bei dieser Dosis ein unzureichendes klinisches Ansprechen aufwiesen.
Kinder und Jugendliche:
In den drei pivotalen, doppelblinden, placebokontrollierten Phase 3 Studien gab es insgesamt n = 143 Jugendliche im Alter zwischen 12 und 18 Jahren, die in diese Studien zusätzlich zu den erwachsenen Patienten aufgenommen worden waren. Die bei diesen Jugendlichen erhaltenen Ergebnisse waren mit denjenigen der erwachsenen Population vergleichbar.
Eine 19-wöchige, randomisierte, doppelblinde, placebokontrollierte Studie mit offener Verlängerungsphase (Studie 235) beurteilte die kurzfristigen Wirkungen von Fycompa auf die Kognition (Zieldosis: 8 bis 12 mg einmal täglich) während der Anwendung als Zusatztherapie bei 133 (Fycompa n=85, Placebo n=48) jugendlichen Patienten im Alter von 12 bis unter 18 Jahren mit nicht ausreichend kontrollierten fokalen Anfällen. Die kognitive Funktion wurde mithilfe des Global Cognition t-Scores des Cognitive Drug Research (CDR) System bewertet. Es handelt sich dabei um einen aus 5 Domänen zusammengesetzten Score, der Folgendes testet: Power of Attention (Aufmerksamkeitsleistung), Continuity of Attention (Aufmerksamkeitsdauer), Quality of Episodic Secondary Memory (Qualität des episodischen Sekundärspeichers), Quality of Working Memory (Qualität des Arbeitsgedächtnisses) und Speed of Memory (Gedächtnisgeschwindigkeit). Die mittlere Veränderung (SD) des CDR System Global Cognition t-Scores gegenüber dem Ausgangswert bis zum Ende der doppelblinden Behandlungsphase (19 Wochen) betrug 1,1 (7,14) in der Placebo-Gruppe und (minus) –1,0 (8,86) in der Perampanel-Gruppe, wobei der Unterschied zwischen den Behandlungsgruppen in Bezug auf den LS-Mittelwert (95% KI) (minus) -2,2 (-5,2; 0,8) betrug. Es bestand kein statistisch signifikanter Unterschied zwischen den Behandlungsgruppen (p = 0,145). Die Global Cognition t-Scores des CDR System für Placebo und Perampanel betrugen 41,2 (10,7) bzw. 40,8 (13,0) bei der Ausgangswerterhebung. Bei Patienten, die Perampanel in der offenen Verlängerungsphase erhielten (n = 112), betrug die mittlere Veränderung (SD) des Global Cognition t-Scores des CDR System gegenüber dem Ausgangswert bis zum Ende der offenen Behandlung (52 Wochen) (minus) -1,0 (9,91). Dieses Ergebnis war nicht statistisch signifikant (p = 0,96). Nach bis zu 52 Wochen Behandlung mit Perampanel (n = 114) war keine Wirkung auf das Knochenwachstum zu beobachten. Nach bis zu 104 Wochen Behandlung zeigten sich keine Wirkungen auf Körpergewicht, Körpergrösse und sexuelle Entwicklung (n = 114).
Klinische Wirksamkeit – primär generalisierte tonisch-klonische Anfälle
In einer multizentrischen, randomisierten, doppelblinden, placebokontrollierten Studie wurde die Wirksamkeit von Perampanel bei Patienten ab 12 Jahren, die an idiopathisch generalisierter Epilepsie mit primär tonisch-klonischen Anfällen litten, untersucht.
Eingeschlossen wurden Patienten, die mit einem bis drei gleichzeitig verabreichten Antiepileptika während der 8-wöchigen Baseline-Periode mindestens 3 primär generalisierte tonisch-klonische Anfälle hatten. Die Studie umfasste 164 Patienten (Perampanel n = 82, Placebo n = 82), die über vier Wochen auf die Zieldosis von 8 mg/Tag, oder die höchst tolerierte Dosis, auftitriert wurden und über weitere 13 Wochen auf dem Dosislevel behandelt wurden. Die gesamte Behandlungsdauer betrug 17 Wochen. Die Studienmedikation wurde einmal täglich eingenommen.
Die 50%-Responderrate für primär generalisierte tonisch-klonische Anfälle während des Erhaltungstherapiezeitraums war in der Perampanel-Gruppe statistisch signifikant höher (58,0%) als in der Placebo-Gruppe (35,8%), p=0,0059. Die mediane prozentuale Veränderung der Häufigkeit von primär generalisierten tonisch-klonischen Anfällen pro 28-Tage-Zeitraum war während der Titrations- und Erhaltungstherapiephase (kombiniert) im Verhältnis zur Vorrandomisierung unter Perampanel grösser (-76,5%) als unter Placebo (-38,4%), p<0,0001. Während der 3-monatigen Erhaltungsphase wurden 30,9% (25/81) der Patienten, die in den klinischen Studien mit Perampanel behandelt wurden, frei von primär generalisierten tonisch-klonischen Anfällen, verglichen mit 12,3% (10/81) unter Placebo. Die Studie zeigt, dass die einmal täglich Gabe von 8 mg Perampanel als Zusatztherapie signifikant wirksamer als Placebo ist.
Offene Verlängerungsphase: Von den 140 Patienten (81,4%), welche die kontrollierte Studie abschlossen traten 114 in die offene Verlängerungsphase. Die Patienten auf Placebo wurden innerhalb von sechs Wochen auf Perampanel umgestellt. Gefolgt von einer Erhaltungstherapie (≥1 Jahr). In der Verlängerungsphase ≥1 Jahr erhielten 73,7% der Patienten mehr als 4 bis 8 mg/Tag und 16,7% 8 bis 12 mg/Tag.
Die Studie schloss 22 Jugendliche im Alter zwischen 12 und 18 Jahren ein. Die Ergebnisse dieser Population sind mit denen der Erwachsenen vergleichbar.
Andere Anfallstypen generalisierter Anfälle:
Die Wirksamkeit und Sicherheit von Perampanel bei Patienten mit myoklonischen Anfällen ist nicht belegt; mit den verfügbaren Daten kann keine abschliessende Beurteilung vorgenommen werden. Die Wirksamkeit von Perampanel in der Behandlung von Absencen wurde nicht gezeigt.
In der multizentrischen, randomisierten, doppelblinden, placebokontrollierten Studie 332 waren von den Patienten mit PGTC- und zusätzlichen myoklonischen Anfällen 16,7% (4/24) unter Perampanel verglichen mit 13,0% (3/23) unter Placebo anfallsfrei. Bei Patienten, die zusätzlich zu den PGTC-Anfällen auch Absencen hatten, waren 22,2% (6/27) auf Perampanel verglichen mit 12,1% (4/33) auf Placebo anfallsfrei. Anfallsfrei (PGTC-, myoklonische Anfälle und Absencen) waren 23,5% (19/81) der Patienten auf Perampanel verglichen mit 4.9% (4/81) auf Placebo.
Absetzen der AED-Begleitmedikation
In einer retrospektiven Studie zur klinischen Praxis wurden 51 Patienten mit Epilepsie, die Perampanel als Zusatztherapie erhielten, auf eine Perampanel-Monotherapie umgestellt. Die Mehrheit dieser Patienten hatte eine Vorgeschichte mit fokalen Anfällen. Von diesen Patienten kehrten 14 (27%) in den Folgemonaten wieder zur Zusatztherapie zurück. 34 Patienten wurden für mindestens 6 Monate nachbeobachtet und 24 dieser Patienten (71%) behielten die Perampanel-Monotherapie für mindestens 6 Monate bei. 10 Patienten wurden für mindestens 18 Monate nachbeobachtet und 3 dieser Patienten (30%) behielten die Perampanel-Monotherapie für mindestens 18 Monate bei.
PharmakokinetikDie Pharmakokinetik von Perampanel wurde bei gesunden Erwachsenen (18 bis 79 Jahre), Erwachsenen und Jugendlichen mit fokalen und primär generalisierten tonisch-klonischen Anfällen sowie bei Erwachsenen mit Parkinson, diabetischer Neuropathie, Multipler Sklerose und Leberfunktionsstörungen untersucht.
Absorption
Perampanel wird nach oraler Applikation schnell und vollständig absorbiert und weist einen vernachlässigbaren First-Pass-Effekt auf (die absolute Bioverfügbarkeit beträgt ungefähr 100%).
Nahrungsmittel beeinflussen das Ausmass der Absorption nicht, verlangsamen aber die Absorptionsrate. Bei gleichzeitiger Nahrungsaufnahme ist die maximale Plasmakonzentration verringert und im Vergleich zur Einnahme in nüchternem Zustand um 2 Stunden verzögert.
Bei gesunden Probanden erhöhten sich die Plasmaspiegel von Perampanel im Bereich von 2 bis 12 mg direkt proportional zu den verabreichten Dosen. In einer populations-pharmakokinetischen Analyse von Patienten mit fokalen Anfällen, die bis zu 12 mg/Tag und mit primär generalisierten tonisch-klonischen Anfällen mit bis zu 8 mg/Tag Perampanel in placebokontrollierten klinischen Studien erhielten, wurde ein linearer Zusammenhang zwischen der Dosis und der Plasmakonzentration von Perampanel gefunden.
Perampanel Suspension zum Einnehmen und Perampanel Filmtabletten haben sich unter Nahrungskarenz auf mg/mg-Basis als bioäquivalent erwiesen. Wenn eine 12-mg-Einzeldosis beider Formulierungen mit einer fettreichen Mahlzeit eingenommen wurde, erreichte Perampanel Suspension zum Einnehmen die gleiche AUC0-inf und eine etwa 23% geringere Cmax. Die maximalen Plasmaspiegel (Tmax) verzögerten sich um etwa 2 Stunden im Vergleich zu den Filmtabletten. Eine populationspharmakokinetische Analyse zeigte jedoch, dass unter simulierten Steady-State- Expositionsbedingungen die Cmax und AUC(0-24h) der Perampanel Suspension zum Einnehmen bioäquivalent zur Tablettenformulierung waren, sowohl unter Nahrungskarenz als auch nach Nahrungsaufnahme.
Bei Gabe zusammen mit einer fettreichen Mahlzeit waren die Cmax und AUC0-inf einer 12-mg-Einzeldosis der Perampanel Suspension zum Einnehmen etwa 22% bzw. 13% niedriger im Vergleich zur Nahrungskarenz.
Distribution
Daten von in-vitro Studien weisen darauf hin, dass Perampanel zu ungefähr 95% an Plasmaproteine gebunden wird.
In-vitro Studien zeigen, dass Perampanel kein Substrat oder signifikanter Inhibitor der organische Anionen transportierenden Polypeptide (OATP) 1B1 und 1B3, der organischen Anionen-Transporter (OAT) 1, 2, 3 und 4, der organischen Kationen-Transporter (OCT) 1, 2 und 3 sowie der Efflux-Transporter P-Glykoprotein und Brustkrebs-Resistenz-Protein (BCRP) ist.
Metabolismus
Perampanel wird durch primäre Oxidation und fortlaufende Glukuronidierung umfassend metabolisiert. Der Metabolismus von Perampanel wird primär durch CYP3A4 und/oder CYP3A5 und zu kleinerem Anteil CYP1A2 und CYP2B6 vermittelt, basierend auf Resultaten von in-vitro Studien, in welchen rekombinantes humanes CYP und humane Lebermikrosomen verwendet wurden. Nach Anwendung von radioaktiv markiertem Perampanel wurden nur Spuren von Perampanel-Metaboliten im Plasma beobachtet.
Elimination
Nach Einnahme einer radioaktiv markierten Perampanel Dosis wurde bei 8 gesunden älteren Probanden 30% der wiedergefundenen Radioaktivität im Urin und 70% in den Fäzes gemessen. Die wiedergefundene Radioaktivität im Urin und in den Fäzes bestand hauptsächlich aus einer Mischung von oxidativen und konjugierten Metaboliten. In einer populations-pharmakokinetischen Analyse von zusammengefassten Daten aus 19 Phase I Studien betrug die mittlere t½ von Perampanel 105 Stunden. Bei einer Dosierung in Kombination mit dem potenten CYP3A Induktor Carbamazepin betrug die t½ 25 Stunden.
Kinetik spezieller Patientengruppen
Patienten mit eingeschränkter Leberfunktion
Die Pharmakokinetik von Perampanel nach einer einzigen 1 mg Dosis wurde in 12 Patienten mit schwacher und mässiger Leberfunktionsstörung (Child-Pugh A respektive B) evaluiert und mit 12 gesunden, demographisch vergleichbaren Probanden verglichen. Die mittlere scheinbare Clearance von ungebundenem Perampanel bei geringfügig beeinträchtigten Patienten lag bei 188 ml/min gegenüber 338 ml/min bei der Kontrollgruppe; bei den mässig beeinträchtigten Patienten lag sie bei 120 ml/min gegenüber 392 ml/min bei der Kontrollgruppe. Die t½ verlängerte sich bei geringfügig beeinträchtigten (306 h gegenüber 125 h) und mässig beeinträchtigten Patienten (295 h gegenüber 139 h) verglichen mit vergleichbaren gesunden Probanden der Kontrollgruppe.
Patienten mit eingeschränkter Nierenfunktion
Die Pharmakokinetik von Perampanel wurde bei Patienten mit Niereninsuffizienz nicht systematisch untersucht. Perampanel wird fast ausschliesslich durch Metabolisierung eliminiert, gefolgt von einer schnellen Ausscheidung der Metaboliten; nur Spuren von Perampanel-Metaboliten werden im Plasma beobachtet. In einer populations-pharmakokinetischen Analyse von Patienten mit fokalen Anfällen mit einer Kreatinin-Clearance im Bereich von 39 bis 160 ml/min, die Perampanel in Dosen bis zu 12 mg/Tag in placebokontrollierten klinischen Studien erhielten, wurde die Perampanel-Clearance durch die Kreatinin-Clearance nicht beeinflusst.
In einer populations-pharmakokinetischen Analyse von Patienten mit primär-generalisierten tonisch-klonischen Anfällen, die in einer placebokontrollierten Studie bis zu 8 mg/Tag Perampanel erhielten, wurde die Perampanel-Clearance durch die Kreatinin-Clearance nicht beeinflusst.
Geschlecht
In einer populations-pharmakokinetischen Analyse von Patienten mit fokalen Anfällen, die Perampanel in Dosen bis zu 12 mg/Tag und von Patienten mit primär generalisierten tonisch-klonischen Anfällen die Perampanel in Dosen bis zu 8 mg/Tag in placebokontrollierten klinischen Studien erhielten, war die Perampanel-Clearance bei Frauen (0.54 l/h) um 18% tiefer als bei Männern (0.66 l/h).
Ältere Patienten (ab 65 Jahren)
In einer populations-pharmakokinetischen Analyse von Patienten mit fokalen Anfällen (Alter 12 bis 74 Jahre) und mit primär generalisierten tonisch-klonischen Anfällen (Alter 12 bis 58 Jahre), die Perampanel in Dosen bis zu 8 mg/Tag respektive 12 mg/Tag in placebokontrollierten klinischen Studien erhielten, wurde kein signifikanter Effekt des Alters auf die Perampanel-Clearance gefunden.
Jugendliche (12-18 Jahre)
In einer populations-pharmakokinetischen Analyse von jugendlichen Patienten in den klinischen Studien der Phase 2 und 3 wurden keine namhaften Unterschiede zwischen dieser Population und der Gesamtpopulation gefunden.
Präklinische DatenPräklinische Daten mit möglicher Relevanz für die klinische Anwendung sind nachfolgend zusammengefasst:
In einer pharmakologischen Sicherheitsstudie an Ratten wurde ein dosisabhängiger Anstieg der Körpertemperatur (bis zu +0,6 °C bei 5 mg/kg) beobachtet. In Toxizitätsstudien wurde nach wiederholter Gabe manchmal eine Hypothermie bei höheren Dosierungen beobachtet. In klinischen Studien wurde keine eindeutige Erhöhung oder Verringerung der Körpertemperatur festgestellt.
Die Leber ist als Target nach der wiederholten Gabe hoher Dosierungen in den Toxizitätsstudien ermittelt worden (erhöhtes Gewicht, Zellatrophie und/oder -nekrose). Basierend auf kovalenter Bindung an Makromoleküle akkumuliert Perampanel und erreicht hohe Gewebekonzentrationen in diesem Organ und interagiert mit Cytochrom P450- und UGT-Enzymen sowie dem OAT2-Transportprotein. Bezogen auf die systemische Exposition (AUC) bei an Tieren ermitteltem no-observed-adverse-effect level (NOAEL) und Patienten mit gestörter Leberfunktion beträgt der Sicherheitsabstand ≤1.
Perampanel zeigte keine Gentoxizität in den durchgeführten in vitro- oder in vivo-Studien.
In einer 2-jährigen Kanzerogenitätsstudie an Ratten wurden Keratoakanthome (in männlichen Tieren) und Phäochromozytome (in weiblichen Tieren) in der Kontroll- und, mit höherer Inzidenz, den Perampanel-behandelten Gruppen beobachtet, bei fehlender statistischer Signifikanz. Die Inzidenz lag innerhalb des Bereiches für spontanes Auftreten in älteren Ratten.
In tierexperimentellen Studien wurde eine erhöhte Inzidenz von Hautreaktionen nach UV-Licht Exposition (Faltenbildung, Auftreten weisser oder erythemischer/geröteter Regionen), mit einem Sicherheitsabstand von ≤3 (bezogen auf die systemische Exposition, AUC, und einer klinischen Dosis von 12 mg Perampanel/Tag) beobachtet. Gewebe-Verteilungs-Studien mit 14C-Perampanel zeigten lange Retentionszeiten für die Radioaktivität (bis zu 110 Wochen) im Bulbus oculi bei Nagern und Nichtnagern. Zwar zeigten allgemeine Toxizitätsstudien bei wiederholter Verabreichung keine behandlungsbedingten ophthalmoskopische oder histopathologische Befunde am Auge.In der 2-jährigen Kanzerogenitätsstudie wurden allerdings eine dosisabhängige Keratitis (≥3 mg/kg/Tag, Sicherheitsabstand <1 bezogen auf die systemische Exposition, AUC und einer klinischen Dosis von 12 mg Perampanel/Tag) sowie Infiltrationen inflammatorischer Zellen/Ulzera der Haut (≥3 mg/kg/Tag, Sicherheitsabstand <1 bezogen auf die systemische Exposition, AUC und einer klinischen Dosis von 12 mg Perampanel/Tag) bei Mäusen beobachtet. Die in dieser Studie aufgetretenen nicht-neoplastischen Effekte am Urogenitaltrakt (Dilatationen und mesenchymale Läsionen) lassen sich mit Harnretention/Obstruktionen in Niere und Blase erklären.
In den Fruchtbarkeitsstudien an Ratten wurden bei Weibchen nach hohen Dosen (30 mg/kg; Sicherheitsabstand von <1 bezogen auf die systemische Exposition am no-observed-effect level, NOEL, und einer klinischen Dosis von 12 mg Perampanel/Tag) verlängerte und unregelmässige Zyklen beobachtet; jedoch beeinflussten diese Veränderungen die Fruchtbarkeit und die frühe embryonale Entwicklung nicht. Es gab keine Auswirkungen auf die männliche Fruchtbarkeit.
Der Übergang in die Muttermilch wurde in Ratten 10 Tage nach der Geburt gemessen. Die Maximalwerte wurden nach einer Stunde erreicht und waren 3,65 mal höher als die Plasmawerte. Perampanel überwindet die Plazentaschranke. Jedoch war der Transfer durch die Plazenta relativ gering; 0,09% oder weniger der applizierten Dosis wurde im Fötus nachgewiesen.
Tierexperimentelle Studien ergaben keine Hinweise auf teratogene Wirkungen bei Ratten oder Kaninchen, jedoch wurde bei Ratten bei Gabe maternal-toxischen Dosen Embryotoxizität beobachtet (Sicherheitsabstand <1 bezogen auf die systemische Exposition, AUC und einer klinischen Dosis von 12 mg Perampanel/Tag). In einer peri- und postnatalen Entwicklungstoxizitätsstudie in Ratten wurden bei toxischen Dosen abnormale Geburten und Pflegebedingungen beobachtet und die Anzahl von Totgeburten beim Nachwuchs war erhöht (Sicherheitsabstand von <1 bezogen auf die systemische Exposition, AUC, am NOEL und einer klinischen Dosis von 12 mg Perampanel/Tag). Zusätzlich neigte der Geburtenindex und der Lebensfähigkeitsindex 4 Tage nach der Geburt zu tiefen Werten, und es wurde eine Unterdrückung der Gewichtszunahme und eine verzögerte morphologische Differenzierung (verzögerte Öffnung der Vaginalöffnung oder Teilung der balanopreputial Hautfalte) beim Nachwuchs beobachtet. Jedoch wurden im Nachwuchs keine Auswirkungen auf Verhaltens- oder Reproduktionsfunktionen beobachtet.
In Toxizitätstudien an juvenile Ratten und Hunden wurde eine erhöhte Empfindlichkeit gegenüber Perampanel im Vergleich zu erwachsenen Tieren bei ähnlicher systemischer Exposition beobachtet.
Sonstige HinweiseHaltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Haltbarkeit nach Anbruch
Fycompa Suspension zum Einnehmen: ist nach dem Öffnen 90 Tage haltbar.
Besondere Lagerungshinweise
Nicht über 30 °C lagern.
Ausser Reichweite von Kindern aufbewahren.
Zulassungsnummer62440, 67665 (Swissmedic).
PackungenFycompa 2 mg: Packungen mit 7 Filmtabletten (B)
Fycompa 4 mg: Packungen mit 28 Filmtabletten (B)
Fycompa 6 mg: Packungen mit 28 Filmtabletten (B)
Fycompa 8 mg: Packungen mit 28 Filmtabletten (B)
Fycompa 10 mg: Packungen mit 28 Filmtabletten (B)
Fycompa 12 mg: Packungen mit 28 Filmtabletten (B)
Fycompa 0,5 mg/ml: 340 ml Suspension zum Einnehmen, in einer Flasche mit kindersicherem Verschluss; jede Packung enthält einen Adapter zum Eindrücken in die Flasche und zwei 20 ml Spritzen mit 0,5 ml-Skalierung.
ZulassungsinhaberinEisai Pharma AG, Zürich.
Stand der InformationDezember 2019.
|

