ZusammensetzungLyumjev 100 I.E./ml
Wirkstoffe
Insulinum lisprum ([Lys (B28), Pro (B29)] humanum insulinum analogum*), 100 I.E. (3.5 mg).
Hilfsstoffe
Treprostinilum natricum, natrii citras dihydricus, zinci oxidum, magnesii chloridum hexahydricum, metacresolum 3.15 mg, glycerolum, acidum hydrochloridum, natrii hydroxidum, aqua ad iniectabilia q.s. ad sol. pro 1 ml.
Enthält 1.13 mg Natrium pro 1 ml.
Lyumjev 200 I.E./ml
Wirkstoffe
Insulinum lisprum ([Lys (B28), Pro (B29)] humanum insulinum analogum*), 200 I.E. (6.9 mg).
Hilfsstoffe
Treprostinilum natricum, natrii citras dihydricus, zinci oxidum, magnesii chloridum hexahydricum, metacresolum 3.15 mg, glycerolum, acidum hydrochloridum, natrii hydroxidum, aqua ad iniectabilia q.s. ad sol. pro 1 ml.
Enthält 1.32 mg Natrium pro 1 ml.
* Insulin Lispro ist ein Insulin-Analogon, das mittels gentechnologischer Methoden unter Verwendung von Escherichia coli gewonnen wird.
Indikationen/AnwendungsmöglichkeitenZur Behandlung von Erwachsenen mit Diabetes mellitus.
Dosierung/AnwendungDie Dosierung wird vom behandelnden Arzt bzw. Ärztin je nach Stoffwechsellage des Patienten festgesetzt.
Lyumjev ist ein schnell wirksames Insulin zur subkutanen Injektion.
Lyumjev soll im Allgemeinen in Kombination mit einem intermediär- oder langwirksamen Insulin angewendet werden.
Lyumjev ist für die kontinuierliche subkutane Insulin-Infusionstherapie (CSII) geeignet und dient dabei zur Abdeckung des Bedarfs an Bolus- und Basalinsulin.
Aufgrund seines schnellen Wirkungseintritts kann Lyumjev unmittelbar vor Beginn sowie bis zu 20 Minuten nach Beginn einer Mahlzeit verabreicht werden. Zum Erreichen einer möglichst optimalen glykämischen Kontrolle sollte die Bolusgabe nach Beginn der Mahlzeit nur in Ausnahmefällen erfolgen.
Dosisanpassung/Titration
Bei der Umstellung von einem anderen schnellwirksamen Insulin auf Lyumjev kann der Wechsel auf der Grundlage Einheit-zu-Einheit erfolgen. Die Wirkstärke von Insulin-Analoga, einschliesslich Lyumjev, wird in I.E. angegeben. Eine (1) Einheit Lyumjev entspricht 1 internationalen Einheit (I.E.) Humaninsulin oder 1 Einheit eines anderen schnellwirksamen Insulin-Analogons.
Die fortlaufende Anpassung der Dosis von Lyumjev soll auf Grundlage der metabolischen Bedürfnisse des Patienten, der Ergebnisse aus der Blutglukoseüberwachung und der glykämischen Zielwerte erfolgen. Dosisanpassungen können erforderlich werden, wenn von einem anderen Insulin umgestellt wird, bei Veränderungen der körperlichen Aktivität, Veränderungen der Begleitmedikation, Veränderungen der Ernährungsgewohnheiten (d.h. Menge und Art der Nahrung, Zeitpunkt der Mahlzeiten), Veränderungen der Nieren- oder Leberfunktion oder bei akuter Erkrankung, um das Risiko einer Hypoglykämie oder Hyperglykämie zu minimieren.
Therapieeinleitung
Bei der Anfangsdosierung sollten das Gewicht des Patienten und die Blutglukosekonzentrationen berücksichtigt werden.
Übliche Dosierung
Die Dosierung wird vom behandelnden Arzt bzw. Ärztin je nach Stoffwechsellage des Patienten festgesetzt.
Um die Rückverfolgbarkeit von biotechnologisch hergestellten Arzneimitteln sicherzustellen, wird empfohlen, Handelsname und Chargennummer bei jeder Behandlung zu dokumentieren.
Spezielle Dosierungsanweisungen
Patienten, die die Verabreichung der Insulindosis vor einer Mahlzeit vergessen, sollen ihre Blutglukosewerte überwachen, um über die Notwendigkeit einer Insulindosis zu entscheiden, und zur nächsten Mahlzeit wieder ihren üblichen Dosierungsplan fortsetzen.
Lyumjev soll von Patienten mit eingeschränkter visueller Wahrnehmung nicht ohne Hilfe durch eine geschulte Person verwendet werden.
Patienten mit Leberfunktionsstörungen
Der Insulinbedarf kann bei Patienten mit eingeschränkter Leberfunktion reduziert sein, aufgrund einer reduzierten Fähigkeit zur Gluconeogenese und aufgrund eines geringeren Insulinabbaus.
Patienten mit Nierenfunktionsstörungen
Der Insulinbedarf kann bei bestehender Nierenschädigung vermindert sein.
Ältere Patienten
Die Sicherheit und Wirksamkeit von Lyumjev bei älteren Patienten im Alter von 65 bis 75 Jahren wurde gezeigt. Eine enge Glukoseüberwachung wird empfohlen und die Insulindosis sollte individuell angepasst werden. Die therapeutische Erfahrung bei Patienten ≥75 Jahre ist begrenzt.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Lyumjev bei Kindern und Jugendlichen unter 18 Jahre wurde bislang nicht belegt.
Art der Anwendung
Patienten sollen in der richtigen Anwendung und Injektionstechnik geschult werden, bevor mit Lyumjev begonnen wird. Patienten müssen angewiesen werden:
·Vor der Anwendung immer das Etikett des Insulins prüfen.
·Vor der Verwendung das Aussehen von Lyumjev kontrollieren und bei Partikeln oder Verfärbungen verwerfen.
·Die Injektionsstellen wechseln, um das Risiko für Lipodystrophie zu reduzieren.
·Die Nadel nach jeder Injektion entsorgen.
·Den Fertigpen verwerfen, wenn Teile davon zerbrochen oder beschädigt aussehen.
·Ersatz oder eine alternative Methode der Anwendung mitführen, für den Fall, dass die übliche Art der Anwendung nicht möglich ist.
Subkutane Injektion
Lyumjev wird zu Beginn der Mahlzeit subkutan in Abdomen, Oberarm, Oberschenkel oder Gesäss injiziert.
Kontinuierliche subkutane Insulin-Infusion (Insulinpumpe)
NUR für Lyumjev 100 I.E./ml Durchstechflasche
Lyumjev 100 I.E./ml Durchstechflasche kann in geeigneten Insulin-Infusionspumpen verwendet werden.
Lyumjev 100 I.E./ml Durchstechflasche ist entsprechend der Anweisungen des Pumpenherstellers zu verwenden.
Lyumjev 200 I.E./ml darf NICHT mit kontinuierlicher subkutaner Insulin-Infusionspumpe angewendet werden.
Intravenöse Anwendung,
NUR für Lyumjev 100 I.E./ml Durchstechflasche.
Lyumjev 100 I.E. /ml ist in einer Durchstechflasche erhältlich, falls eine intravenöse Anwendung notwendig ist.
Lyumjev 100 I.E./ml Durchstechflasche ist auf eine Konzentration von 1.0 I.E./ml zu verdünnen, hierzu wird 0.9% Natriumchlorid oder 5% Glukose verwendet (siehe Rubrik «Sonstige Hinweise: intravenöse Anwendung»). Die Kompatibilität mit Ethylen-Propylen-Copolymer sowie Polyolefin mit Polyvinylchlorid-Beuteln wurde nachgewiesen.
Die intravenöse Anwendung von Lyumjev 100 I.E./ml Durchstechflasche muss unter medizinischer Aufsicht erfolgen.
Lyumjev 200 I.E./ml darf NICHT intravenös angewendet werden.
Lyumjev Durchstechflaschen
Wenn eine Anwendung mittels Spritze erforderlich ist, sollte eine Durchstechflasche verwendet werden.
Die Spritze muss für 100 I.E./ml markiert sein.
Patienten, die Durchstechflaschen verwenden, dürfen Nadeln oder Spritzen niemals gemeinsam mit anderen Patienten benutzen.
Nicht mit anderen Lösungen oder Insulin mischen, ausgenommen Infusionslösungen mit 0.9% Natriumchlorid oder 5% Glukose in Wasser.
Lyumjev Patronen
Lyumjev Patronen sind für die Verwendung mit Pens von Lilly entwickelt und geprüft und sollen nicht mit anderen wiederbefüllbaren Pens verwendet werden, da die Dosierungsgenauigkeit mit anderen Pens nicht belegt wurde
Nicht mit anderen Lösungen oder Insulin mischen.
Die Anweisungen für den jeweiligen Pen müssen beachtet werden beim Einlegen der Patrone, Aufsetzen der Nadel und Durchführung der Insulininjektion.
Zur Vermeidung einer möglichen Übertragung von Krankheiten darf jede Patrone nur von einem einzigen Patienten benutzt werden, auch wenn die Pen-Nadel gewechselt wird.
Lyumjev KwikPens
Lyumjev KwikPen sind nur zur subkutanen Injektion geeignet.
Lyumjev ist in zwei Konzentrationen verfügbar:
Lyumjev 100 I.E./ml KwikPen/Lyumjev 100 I.E./ml Junior KwikPen und Lyumjev 200 I.E./ml KwikPen.
Mit Lyumjev 100 I.E./ml und Lyumjev 200 I.E./ml KwikPen können in einer Injektion 1-60 I.E. in Schritten von 1 Einheit verabreicht werden. Der Lyumjev 100 I.E./ml Junior KwikPen erlaubt in einer Injektion 0.5-30 I.E. in Schritten von 0.5 I.E. zu verabreichen. Die Anzahl der Insulin-I.E., ungeachtet der Stärke, wird im Dosierfenster des Pens angezeigt und bei der Umstellung eines Patienten auf eine neue Konzentration oder einen Pen mit anderen Dosierschritten hat keine Umrechnung zu erfolgen.
Lyumjev 100 I.E./ml Junior KwikPen ist für Patienten geeignet, die von einer feineren Einstellung der Insulindosis profitieren können.
Beachten Sie die Bedienungsanleitungen der KwikPens.
Zur Vermeidung einer möglichen Übertragung von Krankheiten darf jeder Pen nur von einem einzigen Patienten benutzt werden, auch wenn die Nadel gewechselt wird.
KontraindikationenLyumjev ist kontraindiziert während Episoden einer Hypoglykämie und ebenso bei Patienten mit bekannter Überempfindlichkeit gegenüber Insulin Lispro oder einem anderen Bestandteil von Lyumjev (siehe Rubrik «Zusammensetzung»).
Warnhinweise und VorsichtsmassnahmenHypoglykämie
Hypoglykämie ist die häufigste unerwünschte Wirkung der Insulintherapie, einschliesslich Lyumjev. Der Zeitpunkt einer Hypoglykämie reflektiert generell das Wirkprofil des verabreichten Insulinpräparates.
Hypoglykämie kann plötzlich auftreten und die Symptome können individuell unterschiedlich sein, oder sich im Lauf der Zeit beim selben Patienten verändern. Schwere Hypoglykämie kann Krämpfe verursachen, zu Bewusstlosigkeit führen, lebensbedrohlich sein oder zum Tod führen. Die Hypoglykämie-Wahrnehmung kann bei Patienten mit langjährigem Diabetes weniger ausgeprägt sein.
Hyperglykämie
Die Anwendung einer unzureichenden Dosis oder die Unterbrechung einer Behandlung, insbesondere bei Insulin-abhängigen Patienten, kann zu Hyperglykämie und diabetischer Ketoazidose führen; diese Zustände sind potentiell lebensbedrohlich.
Änderungen der Insulintherapie
Änderungen von Insulin, Insulinkonzentration, Hersteller, Art des Insulins oder Art der Anwendung können Einfluss auf die glykämische Kontrolle nehmen und Hypoglykämie oder Hyperglykämie begünstigen. Solche Veränderungen sollen mit Vorsicht und unter enger medizinischer Überwachung erfolgen; die Kontrolle des Blutzuckers sollte intensiviert werden. Bei Patienten mit Typ 2 Diabetes können Anpassungen der antidiabetischen Begleittherapie erforderlich sein.
Hyperglykämie und Ketoazidose aufgrund einer Fehlfunktion des Insulin-Pumpensystems
Fehlfunktionen der Pumpe oder des Infusionssets können zu einer schnell einsetzenden Hyperglykämie und zur Ketoazidose führen. Bei Hyperglykämie oder Ketoazidose muss die Ursache rasch erkannt und behoben werden. Zwischenzeitlich kann eine Therapie mit subkutanen Injektionen erforderlich sein.
Anwendung von Thiazolidindionen in Kombination mit Insulin
Thiazolidindione (TZDs) können eine dosisabhängige Flüssigkeitsretention hervorrufen, insbesondere bei Kombination mit Insulin. Flüssigkeitsretention kann zum Auftreten oder zur Exazerbation einer Herzinsuffizienz führen. Patienten, die mit Insulin und einem TZD behandelt werden, sollen auf Anzeichen und Symptome einer Herzinsuffizienz beobachtet werden. Wenn sich eine Herzinsuffizienz entwickelt, muss das Absetzen des TZD in Betracht gezogen werden.
Überempfindlichkeit und allergische Reaktionen
Schwere, lebensbedrohliche, generalisierte Allergie, einschliesslich Anaphylaxie, kann mit Insulin-Zubereitungen, einschliesslich Lyumjev, auftreten. Bei auftretender Überempfindlichkeit ist Lyumjev abzusetzen.
Anwendungsfehler
Zur Vermeidung von Anwendungsfehlern zwischen Lyumjev und anderen Insulinen müssen Patienten vor jeder Injektion das Etikett des Insulins prüfen.
Insulin aus dem Lyumjev 200 I.E./ml KwikPen darf nicht in eine Spritze aufgezogen werden. Die Markierungen auf der Insulinspritze würden die Dosis nicht korrekt messen, was zu Überdosierung und schwerer Hypoglykämie führen kann.
Vorsicht ist geboten bei Umstellung der Therapie auf eine andere pharmazeutische Formulierung und/oder ein anderes Arzneimittel mit gleicher aktiver Substanz. Der Patient muss angemessen überwacht werden.
Hilfsstoffe
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Dosis.
InteraktionenDie nachfolgenden Substanzen können den Insulinbedarf reduzieren: Antidiabetika (orale oder injizierbare), Salicylate, Sulfonamid-Antibiotika, bestimmte Antidepressiva (Monoaminoxidaseinhibitoren [MAO-HemmerI], selektive Serotoninwiederaufnahmehemmer), Angiotensin Converting Enzyme (ACE) Hemmer, Angiotensin II Rezeptorblocker oder Somatostatin-Analoga.
Die nachfolgenden Substanzen können den Insulinbedarf erhöhen: Orale Kontrazeptiva, Kortikosteroide, Schilddrüsenhormone, Danazol, Sympathikomimetika, Diuretika oder Wachstumshormone.
Alkohol kann die blutzuckersenkende Wirkung von Lyumjev verstärken oder abschwächen.
β-Blocker können die Hypoglykämie-Warnsymptome abschwächen bzw. maskieren.
Schwangerschaft, StillzeitSchwangerschaft
Klinische Daten zur Anwendung bei Schwangeren sind nicht verfügbar.
Informationen zum Arzneimittel-bedingten Risiko für schwere Geburtsdefekte oder Fehlgeburten zu Lyumjev bei Schwangeren sind nicht vorhanden. Die zur Anwendung von Insulin Lispro in der Schwangerschaft veröffentlichten Studien haben keinen Zusammenhang zwischen Insulin Lispro und schweren Geburtsdefekten, Fehlgeburt oder unerwünschten maternalen oder fetalen Endpunkten berichtet. Schlecht kontrollierter Diabetes in der Schwangerschaft ist mit Risiken für Mutter und Fetus verbunden.
Es ist unbedingt notwendig, dass eine mit Insulin behandelte Patientin (insulinabhängig oder mit Schwangerschaftsdiabetes) während der Schwangerschaft sehr genau überwacht wird. Der Insulinbedarf sinkt meistens während der ersten drei Schwangerschaftsmonate und steigt ab dem vierten Schwangerschaftsmonat an. Patientinnen mit Diabetes sollten unbedingt ärztlichen Rat einholen, wenn eine Schwangerschaft geplant wird oder eingetreten ist. Eine genaue Blutzuckerkontrolle sowie ein allgemein guter Gesundheitszustand sind bei Schwangeren mit Diabetes besonders wichtig.
Stillzeit
Während der Stillzeit kann eine neue Einstellung der Insulindosierung und der Diät oder beides notwendig sein.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEine Hypoglykämie kann die Konzentrations- und Reaktionsfähigkeit eines Patienten herabsetzen. Dies kann in Situationen, in denen diese Fähigkeiten von besonderer Bedeutung sind (z.B. beim Fahren eines Autos oder beim Bedienen von Maschinen) ein Risiko darstellen.
Dem Patienten sollte geraten werden, Vorsichtsmassnahmen zur Vermeidung von Hypoglykämien beim Führen von Fahrzeugen zu treffen. Dies ist bei Patienten mit häufigen Hypoglykämie-Episoden oder verringerter oder fehlender Wahrnehmung von Hypoglykämie-Warnsymptomen besonders wichtig. In diesen Fällen sollte überlegt werden, ob das Führen eines Fahrzeuges ratsam ist
Unerwünschte WirkungenDie am häufigsten während der Therapie berichtete unerwünschte Wirkung ist Hypoglykämie (siehe unter «Beschreibung ausgewählter unerwünschten Wirkungen» weiter unten).
Nachfolgend werden die unerwünschten Wirkungen aufgeführt, die in den klinischen Studien ITRM (klinische Studie Phase 3, Typ 1 Diabetes) und ITRN (klinische Studie Phase 3, Typ 2 Diabetes) bei mit Lyumjev behandelten Patienten festgestellt wurden, dargestellt mit Systemorganklassen und bevorzugten Begriffen nach MedDRA und mit folgenden Häufigkeiten: sehr häufig: ≥1/10; häufig: ≥1/100 bis <1/10; gelegentlich ≥1/1'000 bis <1/100; selten ≥1/10'000 bis <1/1'000; sehr selten: <1/10'000.
Stoffwechsel- und Ernährungsstörungen
Sehr häufig: Hypoglykämie.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Reaktionen an der Injektionsstelle.
Häufig: Allergische Reaktion.
Erkrankungen der Haut und des Unterhautzellgewebes
Gelegentlich: Lipodystrophie.
Gelegentlich: Ausschlag.
Gelegentlich: Pruritus.
Beschreibung ausgewählter Nebenwirkungen
Hypoglykämie
Hypoglykämie ist die am häufigsten berichtete unerwünschte Wirkung bei Patienten, die Insulin anwenden, einschliesslich Lyumjev.
Es wurden keine klinisch bedeutsamen Unterschiede in der Gesamtrate der Hypoglykämien bei mit Lyumjev oder mit Humalog (ein anderes Insulin lispro-Präparat) behandelten Patienten beobachtet. In klinischen Studien, in denen Lyumjev und Humalog zu unterschiedlichen Zeiten in Bezug auf die Mahlzeiteinnahme verabreicht wurde, konnten keine klinisch relevanten Unterschiede in der Gesamtrate der Hypoglykämie beobachtet werden.
Nach der Injektion/Infusion von Lyumjev kann Hypoglykämie aufgrund des schnelleren Wirkungseintritts früher auftreten als bei anderen prandial verabreichten Insulinen.
Allergische Reaktionen
Schwere, lebensbedrohliche, generalisierte Allergie, einschliesslich Anaphylaxie, generalisierte Hautreaktionen, Angioödem, Bronchospasmen, Hypotonie und Schock können unter Insulinen auftreten, einschliesslich Lyumjev.
Reaktionen an der Injektionsstelle
Wie bei anderen Insulin-Therapien wurden von Patienten unter Lyumjev Ausschlag, Rötung, Entzündung, Schmerzen, Hämatome oder Juckreiz an der Injektionsstelle berichten. Diese Reaktionen sind meist leicht und verschwinden gewöhnlich unter fortgesetzter Therapie.
Immunogenität
Die Anwendung von Insulin kann zur Bildung von Insulin-Antikörpern führen. Das Vorhandensein von Antikörpern, die sich gegen das Arzneimittel richten, hatte keine klinisch relevanten Wirkungen auf die Pharmakokinetik, Wirksamkeit oder Sicherheit von Lyumjev.
Lipodystrophie
Die Anwendung von Insulin, einschliesslich Lyumjev, kann zu Lipodystrophie führen [Lipohypertrophie (Zunahme oder Verdickung des Gewebes) oder Lipoatrophie (Vertiefung in der Haut)].
Ödeme
Im Zusammenhang mit Insulin-Therapie wurde über Ödeme berichtet, insbesondere wenn eine zuvor schlechte metabolische Kontrolle durch intensivierte Insulintherapie verbessert wurde.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungEine Überdosierung verursacht Hypoglykämie.
Hypoglykämie kann auftreten, wenn die Menge Insulin Lispro im Verhältnis zu Nahrungsaufnahme, Energieverbrauch oder beidem zu gross ist.
Anzeichen und Symptome
Zu den begleitenden Symptomen einer Hypoglykämie gehören Teilnahmslosigkeit, Verwirrtheit, Palpitationen, Schwitzen, Erbrechen und Kopfschmerzen.
Behandlung
Leichte Episoden einer Hypoglykämie können im Allgemeinen durch orale Glukoseaufnahme behandelt werden. Anpassungen von Arzneimitteldosierung, Mahlzeitenschema oder körperlicher Aktivität können erforderlich sein. Schwerere Episoden mit Koma, Krämpfen oder neurologischer Beeinträchtigung können mit Glukagon oder konzentrierter, intravenöser Glukose behandelt werden. Es kann notwendig sein, Kohlenhydrat-Aufnahme und Beobachtung fortzuführen, da eine Hypoglykämie nach nur scheinbarer Genesung nochmals auftreten kann.
Eigenschaften/WirkungenATC-Code
A10AB04
Wirkungsmechanismus
Die Hauptwirkung von Lyumjev ist die Regulierung des Glukosestoffwechsels. Die blutzuckersenkende Wirkung von Insulinen, einschliesslich Insulin Lispro, der Wirkstoff von Lyumjev, beruhen auf der Fähigkeit ihrer spezifischen Bindung an Insulinrezeptoren. Rezeptorgebundenes Insulin senkt die Blutglukosekonzentration durch Stimulation der peripheren Glukoseaufnahme durch Skelettmuskeln und Fett, und durch Hemmung der hepatischen Glukoseproduktion. Insuline hemmen Lipolyse und Proteolyse und verstärken die Proteinsynthese.
Lyumjev ist eine schnell wirkende Formulierung von Insulin Lispro, welches die Hilfsstoffe Citrat und Treprostinil enthält. Citrat erhöht die lokale vaskuläre Permeabilität und Treprostinil induziert eine lokale Vasodilatation, um eine beschleunigte Absorption von Insulin Lispro zu erreichen.
Pharmakodynamik
Frühe und späte Insulinwirkung
Eine Glukose-Clamp-Studie wurde bei 40 Patienten mit Typ 1 Diabetes durchgeführt. Sie erhielten 15 I.E. Lyumjev und Humalog subkutan als Einzeldosis. Bei gleicher Dosierung war Lyumjev äquipotent zu Humalog, die Wirkung trat jedoch schneller ein und war von kürzerer Dauer (siehe Abbildung 1).
Abbildung 1: Mittlere Glukose-Infusionsrate bei Patienten mit Typ 1 Diabetes nach subkutaner Injektion von Lyumjev oder Humalog (Dosis mit 15 I.E.)
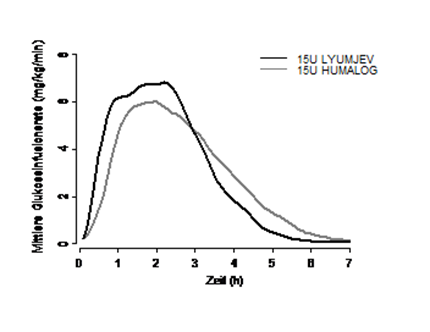
In ähnlicher Weise wurde bei Patienten mit Typ 2 Diabetes unter Lyumjev eine schnellere frühe Insulinwirkung und eine verminderte späte Insulinwirkung beobachtet.
Postprandiale Glukosesenkung,
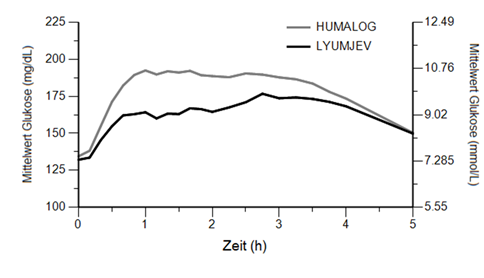
Lyumjev reduzierte den postprandiale Blutzuckeranstieg während einer standardisierten Testmahlzeit über die vollständigen 5 Stunden der Testmahlzeitenphase im Vergleich zu Humalog bei Patienten mit Typ 1 (32% [präprandialer Bolus] bzw. 18% [Bolusgabe 20 Minuten nach Beginn der Mahlzeit] Reduktion) oder Typ 2 Diabetes (25% Reduktion unabhängig vom Zeitpunkt der Bolusgabe).
Abbildung 2: Mittlerer Blutzucker nach subkutaner Injektion von Lyumjev oder Humalog (mittlere Dosis 12 I.E.) zu Beginn einer standardisierten Testmahlzeit bei Patienten mit Typ 1 Diabetes
Vergleich von Lyumjev 200 I.E./ml und Lyumjev 100 I.E./ml
Maximale und totale glukosesenkende Wirkung nach subkutaner Gabe einer Einzeldosis von 15 I.E. bei gesunden Probanden waren vergleichbar für Lyumjev 100 I.E./ml und Lyumjev 200 I.E./ml.
Klinische Wirksamkeit
Die Wirksamkeit von Lyumjev wurde in zwei Studien, eine bei Patienten mit Typ 1 Diabetes (PRONTO-T1D) und eine mit Patienten zu Typ 2 Diabetes (PRONTO-T2D), untersucht. Eine zusätzliche Studie bei Patienten mit Typ 1 Diabetes (PRONTO-Pump) untersuchte die Kompatibilität und Sicherheit von Lyumjev zur kontinuierlichen subkutanen Insulin-Infusion (CSII).
Typ 1 Diabetes – Erwachsene
Die 26-wöchige Studie PRONTO-T1D verglich die glukosesenkende Wirksamkeit von Lyumjev und Humalog bei 1'222 Patienten mit Typ 1 Diabetes im Rahmen einer Behandlung mit mehrfachen täglichen Injektion (MDI). Patienten in der 3-armigen Studie erhielten randomisiert eine Behandlung mit prä- (N=451; verblindet) oder postprandialer (N=329; open-label) Injektion von Lyumjev oder mit Humalog (N=442; verblindet). Prä- bzw. postprandiale Injektionen erfolgten 0 bis 2 Minuten vor der Mahlzeit bzw. bis zu 20 Minuten nach Beginn der Mahlzeit. Alle Patienten erhielten zusätzlich ein Basalinsulin (Insulin Glargin [1-2mal täglich] oder Insulin Degludec [einmal täglich]) und wurden auf den Zielwert HbA1c < 7% behandelt.
Die Senkung des HbA1c durch präprandial injiziertes Lyumjev war numerisch leicht grösser als durch präprandial injiziertes Humalog (siehe Tabelle 1). Die entsprechenden Ansprechraten (Prozent der Patienten, die den HbA1c-Zielwert von <7% erreichten) betrugen 37.4% (präprandiales Lyumjev), 33.6% (präprandiales Humalog) und 25.6% (postprandiales Lyumjev). Im Toleranztest mit gemischter Mahlzeit sowie in 269 Patienten einer Substudie mit kontinuierlichem Glukosemonitoring (CGM) war der postprandiale Glukoseanstieg mit Lyumjev signifikant geringer als mit Humalog (beide präprandial injiziert).
Tabelle 1: Ergebnisse aus der klinischen Basal-Bolus Studie über 26 Wochen bei Patienten mit Typ 1 Diabetes
|
|
Präprandial verabreichtes Lyumjev + Basalinsulin
|
Präprandial verabreichtes Humalog + Basalinsulin
(Kontroll-Arm)
|
Postprandial verabreichtes Lyumjev + Basalinsulin
| |
Anzahl der randomisierten Patienten (N)
|
451
|
442
|
329
| |
HbA1c (%)
| |
Ausgangswert → Woche 26
|
7.34 → 7.21
|
7.33 → 7.29
|
7.36 → 7.42
| |
Veränderung gegenüber dem Ausgangswert
|
-0.13
|
-0.05
|
0.08
| |
Behandlungsdifferenz zum Kontroll-Arm [95% KI]
|
-0.08 [-0.16, -0.00]B
|
|
0.13 [0.04, 0.22]C
| |
Blutzuckeranstieg 2 Stunden postprandial (mmol/l) A
| |
Ausgangswert → Woche 26
|
6.26 → 4.04
|
5.64 → 5.77
|
5.99 → 5.40
| |
Veränderung gegenüber dem Ausgangswert
|
-1.93
|
-0.20
|
-0.56
| |
Behandlungsdifferenz
|
-1.73 [-2.28, -1.18]B,D
|
|
-0.37 [-0.98, -0.24]C
|
Ausgangs- und Studienende (Woche 26) -Werte basieren auf den kleinsten mittleren Quadraten (adjustierte Mittelwerte). Das 95% Konfidenzintervall ist in ‹[ ]› angegeben.
A Mahlzeittest
B Die Differenz bezieht sich auf prandial verabreichtes Lyumjev – prandial verabreichtes Humalog.
C Die Differenz bezieht sich auf postprandial verabreichtes Lyumjev – prandial verabreichtes Humalog
D Statistisch signifikant zugunsten von prandial verabreichtem Lyumjev
Typ 2 Diabetes – Erwachsene
Die Studie PRONTO-T2D verglich die glukosesenkende Wirksamkeit von Lyumjev und Humalog über 26 Wochen bei 673 Patienten mit Typ 2 Diabetes. Patienten in 2 Studienarmen erhielten randomisiert eine Behandlung mit präprandialer Injektion von Lyumjev (N=336; verblindet) oder Humalog (N=337; verblindet). Die präprandiale Injektion erfolgte 0 bis 2 Minuten vor der Mahlzeit. Alle Patienten erhielten zusätzlich ein Basalinsulin (Insulin Glargin oder Insulin Degludec). Patienten durften begleitend unter einer oralen Diabetestherapie, Metformin und/oder einen SGLT2 Inhbitor stehen.
Die Senkung des HbA1c durch präprandial injiziertes Lyumjev war der durch präprandial injiziertes Humalog nicht unterlegen (siehe Tabelle 2). Die entsprechenden Ansprechraten (Prozent der Patienten, die den HbA1c-Zielwerts von <7% erreichten) betrugen 58.2% (Lyumjev) und 52.5% (Humalog). Im Toleranztest mit gemischter Mahlzeit war der postprandiale Glukoseanstieg mit Lyumjev signifikant geringer als mit Humalog.
Tabelle 2: Ergebnisse aus der klinischen Basal-Bolus Studie bei Patienten mit Typ 2 Diabetes
|
|
Prandial verabreichtes Lyumjev + Basalinsulin
|
Prandial verabreichtes Humalog + Basalinsulin
| |
Anzahl der randomisierten Patienten (N)
|
336
|
337
| |
HbA1c (%)
| |
Ausgangswert → Woche 26
|
7.28 → 6.92
|
7.31 → 6.86
| |
Veränderung gegenüber dem Ausgangswert
|
-0.38
|
-0.43
| |
Behandlungsdifferenz zum Humalog-Arm [95% KI]
|
0.06 [-0.05, 0.16]
|
Die Werte in Woche 26 und die Veränderung gegenüber dem Ausgangswert basieren auf den kleinsten mittleren Quadraten (adjustierte Mittelwerte).
Das 95% Konfidenzintervall wird in «[ ]» angegeben. Der Unterschied bezieht sich auf prandial verabreichtem Lyumjev– prandial verabreichtem Humalog.
Sicherheit und Wirksamkeit bei älteren Patienten
In den zwei klinischen Studien über 26 Wochen waren 187 von 1'116 (17%) der Patienten unter Lyumjev mit Typ 1 Diabetes oder Typ 2 Diabetes ≥65 Jahre und 18 von 1'116 (2%) waren ≥75 Jahre. Insgesamt wurden zwischen älteren und jüngeren Patienten keine Unterschiede in der Sicherheit oder Wirksamkeit beobachtet.
Kontinuierliche subkutane Insulin-Infusion (CSII)
Eine 12-wöchige doppelblinde Cross-over Studie (2 Phasen über 6 Wochen) untersuchte die Kompatibilität und Sicherheit von Lyumjev und Humalog in 49 erwachsenen Patienten mit Typ 1 Diabetes, welche mit kontinuierlicher subkutaner Insulin-Infusion(CSII) behandelt wurden. Die Studienteilnehmer führten während der Studie ein kontinuierliches Glukosemonitoring (CGM) durch. Es zeigte sich kein statistisch signifikanter Therapieunterschied bezüglich der Rate oder Inzidenz von Infusionsset-Ausfällen zwischen Lyumjev und Humalog.
PharmakokinetikAbsorption
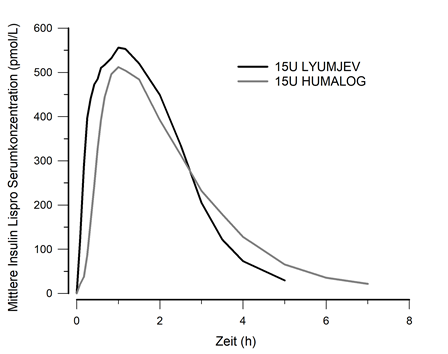
Die Absorption von Insulin Lispro war beschleunigt und zeigte eine kürzere Dauer der Exposition bei gesunden Probanden und Patienten mit Diabetes nach Injektion von Lyumjev im Vergleich zu Humalog.
·Insulin Lispro erschien im Kreislauf etwa 1 Minute nach der Injektion von Lyumjev, was fünf Minuten schneller war im Vergleich zu Humalog (Abbildung 3).
·Die Zeit bis 50% der maximalen Konzentration war unter Lyumjev 14 Minuten kürzer im Vergleich zu Humalog.
·Nach der Injektion von Lyumjev war in den ersten 15 Minuten achtmal mehr Insulin Lispro im Blutkreislauf im Vergleich zu Humalog und dreimal mehr in den ersten 30 Minuten.
·Die maximale Konzentration von Insulin Lispro wurde 57 Minuten nach Verabreichung von Lyumjev erreicht.
·Unter Lyumjev war 3 Stunden nach der Injektion 43% weniger Insulin Lispro im Blutkreislauf, verglichen mit Humalog.
·Die Dauer der Insulin Lispro-Exposition unter Lyumjev war 1 Stunde kürzer als unter Humalog.
·Die Insulin Lispro-Gesamtexposition und die maximale Konzentration waren vergleichbar zwischen Lyumjev und Humalog.
Bei gesunden Probanden betrug die Variabilität von Tag-zu-Tag [CV%] innerhalb der Probanden unter Lyumjev 10% für die Gesamtexposition (AUC0-10 h) und 16% für die maximale Insulin Lispro Konzentration (Cmax).
Abbildung 3: Insulin Lispro im Serum nach subkutaner Injektion von Lyumjev oder Humalog (Dosis mit 15 I.E.)
Die absolute Bioverfügbarkeit von Insulin Lispro nach subkutaner Anwendung von Lyumjev in Abdomen, Deltoideus und Oberschenkel betrug etwa 65%. Die beschleunigte Absorption von Insulin Lispro und die frühe Exposition gegenüber Insulin Lispro wird unabhängig von der Injektionsstelle aufrechterhalten. Die maximalen Konzentrationen und die Zeit bis zur maximalen Konzentration waren vergleichbar für Abdomen und Oberarm; am Oberschenkel war die Zeit bis zur maximalen Konzentration länger und die maximale Konzentration niedriger.
Innerhalb des therapeutischen Dosisbereichs stiegen die gesamte Insulin Lispro-Exposition und die maximale Insulin Lispro-Konzentration proportional mit zunehmender subkutaner Dosis von Lyumjev an.
Kontinuierliche subkutane Insulin-Infusion (CSII)
Die Absorption von Insulin Lispro war beschleunigt, wenn Lyumjev bei Patienten mit Typ 2 Diabetes mittels CSII angewendet wurde.
·Die Zeit bis zum Erreichen von 50% der maximalen Konzentration betrug 14 Minuten; 9 Minuten kürzer als unter Humalog.
·Nach Anwendung von Lyumjev war in den ersten 30 Minuten 1.5-mal mehr Insulin Lispro verfügbar im Vergleich zu Humalog.
Vergleich von Lyumjev 200 I.E./ml und Lyumjev 100 I.E./ml
Die Ergebnisse einer Studie bei gesunden Probanden zeigte die Bioäquivalenz von Lyumjev 200 I.E./ml und Lyumjev 100 I.E./ml nach Anwendung einer Einzeldosis von 15 I.E. basierend auf der Kurve der freien Insulin Lispro-Konzentration im Serum vom Zeitpunkt Null bis unendlich und der maximalen Insulin Lispro-Konzentration. Die beschleunigte Insulin Lispro Absorption nach Anwendung von 200 I.E./ml war ähnlich zu der, die unter Lyumjev 100 I.E./ml beobachtet wurde.
Distribution
Der geometrische Mittelwert (% Variationskoeffizienz [CV%]) des Verteilungsvolumens (Vd) von Insulin Lispro betrug 34 l (30%) nach intravenöser Anwendung von Lyumjev als Bolusinjektion in einer Dosis von 15 I.E. bei gesunden Probanden.
Metabolismus
Keine neuen Studiendaten zu Insulin Lispro.
Elimination
Der geometrische Mittelwert (CV%) der Clearance von Insulin Lispro betrug 32 l/Stunde (22%) und die mediane Halbwertszeit von Insulin Lispro betrug 44 Minuten nach intravenöser Anwendung von Lyumjev als Bolusinjektion in einer Dosis von 15 I.E. bei gesunden Probanden.
Kinetik spezieller Patientengruppen,
Alter, Geschlecht und ethnische Abstammung hatten keine Auswirkungen auf die Pharmakokinetik und Pharmakodynamik von Lyumjev.
Leberfunktionsstörungen
Eine Einschränkung der Leberfunktion hat keinen bekannten Einfluss auf die Pharmakokinetik von Insulin Lispro. Bei Leberfunktionsstörung kann der Insulinbedarf reduziert sein.
Nierenfunktionsstörungen
Eine Einschränkung der Nierenfunktion hat keinen bekannten Einfluss auf die Pharmakokinetik von Insulin Lispro. Bei Nierenfunktionsstörung kann der Insulinbedarf reduziert sein.
Präklinische DatenNicht-klinische Daten zeigten keine besonderen Gefahren für den Menschen, basierend auf konventionellen Studien zur Sicherheitspharmakologie, Toxizität bei wiederholter Verabreichung, Genotoxizität, oder zur Reproduktions- und Entwicklungstoxizität nach Exposition mit Insulin Lispro.
Sonstige HinweiseDieses Arzneimittel darf nicht mit anderen Insulinen oder anderen Arzneimitteln gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Haltbarkeit nach Anbruch
Nach dem Öffnen/Anbruch (nach Durchstechen von Dichtscheibe oder Stopfen) 28 Tage haltbar.
Besondere Lagerungshinweise
Vor Anbruch im Kühlschrank (2-8°C) lagern.
Nicht einfrieren.
Den Behälter im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Vor direkter Hitze, direktem Licht oder Sonnenlicht schützen.
Ausser Reichweite von Kindern aufbewahren.
Durchstechflasche
Nach Anbruch (nach Durchstechen des Stopfens):
Im Kühlschrank (2–8°C) lagern. Falls dies nicht möglich ist, ohne Kühlung aufbewahren bei Temperaturen nicht über 30°C.
Patrone
Nach Anbruch (nach Durchstechen der Dichtscheibe):
Belassen Sie die Kappe auf dem Pen, sobald eine Patrone eingelegt ist, zum Schutz vor Licht.
Ohne Kühlung aufbewahren. Nicht bei Temperaturen über 30°C aufbewahren.
KwikPen
Nach Anbruch (nach Durchstechen der Dichtscheibe):
Belassen Sie die Kappe auf dem Pen, zum Schutz vor Licht.
Ohne Kühlung aufbewahren. Nicht bei Temperaturen über 30°C aufbewahren.
Hinweise für die Handhabung
Intravenöse Anwendung
Die chemische und physikalische Stabilität der verdünnten Lösung wurde für einen Zeitraum von 14 Tagen bei 2 bis 8°C und für 20 Std bei Raumtemperatur gezeigt. Aus mikrobiologischer Sicht ist die verdünnte Lösung sofort zu verwenden. Wird die Lösung nicht sofort verwendet, so liegen Lagerungsbedingungen und Dauer der Lagerung in der Verantwortung des Anwenders und dürfen im Normalfall nicht mehr als 24 Stunden bei 2 bis 8°C betragen, es sei denn die Verdünnung ist unter kontrollierten und validierten aseptischen Bedingungen erfolgt.
Kontinuierliche subkutane Insulin-Infusion
Lyumjev 100 I.E./ml Durchstechflasche kann in einer kontinuierlichen Insulin-Infusionspumpe bis zu 9 Tage verwendet werden. Schläuche, deren innere Oberflächen aus Polyethylen oder Polyolefin bestehen, wurden getestet und waren mit der Pumpenanwendung kompatibel.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Zulassungsnummer67550, 67793, 67794 (Swissmedic).
PackungenLyumjev Injektionslösung 100 I.E./ml:
Durchstechflasche 10 ml: 1 (B)
Patronen (3,0 ml) für 3,0 ml Pen: 5 (B)
Lyumjev 100 I.E./ml KwikPen (3,0 ml): 5 (B)
Lyumjev 100 I.E./ml Junior KwikPen (3,0 ml): 5 (B)
Lyumjev Injektionslösung 200 I.E./ml:
Lyumjev 200 I.E./ml KwikPen (3,0 ml): 5 (B)
ZulassungsinhaberinEli Lilly (Suisse) SA, 1214 Vernier/GE.
Stand der InformationFebruar 2020.
|



