ZusammensetzungWirkstoffe
Cenobamat
Hilfsstoffe
Tablettenkern
Lactose-Monohydrat, Magnesiumstearat (E470b), mikrokristalline Cellulose (E460), hochdisperses Siliciumdioxid (E551), Carboxymethylstärke-Natrium (Typ A)
Filmüberzug
25 mg und 100 mg Filmtabletten:
Indigocarmin-Aluminiumsalz (E132), rotes Eisenoxid (E172), gelbes Eisenoxid (E172), Macrogol, Poly(vinylalkohol) (E1203), Talkum (E553b), Titandioxid (E171)
50 mg Filmtabletten:
Gelbes Eisenoxid (E172), Macrogol, Poly(vinylalkohol) (E1203), Talkum (E553b), Titandioxid (E171)
150 mg und 200 mg Filmtabletten:
Rotes Eisenoxid (E172), gelbes Eisenoxid (E172), Macrogol, Poly(vinylalkohol) (E1203), Talkum (E553b), Titandioxid (E171)
Jede 12,5 mg Tablette enthält 39,7 mg Lactose-Monohydrat und 0,16 mg Natrium.
Jede 25 mg Tablette enthält 79,3 mg Lactose-Monohydrat und 0,32 mg Natrium.
Jede 50 mg Tablette enthält 158,7 mg Lactose-Monohydrat und 0,64 mg Natrium.
Jede 100 mg Tablette enthält 108,7 mg Lactose-Monohydrat und 0,64 mg Natrium.
Jede 150 mg Tablette enthält 163 mg Lactose-Monohydrat und 0,96 mg Natrium.
Jede 200 mg Tablette enthält 217,4 mg Lactose-Monohydrat und 1,28 mg Natrium.
Indikationen/AnwendungsmöglichkeitenOntozry wird angewendet zur Zusatztherapie fokaler Anfälle mit oder ohne sekundäre Generalisierung bei erwachsenen Patienten mit Epilepsie, die trotz einer vorangegangenen Behandlung mit mindestens 2 antiepileptischen Arzneimitteln nicht ausreichend kontrolliert sind.
Dosierung/AnwendungÜbliche Dosierung
Die empfohlene Anfangsdosis von Cenobamat beträgt 12,5 mg pro Tag und wird schrittweise auf die empfohlene Zieldosis von 200 mg pro Tag titriert. Basierend auf dem klinischen Ansprechen kann die Dosis auf maximal 400 mg pro Tag erhöht werden.
Der empfohlene Titrationsplan ist in Tabelle 1 angegeben. Dieser sollte wegen des Potenzials für schwerwiegende Nebenwirkungen nicht überschritten werden (siehe Rubrik «Unerwünschte Wirkungen»).
Tabelle 1: Empfohlene Dosierung bei Erwachsenen mit fokalen Anfällen bei Epilepsie
|
Behandlungsphase
|
Dosis (pro Tag, oral)
|
Dauer
| |
Einleitung der Behandlung
|
12,5 mg
|
Wochen 1 und 2
| |
25 mg
|
Wochen 3 und 4
| |
Titration
|
50 mg
|
Wochen 5 und 6
| |
100 mg
|
Wochen 7 und 8
| |
150 mg
|
Wochen 9 und 10
| |
Zieldosis
|
200 mg
|
Wochen 11 und 12 und danach
| |
Dosisoptimierung
|
Einige Patienten, die keine optimale Anfallskontrolle erreichen, können von Dosen über 200 mg (erhöht in Schritten von 50 mg/Tag alle zwei Wochen) bis zu einem Maximum von 400 mg täglich profitieren.
|
Versäumte Dosen
Wenn Patienten eine Dosis vergessen, wird empfohlen, eine Einzeldosis einzunehmen, sobald sie sich daran erinnern, es sei denn, der Zeitraum bis zur nächsten regulär geplanten Dosis beträgt weniger als 12 Stunden.
Behandlungsabbruch
Es wird empfohlen, die Behandlung schrittweise (d.h. über mindestens 2 Wochen) abzusetzen, um das Potenzial für Rebound-Anfälle zu minimieren, es sei denn, Sicherheitsbedenken erfordern ein abruptes Absetzen.
Patienten mit Leberfunktionsstörungen
Die Exposition gegenüber Cenobamat war bei Patienten mit chronischer Lebererkrankung erhöht. Eine Änderung der Anfangsdosis ist nicht erforderlich; eine Verringerung der Zieldosen um bis zu 50 % sollte jedoch gegebenenfalls in Betracht gezogen werden. Die maximal empfohlene Dosis bei Patienten mit leichter und mittelschwerer Leberfunktionsstörung beträgt 200 mg/Tag. Cenobamat sollte nicht bei Patienten mit einer schweren Leberfunktionsstörung angewendet werden.
Patienten mit Nierenfunktionsstörungen
Bei Patienten mit leichter bis mittelschwerer (Kreatinin-Clearance 30 bis < 90 ml/min) oder schwerer (Kreatinin-Clearance < 30 ml/min) Nierenfunktionsstörung sollte Cenobamat mit Vorsicht angewendet werden, und es kann eine Reduzierung der Zieldosis erwogen werden. Die maximal empfohlene Dosis bei Patienten mit leichter, mittelschwerer oder schwerer Nierenfunktionsstörung beträgt 300 mg/Tag. Cenobamat sollte nicht bei Patienten mit terminaler Niereninsuffizienz oder bei Patienten, die sich einer Hämodialyse unterziehen, angewendet werden.
Ältere Patienten
Die Anzahl von Patienten im Alter von über 65 Jahren in klinischen Studien mit Cenobamat war nicht ausreichend, um festzustellen, ob sie anders ansprechen als jüngere Patienten. Es wurde berichtet, dass bei älteren Patienten, die antiepileptische Arzneimittel einnehmen, häufiger unerwünschte Reaktionen wie Ermüdung, Gangstörung, Sturz, Ataxie, Gleichgewichtsstörung, Schwindel und Somnolenz auftreten. Im Allgemeinen sollte die Dosisauswahl für einen älteren Patienten vorsichtig erfolgen, in der Regel beginnend am unteren Ende des Dosierungsbereichs, um die grössere Häufigkeit von verminderter Leber- oder Nierenfunktion und von Begleiterkrankungen sowie die möglichen Wechselwirkungen bei Patienten mit Polypharmazie zu berücksichtigen (siehe Rubrik «Warnhinweise und Vorsichtsmassnahmen»).
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Cenobamat bei Kindern und Jugendlichen im Alter von 0 Monaten bis 18 Jahren ist nicht erwiesen. Es liegen keine Daten vor.
Art der Anwendung
Zum Einnehmen.
Cenobamat sollte in der Regel einmal täglich zu einem beliebigen Zeitpunkt als orale Einzeldosis eingenommen werden. Es sollte jedoch vorzugsweise jeden Tag zur gleichen Zeit eingenommen werden. Es kann mit oder ohne Nahrung eingenommen werden (siehe Rubrik «Pharmakokinetik»). Die Tablette sollte mit einem Glas Wasser eingenommen werden. Die Tabletten können nicht genau geteilt werden, da es keine Bruchlinie gibt und die Genauigkeit der Dosis nicht gewährleistet werden kann.
KontraindikationenÜberempfindlichkeit gegen den Wirkstoff oder einen der in Rubrik «Zusammensetzung» genannten Hilfsstoffe.
Familiäres Short-QT-Syndrom (siehe Rubrik «Warnhinweise und Vorsichtsmassnahmen»).
Warnhinweise und VorsichtsmassnahmenSuizidgedanken
Suizidgedanken und suizidales Verhalten wurden bei Patienten berichtet, die mit Antiepileptika, einschliesslich Cenobamat, behandelt wurden. Eine Metaanalyse randomisierter Placebo-kontrollierter Studien mit Antiepileptika hat ebenfalls ein geringfügig erhöhtes Risiko für Suizidgedanken und verhalten gezeigt. Der Mechanismus dieses Risikos ist nicht bekannt. Daher sollten die Patienten auf Anzeichen suizidaler Gedanken und Verhaltensweisen überwacht werden und eine angemessene Behandlung sollte erwogen werden.
Patienten (und Betreuern von Patienten) sollte geraten werden, zeitnah ärztlichen Rat einzuholen, wenn Anzeichen für suizidale Gedanken oder suizidales Verhalten auftreten.
Syndrom der Arzneimittelreaktion mit Eosinophilie und systemischen Symptomen (Drug Rash with Eosinophilia and Systemic Symptoms - DRESS)
Eine Arzneimittelreaktion mit Eosinophilie und systemischen Symptomen (DRESS), die lebensbedrohlich oder tödlich sein kann, wurde in Verbindung mit Cenobamat berichtet, wenn mit höheren Dosen begonnen und schnell titriert wurde (wöchentliche oder schnellere Titration) (siehe Rubrik «Unerwünschte Wirkungen»). Als Cenobamat bei 12,5 mg/Tag begonnen und alle zwei Wochen titriert wurde, wurden in einer offenen Sicherheitsstudie mit 1'340 Epilepsiepatienten keine Fälle von DRESS gemeldet.
Zum Zeitpunkt der Verschreibung sollten die Patienten über die Anzeichen und Symptome von DRESS informiert und eng auf Hautreaktionen überwacht werden. Zu den Symptomen von DRESS gehören typischerweise, wenn auch nicht ausschliesslich, Fieber, Hautausschlag in Verbindung mit einer Beteiligung anderer Organsysteme, Lymphadenopathie, Anomalien der Leberfunktionstests und Eosinophilie. Es ist wichtig zu beachten, dass es frühe Manifestationen von Überempfindlichkeit, wie Fieber oder Lymphadenopathie, geben kann, auch wenn ein Ausschlag nicht evident ist. Wenn Anzeichen und Symptome auftreten, die auf diese Reaktionen hindeuten, sollte Cenobamat sofort abgesetzt und (gegebenenfalls) eine alternative Behandlung erwogen werden.
QT-Zeit-Verkürzung
Unter Cenobamat wurde eine dosisabhängige Verkürzung des QTcF-Intervalls beobachtet. Reduktionen des QTcF-Intervalls unter 340 ms wurden nicht beobachtet (siehe Rubrik «Pharmakodynamik»). In klinischen Studien gab es keine Hinweise darauf, dass die Kombination von Cenobamat mit anderen Antiepileptika zu einer weiteren QT-Zeit-Verkürzung führte. Ärzte sollten bei der Verschreibung von Cenobamat in Kombination mit anderen Arzneimitteln, von denen bekannt ist, dass sie die QT-Zeit verkürzen, Vorsicht walten lassen.
Das familiäre Short-QT-Syndrom ist ein seltenes genetisches Syndrom, das mit einem erhöhten Risiko für plötzlichen Tod und ventrikuläre Arrhythmien, insbesondere Kammerflimmern, verbunden ist. Cenobamat darf bei Patienten mit familiärem Short-QT-Syndrom nicht angewendet werden (siehe Rubrik «Kontraindikationen»).
Hilfsstoffe von besonderem Interesse
Lactose: Patienten mit der seltenen hereditären Galactose-Intoleranz, völligem Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten dieses Arzneimittel nicht anwenden.
Natrium: Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Tablette/Filmtablette, d.h. es ist nahezu «natriumfrei».
InteraktionenPharmakodynamische Interaktionen
ZNS-Depressiva
Die gleichzeitige Einnahme von Cenobamat mit anderen ZNS-Depressiva, einschliesslich Alkohol, Barbituraten und Benzodiazepinen, kann das Risiko neurologischer Nebenwirkungen erhöhen. Daher müssen die Dosen von Barbituraten und Benzodiazepinen bei gleichzeitiger Anwendung mit Cenobamat auf der Grundlage des individuellen Ansprechens möglicherweise reduziert werden, wie klinisch angemessen.
Pharmakokinetische Interaktionen
Cenobamat wird in grossem Umfang metabolisiert, hauptsächlich durch Glucuronidierung und in geringerem Masse durch Oxidation.
Cenobamat kann die Exposition von Produkten verringern, die hauptsächlich von CYP3A4 und 2B6 metabolisiert werden. Cenobamat kann die Exposition von Produkten erhöhen, die hauptsächlich von CYP2C19 metabolisiert werden. Wenn die Behandlung mit Cenobamat begonnen oder abgebrochen oder die Dosis geändert wird, kann es 2 Wochen dauern, bis das neue Niveau der Enzymaktivität erreicht ist.
Die folgende Tabelle zeigt die Wechselwirkungen zwischen Cenobamat und anderen Arzneimitteln.
Tabelle 2: Wechselwirkungen zwischen Cenobamat und anderen Arzneimitteln sowie Empfehlungen zur gleichzeitigen Anwendung
|
Wirkstoff (Dosierungsschema)
|
Wirkung auf PK-Parameter
(möglicher Wechselwirkungsmechanismus)
|
Empfehlung für die gleichzeitige Anwendung
| |
Phenytoin (300 mg/Tag)
Cenobamat (200 mg/Tag)
|
Phenytoin:
Cmax +67 % (GMR 167 % - 90KI 155;180)
AUC +84 % (GMR 184 % - 90KI 169;201)
Cenobamat:
Cmax -27 % (GMR 73 % - 90KI 69;78)
AUC -28 % (GMR 72 % - 90KI 67;76)
|
Keine Dosisanpassung von Cenobamat. Überwachung der Phenytoinkonzentrationen während der Titration von Cenobamat und Verringerung der Dosis von Phenytoin in Betracht ziehen.
| |
Phenobarbital (90 mg/Tag)
Cenobamat (200 mg/Tag)
|
Phenobarbital:
Cmax +34 % (GMR 134 % - 90KI 128;139)
AUC +37 % (GMR 137 % - 90KI 133;142)
Cenobamat:
Cmax -10% (GMR 90% - 90KI 83;99)
AUC -15% (GMR 85% - 90KI 77;92)
|
Keine Dosisanpassung von Cenobamat. Überwachung der Phenobarbitalkonzentrationen während der Titration von Cenobamat und Verringerung der Dosis von Phenobarbital in Betracht ziehen.
| |
Clobazam (100-400 mg/Tag)
Cenobamat (100-400 mg/Tag)
|
Clobazam:
Möglicher Anstieg des aktiven Metaboliten N-Desmethylclobazam
Cenobamat:
AUC +24% (GMR 124% - 90KI 115;134)
(Induktion von CYP3A4 und Hemmung von CYP2C19)
|
Keine Dosisanpassung von Cenobamat.
Verringerung der Dosis von Clobazam in Betracht ziehen.
| |
Lamotrigin
Cenobamat (100, 200 und 400 mg/Tag)
|
Lamotrigin:
Dosisabhängige Abnahme der Konzentrationen. Simulierte prozentuale Veränderung gegenüber dem Ausgangswert von -21 % (95KI -28;-16), -35 % (95KI -43;-27) bzw. -52 % (95KI -60;-43) für Cenobamat 100, 200 und 400 mg/Tag
Cenobamat:
Keine wesentlichen Veränderungen
|
Keine Dosisanpassung von Cenobamat.
Erhöhung der Dosis von Lamotrigin in Betracht ziehen.
| |
Carbamazepin (400 mg/Tag)
Cenobamat (200 mg/Tag)
|
Carbamazepin:
Cmax -23% (GMR 77% - 90KI 71;83)
AUC -24% (GMR 76% - 90KI 71;82)
Cenobamat:
Cmax -3% (GMR 97% - 90KI 94;101)
AUC -3% (GMR 97% - 90KI 95;100)
|
Keine Dosisanpassung erforderlich, weder für Cenobamat noch für Carbamazepin, da keine klinisch bedeutsamen Verringerungen der Wirksamkeit bei Patienten, die gleichzeitig Carbamazepin einnahmen, beobachtet wurden.
| |
Valproinsäure (1000 mg/Tag)
Cenobamat (150 mg/Tag)
|
Valproinsäure:
Cmax +5% (GMR 105% - 90KI 94;117)
AUC +10% (GMR 110% - 90KI 99;121)
Cenobamat:
Cmax 0% (GMR 100% - 90KI 98;103)
AUC +9% (GMR 109% - 90KI 106;112)
|
Keine Dosisanpassung erforderlich.
| |
Levetiracetam
Cenobamat
|
Levetiracetam:
Keine wesentlichen Veränderungen
Cenobamat:
Keine wesentlichen Veränderungen
|
Keine Dosisanpassung erforderlich.
| |
Oxcarbazepin
Cenobamat
|
Oxcarbazepin:
Keine wesentlichen Veränderungen
Cenobamat:
Keine wesentlichen Veränderungen
|
Keine Dosisanpassung erforderlich.
| |
Orale Kontrazeptiva
Cenobamat
|
Orale Kontrazeptiva:
Verringerte Exposition gegenüber von CYP3A4 metabolisierten Kontrazeptiva aufgrund der Induktion durch Cenobamat
Cenobamat:
Keine wesentlichen Veränderungen
|
Zusätzliche oder alternative nichthormonelle Massnahmen der Empfängnisverhütung anwenden.
| |
CYP3A4-Substrate (Midazolam 2 mg)
Cenobamat (100-200 mg/Tag)
|
Midazolam:
AUC -27 % (GMR 73 % - 90KI 65;82) und Cmax -27% (GMR 73% - 90KI 65;83) mit Cenobamat 100 mg
AUC -72 % (GMR 28 % - 90KI 24;32) und Cmax -61% (GMR 39% - 90KI 33;45) mit Cenobamat 200 mg
|
Erhöhung der Dosis von CYP3A4-Substraten in Betracht ziehen.
| |
CYP2B6-Substrate (Bupropion 150 mg)
Cenobamat (200 mg/Tag)
|
Bupropion:
Cmax -23% (GMR 77% - 90KI 67;89)
AUC -39% (GMR 61% - 90KI 52;72)
|
Erhöhung der Dosis von CYP2B6-Substraten in Betracht ziehen.
| |
CYP2C19-Substrate (Omeprazol 20 mg)
Cenobamat (200 mg/Tag)
|
Omeprazol:
Cmax +83% (GMR 183% - 90KI 126;267)
AUC +107% (GMR 207% - 90KI 144;298)
|
Verringerung der Dosis von CYP2C19-Substraten in Betracht ziehen.
| |
CYP2C9-Substrate (Warfarin 5 mg)
Cenobamat (200 mg/Tag)
|
S-Warfarin:
Cmax +7% (GMR 107% - 90KI 96;119)
AUC +14% (GMR 114% - 90KI 110;118)
|
Keine Dosisanpassung von CYP2C9-Substraten erforderlich.
| |
OAT3-Substrate (Baricitinib, Cefaclor, Empagliflozin, Penicillin G, Ritobegron, Sitagliptin)
Cenobamat
|
In-vitro-Studie
(OAT3-Hemmung)
|
Verringerung der Dosis von OAT3-Substraten in Betracht ziehen.
|
GMR = Verhältnis der geometrischen Mittelwerte (Geometric Mean Ratio); 90KI bzw. 95KI = 90%- bzw. 95%-Konfidenzintervall
Die gleichzeitige Verabreichung von Inhibitoren oder Induktoren sollte unter Berücksichtigung der in der Fachinformation des jeweiligen Substrats enthaltenen Hinweise und Informationen erfolgen.
Schwangerschaft, StillzeitFrauen im gebärfähigen Alter und Empfängnisverhütung bei Frauen
Frauen im gebärfähigen Alter müssen während der Behandlung mit Cenobamat und bis zu 4 Wochen nach Beendigung der Behandlung eine zuverlässige Verhütungsmethode anwenden (siehe Rubrik «Interaktionen»). Frauen im gebärfähigen Alter, die gleichzeitig orale Kontrazeptiva verwenden, müssen während der Behandlung mit Cenobamat und bis zu 4 Wochen nach Beendigung der Behandlung eine zuverlässige zusätzliche oder alternative nicht-hormonelle Verhütungsmethode anwenden (siehe Rubrik «Interaktionen»).
Schwangerschaft
Risiken im Zusammenhang mit Epilepsie und Antiepileptika im Allgemeinen
Es hat sich gezeigt, dass bei der Nachkommenschaft von behandelten Frauen mit Epilepsie die Prävalenz von Missbildungen zwei- bis dreimal so hoch ist wie in der Allgemeinbevölkerung mit etwa 3 %. In der behandelten Population wurde bei Polytherapie eine Zunahme der Missbildungen festgestellt; es ist jedoch nicht geklärt, inwieweit die Behandlung und/oder die Grunderkrankung dafür verantwortlich ist. Ein Abbruch der antiepileptischen Behandlung kann zu einer Verschlimmerung der Krankheit führen, was für die Mutter und den Fötus schädlich sein könnte.
Risiken im Zusammenhang mit Cenobamat
Es liegen keine kontrollierten klinischen Studien zur Anwendung von Cenobamat bei schwangeren Frauen vor.
Tierexperimentelle Studien haben gezeigt, dass Cenobamat die Plazenta von Ratten passiert. Tierexperimentelle Studien haben eine Reproduktionstoxizität bei Spiegeln unterhalb der klinischen Exposition gezeigt (siehe Rubrik «Präklinische Daten»). Ontozry darf während der Schwangerschaft nicht angewendet werden, es sei denn, dass eine Behandlung mit Cenobamat aufgrund des klinischen Zustandes der Frau erforderlich ist.
Stillzeit
Es ist nicht bekannt, ob Cenobamat oder seine Metaboliten in die Muttermilch übergehen.
In Tierexperimentellen Studien wurde ein Transfer in die Milch gezeigt (siehe Rubrik «Präklinische Daten»). Ein Risiko für den Säugling kann nicht ausgeschlossen werden. Es muss eine Entscheidung darüber getroffen werden, ob das Stillen zu unterbrechen ist oder ob die Behandlung mit Cenobamat zu unterbrechen ist. Dabei ist sowohl der Nutzen des Stillens für das Kind als auch der Nutzen der Therapie für die Frau zu berücksichtigen.
Fertilität
Die Auswirkungen von Cenobamat auf die menschliche Fertilität sind unbekannt. Aufgrund der Exposition unterhalb des klinischen Niveaus liegen keine ausreichenden tierexperimentellen Daten vor (siehe Rubrik «Präklinische Daten»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenOntozry hat einen mässigen Einfluss auf die Fahrtüchtigkeit oder die Fähigkeit, Maschinen zu bedienen.
Cenobamat kann Schläfrigkeit, Schwindelgefühl, Müdigkeit, Sehstörungen und andere Symptome im Zusammenhang mit dem ZNS verursachen, die die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen beeinflussen können. Den Patienten wird empfohlen, kein Fahrzeug zu führen, keine komplexen Maschinen zu bedienen oder anderen potenziell gefährlichen Tätigkeiten nachzugehen, bis bekannt ist, ob Cenobamat ihre Fähigkeit zur Ausführung dieser Aufgaben beeinträchtigt (siehe Rubrik «Interaktionen»).
Unerwünschte WirkungenZusammenfassung des Sicherheitsprofils
Die häufigsten berichteten unerwünschten Reaktionen waren Somnolenz, Schwindelgefühl, Ermüdung, Sehstörungen, Kopfschmerzen und andere ZNS-bezogene Symptome.
Die Abbruchraten wegen unerwünschter Reaktionen in klinischen Studien betrugen 5 %, 6 % und 19 % bei Patienten, die randomisiert Cenobamat in Dosen von 100 mg/Tag, 200 mg/Tag und 400 mg/Tag erhielten, verglichen mit 3 % bei Patienten, die randomisiert Placebo erhielten. Die Dosis von 400 mg war stärker mit unerwünschten Reaktionen assoziiert, insbesondere wenn sie gleichzeitig mit Clobazam eingenommen wurde.
Die unerwünschten Reaktionen, die am häufigsten zum Absetzen führten, waren in absteigender Reihenfolge der Häufigkeit: Ataxie (1,6 % vs. 0,5 % Placebo), Schwindelgefühl (1,6 % vs. 0,5 % Placebo), Somnolenz (1,4 % vs. 0,5 % Placebo), Nystagmus (0,7 % vs. 0 % Placebo), Vertigo (0,7 % vs. 0 % Placebo) und Doppeltsehen (0,5 % vs. 0 % Placebo). Diese unerwünschten Reaktionen sind dosisabhängig und das Titrationsschema sollte strikt befolgt werden.
Tabellarische Auflistung von unerwünschten Wirkungen
Die in klinischen Studien berichteten unerwünschten Wirkungen sind in Tabelle 3 nach Systemorganklasse (SOC) und nach Häufigkeit aufgeführt. Innerhalb jeder Häufigkeitsgruppe sind die unerwünschten Wirkungen in absteigender Reihenfolge des Schweregrades angeordnet: sehr häufig (≥1/10), häufig (≥1/100 bis < 1/10), gelegentlich (≥1/1'000 bis < 1/100) und selten (≥1/10'000 bis <1/1'000).
Tabelle 3: Tabellarische Auflistung von unerwünschten Wirkungen
|
Systemorganklasse
|
Häufigkeit
|
unerwünschte Wirkungen aus klinischen Studien
| |
Erkrankungen des Immunsystems
|
Gelegentlich
|
Überempfindlichkeit*
| |
Psychiatrische Erkrankungen
|
Häufig
|
Verwirrtheitszustand, Reizbarkeit
| |
Gelegentlich
|
Suizidgedanken
| |
Erkrankungen des Nervensystems
|
Sehr häufig
|
Somnolenz* 38.9%, Anomalien der Koordination und des Gangs* 33.0%, Kopfschmerzen 11.3%
| |
Häufig
|
Dysarthrie, Nystagmus, Aphasie, eingeschränktes Erinnerungsvermögen
| |
Augenerkrankungen
|
Häufig
|
Doppeltsehen, Verschwommensehen
| |
Erkrankungen des Gastrointestinaltrakts
|
Häufig
|
Obstipation, Diarrhoe, Übelkeit, Erbrechen, Mundtrockenheit
| |
Erkrankungen der Haut und des Unterhautgewebes
|
Häufig
|
Ausschlag*
| |
Selten
|
Arzneimittelreaktion mit Eosinophilie und systemischen Symptomen (DRESS)
| |
Untersuchungen
|
Häufig
|
Erhöhte Leberenzyme*
|
*Gruppierte Begriffe: Somnolenz: Somnolenz, Ermüdung, Sedierung und Hypersomnie; Anomalien der Koordination und des Gangs: Schwindelgefühl, Vertigo, Gleichgewichtsstörung, Ataxie, Gangstörung und abnormale Koordination; Überempfindlichkeit: Überempfindlichkeit, Arzneimittelüberempfindlichkeit, Augenlidödem; Ausschlag: Hautausschlag, erythematöser Ausschlag, generalisierter Ausschlag, makulöser Ausschlag, makulo-papulöser Ausschlag, morbilliformer Ausschlag, papulöser Ausschlag, Ausschlag mit Juckreiz; Erhöhte Leberenzyme: Alanin-Aminotransferase erhöht, Aspartataminotransferase erhöht, Leberenzyme erhöht, Leberfunktion anormal, Transaminasen erhöht.
Beschreibung spezifischer unerwünschter Wirkungen und Zusatzinformationen
Arzneimittelreaktion mit Eosinophilie und systemischen Symptomen (DRESS)
Innerhalb von 2 bis 4 Wochen nach dem Start von Cenobamat in Studien mit hohen Anfangsdosen (50 mg oder 100 mg einmal täglich) und wöchentlicher oder schnellerer Titration wurden drei Fälle von DRESS berichtet. Als Cenobamat bei 12,5 mg/Tag begonnen und alle zwei Wochen titriert wurde, wurden in einer offenen Sicherheitsstudie mit 1'340 Epilepsiepatienten keine Fälle von DRESS gemeldet.
Zum Zeitpunkt der Verschreibung sollten die Patienten über die Anzeichen und Symptome von DRESS informiert und eng auf Hautreaktionen überwacht werden. Zu den Symptomen von DRESS gehören typischerweise, wenn auch nicht ausschliesslich, Fieber, Hautausschlag in Verbindung mit einer Beteiligung anderer Organsysteme, Lymphadenopathie, Anomalien der Leberfunktionstests und Eosinophilie. Es ist wichtig zu beachten, dass es frühe Manifestationen von Überempfindlichkeit, wie Fieber oder Lymphadenopathie, geben kann, auch wenn ein Ausschlag nicht evident ist. Wenn Anzeichen und Symptome auftreten, die auf diese Reaktionen hindeuten, sollte Cenobamat sofort abgesetzt und (gegebenenfalls) eine alternative Behandlung erwogen werden. Ontozry sollte immer mit 12,5 mg einmal täglich begonnen und nicht schneller als einmal alle zwei Wochen titriert werden (siehe Rubrik «Dosierung/Anwendung» und «Warnhinweise und Vorsichtsmassnahmen»).
Überempfindlichkeit
Bei vier (0,9 %) mit Cenobamat behandelten Patienten und einem (0,5 %) Placebo-Patienten kam es zu einem Überempfindlichkeitsereignis. Bei zwei Patienten in der Cenobamat-Dosisgruppe kam es zu einer Arzneimittelüberempfindlichkeit. Bei einem mit Cenobamat behandelten Patienten kam es zu einem Überempfindlichkeitsereignis und bei einem mit Cenobamat behandelten Patienten zu einem Ereignis mit einem Augenlidödem. Bei dem Placebo-Patienten kam es zu einem Überempfindlichkeitsereignis. Alle Ereignisse wurden als leicht oder mittelschwer eingestuft.
Spezialpopulationen
Ältere Personen
Sicherheitsdaten aus den gepoolten doppelblinden Datensätzen und allen Phase-2/3-Datensätzen gemeinsam mit PK-Daten aus einer Phase-1-Studie zeigten keine zusätzlichen Sicherheitsrisiken bei älteren Patienten im Alter von ≥ 65 Jahren bei Studieneintritt. Eine zusätzliche Unterteilung nach Alter bei Patienten, die bei der Studienteilnahme ≥65 Jahre alt waren, ergab für diese 87 Patienten ähnliche Ergebnisse hinsichtlich unerwünschter Ereignisse wie bei den 51 Patienten, die bei Studieneintritt ≥ 65 Jahre alt waren (siehe Rubrik «Dosierung/Anwendung»).
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungDie Symptome einer Überdosierung entsprechen voraussichtlich den bekannten Nebenwirkungen von Ontozry – Somnolenz, Müdigkeit und Schwindel. Es gibt kein spezifisches Gegenmittel gegen die Wirkungen von Cenobamat. Eine allgemeine unterstützende Betreuung des Patienten ist angezeigt, einschliesslich der Überwachung der Vitalparameter und der Beobachtung des klinischen Status des Patienten.
Eigenschaften/WirkungenATC-Code
N03AX25
Pharmakotherapeutische Gruppe: Antiepileptika, sonstige Antiepileptika
Wirkungsmechanismus
Cenobamat ist ein kleines Molekül mit einem dualen Wirkmechanismus. Es ist ein positiver allosterischer Modulator von Subtypen des γ-Aminobuttersäure-(GABAA-) Ionenkanals, der nicht an die Benzodiazepin-Bindungsstelle bindet. Es konnte auch gezeigt werden, dass Cenobamat das wiederholte neuronale Feuern reduziert, indem es die Inaktivierung von Natriumkanälen verstärkt und die persistente Komponente des Natriumstroms hemmt. Der genaue Wirkmechanismus, mit dem Cenobamat seine therapeutische Wirkung bei Patienten mit fokalen Anfällen ausübt, ist unbekannt.
Pharmakodynamik
Kardiale Elektrophysiologie
In einer placebokontrollierten QT-Studie an gesunden Freiwilligen wurde eine dosisabhängige Verkürzung des QTcF-Intervalls mit Cenobamat beobachtet. Die mittlere ΔΔQTcF beträgt -10,8 [KI: -13,4, -8,2] ms bei 200 mg einmal täglich und -18,4 [KI: -21,5, -15,2] ms bei 500 mg einmal täglich (das 1,25fache der maximal empfohlenen Dosis). Reduktionen des QTc-Intervalls unter 340 ms wurden nicht beobachtet (siehe Rubrik «Warnhinweise und Vorsichtsmassnahmen»).
Klinische Wirksamkeit
Die Wirksamkeit von Cenobamat als Begleittherapie bei fokal einsetzenden Anfällen wurde in einer multizentrischen, randomisierten, doppelblinden, placebokontrollierten Doppelblindstudie an erwachsenen Patienten mit fokaler Epilepsie untersucht, die trotz einer Antiepileptika-Behandlung in der Vorgeschichte nicht ausreichend kontrolliert wurden. Die Patienten wurden mit ein bis drei begleitenden Antiepileptika behandelt, die im Verlauf der doppelblinden Studienbehandlung stabil blieben. Die tägliche Dosis von Cenobamat reichte von 100 bis 400 mg/Tag.
Die Studie umfasste einen 8wöchigen prospektiven Baselinezeitraum, in dem die Patienten mindestens 3 oder 4 partielle Anfälle pro 28 Tage haben mussten, wobei die anfallsfreie Zeit 3 bis 4 Wochen nicht überschreiten durfte, gefolgt von einem 18wöchigen Behandlungszeitraum, einschliesslich 12 Wochen mit fester Dosis. Die zum Zeitpunkt des Studieneintritts am häufigsten eingenommenen Antiepileptika waren Levetiracetam, Lamotrigin, Carbamazepin und Lacosamid. Alle Patienten, die in die Studie eintraten, hatten weiterhin Anfälle, obwohl die Mehrheit in der Vergangenheit bereits mit zwei oder mehr Antiepileptika behandelt worden war. Mehr als 80 % der Patienten nahmen zum Zeitpunkt der Aufnahme in die Studie gleichzeitig zwei oder mehr Antiepileptika ein. Die Wirksamkeitsergebnisse sind in Tabelle 4 zusammengefasst.
Die Studie verglich die Dosen von Cenobamat 100 mg/Tag, 200 mg/Tag und 400 mg/Tag mit Placebo, zusätzlich zur Standardbehandlung. Die Patienten setzten die stabile Behandlung mit ein bis drei Hintergrund-Antiepileptika fort. Die Patienten, die zu 400 mg/Tag randomisiert worden waren, erhielten zunächst eine tägliche Dosis von 50 mg, die anschliessend jede Woche um 50 mg/Tag erhöht wurde, bis 200 mg/Tag erreicht waren, und dann jede Woche um 100 mg/Tag.
Tabelle 4 zeigt den Anteil der Patienten, bei denen die Anfallshäufigkeit gegenüber der Baseline um 50 % oder mehr reduziert wurde.
Tabelle 4: Anteil der Patienten, die in Studie C017 ein Ansprechen von 50 % oder mehr zeigten
|
Studie
|
Standardversorgung und Placebo
|
Standardversorgung und Cenobamat
| |
100 mg/Tag
|
200 mg/Tag
|
400 mg/Tag
| |
Studie C017
| |
|
n = 102
|
n = 102
|
n = 98
|
n = 95
| |
50 % Ansprechrate1
|
26 (25,5 %)
|
41 (40,2 %)
|
55 (56,1 %)
|
61 (64,2 %)
| |
Unterschied Cenobamat – Placebo
|
|
14,7 %
(p = 0,036)
|
30,6 %
(p < 0,001)
|
38,7 %
(p < 0,001)
|
1Über 12 Wochen doppelblinde Behandlung mit fester Dosierung
Abbildung 1 zeigt den Prozentsatz der Patienten nach Kategorie des Ansprechens der Anfälle während der Erhaltungsphase mit zunehmend strengeren Kriterien für das Ansprechen.
Abbildung 1: Kumulative Verteilung der prozentualen Reduktion der Anfälle gegenüber Baseline nach Behandlungsgruppe in der 12wöchigen Phase mit fester Dosis in der Studie
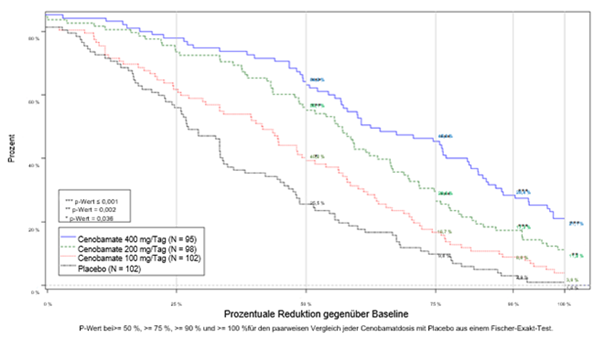
Anfallsfreiheit (100 %ige Reduktion der Anfälle) erreichten in der Studie 4 von 102 (3,9 %) Patienten in der Gruppe mit Cenobamat 100 mg/Tag, 11 von 98 (11,2 %) Patienten in der Gruppe mit Cenobamat 200 mg/Tag, 20 von 95 (21,1 %) Patienten in der Gruppe mit Cenobamat 400 mg/Tag und 1 von 102 (1 %) Patienten in der Placebo-Gruppe während der 12wöchigen Phase mit fester Dosis. Ähnliche Antworten wurden bei Subpopulationen beobachtet, die grösser oder kleiner als die mediane Anfallshäufigkeit und grösser oder kleiner als die mediane Krankheitsdauer waren.
Langzeitdaten
Die Mehrheit der Patienten entschied sich für die Teilnahme an der offenen Verlängerung von Studie 1 (98,9 %). 80 % der Patienten blieben mindestens 12 Monate und 58 % mindestens 60 Monate in der Studie. Es wurden zusätzliche Daten zur Anfallshäufigkeit gesammelt, die mit den Ergebnissen aus dem doppelblinden Teil der Studie übereinstimmten.
Pädiatrie
Die Europäische Arzneimittelagentur hat für Ontozry eine Zurückstellung von der Verpflichtung zur Vorlage von Ergebnissen zu Studien in einer oder mehreren pädiatrischen Altersklassen mit Epilepsie gewährt (siehe Rubrik «Dosierung/Anwendung»).
PharmakokinetikAbsorption
Cenobamat wird nach oraler Verabreichung gut resorbiert (mindestens 88 % bezogen auf den Nachweis im Urin), wobei die mediane Tmax zwischen 1 und 4 Stunden nach Verabreichung einer oder mehrerer Dosen unter Fastenbedingungen im Bereich von 10 bis 400 mg liegt.
Die gleichzeitige Verabreichung mit einer fettreichen Mahlzeit (800-1'000 kcal mit 50 % Fett) zeigte keine signifikante Wirkung auf die Rate und das Ausmass der Resorption von Cenobamat.
Distribution
Das scheinbare Verteilungsvolumen (Vd/F) von Cenobamat nach oraler Verabreichung beträgt etwa 40-50 l. Die Plasmaproteinbindung von Cenobamat beträgt 60 % und ist unabhängig von der Konzentration in vitro. Cenobamat bindet primär an humanes Albumin-Protein.
Metabolismus
Cenobamat wird weitgehend metabolisiert. Der primäre Stoffwechselweg ist die Glucuronidierung über UGT2B7 und in geringerem Masse über UGT2B4. Zu den kleineren Stoffwechselwegen für Cenobamat gehört die Oxidation über CYP2E1, CYP2A6, CYP2B6 und in geringerem Masse über CYP2C19 und CYP3A4/5.
Elimination
Cenobamat und seine Metaboliten werden hauptsächlich über den Urin ausgeschieden (88% der Dosis). Die Exkretion via Fäzes machte nur 5,2 % der Dosis aus. Mehr als 50 % der Dosis wurde innerhalb von 72 Stunden ausgeschieden. Die scheinbare terminale Halbwertszeit von Cenobamat im Plasma betrug 50 bis 60 Stunden innerhalb des therapeutischen Bereichs von 100 mg/Tag bis 400 mg/Tag. Ein Steady State wird nach 14 Tagen erreicht.
Linearität/Nicht Linearität
Die Cmax von Cenobamat stieg proportional mit steigenden Dosen nach einmaliger oraler Gabe von 5 bis 750 mg, während die AUC in diesem Dosisbereich überproportional anstieg. Die Cenobamat Steady-State-Expositionen (Cmax und AUC) nahmen mit steigenden Dosen im therapeutischen Bereich (100 bis 400 mg) proportional zu, aber Dosen unter 100 mg/Tag werden möglicherweise schneller abgebaut.
Kinetik spezieller Patientengruppen
Leberfunktionsstörungen
Die Plasma-AUC von Cenobamat war bei Patienten mit leichter und mittelschwerer Leberfunktionsstörung nach einer einmaligen oralen Cenobamat-Gabe von 200 mg im Vergleich zu gesunden Kontrollen 1,9- und 2,3fach höher (siehe Rubrik «Dosierung/Anwendung»). Die Wirkung einer schweren Leberfunktionsstörung auf die Pharmakokinetik von Cenobamat wurde nicht untersucht.
Nierenfunktionsstörungen
Die Plasma-AUC von Cenobamat war bei Patienten mit leichter (CLcr 60 bis < 90 ml/min) und mittelschwerer (CLcr 30 bis < 60 ml/min) Nierenfunktionsstörung nach einer einmaligen oralen Cenobamat-Gabe von 200 mg im Vergleich zu gesunden Kontrollen 1,4- bis 1,5fach höher. Bei Patienten mit schwerer (CLcr < 30 ml/min) Nierenfunktionsstörung veränderte sich die Plasma-AUC für Cenobamat nach einmaliger oraler Gabe von 100 mg Cenobamat im Vergleich zu gesunden Kontrollen nicht signifikant (siehe Rubrik «Dosierung/Anwendung»). Die Wirkung einer Hämodialyse auf die Pharmakokinetik von Cenobamat wurde nicht untersucht.
Ältere Patienten
Basierend auf den Daten von Patienten im Alter von 18 bis 77 Jahren wurden keine klinisch signifikanten Unterschiede in der Pharmakokinetik von Cenobamat in Bezug auf das Alter beobachtet.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Ontozry bei Patienten unter 18 Jahren wurde nicht untersucht.
Geschlecht
Es wurde kein Unterschied in der Pharmakokinetik von Cenobamat zwischen männlichen und weiblichen Patienten beobachtet.
Ethnische Zugehörigkeit
In einer Analyse zur Populations-PK von gepoolten Daten aus klinischen Studien von Patienten, die als asiatisch, schwarz, kaukasisch, hispanisch oder andere kategorisiert wurden, wurde kein klinisch signifikanter Effekt der ethnischen Zugehörigkeit auf die Pharmakokinetik von Cenobamat festgestellt.
Körpergewicht
Über einen Körpergewichtsbereich von 54 kg bis 112 kg wurde eine Abnahme der Exposition um 45 % geschätzt. Diese Variabilität wird bei der Festlegung einer Dosis von Cenobamat nicht als klinisch relevant angesehen. Bei Patienten, bei denen Gewichtsveränderungen von ≥30 % ihres ursprünglichen Körpergewichts oder mehr auftreten, müssen jedoch möglicherweise Anpassungen der Cenobamat-Dosis in Betracht gezogen werden.
Präklinische DatenBasierend auf den konventionellen Studien zur Sicherheitspharmakologie, Toxizität bei wiederholter Gabe, Genotoxizität und zum kanzerogenen Potential lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen. Die maximale systemische Exposition, die in der Kanzerogenitätsstudie bei Ratten erreicht wurde, war jedoch geringer als die beim Menschen bei der maximal empfohlenen Humandosis (MRHD) von 400 mg/Tag.
Toxizität bei wiederholter Gabe
Die Höchstdosen in Studien zur Toxizität bei wiederholter Verabreichung wurden durch adversen ZNS-Wirkungen von Cenobamat (einschliesslich Hypoaktivität, unkoordinierter Gang, Unterkühlung und Tremor) begrenzt. Systemische Expositionen bei NOAEL (Dosis ohne beobachtete schädliche Wirkung) lagen unter den Expositionen, die beim Menschen bei der MRHD erreicht wurden.
Reproduktionstoxizität
Studien zur Reproduktionstoxizität zeigten nachteilige Auswirkungen auf die embryo-fötale und postnatale Entwicklung. Es wurden keine nachteiligen Auswirkungen auf die Fertilität beobachtet. Die systemischen Expositionen bei den jeweiligen NOAEL für Fertilität, embryo-fötale Entwicklung und prä-/postnatale Entwicklung lagen bei der MRHD jedoch unter der Exposition des Menschen.
Die orale Verabreichung von Cenobamat an trächtige Ratten und Kaninchen während der Phase der Organogenese führte bei Dosen, die mit mütterlicher Toxizität assoziiert waren, zu einer erhöhten Mortalität. Bei Ratten gab es eine geringe Zunahme viszeraler Missbildungen; eine vollständige Interpretation des teratogenen Potenzials bei der hohen Dosis war jedoch auf Grund der hohen mütterlichen Toxizität nicht möglich.
Bei der oralen Verabreichung von Cenobamat an weibliche Ratten während der Trächtigkeit und Laktation wurden bei den Nachkommen bei allen Dosen neurologische Verhaltensstörungen (erhöhte akustische Schreckreaktion) beobachtet, eine verminderte Gewichtszunahme vor dem Absetzen und nachteilige Reaktionen auf die weibliche Fortpflanzungsfunktion (verminderte Anzahl von Gelbkörpern, Implantationen und lebenden Föten) beobachtet.
Sonstige HinweiseInkompatibilitäten
Nicht zutreffend.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Arzneimittel für Kinder unzugänglich aufbewahren.
Nicht über 30°C lagern.
Hinweise für die Handhabung
Cenobamat ist in aquatischen Systemen sehr persistent. Nicht verwendetes Arzneimittel oder Abfallmaterial ist fachgerecht zu entsorgen.
Zulassungsnummer68051 (Swissmedic)
PackungenPVC/Aluminium-Blisterpackungen
Ontozry-Starterpackung 12,5 mg und 25 mg
Packung mit 14 Tabletten zu 12,5 mg und 14 Filmtabletten zu 25 mg [B]
Ontozry 50 mg
Packungen mit 14, 28 oder 84 Filmtabletten [B]
Ontozry 100 mg
Packungen mit 14, 28 oder 84 Filmtabletten [B]
Ontozry 150 mg
Packungen mit 14, 28 oder 84 Filmtabletten [B]
Ontozry 200 mg
Packungen mit 14, 28 oder 84 Filmtabletten [B]
Es werden möglicherweise nicht alle Packungsgrössen in den Verkehr gebracht.
ZulassungsinhaberinAngelini Pharma S.p.A., Rom, Zweigniederlassung Zug
Stand der InformationJuli 2024
|

