Eigenschaften/WirkungenATC-Code
N03AX25
Pharmakotherapeutische Gruppe: Antiepileptika, sonstige Antiepileptika
Wirkungsmechanismus
Cenobamat ist ein kleines Molekül mit einem dualen Wirkmechanismus. Es ist ein positiver allosterischer Modulator von Subtypen des γ-Aminobuttersäure-(GABAA-) Ionenkanals, der nicht an die Benzodiazepin-Bindungsstelle bindet. Es konnte auch gezeigt werden, dass Cenobamat das wiederholte neuronale Feuern reduziert, indem es die Inaktivierung von Natriumkanälen verstärkt und die persistente Komponente des Natriumstroms hemmt. Der genaue Wirkmechanismus, mit dem Cenobamat seine therapeutische Wirkung bei Patienten mit fokalen Anfällen ausübt, ist unbekannt.
Pharmakodynamik
Kardiale Elektrophysiologie
In einer placebokontrollierten QT-Studie an gesunden Freiwilligen wurde eine dosisabhängige Verkürzung des QTcF-Intervalls mit Cenobamat beobachtet. Die mittlere ΔΔQTcF beträgt -10,8 [KI: -13,4, -8,2] ms bei 200 mg einmal täglich und -18,4 [KI: -21,5, -15,2] ms bei 500 mg einmal täglich (das 1,25fache der maximal empfohlenen Dosis). Reduktionen des QTc-Intervalls unter 340 ms wurden nicht beobachtet (siehe Rubrik «Warnhinweise und Vorsichtsmassnahmen»).
Klinische Wirksamkeit
Die Wirksamkeit von Cenobamat als Begleittherapie bei fokal einsetzenden Anfällen wurde in einer multizentrischen, randomisierten, doppelblinden, placebokontrollierten Doppelblindstudie an erwachsenen Patienten mit fokaler Epilepsie untersucht, die trotz einer Antiepileptika-Behandlung in der Vorgeschichte nicht ausreichend kontrolliert wurden. Die Patienten wurden mit ein bis drei begleitenden Antiepileptika behandelt, die im Verlauf der doppelblinden Studienbehandlung stabil blieben. Die tägliche Dosis von Cenobamat reichte von 100 bis 400 mg/Tag.
Die Studie umfasste einen 8wöchigen prospektiven Baselinezeitraum, in dem die Patienten mindestens 3 oder 4 partielle Anfälle pro 28 Tage haben mussten, wobei die anfallsfreie Zeit 3 bis 4 Wochen nicht überschreiten durfte, gefolgt von einem 18wöchigen Behandlungszeitraum, einschliesslich 12 Wochen mit fester Dosis. Die zum Zeitpunkt des Studieneintritts am häufigsten eingenommenen Antiepileptika waren Levetiracetam, Lamotrigin, Carbamazepin und Lacosamid. Alle Patienten, die in die Studie eintraten, hatten weiterhin Anfälle, obwohl die Mehrheit in der Vergangenheit bereits mit zwei oder mehr Antiepileptika behandelt worden war. Mehr als 80 % der Patienten nahmen zum Zeitpunkt der Aufnahme in die Studie gleichzeitig zwei oder mehr Antiepileptika ein. Die Wirksamkeitsergebnisse sind in Tabelle 4 zusammengefasst.
Die Studie verglich die Dosen von Cenobamat 100 mg/Tag, 200 mg/Tag und 400 mg/Tag mit Placebo, zusätzlich zur Standardbehandlung. Die Patienten setzten die stabile Behandlung mit ein bis drei Hintergrund-Antiepileptika fort. Die Patienten, die zu 400 mg/Tag randomisiert worden waren, erhielten zunächst eine tägliche Dosis von 50 mg, die anschliessend jede Woche um 50 mg/Tag erhöht wurde, bis 200 mg/Tag erreicht waren, und dann jede Woche um 100 mg/Tag.
Tabelle 4 zeigt den Anteil der Patienten, bei denen die Anfallshäufigkeit gegenüber der Baseline um 50 % oder mehr reduziert wurde.
Tabelle 4: Anteil der Patienten, die in Studie C017 ein Ansprechen von 50 % oder mehr zeigten
|
Studie
|
Standardversorgung und Placebo
|
Standardversorgung und Cenobamat
| |
100 mg/Tag
|
200 mg/Tag
|
400 mg/Tag
| |
Studie C017
| |
|
n = 102
|
n = 102
|
n = 98
|
n = 95
| |
50 % Ansprechrate1
|
26 (25,5 %)
|
41 (40,2 %)
|
55 (56,1 %)
|
61 (64,2 %)
| |
Unterschied Cenobamat – Placebo
|
|
14,7 %
(p = 0,036)
|
30,6 %
(p < 0,001)
|
38,7 %
(p < 0,001)
|
1Über 12 Wochen doppelblinde Behandlung mit fester Dosierung
Abbildung 1 zeigt den Prozentsatz der Patienten nach Kategorie des Ansprechens der Anfälle während der Erhaltungsphase mit zunehmend strengeren Kriterien für das Ansprechen.
Abbildung 1: Kumulative Verteilung der prozentualen Reduktion der Anfälle gegenüber Baseline nach Behandlungsgruppe in der 12wöchigen Phase mit fester Dosis in der Studie
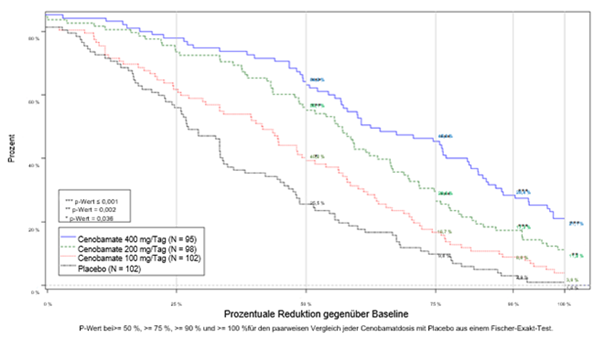
Anfallsfreiheit (100 %ige Reduktion der Anfälle) erreichten in der Studie 4 von 102 (3,9 %) Patienten in der Gruppe mit Cenobamat 100 mg/Tag, 11 von 98 (11,2 %) Patienten in der Gruppe mit Cenobamat 200 mg/Tag, 20 von 95 (21,1 %) Patienten in der Gruppe mit Cenobamat 400 mg/Tag und 1 von 102 (1 %) Patienten in der Placebo-Gruppe während der 12wöchigen Phase mit fester Dosis. Ähnliche Antworten wurden bei Subpopulationen beobachtet, die grösser oder kleiner als die mediane Anfallshäufigkeit und grösser oder kleiner als die mediane Krankheitsdauer waren.
Langzeitdaten
Die Mehrheit der Patienten entschied sich für die Teilnahme an der offenen Verlängerung von Studie 1 (98,9 %). 80 % der Patienten blieben mindestens 12 Monate und 58 % mindestens 60 Monate in der Studie. Es wurden zusätzliche Daten zur Anfallshäufigkeit gesammelt, die mit den Ergebnissen aus dem doppelblinden Teil der Studie übereinstimmten.
Pädiatrie
Die Europäische Arzneimittelagentur hat für Ontozry eine Zurückstellung von der Verpflichtung zur Vorlage von Ergebnissen zu Studien in einer oder mehreren pädiatrischen Altersklassen mit Epilepsie gewährt (siehe Rubrik «Dosierung/Anwendung»).
|

