Eigenschaften/WirkungenATC-Code
C03DA05
Wirkungsmechanismus
Finerenon ist ein nichtsteroidaler, selektiver Antagonist des Mineralokortikoid-Rezeptors (MR) und schwächt die durch eine MR-Überaktivierung vermittelte Entzündung und Fibrose wirksam ab. Der MR wird in Nieren, Herz und Blutgefässen exprimiert, wo Finerenon auch der Natriumretention und hypertrophen Prozessen entgegenwirkt. Finerenon hat aufgrund seiner nichtsteroidalen Struktur und seines sperrigen Bindungsmodus eine hohe Potenz und Selektivität für den MR. Finerenon hat keine relevante Affinität für Androgen-, Progesteron-, Östrogen- sowie Glukokortikoidrezeptoren und verursacht daher keine geschlechtshormonbedingten Nebenwirkungen (wie z.B. Gynäkomastie). Seine Bindung an den MR führt zu einem spezifischen Rezeptor-Ligand-Komplex, der die Rekrutierung von transkriptionellen Koaktivatoren blockiert, die an der Expression von proinflammatorischen und profibrotischen Mediatoren beteiligt sind.
Pharmakodynamik
Wirkungen bei gesunden Probanden
Mehrdosisschemata (Tagesdosen von 20 mg oder 40 mg über 10 Tage) führten zur Aktivierung des Renin-Angiotensin-Aldosteron-Systems (RAAS), d.h. zu reversiblen Anstiegen der Plasma-Renin-Aktivität und der Serumaldosteronkonzentrationen, wobei innerhalb von 48 Stunden nach der letzten Dosis wieder die Ausgangswerte erreicht wurden.
Nach Aktivierung des MR mit seinem Agonisten Fludrocortison zeigten Einzeldosen Finerenon von bis zu 20 mg dosisabhängige natriuretische Wirkungen, sowie eine verringerte Kaliumausscheidung im Urin verglichen mit Placebo.
Einzel- oder Mehrfachdosen von Finerenon hatten bei gesunden Probanden keinen Einfluss auf die Vitalzeichen.
Wirkungen bei Patienten mit chronischer Nierenerkrankung und Typ-2-Diabetes
In den zwei Phase-III-Studien FIDELIO-DKD und FIGARO-DKD betrug die placebokorrigierte relative Reduktion des Albumin-Kreatinin-Quotienten im Urin (UACR) bei Patienten, die randomisiert einer Behandlung mit Finerenon zugeteilt waren, nach 4 Monaten 31 % bzw. 32 %. Die Senkung des UACR persistierte in beiden Studien.
In der Studie ARTS DN, einer randomisierten, doppelblinden, placebokontrollierten, multizentrischen Phase-IIb-Dosisfindungsstudie an Erwachsenen mit chronischer Nierenkrankheit und Typ-2-Diabetes betrug die placebokorrigierte relative Reduktion des UACR nach 90 Tagen 25 % bzw. 38 % bei den mit Finerenon 10 mg bzw. 20 mg einmal täglich behandelten Patienten.
Kardiale Elektrophysiologie
Eine eingehende QT-Studie mit 57 gesunden Probanden ergab keine Hinweise auf eine QT/QTc-verlängernde Wirkung von Finerenon nach Einzeldosen von 20 mg (therapeutisch) oder 80 mg (supratherapeutisch), was darauf hindeutet, dass Finerenon keine Wirkung auf die kardiale Repolarisation hat.
Klinische Wirksamkeit
Finerenon wurde in den zwei randomisierten, doppelblinden, placebokontrollierten, multizentrischen Phase-III-Studien FIDELIO-DKD und FIGARO-DKD untersucht.
Die FIDELIO-DKD Studie untersuchte die Wirkung von Finerenon verglichen mit Placebo auf renale und kardiovaskuläre Ergebnisse bei erwachsenen Patienten mit Typ-2-Diabetes und chronischer Nierenerkrankung (Einschlusskriterien: a) moderate Albuminurie [UACR ≥30 - < 300 mg/g] und eGFR 25 - 60 ml/min/1.73 m2 bei gleichzeitigem Vorliegen einer diabetischen Retinopathie ODER b) schwere Albuminurie [UACR ≥300 mg/g] und eGFR 25 – 75 ml/min/1.73 m2). In die Studie eingeschlossene Patienten mussten einen Serumkaliumspiegel von ≤4.8 mmol/l aufweisen und eine Vorbehandlung mit einer Standardtherapie, inklusive einer maximal verträglichen Dosis eines Angiotensin-Converting-Enzyme-Hemmers (ACEI [34 %]) oder eines Angiotensinrezeptorblockers (ARB [66%]) erhalten Die Indikation für eine Behandlung mit einem MRA gemäss Leitlinien (wie symptomatische chronische Herzinsuffizienz mit reduzierter Auswurffraktion) war ein Ausschlusskriterium.
Der primäre Endpunkt der FIDELIO-DKD-Studie war zusammengesetzt aus der Zeit bis zum ersten Auftreten eines Nierenversagens (definiert als chronische Dialyse, Nierentransplantation oder Abfall der eGFR auf < 15 ml/min/1.73 m2 über mindestens vier Wochen), einer Abnahme der eGFR um ≥40 % gegenüber dem Ausgangswert über mindestens vier Wochen oder eines nierenbedingten Todes. Sekundärer Schlüsselendpunkt war ein zusammengesetzter kardiovaskulärer Endpunkt bestehend aus der Zeit bis zum ersten Auftreten von kardiovaskulärem (KV) Tod, nichttödlichem Myokardinfarkt (MI), nichttödlichem Schlaganfall oder Hospitalisierung wegen Herzinsuffizienz.
Die Studie untersuchte 5662 Patienten, welche im Verhältnis 1:1 für die Behandlung mit Finerenon einmal täglich (n = 2824) oder Placebo (n = 2838) randomisiert wurden. Die Anfangsdosis betrug entweder 10 mg [bei einer eGFR von 25 - < 60 ml/min/1.73 m2] oder 20 mg [bei einer eGFR von ≥60 ml/min/1.73 m2]. Die Dosisstärke wurde im Verlauf der Studie auf 10 mg oder 20 mg QD, hauptsächlich auf Grund des Serumkaliumspiegels, angepasst. Die mediane Beobachtungsdauer betrug 2.6 Jahre. Die Studienpopulation war zu 63 % weisser, zu 25 % asiatischer und zu 5 % schwarzer Abstammung. Das mittlere Alter bei der Rekrutierung betrug 66 Jahre, und 70 % der Patienten waren Männer. Der mittlere eGFR-Ausgangswert betrug 44.4 ml/min/1.73 m2 und 55 % der Patienten hatten eine eGFR < 45 ml/min/1.73 m2. Der mediane UACR betrug 853 mg/g, das mittlere glykierte Hämoglobin A1c (HbA1c) betrug 7.7 %. Zirka 46 % der Studienteilnehmer hatten eine atherosklerotische kardiovaskuläre Vorerkrankung, 30 % eine koronare Herzkrankheit und 8 % eine Herzinsuffizienz in der Anamnese. Der mittlere Blutdruck betrug 138/76 mmHg. Die mittlere Dauer seit Diagnose des Typ-2-Diabetes bei Aufnahme in die Studie betrug 16.6 Jahre, und bei Studienbeginn erhielten nahezu alle Studienteilnehmer (97%) ein oder mehrere Antidiabetika (Insulin [64 %], Biguanide [44 %], Glucagon-like-Peptid-1-[GLP-1-]Rezeptoragonisten [7 %], Natrium-Glukose-Cotransporter-2-[SGLT2-]Inhibitoren [5 %]). Ausserdem wiesen 47 % bzw. 26 % der Patienten zu Studienbeginn eine vorbestehende diabetische Retinopathie und diabetische Neuropathie auf. Der Grossteil der Patienten erhielt zusätzlich ein Statin (74 %) und/oder einen Calciumantagonisten (63 %).
Die FIDELIO-DKD Studie zeigte eine Überlegenheit der Behandlung mit Finerenon gegenüber Placebo für den kombinierten (renalen) primären Endpunkt (HR 0.82, 95%-KI 0.73–0.92, p = 0.0009; siehe Tabelle 3 und Abbildung 1).
Ferner reduzierte Finerenon signifikant das Risiko für den kombinierten (kardiovaskulären) sekundären Schlüsselendpunkt (HR 0.86, 95%-KI 0.75–0.99, p = 0.0344; siehe Tabelle 3 und Abbildung 2). Im Finerenon-Arm ergaben sich im Vergleich zum Placebo-Arm niedrigere Inzidenzraten in Bezug auf Herzinsuffizienz, nichttödlichem MI und kardiovaskulär bedingtem Tod. Nichttödliche Schlaganfälle traten in beiden Behandlungsarmen mit ähnlicher Inzidenz auf (siehe Tabelle 3).
Tabelle 3: Analyse der primären und wichtigsten sekundären Ereigniszeit-Endpunkte (und ihrer Einzelkomponenten) in der Phase-III-Studie FIDELIO-DKD
|
|
Patienten mit chronischer Nierenerkrankung und Typ-2-Diabetes
| |
|
Finerenon*
10 oder 20 mg 1x täglich
n = 2824
|
Placebo*
n = 2838
|
Behandlungseffekt
Finerenon/Placebo
| |
Primäre und sekundäre Ereigniszeit-Endpunkte:
|
n (%)
|
Ereignisrate (100 Pt.j.)
|
n (%)
|
Ereignisrate (100 Pt.j.)
|
Hazard Ratio
(95%-KI)
|
p-Wert
| |
Primärer kombinierter Endpunkt «Nierenversagen, anhaltende eGFR-Abnahme ≥40 % oder nierenbedingter Tod»
|
498 (17.6 %)
|
7.53
|
600 (21.1 %)
|
9.09
|
0.82
[0.73; 0.92]
|
0.0009
| |
Nierenversagen
|
205 (7.3 %)
|
2.96
|
235 (8.3 %)
|
3.39
|
0.86
[0.72; 1.05]
|
-
| |
Anhaltende eGFR-Abnahme ≥40 %
|
473 (16.7 %)
|
7.15
|
577 (20.3 %)
|
8.74
|
0.81
[0.72; 0.91]
|
-
| |
Nierenbedingter Tod
|
2 (< 0.1 %)
|
-
|
2 (< 0.1 %)
|
-
|
-
|
-
| |
Sekundärer kombinierter Endpunkt «KV Tod, nichttödlicher MI, nichttödlicher Schlaganfall oder Hospitalisierung wegen Herzinsuffizienz»
|
366 (13.0 %)
|
5.11
|
420 (14.8 %)
|
5.93
|
0.86
[0.75; 0.99]
|
0.0344
| |
KV Tod
|
128 (4.5 %)
|
1.70
|
150 (5.3 %)
|
1.99
|
0.86
[0.68; 1.09]
|
-
| |
Nichttödlicher MI
|
70 (2.5 %)
|
0.94
|
87 (3.1 %)
|
1.18
|
0.80
[0.58; 1.09]
|
-
| |
Nichttödlicher Schlaganfall
|
90 (3.2 %)
|
1.22
|
87 (3.1 %)
|
1.18
|
1.03
[0.77; 1.38]
|
-
| |
Hospitalisierung wegen Herzinsuffizienz
|
138 (4.9 %)
|
1.88
|
162 (5.7 %)
|
2.22
|
0.85
[0.68; 1.07]
|
-
| |
* Behandlung zusätzlich zu maximal verträglichen zugelassenen Dosen von ACEI oder ARB.
|
Abbildung 1: Zeit bis zum ersten Auftreten von Nierenversagen, anhaltender eGFR-Abnahme ≥40 % vs. Ausgangswert oder nierenbedingtem Tod in der FIDELIO-DKD-Studie
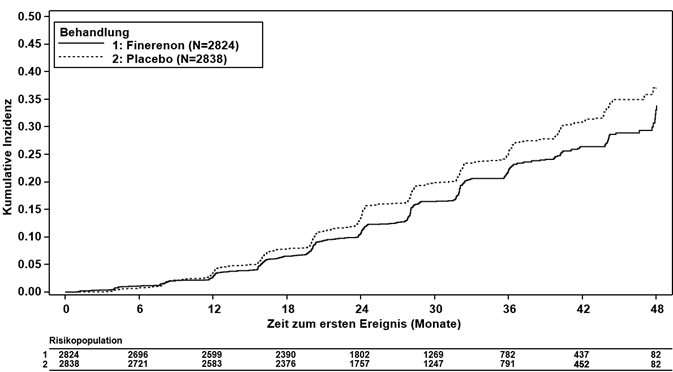
Abbildung 2: Zeit bis zum ersten Auftreten von KV Tod, nichttödlichem MI, nichttödlichem Schlaganfall oder Hospitalisierung wegen Herzinsuffizienz in der FIDELIO-DKD-Studie
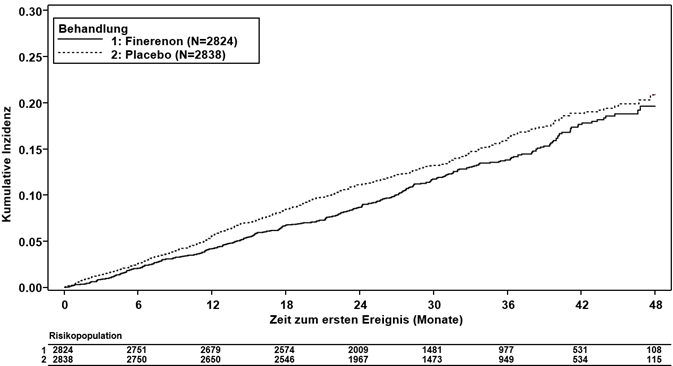
Die FIGARO-DKD Studie untersuchte die Wirkung von Finerenon gegenüber Placebo auf das Eintreten kardiovaskulärer und renaler Ereignisse bei erwachsenen Patienten mit Typ-2-Diabetes und chronischer Nierenerkrankung (Einschlusskriterien: a) moderate Albuminurie [UACR ≥30 - < 300 mg/g] und eGFR 25 - 90 ml/min/1.73 m2 ODER b) schwere Albuminurie [UACR ≥300 mg/g] und eGFR ≥60 ml/min/1.73 m2). Um in die Studie eingeschlossen zu werden, mussten die Patienten ausserdem einen Serumkaliumspiegel von ≤4.8 mmol/l aufweisen sowie bereits eine Vorbehandlung mit einer Standardtherapie, inklusive einer maximal verträglichen Dosis eines Angiotensin-Converting-Enzyme-Hemmers (ACEI [43 %]) oder eines Angiotensinrezeptorblockers (ARB [57%]) erhalten. Die Indikation für eine Behandlung mit einem MRA gemäss Leitlinien (wie symptomatische chronische Herzinsuffizienz mit reduzierter Auswurffraktion) war ein Ausschlusskriterium.
Der primäre Endpunkt in der FIGARO-DKD-Studie war ein zusammengesetzter kardiovaskulärer (KV) Endpunkt bestehend aus der Zeit bis zum ersten Auftreten von KV Tod, nichttödlichem MI, nichttödlichem Schlaganfall oder Hospitalisierung wegen Herzinsuffizienz. Sekundärer Schlüsselendpunkt war ein zusammengesetzter renaler Endpunkt aus der Zeit bis zum Nierenversagen, einer Abnahme der eGFR um ≥40 % gegenüber dem Ausgangswert über mindestens vier Wochen oder eines nierenbedingten Todes.
Die Studie untersuchte 7328 Patienten, welche im Verhältnis 1:1 für die Behandlung mit Finerenon (n = 3674) oder Placebo (n = 3654) randomisiert wurden. Die Anfangsdosis betrug entweder 10 mg [bei einer eGFR von 25 - < 60 ml/min/1.73 m2] oder 20 mg [bei einer eGFR von ≥60 ml/min/1.73 m2]. Die Dosisstärke wurde im Verlauf der Studie auf 10 mg oder 20 mg QD, hauptsächlich auf Grund des Serumkaliumspiegels, angepasst. Die mediane Beobachtungsdauer betrug 3.4 Jahre. Die Studienpopulation war zu 72 % weisser, zu 20 % asiatischer und zu 4 % schwarzer Abstammung. Das mittlere Alter bei der Rekrutierung betrug 64 Jahre, und 69 % der Patienten waren Männer. Der mittlere eGFR-Ausgangswert betrug 67.8 ml/min/1.73 m2 und 62 % der Patienten hatten eine eGFR ≥60 ml/min/1.73 m2. Der mediane UACR betrug 309 mg/g, das mittlere glykierte Hämoglobin A1c (HbA1c) betrug 7.7 %. Zirka 45 % der Studienteilnehmer hatten eine atherosklerotische kardiovaskuläre Erkrankung in der Anamnese, 8 % hatten eine Herzinsuffizienz in der Anamnese. Der mittlere Blutdruck betrug 136/77 mmHg. Die mittlere Dauer des Typ-2-Diabetes bei Aufnahme in die Studie betrug 14.5 Jahre und bei Studienbeginn erhielten nahezu alle Studienteilnehmer (98%) ein oder mehrere Antidiabetika (Insulin [54 %], Biguanide [69 %], GLP-1-Rezeptoragonisten [8 %], SGLT2-Inhibitoren [8 %]). Ausserdem wiesen 31 % bzw. 28% der Patienten zu Studienbeginn eine vorbestehende diabetische Retinopathie und diabetische Neuropathie auf. Der Grossteil der Patienten erhielt zusätzlich ein Statin (71 %).
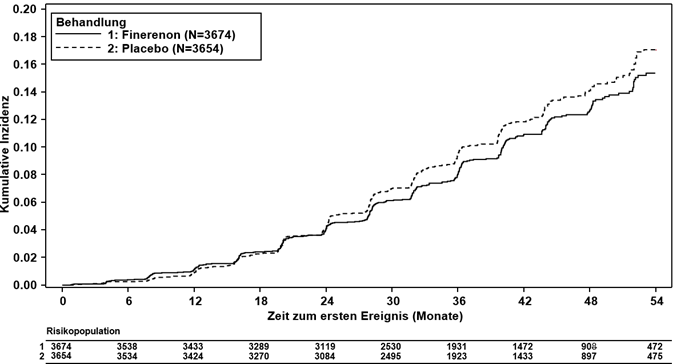
Finerenon reduzierte signifikant das Risiko für den primären (kardiovaskulären) kombinierten Endpunkt verglichen mit Placebo (HR 0.87, 95%-KI 0.76–0.98, p = 0.0254) (siehe Abbildung 3 und Tabelle 4). Der Behandlungseffekt für den primären Endpunkt war in allen Untergruppen, darunter Region, eGFR, UACR, systolischer Blutdruck und HbA1c zur Baseline, einheitlich. In dem Finerenon-Arm wurde im Vergleich zum Placebo-Arm eine niedrigere Inzidenzrate des kombinierten sekundären (renalen) Endpunkts aus Nierenversagen, anhaltender eGFR-Abnahme ≥40 % oder nierenbedingtem Tod beobachtet; dieser Unterschied erreichte jedoch keine statistische Signifikanz (HR 0.87, 95%-KI 0.75–1.01, p = 0.0635) (siehe Abbildung 4 und Tabelle 4).
Tabelle 4: Analyse der primären und sekundären Ereigniszeit-Endpunkte (und ihrer Einzelkomponenten) in der Phase-III-Studie FIGARO-DKD
|
|
Patienten mit
chronischer Nierenerkrankung und Typ-2-Diabetes
| |
|
Finerenon*
10 oder 20 mg 1x täglich
n = 3674
|
Placebo*
n = 3654
|
Behandlungseffekt
Finerenon/Placebo
| |
Primäre und sekundäre Ereigniszeit-Endpunkte:
|
n (%)
|
Ereignisrate (100 Pt.j.)
|
n (%)
|
Ereignisrate (100 Pt.j.)
|
Hazard Ratio
(95%-KI)
|
p-Wert
| |
Primärer kombinierter Endpunkt «KV Tod, nichttödlicher MI, nichttödlicher Schlaganfall oder Hospitalisierung wegen Herzinsuffizienz»
|
457 (12.4 %)
|
3.88
|
518 (14.2 %)
|
4.46
|
0.87
[0.76; 0.98]
|
0.0254
| |
KV Tod
|
193 (5.3 %)
|
1.56
|
214 (5.9 %)
|
1.75
|
0.89
[0.73; 1.08]
|
-
| |
Nichttödlicher MI
|
103 (2.8 %)
|
0.85
|
101 (2.8 %)
|
0.84
|
1.00
[0.76; 1.32]
|
-
| |
Nichttödlicher Schlaganfall
|
108 (2.9 %)
|
0.89
|
111 (3.0 %)
|
0.93
|
0.97
[0.74; 1.26]
|
-
| |
Hospitalisierung wegen Herzinsuffizienz
|
117 (3.2 %)
|
0.97
|
163 (4.5 %)
|
1.36
|
0.71
[0.56; 0.90]
|
-
| |
Kombinierter Endpunkt «Nierenversagen, anhaltende eGFR-Abnahme ≥40 % oder nierendbedingter Tod»
|
350 (9.5 %)
|
3.17
|
395 (10.8 %)
|
3.59
|
0.87
[0.75; 1.01]
|
0.0635**
| |
Nierenversagen
|
46 (1.3 %)
|
0.40
|
62 (1.7 %)
|
0.55
|
0.72
[0.49; 1.05]
|
-
| |
Anhaltende eGFR-Abnahme ≥40 %
|
338 (9.2 %)
|
3.06
|
385 (10.5 %)
|
3.50
|
0.86
[0.74; <1.00]
|
-
| |
Nierenbedingter Tod
|
0
|
-
|
2 (<0.1 %)
|
-
|
-
|
-
| |
* Behandlung zusätzlich zu maximal verträglichen zugelassenen Dosen von ACEI oder ARB.
** Nicht signifikant.
|
Abbildung 3: Zeit bis zum ersten Auftreten von KV Tod, nichttödlichem MI, nichttödlichem Schlaganfall oder Hospitalisierung wegen Herzinsuffizienz in der FIGARO-DKD-Studie
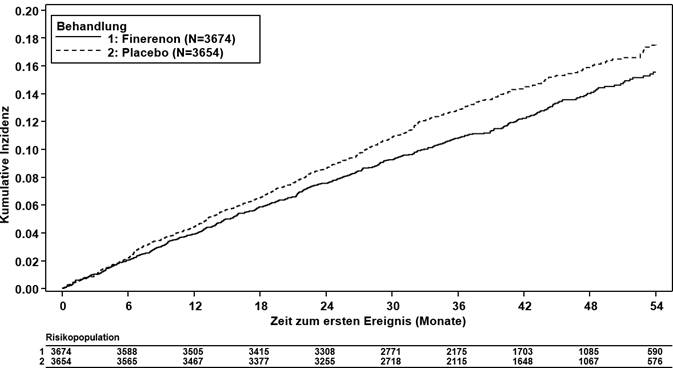
Abbildung 4: Zeit bis zum ersten Auftreten von Nierenversagen, anhaltender eGFR-Abnahme ≥40 % vs. Ausgangswert oder nierenbedingtem Tod in der FIGARO-DKD-Studie
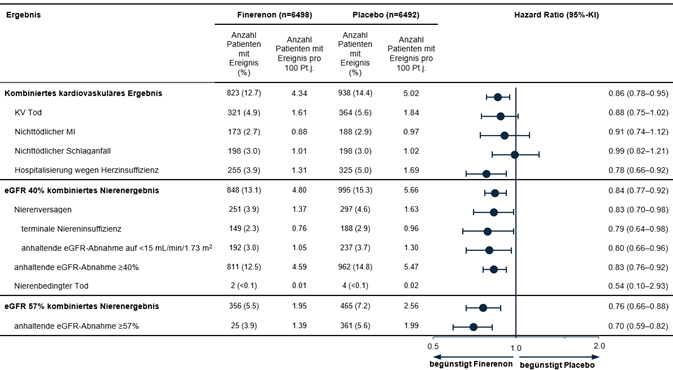
In einer vorgegebenen gepoolten Analyse der Studien FIDELIO-DKD und FIGARO-DKD reduzierte Finerenon das Risiko für den kombinierten kardiovaskulären Endpunkt «Zeit bis zum Eintritt von KV Tod, nichttödlichem MI, nichttödlichem Schlaganfall oder Hospitalisierung wegen Herzinsuffizienz» verglichen mit Placebo (HR 0.86 [95%-KI 0.78; 0.95]) (siehe Abbildung 5). Das Risiko für den kombinierten renalen Endpunkt «Zeit bis zum Eintritt von Nierenversagen, anhaltender eGFR-Abnahme ≥40 % gegenüber dem Ausgangswert oder nierenbedingtem Tod» war ebenfalls reduziert mit Finerenon verglichen mit Placebo (HR 0.84 [95%-KI 0.77; 0.92]), ebenso wie der kombinierte Endpunkt aus Zeit bis zum Eintritt von Nierenversagen, anhaltender eGFR-Abnahme ≥57 % (entspricht etwa einer Verdoppelung des Serumkreatinins) gegenüber dem Ausgangswert oder nierenbedingtem Tod (HR 0.76 [95%-KI 0.66; 0.88]) (siehe Abbildung 5).
Abbildung 5: Kombinierte kardiovaskuläre und renale Endpunkte in der gepoolten Analyse von FIDELIO-DKD und FIGARO-DKD
|





