Eigenschaften/WirkungenATC-Code
D11AH08
Wirkungsmechanismus
Abrocitinib ist ein Inhibitor der Januskinase (JAK)1. JAKs sind intrazelluläre Enzyme, die Signale weiterleiten, die aus Zytokin- oder Wachstumsfaktor-Rezeptor-Interaktionen auf der Zellmembran hervorgehen und an zellulären Prozessen der Hämatopoese und Immunabwehr beteiligt sind. JAKs phosphorylieren und aktivieren Signaltransduktoren und Aktivatoren der Transkription (STATs), die wiederum die intrazelluläre Aktivität modulieren, einschliesslich der Genexpression. Die Hemmung von JAK1 moduliert die Signalwege und verhindert damit die Phosphorylierung und Aktivierung von STATs.
In biochemischen Tests zeigt Abrocitinib gegenüber JAK1 eine höhere Selektivität als gegenüber den anderen drei JAK-Isoformen JAK2 (28-fach), JAK3 (>340-fach) und Tyrosinkinase 2 (TYK2, 43-fach). Im zellulären Umfeld hemmt es vorzugsweise die zytokininduzierte STAT-Phosphorylierung durch Signalpaare, an denen JAK1 beteiligt ist, und belässt die Signalübertragung durch JAK2/JAK2- oder JAK2/TYK2-Paare. Die Bedeutung der selektiven enzymatischen Hemmung bestimmter JAK-Enzyme für die klinische Wirkung ist derzeit nicht bekannt.
Pharmakodynamik
Die Anwendung von Abrocitinib führte zu einer dosisabhängigen Verringerung von Serummarkern für Entzündungen, darunter hochempfindliches C-reaktives Protein (hsCRP), Interleukin-31 (IL 31) und Thymus- und Aktivierungs-reguliertes Chemokin (TARC). Diese Veränderungen gingen innerhalb von 4 Wochen nach Absetzen des Medikaments wieder auf Werte im Bereich des Ausgangswertes zurück.
Die mittlere absolute Lymphozytenzahl stieg von 1785/mm3 zu Beginn der Behandlung auf 1876/mm3 2 Wochen nach Beginn der Behandlung mit Abrocitinib 100 mg QD und kehrte bis Monat 9 der Behandlung zum Ausgangswert zurück. Bei den meisten Patienten blieb die ALC innerhalb des Referenzbereichs. Die Behandlung mit Abrocitinib war mit einem Anstieg der B-Zellzahlen von 250.5/mm3 bei Behandlungsbeginn auf 320.0/mm3 in Woche 16 und einem Rückgang der NK-Zellzahlen von 157.5/mm3 bei Behandlungsbeginn auf 125.7/mm3 in Woche 4 mit Abrocitinib 100 mg QD verbunden. Die klinische Bedeutung dieser Veränderungen der B-Zell- und NK-Zellzahlen ist nicht bekannt.
Kardiale Elektrophysiologie
Die Wirkung von Abrocitinib auf das QTc-Intervall wurde bei Probanden, die Einzeldosen von Abrocitinib 600 mg erhielten, in einer placebo- und positiv-kontrollierten umfassenden QT-Studie untersucht. In einer Konzentrations-QTc-Analyse führte Abrocitinib bei den untersuchten therapeutischen und supratherapeutischen Plasmakonzentrationen nicht zu einer Verlängerung der QTc-Intervalle.
Klinische Wirksamkeit
Die Wirksamkeit und Sicherheit von Abrocitinib als Monotherapie und in Kombination mit wirkstoffhaltigen topischen Hintergrundtherapien über 12-16 Wochen wurden in 1'616 Patienten in drei Phase 3 randomisierten, doppelblinden, placebokontrollierten Zulassungsstudien (MONO-1, MONO 2 und COMPARE) untersucht. Darüber hinaus wurde die Wirksamkeit und Sicherheit von Abrocitinib in der Monotherapie über 52 Wochen (mit der Option einer Notfallbehandlung bei Patienten mit Wirkverlust) bei 1'233 Patienten in einer randomisierten, doppelblinden, placebokontrollierten Phase-3-Induktionsstudie (REGIMEN) untersucht. Die Patienten in diesen 4 Studien wiesen eine mittelschwere bis schwere atopische Dermatitis auf, definiert als Investigator's Global Assessment(IGA)-Score ≥3, Ekzema Area and Severity Index(EASI)-Score ≥16, Beteiligung der Körperoberfläche (BSA) ≥10% und Bewertung nach der Peak Pruritus Numerical Rating Scale (PP-NRS) von ≥4 bei der Erstuntersuchung bis zur Randomisierung. Patienten, die zuvor ein unzureichendes Ansprechen hatten oder für die eine topische Behandlung medizinisch nicht ratsam war oder die systemische Therapien erhalten hatten, waren einschlussfähig.
Alle Patienten, die die Hauptstudien abgeschlossen hatten, waren qualifiziert, an der Langzeit-Erweiterungsstudie EXTEND teilzunehmen.
Baseline-Charakteristika
In den placebokontrollierten Studien (MONO-1, MONO-2, COMPARE) und der Open-Label-Induktions- und randomisierten Absetzstudie (REGIMEN) waren über alle Behandlungsgruppen hinweg 41.4% bis 51.1% weiblich, 59.3% bis 77.8% kaukasisch, 15.0% bis 33.0% asiatisch und 4.1% bis 8.3% schwarz, und das Durchschnittsalter betrug 32.1 bis 37.7 Jahre. In diesen Studien hatten 32.2% bis 40.8% einen Ausgangswert von IGA 4 (schwere atopische Dermatitis), und 41.4% bis 59.5% der Patienten hatten zuvor eine systemische Behandlung für atopische Dermatitis erhalten. Der mittlere EASI-Score bei Studienbeginn lag zwischen 28.5 und 30.9, der PP-NRS bei Studienbeginn zwischen 7.0 und 7.3 und der Dermatology Life Quality Index (DLQI) bei Studienbeginn zwischen 14.4 und 16.0.
Klinisches Ansprechen
Studien mit einer 12-wöchigen Monotherapie (MONO-1, MONO-2) und einer 16-wöchigen TCS-Kombination (COMPARE)
Von den Patienten unter Behandlung mit 100 mg Abrocitinib einmal täglich erzielte ein signifikant grösserer Anteil als in der Placebogruppe in Woche 12 oder Woche 16 beide primären Endpunkte IGA 0 oder 1 und/oder EASI-75 (siehe Tabelle 5).
Unter Behandlung mit 100 mg Abrocitinib einmal täglich erzielte ein signifikant grösserer Anteil der Patienten als in der Placebogruppe eine Verbesserung auf der PP-NRS 4 (definiert als eine Verbesserung des Schweregrads der PP-NRS um ≥4 Punkte) (%, 95% KI in Woche 12: MONO-1: 37.3% (29.2, 46.3) vs. 15.3% (6.6, 24.0); MONO-2: 45.2% (37.1, 53.3) vs. 11.5% (4.1, 19.0); COMPARE: 47.5% (40.9, 54.1) vs. 28.9% (20.8, 37.0). Diese Verbesserung war bereits in Woche 2 festzustellen und hielt bis Woche 12 an (Abbildung 1). Ein höherer Anteil der Patienten erreichte mit Abrocitinib 100 mg einmal täglich im Vergleich zu Placebo an Tag 6 PP-NRS4 (%, 95% KI: COMPARE: 15.0% (10.2, 19.8) vs. 10.9% (5.3, 16.5)).
Die Behandlungswirkungen in Teilgruppen (z.B. nach Gewicht, Alter, Geschlecht, Ethnie und vorgängiger systemischer immunsupprimierender Behandlung) in den Studien MONO-1, MONO-2 und COMPARE stimmten mit den Ergebnissen im Gesamtstudienkollektiv überein.
|
Tabelle 5. Wirksamkeitsergebnisse mit Cibinqo als Monotherapie in Woche 12
| |
|
MONO-1c
|
MONO-2c
| |
Woche 12
|
Woche 12
| |
CBQ-Monotherapie
|
PBO
N = 77
|
CBQ-Monotherapie
|
PBO
N = 78
| |
100 mg q.d.
N = 156
|
100 mg q.d.
N = 158
| |
|
% Responder (95 %-KI)
| |
IGA 0 oder 1a
|
23.7d
(17.0; 30.4)
|
7.9
(1.8; 14.0)
|
28.4d
(21.3; 35.5)
|
9.1
(2.7; 15.5)
| |
EASI-75b
|
39.7d
(32.1; 47.4)
|
11.8
(4.6; 19.1)
|
44.5d
(36.7; 52.3)
|
10.4
(3.6; 17.2)
| |
PSAADe
|
-2.2d
(-2.6; -1.9)
|
-1.1
(-1.7; -0.6)
|
-3.0d
(-3.3; -2.7)
|
-2.4d
(-2.8; -2.1)
|
-0.8
(-1.3; -0.3)
| |
Abkürzungen: CBQ = Cibinqo; KI = Konfidenzintervall; EASI = Eczema Area and Severity Index (Index zur Feststellung der Ausdehnung und Schwere eines Ekzems); IGA = Investigator Global Assessment (Gesamtbeurteilung durch den Prüfarzt); N = Anzahl der randomisierten Patienten; PBO = Placebo; PP-NRS = Peak Pruritus Numerical Rating Scale (Numerische Skala zur Bewertung des stärksten Juckreizes); PSAAD = Pruritus and Symptoms Assessment for Atopic Dermatitis (Pruritus- und Symptombewertung bei atopischer Dermatitis); q.d. = einmal täglich.
a. IGA-Responder waren Patienten mit einem IGA-Score «clear» (erscheinungsfrei, 0) oder «almost clear» (fast erscheinungsfrei, 1) (auf einer 5-Punkte-Skala) und einer Reduzierung gegenüber der Ausgangspunktzahl um ≥2 Punkte.
b. EASI-75-Responder waren Patienten mit einer Verbesserung des EASI gegenüber dem Ausgangswert um ≥75%.
c. Cibinqo als Monotherapie.
d. Statistisch signifikant mit Adjustierung bezüglich Multiplizität vs. Placebo.
e. Bei den gezeigten Ergebnissen handelt es sich um die Veränderung der angepassten Mittelwerte (Methode der kleinsten Quadrate) gegenüber dem Ausgangswert.
|
|
Tabelle 6. Wirksamkeitsergebnisse mit Cibinqo in Kombination mit einer topischen Therapie in Woche 12 und Woche 16
| |
|
COMPAREc
| |
Woche 12
|
Woche 16
| |
CBQ + Topika
|
PBO + Topika
N = 131
|
DUP + Topika
N = 243
|
CBQ + Topika
|
PBO + Topika
N = 131
|
DUP + Topika
N = 243
| |
100 mg
N = 238
|
100 mg
N = 238
| |
|
% Responder (95 %-KI)
| |
IGA 0 oder 1a
|
36.6d
(30.4; 42.8)
|
14.0
(8.0; 19.9)
|
36.5
(30.4; 42.6)
|
34.8d
(28.6; 40.9)
|
12.9
(7.0; 18.8)
|
38.8
(32.5; 45.1)
| |
EASI-75b
|
58.7d
(52.4; 65.0)
|
27.1
(19.5; 34.8)
|
58.1
(51.9; 64.3)
|
60.3d
(53.9; 66.6)
|
30.6
(22.5; 38.8)
|
65.5
(59.4; 71.6)
| |
Abkürzungen: CBQ = Cibinqo; KI = Konfidenzintervall; DUP = Dupilumab; EASI = Eczema Area and Severity Index (Index zur Feststellung der Ausdehnung und Schwere eines Ekzems); IGA = Investigator Global Assessment (Gesamtbeurteilung durch den Prüfarzt); N = Anzahl der randomisierten Patienten; PBO = Placebo; PP-NRS = Peak Pruritus Numerical Rating Scale (Numerische Skala zur Bewertung des stärksten Juckreizes); PSAAD = Pruritus and Symptoms Assessment for Atopic Dermatitis (Pruritus- und Symptombewertung bei atopischer Dermatitis).
a. IGA-Responder waren Patienten mit einem IGA-Score «clear» (erscheinungsfrei, 0) oder «almost clear» (fast erscheinungsfrei, 1) (auf einer 5-Punkte-Skala) und einer Reduzierung gegenüber der Ausgangspunktzahl um ≥2 Punkte.
b. EASI-75-Responder waren Patienten mit einer Verbesserung des EASI gegenüber dem Ausgangswert um ≥75%.
c. Cibinqo in Kombination mit einer topischen Therapie.
d. Statistisch signifikant mit Adjustierung bezüglich Multiplizität vs. Placebo.
|
In Abbildung 1 ist der Anteil der Patienten mit PP-NRS4 im Zeitverlauf in den Studien MONO-1, MONO-2 und COMPARE gezeigt.
|
Abbildung 1. Anteil der Patienten mit PP-NRS4 im Zeitverlauf in den Studien MONO-1, MONO-2 und COMPARE
|
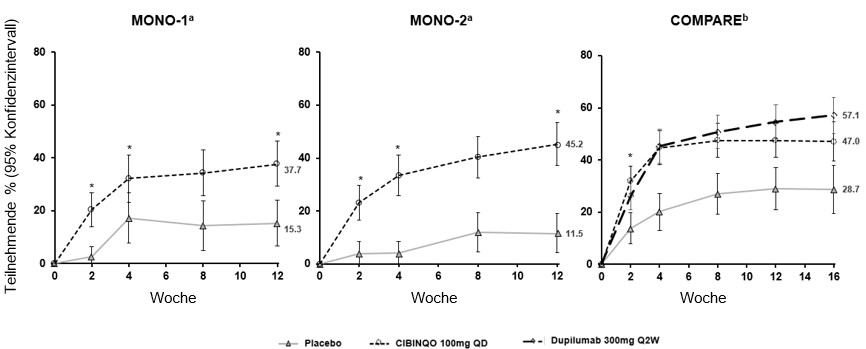
| |
Abkürzungen: PP-NRS = Peak Pruritus Numerical Rating Scale (Numerische Skala zur Bewertung des stärksten Juckreizes); q.d. = einmal täglich.
PP-NRS4-Responder waren Patienten mit einer Verbesserung auf der numerischen Skala zur Bewertung des stärksten Juckreizes (PP-NRS) um ≥4 Punkte gegenüber dem Ausgangswert.
a. Cibinqo als Monotherapie.
b. Cibinqo in Kombination mit einer medizinischen topischen Therapie.
* Statistisch signifikant mit Adjustierung bezüglich Multiplizität vs. Placebo.
|
Langfristige Wirksamkeit
In der Langzeit-Verlängerungsstudie EXTEND erhielten die Patienten Cibinqo mit oder ohne begleitende topische Hintergrundtherapie. Patienten, die zuvor in den qualifizierenden Studien zu 100 mg oder 200 mg Cibinqo einmal täglich randomisiert worden waren, erhielten in EXTEND die gleiche Dosis wie in der Hauptstudie, wobei die Verblindung beibehalten wurde. Unter den Patienten, die in Woche 12 einer qualifizierenden Hauptstudie (z.B. MONO-1, MONO 2, COMPARE) ein Ansprechen unter einer Behandlung von 100 mg Abrocitinib einmal täglich erreichten und in die EXTEND Studie eingeschlossen wurden, war der Anteil der Patienten, die ihr Ansprechen in Woche 96 der kumulativen Behandlung beibehielten 47% für das IGA (0 oder 1) Ansprechen, 59% für EASI-75 und 50% für PP-NRS4 (basierend auf NRI (Non Responder Imputation) Analyse).
Patienten, die Dupilumab in der COMPARE-Studie erhalten hatten und anschliessend in die EXTEND-Studie aufgenommen wurden, erhielten bei Aufnahme in die EXTEND-Studie randomisiert entweder 100 mg oder 200 mg Abrocitinib einmal täglich. Von den Patienten, die in der COMPARE-Studie nicht auf Dupilumab ansprachen und auf Abrocitinib 100 mg einmal täglich randomisiert wurden, erreichte ein erheblicher Anteil 12 Wochen nach der Umstellung auf Abrocitinib ein Ansprechen [34% IGA (0 oder 1) und 68% für EASI-75] (basierend auf NRI (Non-Responder Imputation) Analyse).
|

