ZusammensetzungWirkstoffe
Normales Immunglobulin vom Menschen zur subkutanen Anwendung (SCIg).
Mindestanteil von ≥95% Immunglobulin G (IgG).
IgG-Subklassenverteilung (ungefähre Werte):
IgG1 ………… 70 %
IgG2 ………… 25 %
IgG3 ………… 3 %
IgG4 …………. 2 %
Der maximale IgA Gehalt beträgt 300 µg/ml
Hilfsstoffe
Maltose
Polysorbat 80
Wasser für Injektionszwecke
Indikationen/AnwendungsmöglichkeitenSubstitutionstherapie bei Erwachsenen, Kindern und Jugendlichen (0-18 Jahre) bei
·Primären Immunmangelkrankheiten (PID) mit eingeschränkter Antikörperbildung.
·Sekundären Immunmangelkrankheiten (SID) bei Patienten, die an schweren oder rezidivierenden Infektionen leiden, bei denen eine antimikrobielle Therapie unwirksam ist und die entweder ein nachgewiesenes Versagen spezifischer Antikörper (PSAF)* oder IgG-Serum-Spiegel von <4 g/l aufweisen.
*PSAF = Nichterreichen eines mindestens zweifachen Anstiegs des IgG-Antikörpertiters für Impfstoffe mit Pneumokokken-Polysacchariden und Polypeptid-Antigenen.
Dosierung/AnwendungSubstitutionstherapie
Die Substitutionstherapie muss unter Aufsicht einer medizinischen Fachperson mit Erfahrung in der Behandlung von Immundefekten eingeleitet und überwacht werden.
Die Dosis und das Dosierungsschema sind von der Indikation abhängig.
Das Arzneimittel ist subkutan zu verabreichen.
Bei der Substitutionstherapie muss die Dosis gegebenenfalls individuell für jeden Patienten in Abhängigkeit von den pharmakokinetischen Parametern und dem klinischen Ansprechen angepasst werden. Cutaquig kann in regelmässigen Intervallen von täglich bis alle zwei Wochen verabreicht werden. Die folgenden Dosierungsschemata dienen als Richtlinie:
Substitutionstherapie bei primären Immunmangelkrankheiten (PID)
Das Dosierungsschema sollte zu einem IgG Talspiegel (gemessen vor der nächsten Injektion) von mindestens 5 bis 6 g/l führen und ein Serum IgG innerhalb des Referenzintervalls der jeweiligen Altersgruppe anstreben. Eine Initialdosis von mindestens 0,2 bis 0,5 g/kg (1,2 bis 3,0 ml/kg) Körpergewicht (KG) kann erforderlich sein. Diese kann über mehrere Tage bei einer maximalen Tagesdosis von 0,1 bis 0,15 g/kg KG aufgeteilt werden.
Nach Erreichen des IgG Spiegels im Steady State werden Erhaltungsdosen in wiederholten Intervallen verabreicht, um eine kumulative monatliche Dosis im Bereich von 0,4-0,8 g/kg KG (2,4 bis 4,8 ml/kg KG) zu erzielen. Für jede Einzeldosis muss möglicherweise die Injektionsstelle gewechselt werden.
Die Talspiegel sollten bestimmt und in Zusammenhang mit der Infektionshäufigkeit beurteilt werden. Um die Infektionsrate zu reduzieren, kann es erforderlich sein, die Dosis zu erhöhen und einen höheren Talspiegel anzustreben.
Substitutionstherapie bei sekundären Immunmangelkrankheiten
Empfohlen wird diejenige (Einzel-)Dosis, durch die nach Verabreichung bei wiederholten Intervallen (etwa einmal pro Woche) eine kumulative monatliche Dosis im Bereich von 0,2-0,4 g/kg (1,2 – 2,4 ml/kg) erreicht wird. Für jede Einzeldosis muss möglicherweise die Injektionsstelle gewechselt werden.
Die IgG-Talspiegel sollten bestimmt und in Zusammenhang mit der Infektionshäufigkeit beurteilt werden. Die Dosis sollte nach Bedarf angepasst werden, um optimalen Schutz gegen Infektionen zu
bieten. Bei Patienten mit persistierenden Infektionen kann eine Dosissteigerung erforderlich sein.
Bleibt ein Patient infektionsfrei, kann eine Dosisreduktion erwogen werden.
Kinder und Jugendliche
Die Dosierung bei Kindern und Jugendlichen (0-18 Jahre) unterscheidet sich nicht von der bei Erwachsenen, da sich die Dosierung für jede Indikation nach dem Körpergewicht richtet und dem klinischen Verlauf der Indikationen für eine Substitutionstherapie angepasst wird.
Ältere Patienten
Da sich die Dosis nach dem Körpergewicht richtet und an den klinischen Verlauf der oben genannten Erkrankungen angepasst wird, ist die Dosis bei älteren Patienten nicht anders als die bei 18- bis 65- jährigen Patienten. In den klinischen Studien wurde Cutaquig bei 17 Patienten im Alter von über 65 Jahren untersucht. Die klinische Studie hat keine ausreichende Anzahl von Patienten über 65 Jahre eingeschlossen, um festzustellen, ob ältere Patienten anders ansprechen als jüngere Patienten. Insgesamt sind keine Unterschiede in der Sicherheit oder Wirksamkeit zwischen älteren Patienten und jüngeren Patienten zu erwarten.
Art der Anwendung
Nur zur subkutanen Anwendung.
Die subkutane Injektion für die Behandlung zu Hause ist von medizinischem Fachpersonal einzuleiten und zu überwachen, das in der Anleitung von Patienten zur häuslichen Behandlung erfahren ist. Der Patient und/oder seine Betreuungsperson müssen in die Injektionstechnik, ggf. in den Gebrauch eines Injektionsgerätes, der aseptischen Handhabung, dem Führen eines Behandlungstagebuchs sowie in der Erkennung schwerer Nebenwirkungen und dem Ergreifen entsprechender Massnahmen unterwiesen werden.
Cutaquig kann an Stellen wie Bauch, Oberschenkel, Oberarm und laterale Hüfte injiziert werden.
Injektionsrate
Die Anpassung der Injektionsrate und des Injektionsvolumens pro Stelle basiert auf der Verträglichkeit für den Patienten.
Bei Patienten, die noch keine SCIg-Therapie erhalten haben, wird eine anfängliche Injektionsrate von 15 ml/Stunde/Injektionsstelle empfohlen. Bei Patienten, die bereits mit SCIg behandelt und auf Cutaquig umgestellt werden, wird empfohlen, die bisher verwendeten Infusionsraten für die ersten Infusionen zu verwenden. Die Injektionsrate kann bei guter Verträglichkeit bei anschliessenden Injektionen bei Erwachsenen (≥40 kg) schrittweise um etwa 10 ml/Stunde/Injektionsstelle alle 2-4 Wochen und bei pädiatrischen Patienten (< 40 kg) bis zu 10 ml/Stunde/Injektionsstelle alle 4 Wochen erhöht werden.
Sofern der Patient die anfänglichen Injektionen bei voller Dosis pro Injektionsstelle und maximaler Injektionsrate verträgt, kann anschliessend eine Erhöhung der Injektionsrate erwogen werden, bis eine maximale Injektionsrate von 67,5 ml/h/Injektionsstelle bei Erwachsenen und 25 ml/h/Injektionsstelle bei Kindern erreicht ist.
Es kann mehr als ein Injektionsgerät gleichzeitig genutzt werden.
Injektionsvolumen pro Stelle
Die Produktmenge, die an einer bestimmten Stelle infundiert wird, variiert. Bei Säuglingen und Kindern kann die Injektionsstelle alle 5-15 ml gewechselt werden. Bei Erwachsenen können Dosen von über 30 ml je nach Patientenpräferenz geteilt werden. Die Anzahl der Injektionsstellen ist nicht begrenzt. Der Abstand zwischen den Injektionsstellen sollte mindestens 5 cm betragen.
KontraindikationenÜberempfindlichkeit gegen den Wirkstoff oder einen der genannten sonstigen Bestandteile (Siehe Abschnitt «Zusammensetzung»).
Cutaquig darf nicht intravaskulär injiziert werden.
Es darf im Falle einer schweren Thrombozytopenie und anderer Störungen der Hämostase auch nicht intramuskulär verabreicht werden.
Bei IgA-defizienten Patienten mit Antikörpern gegen IgA und bekannter Überempfindlichkeit gegenüber einer Behandlung mit Humanglobulin.
Warnhinweise und VorsichtsmassnahmenEs wird dringend empfohlen, bei jeder Verabreichung von Cutaquig den Namen und die Chargennummer des Produkts zu dokumentieren, um eine Verbindung zwischen dem Patienten und der Produktcharge herstellen zu können.
Dieses Arzneimittel enthält maximal 90 mg Maltose pro ml als sonstigen Bestandteil. Die Maltose-Interferenz in Blutzuckermesstests kann zu fälschlich erhöhten Glucosewerten und infolgedessen zu einer unangemessenen Verabreichung von Insulin führen, die wiederum zu einer lebensbedrohlichen oder sogar tödlichen Hypoglykämie führen kann. Zudem können Fälle einer echten Hypoglykämie unbehandelt bleiben, wenn der hypoglykämische Zustand durch fälschlich erhöhte Glucosewerte maskiert wird (siehe Abschnitt Interaktionen). Hinsichtlich akuten Nierenversagens siehe weiter unten.
Cutaquig ist nur zur subkutanen Anwendung bestimmt. Falls Cutaquig versehentlich in ein Blutgefäss appliziert wird, können Patienten einen Schock entwickeln.
Die im Kapitel «Art der Anwendung/Injektionsrate» empfohlene Injektionsrate muss genau eingehalten werden. Die Patienten müssen während der gesamten Injektionsdauer engmaschig überwacht und sorgfältig hinsichtlich des Auftretens von Symptomen beobachtet werden.
Bestimmte Nebenwirkungen können häufiger bei Patienten auftreten, die normales Immunglobulin vom Menschen zum ersten Mal erhalten, oder in seltenen Fällen, wenn das Präparat mit normalem Immunglobulin vom Menschen gewechselt wird oder die vorherige Injektion lange Zeit zurückliegt.
Mögliche Komplikationen lassen sich häufig durch Folgendes vermeiden:
·Das Präparat anfänglich langsam injizieren.
·Sicherstellen, dass die Patienten während der gesamten Injektionsdauer sorgfältig auf das Auftreten von Symptomen überwacht werden. Insbesondere Patienten, die noch kein normales Immunglobulin vom Menschen erhalten haben, sowie Patienten, die auf ein anderes Immunglobulinpräparat umgestellt wurden oder deren vorangegangene Injektion lange Zeit zurückliegt, sollten während der ersten Injektion und der ersten Stunde danach überwacht werden, um mögliche Nebenwirkungen festzustellen.
Alle anderen Patienten sollten nach der Verabreichung mindestens 20 Minuten lang beobachtet werden.
Im Falle einer Nebenwirkung muss entweder die Injektionsrate reduziert oder die Injektion beendet werden. Bei Verdacht auf eine allergische oder anaphylaktische Reaktion ist die Injektion sofort abzubrechen. Die erforderliche Behandlung hängt von Art und Schweregrad der Nebenwirkung ab.
Bei einem Schock sind die medizinischen Standardmassnahmen für eine Schockbehandlung anzuwenden.
Überempfindlichkeit
Echte allergische Reaktionen sind selten. Sie können insbesondere bei Patienten mit Anti-IgA-Antikörpern auftreten, die daher mit besonderer Vorsicht behandelt werden sollten. Patienten mit Anti-IgA-Antikörpern, bei denen die Behandlung mit subkutanen IgG Präparaten die einzige Möglichkeit ist, sollten nur unter enger ärztlicher Überwachung mit Cutaquig behandelt werden.
Selten kann normales Immunglobulin vom Menschen einen Blutdruckabfall mit anaphylaktischer Reaktion auslösen, selbst bei Patienten, die eine frühere Behandlung mit normalem Immunglobulin vom Menschen vertragen haben.
Thromboembolie
Patienten sollten vor der Anwendung von Immunglobulinen ausreichend hydriert sein. Mit der Anwendung von Immunglobulinen wurden arterielle und venöse thromboembolische Ereignisse einschliesslich Myokardinfarkt, Schlaganfall, tiefer Venenthrombose und Lungenembolie in Verbindung gebracht. Vorsicht ist geboten bei Patienten mit vorbestehenden Risikofaktoren für thrombotische Ereignisse (wie zum Beispiel fortgeschrittenes Alter, Hypertonie, Diabetes mellitus und Gefässerkrankungen oder thrombotische Episoden in der Anamnese, erworbene oder hereditäre Thrombophilie, bei anhaltenden Immobilisierungsphasen, schwere Hypovolämie, Erkrankungen, die die Blutviskosität erhöhen).
Die Patienten sollten über erste Anzeichen thromboembolischer Ereignisse einschliesslich Kurzatmigkeit, Schmerzen und Schwellung einer Extremität, fokaler neurologischer Ausfälle sowie Schmerzen im Brustraum informiert und dazu angehalten werden, sich beim Einsetzen derartiger Symptome umgehend an ihren Arzt zu wenden.
Aseptisches Meningitissyndrom (AMS)
In Zusammenhang mit der subkutanen Immunglobulinbehandlung wurde über das Auftreten des aseptischen Meningitissyndroms berichtet; die Symptome setzen in der Regel mehrere Stunden bis 2 Tage nach der Behandlung ein. Ein Absetzen der Immunglobulinbehandlung kann innerhalb einiger Tage zum Abklingen der AMS ohne Folgeschäden führen.
Die Patienten sollten über die ersten Anzeichen informiert werden, die starke Kopfschmerzen, Nackensteifigkeit, Benommenheit, Fieber, Photophobie, Übelkeit und Erbrechen umfassen.
Nierenfunktionsstörung/Nierenversagen
Bei Patienten, die eine Immunglobulinbehandlung und insbesondere Saccharose-haltige Präparate erhielten, wurde über schwere renale Nebenwirkungen berichtet (Cutaquig enthält keine Saccharose). Zu diesen gehören akutes Nierenversagen, akute Tubulusnekrose, proximale tubuläre Nephropathie und osmotische Nephrose. Zu den Faktoren, die das Risiko renaler Komplikationen erhöhen, zählen unter anderem vorbestehende Niereninsuffizienz, Diabetes mellitus, Hypovolämie, Begleittherapie mit nephrotoxischen Arzneimitteln, Alter über 65 Jahre, Sepsis, Hyperviskosität und Paraproteinämie.
Hämolyse
IgG-Produkte können Blutgruppenantikörper enthalten, die als Hämolysine wirken und eine In-vivo-Beschichtung der roten Blutkörperchen mit Immunglobulin bewirken, wodurch eine positive direkte Antiglobulin-Reaktion (Coombs-Test) und selten eine Hämolyse hervorgerufen wird. Patienten, die Immunglobulinprodukte erhalten, sollten auf klinische Anzeichen und Symptome einer Hämolyse überwacht werden.
Virussicherheit
Standardmassnahmen zur Prävention von Infektionen, die im Rahmen der Anwendung von aus Blut oder Plasma vom Menschen hergestellten Arzneimitteln auftreten können, umfassen die Spenderauswahl, die Testung jeder einzelnen Spende und jedes Plasmapools auf spezifische Infektionsmarker sowie die Einbeziehung effektiver Herstellungsschritte zur Inaktivierung/Eliminierung von Viren. Trotz dieser Massnahmen kann bei Verabreichung von Arzneimitteln, die aus Blut oder Plasma vom Menschen hergestellt werden, die Möglichkeit der Übertragung von Krankheitserregern nicht völlig ausgeschlossen werden. Dies gilt auch für unbekannte oder neu auftretende Viren und andere Pathogene.
Die getroffenen Massnahmen gelten für umhüllte Viren wie zum Beispiel humanes Immundefizienz-Virus (HIV), Hepatitis B-Virus (HBV) und Hepatitis C-Virus (HCV) als wirksam.
Die getroffenen Massnahmen können bei nicht umhüllten Viren wie zum Beispiel Hepatitis A-Virus (HAV) und Parvovirus B19 von begrenztem Nutzen sein.
Umfangreiche klinische Erfahrungen weisen auf eine Hepatitis A-Virus- bzw. eine ParvovirusB19-übertragungsfreie Anwendung von Immunglobulinen hin. Auch wird angenommen, dass der Antikörpergehalt einen wichtigen Beitrag zur Virussicherheit leistet.
Dieses Arzneimittel enthält 33,1 mg Natrium pro Durchstechflasche mit 48 ml, entsprechend 1,7 % der von der WHO empfohlenen maximalen Tageszufuhr von 2 g Natrium für einen Erwachsenen.
InteraktionenAbgeschwächte Lebendimpfstoffe
Die Verabreichung von Immunglobulin kann für eine Dauer von mindestens 6 Wochen und bis zu 3 Monaten die Wirksamkeit von viralen Lebendimpfstoffen wie beispielsweise gegen Masern, Röteln, Mumps und Varizellen beeinträchtigen. Nach Verabreichung dieses Arzneimittels ist vor der Impfung mit viralen Lebendimpfstoffen ein Abstand von 3 Monaten einzuhalten. Bei einer Masernimpfung kann diese Beeinträchtigung bis zu 1 Jahr anhalten.
Deshalb sollten Patienten, die gegen Masern geimpft wurden, ihren Antikörperstatus überprüfen lassen.
Blutzuckeruntersuchung
Cutaquig enthält Maltose, die von bestimmten Arten von Blutzuckertestsystemen als Glucose fehlinterpretiert werden kann. Um fälschlicherweise erhöhte Glucosewerte zu vermeiden, sollten zur Bestimmung oder Überwachung der Blutzuckerspiegel bei Patienten mit Diabetes nur glucosespezifische Testsysteme verwendet werden.
Auswirkungen auf serologische Untersuchungen
Nach der Verabreichung von Immunglobulin kann der vorübergehende Anstieg verschiedener passiv übertragener Antikörper im Blut des Patienten zu falsch positiven Ergebnissen serologischer Tests führen.
Die passive Übertragung von Antikörpern gegen Erythrozytenantigene, z.B. A, B, D, kann einige serologische Tests (z.B. Retikulozytenzählung, Haptoglobin und Coombs-Test) verfälschen.
Kinder und Jugendliche
Die aufgeführten Wechselwirkungen gelten sowohl für Erwachsene als auch für Kinder und Jugendliche.
Schwangerschaft, StillzeitSchwangerschaft
Da die Sicherheit dieses Arzneimittels bei Anwendung während der Schwangerschaft nicht in kontrollierten klinischen Studien untersucht wurde, sollte es schwangeren Frauen und stillenden Müttern nur mit Vorsicht verabreicht werden. Es wurde nachgewiesen, dass Immunglobulinpräparate die Plazentaschranke vor allem während des dritten Trimesters überqueren. Die klinische Erfahrung mit Immunglobulinen deutet darauf hin, dass keine schädlichen Wirkungen auf den Verlauf der Schwangerschaft, den Fötus und das Neugeborene zu erwarten sind.
Stillzeit
Immunglobuline gehen in die Muttermilch über und können zum Schutz des Neugeborenen vor Pathogenen beitragen, die über die Schleimhäute eindringen.
Fertilität
Die klinische Erfahrung mit Immunglobulinen deutet darauf hin, dass keine schädlichen Wirkungen auf die Fertilität zu erwarten sind.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenDie Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen können durch einige mit Cutaquig assoziierte Nebenwirkungen beeinträchtigt werden. Patienten, bei denen während der Behandlung Nebenwirkungen auftreten, sollten erst wieder ein Fahrzeug führen oder Maschinen bedienen, wenn diese abgeklungen sind.
Unerwünschte WirkungenZusammenfassung des Sicherheitsprofils
Gelegentlich können Nebenwirkungen wie Schüttelfrost, Kopfschmerzen, Schwindel, Fieber, Erbrechen, allergische Reaktionen, Übelkeit, Arthralgie, niedriger Blutdruck und mässige Schmerzen im unteren Rücken auftreten.
Selten können normale Immunglobuline vom Menschen einen plötzlichen Blutdruckabfall und in Einzelfällen einen anaphylaktischen Schock auslösen, selbst wenn der Patient keine Überempfindlichkeit gegen eine frühere Verabreichung gezeigt hat.
Lokale Reaktionen an den Injektionsstellen: Häufig können Schwellung, Schmerzen, Rötung, Verhärtung, lokale Erwärmung, Juckreiz, Hämatome und Hautausschlag auftreten. Die Häufigkeit dieser Reaktionen nimmt normalerweise unter der laufenden Behandlung ab.
Informationen zur Sicherheit in Bezug auf übertragbare Erreger siehe Abschnitt Warnhinweise und Vorsichtsmassnahmen.
Tabellarische Auflistung der Nebenwirkungen
Die Daten zur klinischen Sicherheit von Cutaquig bei Patienten mit PID basieren auf der offenen, einarmigen, prospektiven, multizentrischen Phase-III-Zulassungsstudie (n = 75, 4.462 Injektionen), der prospektiven, offenen, einarmigen, multizentrischen Phase III-Verlängerungsstudie (n = 27, 2.777 Injektionen) und der offenen, dreiarmigen, multizentrischen Phase III-Studie (n = 64, 1.338 Injektionen).
Die nachfolgende Tabelle entspricht der MedDRA-Systemorganklassifikation (SOC und bevorzugter Begriff).
Bei den Häufigkeitsangaben pro Patient wurden folgende Kategorien zugrunde gelegt: Sehr häufig (≥1/10); häufig (≥1/100 bis < 1/10); gelegentlich (≥1/1'000 bis < 1/100); selten (≥1/10'000 bis < 1/1'000); sehr selten (< 1/10'000), nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Innerhalb jeder Häufigkeitsgruppe sind die Nebenwirkungen nach abnehmendem Schweregrad aufgelistet.
Häufigkeit der Nebenwirkungen pro Patient und Injektion in der klinischen Studie mit Cutaquig:
|
Systemorganklasse (SOC) gemäss MedDRA-Datenbank
|
Nebenwirkung
|
Häufigkeit/Injektion
|
Häufigkeit/Patient
| |
Erkrankungen des Nervensystems
|
Kopfschmerzen
Schwindelgefühl
|
Gelegentlich
Selten
|
Häufig
Gelegentlich
| |
Erkrankungen des Gastrointestinaltrakts
|
Übelkeit
|
Gelegentlich
|
Häufig
| |
|
Abdominale Distension
|
Selten
|
Häufig
| |
|
Abdominalschmerzen
|
Selten
|
Häufig
| |
|
Erbrechen
|
Selten
|
Häufig
| |
|
Brechreiz
|
Selten
|
Gelegentlich
| |
Leber- und Gallenerkrankungen
|
Hypertransaminasämie
|
Selten
|
Gelegentlich
| |
Erkrankungen der Haut und des Unterhautgewebes
|
Ausschlag
|
Selten
|
Gelegentlich
| |
|
Hautreaktion
|
Selten
|
Gelegentlich
| |
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
|
Myalgie
|
Selten
|
Häufig
| |
|
Arthralgie
|
Selten
|
Gelegentlich
| |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
|
Reaktion an der Injektionsstelle
|
Sehr häufig (23.3%)
|
Sehr häufig (75%)
| |
|
Pyrexie
|
Selten
|
Häufig
| |
|
Schüttelfrost
|
Selten
|
Häufig
| |
|
Ermüdung
|
Gelegentlich
|
Häufig
| |
|
Brustkorbbeschwerden
|
Selten
|
Gelegentlich
| |
|
Grippeähnliche Erkrankung
|
Selten
|
Gelegentlich
| |
|
Unwohlsein
|
Selten
|
Gelegentlich
| |
|
Schmerz
|
Selten
|
Gelegentlich
| |
Untersuchungen
|
Auftreten von freiem Hämoglobin
|
Selten
|
Häufig
| |
|
Positiver Coombs-Test
|
Selten
|
Gelegentlich
| |
|
Haptoglobin erniedrigt
|
Selten
|
Gelegentlich
| |
|
Hämoglobin erhöht
|
Selten
|
Gelegentlich
| |
|
Kreatinin im Blut erhöht
|
Selten
|
Gelegentlich
|
*MedDRA [Medizinisches Wörterbuch für Aktivitäten im Rahmen der Arzneimittelzulassung]
Die folgenden Nebenwirkungen wurden während der Anwendung nach der Zulassung von Cutaquig festgestellt. Da diese Nebenwirkungen freiwillig von einer Population unbekannter Grösse berichtet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig einzuschätzen oder den Zusammenhang mit der Arzneimittelexposition zu bestimmen.
Diese Liste enthält keine Reaktionen, die bereits in den klinischen Studien zu Cutaquig berichtet wurden:
|
Systemorganklasse (SOC) gemäss MedDRA-Datenbank:
|
Nebenwirkung (PT)
| |
Erkrankungen des Immunsystems
|
Überempfindlichkeit (z.B. Erythem, Urtikaria)
| |
Gefässerkrankungen
|
Thromboembolie, Thrombose (z.B. tiefe Venenthrombose, apoplektischer Insult), Hypertonie
| |
Erkrankungen der Haut und des Unterhautbindegewebes
|
Pruritus
| |
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
|
Rückenschmerzen
|
Die folgenden, zusätzlichen Nebenwirkungen wurden während der Anwendung von subkutanen Immunglobulinpräparaten nach der Marktzulassung festgestellt: Gesichtsödem, Tremor, Blässe, Bronchospasmus, Dyspnoe, Husten, Durchfall, Flushing, Hitzegefühl, Frösteln, Asthenie, Schmerzen an der Injektionsstelle, Engegefühl im Hals, aseptische Meningitis.
Informationen über die Virussicherheit: siehe Kapitel «Warnhinweise und Vorsichtsmassnahmen»
Kinder und Jugendliche
Häufigkeit, Art und Schweregrad der Nebenwirkungen bei Kindern und Jugendlichen sind voraussichtlich die gleichen wie bei Erwachsenen.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungFolgen einer Überdosierung sind nicht bekannt.
Eigenschaften/WirkungenATC-Code
J06B A01
Pharmakotherapeutische Gruppe: Immunsera und Immunglobuline: Normales Immunglobulin vom Menschen, zur extravaskulären Anwendung
Wirkungsmechanismus
Normales Immunglobulin vom Menschen enthält hauptsächlich Immunglobulin G (IgG) mit einem breiten Spektrum von Antikörpern gegen infektiöse Erreger.
Normales Immunglobulin vom Menschen enthält die in der normalen Bevölkerung vorhandenen IgG-Antikörper. Die Herstellung erfolgt aus gepooltem Plasma von mindestens 1000 Spenden. Die IgG-Subklassen sind in annähernd der gleichen Verteilung wie im nativen, menschlichen Plasma vorhanden. Entsprechende Dosen Cutaquig können krankhaft niedrige Immunglobulin-G-Spiegel wieder in den Normalbereich bringen.
Pharmakodynamik
Adäquate Dosen dieses Arzneimittels können bei primären und sekundären Immundefizienzen einen Anstieg abnormal niedriger Immunglobulin G-Spiegel in den Normalbereich bewirken und so gegen Infektionen helfen.
Klinische Wirksamkeit
In der ersten klinischen Studie wurden insgesamt 75 Patienten (37 Erwachsene, 12 junge Kinder [≥2 und < 6], 14 ältere Kinder [≥6 und < 12], 12 Jugendliche [≥12 und < 17]) mit primärer Immundefizienz bis zu 64 Wochen lang mit Cutaquig behandelt. Die jede Woche verabreichte mittlere Dosis pro Patient betrug 0,187 g/kg bei erwachsenen Patienten, 0,150 g/kg bei kleinen Kindern, 0,164 g/kg bei älteren Kindern und 0,170 g/kg bei Jugendlichen. Insgesamt erhielten die Patienten 4.462 wöchentliche Cutaquig-Injektionen.
Weder während der Wash in-/Wash out-Phase noch während der Wirksamkeitsphase wurde bei den Patienten, die Cutaquig erhielten, über schwere bakterielle Infektionen berichtet.
Cutaquig wurde bei 38 pädiatrischen Patienten (26 Kindern [zwischen 2 und < 12 Jahren] und 12 Jugendlichen [zwischen 12 und < 16 Jahren]) mit primärer Immundefizienz untersucht. Es waren keine pädiatriespezifischen Dosen erforderlich, um die gewünschten IgG-Serumspiegel zu erreichen.
Die Verlängerungsstudie war eine prospektive, offene, einarmige, multizentrische Phase-III-Nachbeobachtungsstudie zur Sicherheit, in die 27 Patienten (17 Erwachsene, 2 junge Kinder [≥2 und < 6], 4 ältere Kinder [≥6 und < 12], 4 Jugendliche [≥12 und < 17]) mit primärer Immundefizienz aufgenommen wurden. Zu den 21 Patienten aus der Zulassungsstudie wurden zusätzlich 6 neue Patienten aufgenommen. Die zuvor in die Zulassungsstudie aufgenommenen Patienten wurden bis zu 4,5 Jahre und die neu aufgenommenen Patienten 12 Monate lang beobachtet. Cutaquig wurde bei 25 Patienten wöchentlich und bei zwei Patienten alle zwei Wochen verabreicht. Die durchschnittlich tatsächlich verabreichte Dosis Cutaquig pro Patient, betrug 0,127 g/kg bei jungen Kindern, 0,210 g/kg bei älteren Kindern, 0,160 g/kg bei jugendlichen Patienten und 0,166 g/kg bei erwachsenen Patienten. Insgesamt erhielten die Patienten 2.777 Injektionen (2.740 wöchentlich und 37 alle zwei Wochen). Es wurde eine schwerwiegende bakterielle Infektion (SBI) in Form von Bakteriämie/Sepsis berichtet.
Zur Überprüfung der Sicherheit, Verträglichkeit und Wirksamkeit von Cutaquig wurden 64 Patienten mit PID (59 Erwachsene, 1 junges Kind [≥2 und < 6], 2 ältere Kinder [≥6 und < 12], 2 Jugendliche [≥12 und < 17]) im Alter zwischen 5 und 74 Jahren in eine prospektive, offene, dreiarmige, multizentrische Phase-III-Studie aufgenommen.
Nach Abschluss der 4wöchigen Einstellungsphase begann bei den Patienten die Behandlungsphase mit einer 24wöchigen Nachbeobachtungszeit. Sie wurden einer von 3 Kohorten zugewiesen:
·In Kohorte 1 wurde das zunehmende Volumen pro Stelle bis zu einem Maximum von 100 ml/Injektionsstelle untersucht.
·In Kohorte 2 wurde die Erhöhung der Injektionsgeschwindigkeit bis maximal 100 ml/Stunde und Injektionsstelle bzw. bis zur maximalen Injektionsgeschwindigkeit der eingesetzten Injektionspumpe untersucht.
·In Kohorte 3 wurde die zweiwöchentliche Cutaquig-Gabe untersucht. Die Dosis entsprach dabei dem Doppelten, der dem Körpergewicht entsprechenden wöchentlichen Dosis.
Ein weiterer primärer Endpunkt war der Vergleich der IgG-Talspiegel von wöchentlichen und zweiwöchentlichen Injektionen sowie die Bewertung der Sicherheit und Verträglichkeit erhöhter Injektionssvolumina und erhöhter Injektionsraten an jeder Injektionsstelle.
Die Patienten erhielten insgesamt 1.338 Injektionen (386 in Kohorte 1, 396 in Kohorte 2, 556 in Kohorte 3). In Kohorte 1 (n = 15 Erwachsene) lag das mittlere erreichte Maximalvolumen pro Stelle bei 69,4 ml/Injektionsstelle, mit einem Maximalvolumen von 108 ml/Injektionsstelle. Ein Drittel der Patienten (5/15; 33,3 %) erreichte ≥90 % des erlaubten Maximalvolumens von 100 ml/Injektionsstelle, ein weiteres Drittel erreichte 50 % bis < 90 % des erlaubten Maximalvolumens und ein Drittel erreichte < 50 % des erlaubten Maximalvolumens. Die mediane erreichte Maximalflussrate pro Patient lag bei 56,9 ml/Stunde (Spanne: 34,0 ml/Stunde bis 94,7 ml/Stunde).
In Kohorte 2 (n = 15; 13 Erwachsene, 1 älteres Kind [≥6 und < 12], 1 Jugendlicher [≥12 und < 17]) lag die mittlere erreichte Maximalflussrate pro Stelle bei 42,1 ml/Stunde/Injektionsstelle, mit einer Maximalflussrate von 67,5 ml/Stunde/Injektionsstelle. 73,3 % erreichten eine Maximalflussrate pro Stelle von < 50 % des erlaubten Maximalvolumens von 100 ml/Stunde/Injektionsstelle und die restlichen 26,7 % erreichten 50 % bis 75 % des erlaubten Maximalvolumens. Die mediane erreichte Maximalflussrate pro Patient lag bei 135,0 ml/Stunde (Spanne: 51,4 ml/Stunde bis 192,0 ml/Stunde).
In Kohorte 3 (n = 34; 31 Erwachsene, 1 junges Kind [≥2 und < 6], 1 älteres Kind [≥6 und < 12], 1 Jugendlicher [≥12 und < 17]) wurde bei der Gabe alle 2 Wochen eine Senkung der mittleren (SD) IgG-Talspiegel insgesamt beobachtet (9,927 [2,0146] g/l) im Vergleich zur wöchentlichen Gabe (10,364 [1,9632] g/l) (p = 0,0017; 1seitiges unteres 97,5%-Konfidenzintervall [LCL] = -0,799). Die mediane erreichte Maximalflussrate pro Patient lag bei 93,5 ml/Stunde (Spanne: 24,3 ml/Stunde bis 145,9 ml/Stunde).
Die mittlere tatsächliche Durchschnittsdosis von Cutaquig, die anhand des Körpergewichts verabreicht wurde, betrug 0,143 g/kg in Kohorte 1, 0,157 g/kg in Kohorte 2 und 0,256 g/kg in Kohorte 3.
Während der Studie wurden keine SBI berichtet und die Gesamtrate von SBI betrug 0,00 Personenjahre (Obergrenze 98%-KI [Alternativmethode] = 0,135 [0,614 in Kohorte 1, 0,602 in Kohorte 2 und 0,244 in Kohorte 3]).
Kinder und Jugendliche
Hinsichtlich der pharmakodynamischen Eigenschaften wurden zwischen Erwachsenen sowie Kindern und Jugendlichen keine Unterschiede beobachtet.
PharmakokinetikIm Rahmen einer klinischen Studie der Phase III wurde eine pharmakokinetische (PK-) Teilstudie mit 37 PID-Patienten durchgeführt. Blutproben für die PK-Studie wurden vor dem Wechsel zu Cutaquig (IVIG-Profil: PKIV), nach der 11. Injektion von Cutaquig (erstes SC-Profil: PKSC1) und nach der 28. Injektion von Cutaquig (zweites SC-Profil: PKSC2) entnommen. Das Ziel der PK-Teilstudie war der Vergleich der AUCs (area under the curve) nach der IV- und der SC-Verabreichung unter Verwendung eines Dosis-Korrekturfaktors (DCF) von 1,5. Mit einem Populations-PK-Modell wurden die PK-Parameter geschätzt und Simulationen durchgeführt.
Absorption
Nach subkutaner Verabreichung von Cutaquig werden maximale Serumspiegel nach etwa 2 Tagen erreicht.
Distribution
Bei subkutaner Verabreichung verteilt sich normales Immunglobin zuerst im lokalen, subkutanen Gewebe und diffundiert dann langsam in die Blutbahn des Empfängers und den extravaskulären Raum.
Metabolismus
Aufgrund der allmählichen Absorption führt die SCIg-Verabreichung verglichen mit der IVIG-Behandlung im Fliessgleichgewicht (Steady State) zu flacheren Profilen und niedrigeren Schwankungen: Die mittlere Cmax war nach SCIg niedriger (13,2±3,4 g/l und 13,5±3,7 g/l für PKSC1 bzw. PKSC2) als der Spiegel am Ende der Injektion bei IVIG-Behandlung (18,0±4,5 g/l). Entsprechend waren die mittleren Serum-IgG- und IgG-Talspiegel der Untergruppe nach SC-Behandlung höher (11,5 und 11,7 g/l für PKSC1 bzw. PKSC2; Gesamtschwankungsbereich von 6,5 bis 18,9 g/l) als der am Ende des IVIG-Zeitraums (10,1 g/l; Schwankungsbereich: 6,5 g/l bis 14,3 g/l).
Die SC-Bioverfügbarkeit wurde mit 75 % berechnet, entsprechend einem Dosis-Korrekturfaktor von 1,3 für das Erreichen einer gleichen AUC der Exposition nach körpergewichtsbasierter SCIg-Behandlung im Vergleich mit IVIG-Behandlung.
Die mit den Daten der klinischen Studie durchgeführte PK-basierte Modellierung und Simulation mit wöchentlicher Cutaquig-Dosierung zeigte, dass eine körpergewichtskorrigierte Dosierung ohne einen DCF für die geringere SC-Bioverfügbarkeit ausreichen würde, um bei Dosisintervallen von bis zu einer Woche - einschliesslich einer häufigeren Verabreichung als einmal pro Woche (z.B. täglich) - eine systemische IgG-Exposition im therapeutischen Bereich aufrecht zu erhalten.
Bei grösseren Dosisintervallen (vor allem bei niedrigen IgG-Baseline-Spiegeln) steigt das Risiko, dass die IgG-Talspiegel unter 5 g/l fallen.
Beispiel: Unter der Annahme eines IgG-Baseline-Spiegels von 4,0 g/l und einem Dosis-Umrechnungsfaktor von 1,0 von der IVIG- zur SCIg-Behandlung wurde prognostiziert, dass der Anteil der Patienten, deren IgG-Talspiegel unter 5 g/l fällt, bei einem Dosisintervall von 2 Wochen auf 4 % zunimmt, gegenüber 1,4 % bei Dosisintervallen von weniger als oder gleich einer Woche .
Elimination
IgG und IgG-Komplexe werden in den Zellen des retikuloendothelialen Systems abgebaut. Der Median der Halbwertszeit des IgG nach der Verabreichung von Cutaquig bei PID-Patienten wurde auf ~16 [9,2-36,3] Tage geschätzt; die Berechnung erfolgte in dem Populations-PK-Modell unter der Annahme, dass keine endogene IgG-Produktion stattfindet.
Kinder und Jugendliche
Zwischen erwachsenen und pädiatrischen Studienpatienten mit PID wurden keine klinisch relevanten Unterschiede bei den Pharmakokinetik-Parametern festgestellt.
Eine zu den Daten aus der klinischen Studie mit wöchentlicher Dosierung von Cutaquig durchgeführte Physiologie-basierte pharmakokinetische Modellierung und Simulation zeigt, dass eine körpergewichtsadjustierte Dosierung ausreicht, um eine systemische IgG-Exposition im therapeutischen Bereich unabhängig vom Alter aufrechtzuerhalten.
Präklinische DatenImmunglobuline sind normale Bestandteile des Humanplasmas. Basierend auf den konventionellen Studien zur Sicherheitspharmakologie und lokalen Toleranz lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen. Da die klinischen Erfahrungen keine Hinweise auf ein karzinogenes oder mutagenes Potenzial der Immunglobuline geben, wurden keine experimentellen Studien an heterologen Spezies durchgeführt.
Sonstige HinweiseInkompatibilitäten
Da keine Verträglichkeitsstudien durchgeführt wurden, darf das Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Beeinflussung diagnostischer Methoden
Siehe Abschnitt «Interaktionen».
Haltbarkeit
Cutaquig ist bei 2°C bis 8°C bis zu dem auf der Packung und Etikette unter «EXP» aufgedruckten Verfalldatum haltbar.
Haltbarkeit nach Anbruch
Cutaquig ist unmittelbar nach Öffnen der Durchstechflasche zu verwenden.
Besondere Lagerungshinweise
Im Kühlschrank (2-8°C) lagern.
Nicht einfrieren.
In der Originalverpackung aufbewahren.
Den Behälter im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Ausser Reichweite von Kindern aufbewahren.
Das verpackte Produkt ist innerhalb seiner Haltbarkeitsdauer maximal 9 Monate bei Raumtemperatur (bis maximal 25°C) haltbar. In diesem Fall läuft die Haltbarkeit des Produkts nach 9 Monaten ab. Bei Beginn der Lagerung bei Raumtemperatur ist das neue Verfalldatum auf dem Karton zu notieren.
Hinweise für die Handhabung
Das Produkt sollte vor der Anwendung auf Zimmer- oder Körpertemperatur gebracht werden.
Parenterale Arzneimittel sollten vor der Anwendung visuell auf Partikel und Verfärbung geprüft werden. Keine Lösungen verwenden, die trüb sind oder Ablagerungen aufweisen.
Anleitung zur Anwendung
1. Bereitstellen der notwendigen Anzahl an Durchstechflaschen mit Cutaquig
·Falls die Durchstechflaschen im Kühlschrank aufbewahrt wurden, müssen Sie diese vor der Injektion auf Raumtemperatur bringen, was mindestens 90 Minuten dauern kann.
·Verwenden Sie dafür keine Wärmequelle und keine Mikrowelle.
·Schütteln Sie die Durchstechflaschen nicht, um Schaumbildung zu vermeiden.
2. Vorbereiten der Injektion
·Bereiten Sie eine saubere Arbeitsfläche unter Verwendung von antiseptischen Tüchern oder einer Desinfektionslösung vor (Abbildung 1).
·Stellen Sie alle Materialien für die Injektion zusammen:
·Injektionspumpe (optional) und passende Spritze(n)
·Kanüle oder belüftete Überleitungssysteme (um die Lösung aus der Durchstechflasche aufzuziehen)
·Nadeln zur subkutanen Injektion
·Alkohol und Alkoholtupfer/antiseptische Tupfer
·Verbandsmull oder durchsichtiger Wundverband und Klebeband
·Behälter für scharfe Gegenstände
·Behandlungstagebuch und Kugelschreiber
·Waschen Sie Ihre Hände gründlich und warten Sie, bis sie trocken sind (Abbildung 2). Verwenden Sie ein Händedesinfektionsmittel, wie es Ihnen während der Schulung gezeigt wurde.

·Falls erforderlich, programmieren Sie die Pumpe gemäss der Bedienungsanleitung und wie es Ihnen während der Schulung von Ihrer medizinischen Fachkraft gezeigt wurde.
3. Überprüfen und Öffnen der Durchstechflaschen
·Führen Sie bei jeder Durchstechflasche folgende Schritte durch:
·Prüfen Sie, ob es sich auf Basis Ihrer Verschreibung um die richtige, auf dem Etikett angegebene Dosis handelt,
·Prüfen Sie das Aussehen der Lösung (sie soll klar und farblos bis blassgelb oder hellbraun sein),
·Vergewissern Sie sich, dass die Schutzkappe nicht beschädigt ist oder fehlt,
·Prüfen Sie das Verfalldatum und die Batchnummer,
·Verwenden Sie die Lösung nicht, wenn sie trüb ist oder Partikel enthält.
·Entfernen Sie die Schutzkappe.
·Desinfizieren Sie den Gummistopfen mit einem antiseptischen Tupfer und lassen Sie ihn trocknen (Abbildung 3).
4. Vorbereiten und Füllen der Spritze
·Öffnen Sie eine sterile Spritze und Kanüle oder das belüftete Überleitungssystem.
·Bei der Nutzung einer Kanüle befestigen Sie diese mit einer Schraubenbewegung an der Spritze. Bei der Nutzung eines belüfteten Überleitungssystems befestigen Sie dieses an der Flasche.
·Bei der Nutzung einer Kanüle ziehen Sie den Spritzenkolben zurück, um die Spritze mit Luft zu füllen. Die Luftmenge sollte in etwa der Menge an Lösung entsprechen, die Sie der Durchstechflasche entnehmen wollen.Bei der Nutzung eines belüfteten Überleitungssystems ist dieser Schritt nicht notwendig.
·Bei der Nutzung einer Kanüle führen Sie diese in die Durchstechflasche ein und drehen Sie die Durchstechflasche um. Injizieren Sie die Luft – achten Sie dabei darauf, dass sich die Nadelspitze nicht in der Lösung befindet, um Schaumbildung zu vermeiden.Bei der Nutzung eines belüfteten Überleitungssystems verbinden Sie die Spritze mit dem Überleitungssystem.
·Anschliessend ziehen Sie langsam Cutaquig auf, wobei Sie darauf achten müssen, dass die Kanüle immer in der Lösung bleibt (Abbildung 4).

·Ziehen Sie die Kanüle aus der Durchstechflasche zurück oder lösen Sie die Spritze vom Überleitungssystem.
·Diesen gesamten Vorgang müssen Sie möglicherweise wiederholen, wenn Sie mehrere Durchstechflaschen für die berechnete Dosis benötigen.
·Nach Beendigung des Vorgangs entfernen Sie die Nadel und entsorgen Sie sie in dem Behälter für scharfe Gegenstände.
·Fahren Sie umgehend mit dem nächsten Schritt fort, da die IgG-Lösung sofort verwendet werden soll.
5. Vorbereiten der Injektionspumpe und des Schlauches (optional)
·Befestigen Sie die gefüllte Spritze an die Nadel(n) zur subkutanen Injektion und schieben Sie den Spritzenkolben langsam vor, um den Schlauch mit Cutaquig zu füllen und die Luft zu entfernen (Abbildung 5); die Nadel(n) zur subkutanen Injektion bitte nicht vollständig entlüften.
·Folgen Sie bei der Vorbereitung der Injektionspumpe den Anweisungen des Herstellers.
6. Auswahl der Injektionsstellen und Einstechen der Nadel(n) zur subkutanen Injektion
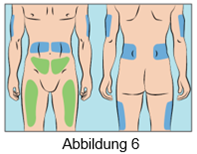
·Cutaquig kann in folgende Bereiche infundiert werden: Bauch, Oberschenkel, Oberarm und/oder seitliche Hüfte (Abbildung 6).
·Der Abstand zwischen den Injektionsstellen sollte mindestens 5 cm betragen.
·Verwenden Sie andere Injektionsstellen als jene, die Sie für die vorangegangene Verabreichung verwendet haben.
·Vermeiden Sie das Einstechen der Nadel in Narben, Tattoos, Dehnungsstreifen oder verletzte/entzündete/rote Hautbereiche.
·Reinigen Sie Ihre Haut an Ihrer/n Injektionsstelle/n mit einem antiseptischen Tupfer und lassen Sie die Haut trocknen.
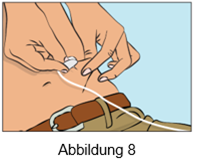
·Drücken Sie die Haut an der Injektionsstelle zwischen Ihrem Daumen und Zeigefinger zusammen (Abbildung 7), entfernen Sie vorsichtig die Nadelabdeckung und stechen Sie die Nadel in die Haut ein (Abbildung 8). Der Winkel der Nadel hängt von der Art der verwendeten Nadel zur subkutanen Injektion ab.

7. Überprüfen der Injektion
·Die Lösung darf nicht in ein Blutgefäss infundiert werden.
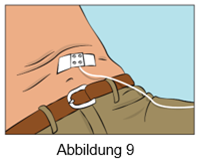
·Befestigen Sie die Nadel über der Injektionsstelle mit sterilem Verbandmull und Klebeband oder einem durchsichtigen Wundverband (Abbildung 9).
8. Beginnen der Injektion
·Beginnen Sie die Injektion. Falls eine Injektionspumpe verwendet wird, befolgen Sie die Anweisungen des Herstellers.
9. Dokumentation der Injektion
·Auf jeder Durchstechflasche mit Cutaquig finden Sie ein abziehbares Etikett mit der Chargennummer. Kleben Sie dieses Etikett in Ihr Behandlungstagebuch. Tragen Sie nach jeder Injektion Dosis, Datum, Zeit, Lage der Injektionsstelle und etwaige Infektionen oder Nebenwirkungen sowie sonstige Kommentare in Zusammenhang mit dieser Injektion ein.
10. Nach Abschluss der Injektion
·Entfernen Sie behutsam die Nadel(n) und werfen Sie sie sofort in den Behälter für scharfe Gegenstände.
·Falls erforderlich, drücken Sie ein kleines Stück Verbandmull auf die Einstichstelle und legen Sie ein Pflaster an.
·Entsorgen Sie alle gebrauchten Einwegmaterialien sowie nicht verwendetes Arzneimittel und die leere(n) Durchstechflasche(n) wie von Ihrer medizinischen Fachkraft empfohlen und entsprechend den nationalen Anforderungen.
Räumen Sie auf und bewahren Sie alle wiederverwendbaren Materialien (z.B. die Injektionspumpe) sicher bis zur nächsten Injektion auf.
Unverbrauchte Arzneimittelreste oder Abfallmaterialien sind nach den lokalen Bestimmungen zu entsorgen.
Zulassungsnummer68222 (Swissmedic)
Packungen6 ml, 12 ml, 24 ml oder 48 ml Lösung in einer Durchstechflasche (Type I Glas) mit einem Brombutyl-Gummistopfen – Packungsgrössen mit 1, 10 oder 20 Durchstechflaschen. (B)
Es werden möglicherweise nicht alle Packungsgrössen in den Verkehr gebracht.
ZulassungsinhaberinOctapharma AG,
Seidenstrasse 2
8853 Lachen
Stand der InformationDezember 2023
|









