ZusammensetzungWirkstoffe
Tirzepatid
Hilfsstoffe
Fertigpen zum einmaligen Gebrauch; Durchstechflasche mit Einzeldosis
Natriummonohydrogenphosphat-Heptahydrat
Natriumchlorid
Salzsäure und Natriumhydroxid (zur Einstellung des pH-Wertes)
Wasser für Injektionszwecke
Gesamt-Natriumgehalt: 1.8-1.9 mg/Dosis
Fertigpen zum mehrmaligen Gebrauch, KwikPen
Natriummonohydrogenphosphat-Heptahydrat
Benzylalkohol 5.4 mg
Glycerol
Phenol
Natriumchlorid
Salzsäure 10% und Natriumhydroxid (zur Einstellung des pH-Wertes)
Wasser für Injektionszwecke
Gesamt-Natriumgehalt: 0.6 mg/Dosis
Indikationen/AnwendungsmöglichkeitenDiabetes mellitus Typ 2
Mounjaro wird zur Behandlung Erwachsener mit unzureichend kontrolliertem Diabetes mellitus Typ 2 ergänzend zu Diät und Bewegung angewendet:
·als Monotherapie bei Kontraindikation oder Unverträglichkeit für Metformin.
·in Kombination mit anderen blutzuckersenkenden Arzneimitteln.
Siehe Abschnitt «Klinische Wirksamkeit» für Ergebnisse zu den in klinischen Studien untersuchten Kombinationen.
Chronische Gewichtsregulierung
Mounjaro wird ergänzend zu einer kalorienreduzierten Ernährung und verstärkten körperlichen Aktivität zur chronischen Gewichtsregulierung angewendet, einschliesslich zur Abnahme und zum Halten des Gewichts, bei Erwachsenen mit einem anfänglichen Body-Mass-Index (BMI) von:
·≥30 kg/m2 (Adipositas) oder
·≥27 kg/m2 bis <30 kg/m2 (Übergewicht) und Vorliegen mindestens einer gewichtsbedingten Begleiterkrankung (z.B. Hypertonie, Dyslipidämie, obstruktive Schlafapnoe, kardiovaskuläre Erkrankung, Prädiabetes oder Diabetes mellitus Typ 2).
Dosierung/AnwendungDie Anfangsdosis von Tirzepatid beträgt einmal wöchentlich 2.5 mg. Nach 4 Wochen wird die Dosis auf 5 mg einmal wöchentlich erhöht. Bei Bedarf kann die Dosis in Schritten von 2.5 mg erhöht werden, nach mindestens 4 Wochen mit der aktuellen Dosis.
Die Höchstdosis beträgt 15 mg einmal wöchentlich.
Wenn Tirzepatid zusätzlich zu einer bestehenden Therapie mit Metformin und/oder einem SGLT2 (Natrium-Glucose-Cotransporter-2) -Inhibitor angewendet wird, kann die Dosis von Metformin und/oder dem SGLT2-Inhibitor beibehalten werden. Wird Tirzepatid zusätzlich zu einem Sulfonylharnstoff oder Insulin gegeben, sollte eine Verringerung der Sulfonylharnstoff- bzw. Insulin-Dosis in Betracht gezogen werden, um das Risiko einer Hypoglykämie zu verringern. Eine Eigenkontrolle des Blutzuckers durch den Patienten ist erforderlich, um die Dosis des Sulfonylharnstoffs oder des Insulins anzupassen. Es wird empfohlen, die Insulindosis schrittweise zu verringern.
Wenn nötig, kann der Tag der wöchentlichen Gabe gewechselt werden, sofern die letzte Dosis mindestens 3 Tage (72 Stunden) zuvor gegeben wurde.
Spezielle Dosierungsanweisungen (siehe auch Rubrik «Pharmakokinetik»)
Dosisanpassungen in Abhängigkeit von, Geschlecht, Abstammung, ethnischer Zugehörigkeit und Körpergewicht sind nicht erforderlich.
Ältere Patienten
Es ist keine Dosisanpassung erforderlich.
Patienten mit Niereninsuffizienz
Es ist keine Dosisanpassung erforderlich, auch bei Nierenerkrankungen im Endstadium ist keine Dosisanpassung erforderlich.
Patienten mit Leberfunktionsstörungen
Es ist keine Dosisanpassung erforderlich.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Tirzepatid bei Kindern und Jugendlichen unter 18 Jahren ist bisher noch nicht nachgewiesen. Es sind keine Daten verfügbar.
Verspätete Dosisgabe
Falls eine Injektion versäumt wurde, sollte sie sobald wie möglich innerhalb von 4 Tagen (96 Stunden) nachgeholt werden. Wenn mehr als 4 Tage vergangen sind, wird die versäumte Dosis ausgelassen, und die nächste Injektion erfolgt am nächsten, normal geplanten Tag. In jedem Fall kann der Patient dann wieder seinen gewohnten wöchentlichen Applikationsrhythmus aufnehmen.
Art der Anwendung
Die Anwendung kann zu jeder Tageszeit erfolgen, unabhängig von den Mahlzeiten.
Mounjaro wird subkutan in Abdomen, Oberschenkel oder Oberarm injiziert.
Die Injektionsstelle soll bei jeder Anwendung geändert werden.
Die Patienten sollten angewiesen werden, die Gebrauchsanweisung in der Packungsbeilage des Fertigpens oder die «Gebrauchsanweisung/Handhabung» in der Packungsbeilage der Durchstechflasche sorgfältig zu lesen, bevor sie sich das Arzneimittel verabreichen.
KontraindikationenÜberempfindlichkeit gegen den Wirkstoff oder einem der Hilfsstoffe
Warnhinweise und VorsichtsmassnahmenPatienten mit medullärem Schilddrüsenkarzinom
Studien mit GLP-1-Rezeptoragonisten und Tirzepatid in Nagern zeigen ein erhöhtes Risiko thyreoidaler C-Zelltumoren (siehe Rubrik «Präklinische Daten»). Eine analoge Erhöhung des Risikos thyreoidaler C-Zell-Tumoren, einschliesslich des medullären Schilddrüsenkarzinoms (medullary thyroid carcinoma, MTC) beim Menschen ist unklar. Patienten mit MTC oder multiplem endokrinem Neoplasie-Syndrom vom Typ 2 (MEN 2) wurden in klinischen Studien mit Tirzepatid nicht untersucht. Diese sollten daher nur nach gründlicher Abwägung des Nutzen-Risiko-Verhältnisses einer Behandlung mit Tirzepatid erhalten.
Akute Pankreatitis
Tirzepatid wurde bei Patienten mit Pankreatitis in der Vorgeschichte nicht untersucht und sollte bei diesen Patienten mit Vorsicht angewendet werden.
Bei Patienten, die mit Tirzepatid behandelt wurden, wurde über akute Pankreatitis berichtet.
Patienten sollten über die charakteristischen Symptome einer akuten Pankreatitis informiert werden. Bei Verdacht auf Pankreatitis sollte Tirzepatid abgesetzt werden. Wird die Diagnose einer Pankreatitis bestätigt, sollte Tirzepatid dauerhaft abgesetzt werden. Eine alleinige Erhöhung der Pankreasenzyme ohne weitere Symptome einer akuten Pankreatitis sagt eine akute Pankreatitis nicht voraus.
Hypoglykämie
Bei Patienten, die Tirzepatid in Kombination mit einem Sulfonylharnstoff oder Insulin verwenden, kann das Risiko einer Hypoglykämie erhöht sein. Das Risiko einer Hypoglykämie kann durch Reduktion der Dosis des Sulfonylharnstoffs bzw. Insulins gesenkt werden.
Gastrointestinale Wirkungen
Die Anwendung von Tirzepatid kann mit gastrointestinalen Nebenwirkungen verbunden sein, zu denen Übelkeit, Erbrechen und Diarrhoe gehören. Diese Ereignisse können zu Dehydratation führen, was zu einer Verschlechterung der Nierenfunktion, einschliesslich akutem Nierenversagen, führen kann. Patienten, die mit Tirzepatid behandelt werden, insbesondere solche mit bereits eingeschränkter Nierenfunktion, sollten darauf hingewiesen werden und Vorkehrungen treffen, um einen Flüssigkeitsmangel zu vermeiden.
Tirzepatid verzögert die Magenentleerung. Pulmonale Aspiration wurde bei Patienten berichtet, die mit lang-wirksamen GLP-1-Rezeptoragonisten behandelt wurden und eine Allgemeinanästhesie oder tiefe Sedierung erhalten haben. Dies soll vor solchen Eingriffen berücksichtigt werden.
Schwere gastrointestinale Erkrankungen
Tirzepatid wurde bei Patienten mit schweren gastrointestinalen Erkrankungen, einschliesslich schwerer Gastroparese, nicht untersucht und sollte bei diesen Patienten mit Vorsicht angewendet werden.
Diabetische Retinopathie
Tirzepatid soll bei Patienten mit nicht-proliferativer diabetischer Retinopathie, die eine Akuttherapie erfordert, sowie bei Patienten mit proliferativer diabetischer Retinopathie oder diabetischem Makulaödem mit Vorsicht und entsprechender Überwachung angewendet werden. Eine zu rasche und starke Absenkung des Blutzuckerspiegels kann insbesondere bei Patienten mit diabetischer Retinopathie initial eine Verschlechterung derselben auslösen.
Akute Erkrankungen der Gallenblase
Ergebnisse klinischer Studien und Postmarketing Daten für GLP-1-Rezeptoragonisten legen ein erhöhtes Risiko für akute Erkrankungen der Gallenblase nahe. In den Placebo-kontrollierten klinischen Studien des Tirzepatid-Entwicklungsprogramms traten solche Ereignisse (Cholelithiasis, Gallenkolik und Cholecystektomie) bei 0.6% der Tirzepatid-behandelten Patienten auf, während in der Placebo Kontrolle keine (0%) Fälle berichtet wurden. Bei Verdacht auf Cholelithiasis sind eine sorgfältige diagnostische Abklärung und entsprechende Nachkontrollen angezeigt.
Hilfsstoffe
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Dosiereinheit, d.h. es ist nahezu «natriumfrei». Mounjaro KwikPen enthält 5.4 mg Benzylalkohol pro Dosiereinheit. Benzylalkohol kann allergische Reaktionen hervorrufen. Grosse Mengen sollten wegen des Risikos der Akkumulation und Toxizität («metabolische Azidose») nur mit Vorsicht und wenn absolut nötig angewendet werden, insbesondere bei Personen mit eingeschränkter Leber- und Nierenfunktion und in der Schwangerschaft und Stillzeit.
InteraktionenTirzepatid verzögert die Magenentleerung, gemessen anhand der Pharmakokinetik von Paracetamol, und hat damit potentiell Auswirkungen auf die Absorption von oral gegebener Begleitmedikation. Dies sollte insbesondere bei gleichzeitig mit Tirzepatid verabreichten Medikamenten, deren Wirksamkeit von Schwellenkonzentrationen abhängt, und solchen mit engem therapeutischem Fenster (z.B. Warfarin, Digoxin) berücksichtigt werden.
Anhand von pharmakokinetischen Modellen auf physiologischer Basis wird nicht erwartet, dass die Behandlung mit Tirzepatid einen klinisch bedeutsamen Einfluss auf oral verabreichte Arzneimittel haben wird (z.B. Warfarin, Metformin, Lisinopril, Metoprolol, Digoxin, Paracetamol, Norelgestromin, Ethinylestradiol, Sitagliptin und Atorvastatin). Dosisanpassungen von gleichzeitig verabreichten oralen Arzneimitteln sind nicht erforderlich.
Paracetamol
Nach einer Einzeldosis Tirzepatid (5 mg) verringerte sich die maximale Paracetamol-Konzentration (Cmax) um 50% und der mittlere Höchstwert der Plasmakonzentration (tmax) wurde eine Stunde später erreicht. Nach gleichzeitiger Verabreichung zeigten sich in Woche 4 keine nennenswerten Auswirkungen auf die Cmax und die tmax von Paracetamol. Die Paracetamol-Gesamtexposition (AUC) wurde nicht beeinflusst. Bei einer gleichzeitigen Verabreichung mit Tirzepatid ist keine Anpassung der Paracetamol-Dosis erforderlich.
Orale Kontrazeptiva
Die Verabreichung kombinierter oraler Kontrazeptiva (0.035 mg Ethinylestradiol plus 0.25 mg Norgestimat, ein Prodrug von Norelgestromin) bei einer Einzeldosis Tirzepatid (5 mg) führte zu einer Verringerung der Cmax und Fläche unter der Konzentrations-Zeit-Kurve (AUC) oraler Kontrazeptiva. Die Cmax von Ethinylestradiol verringerte sich um 59% und die AUC um 20% mit einer Verzögerung des tmax von 4 Stunden. Die Cmax von Norelgestromin verringerte sich um 55% und die AUC um 23% mit einer Verzögerung des tmax von 4.5 Stunden. Die Cmax von Norgestimat verringerte sich um 66% und die AUC um 20% mit einer Verzögerung des tmax von 2.5 Stunden.
Die Anwendung von Tirzepatid kann die Wirksamkeit oraler hormonaler Kontrazeptiva verringern. Bei Empfängnisverhütung mittels oraler hormoneller Kontrazeptiva wird geraten, auf eine nicht-orale Verhütungsmethode zu wechseln oder für mindestens 4 Wochen nach Beginn der Behandlung mit Tirzepatid bzw. nach jeder Dosissteigerung zusätzlich eine Barrieremethode anzuwenden.
Schwangerschaft, StillzeitSchwangerschaft
Es gibt keine oder nur begrenzte Daten zur Anwendung von Tirzepatid bei schwangeren Frauen. Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt (siehe «Präklinische Daten»). Tirzepatid sollte während der Schwangerschaft nicht angewendet werden. Frauen im gebärfähigen Alter wird empfohlen, während der Behandlung mit Tirzepatid zu verhüten. Tirzepatid soll nicht zur Gewichtsabnahme während der Schwangerschaft verwendet werden.
Stillzeit
Es ist nicht bekannt, ob Tirzepatid in die Muttermilch ausgeschieden wird. Ein Risiko für das gestillte Kind kann nicht ausgeschlossen werden.
Es muss entschieden werden, ob das Stillen oder die Anwendung von Tirzepatid beendet werden soll, unter Berücksichtigung des Nutzens des Stillens für das Kind und des Nutzens der Therapie für die Frau.
Fertilität
Die Wirkungen von Tirzepatid auf die menschliche Fertilität sind nicht bekannt.
Studien mit Tirzepatid bei Tieren zeigten keine direkten schädigenden Wirkungen auf die Fertilität. Bei weiblichen Ratten gab es indirekte Effekte auf die Fertilität (siehe «Präklinische Daten»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs wurden keine Studien zu den Auswirkungen auf die Fahrtüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt. Wenn Tirzepatid in Kombination mit Sulfonylharnstoff oder Insulin angewendet wird, müssen Patienten angewiesen werden, bei der Teilnahme am Strassenverkehr oder während des Bedienens von Maschinen Massnahmen zur Hypoglykämievermeidung zu ergreifen.
Unerwünschte WirkungenZusammenfassung des Sicherheitsprofils
Diabetes mellitus Typ 2
In 7 abgeschlossenen Studien der Phase 3 hatten 5'119 Patienten Tirzepatid allein oder in Kombination mit anderen blutzuckersenkenden Arzneimitteln erhalten. Die am häufigsten in klinischen Studien berichteten unerwünschten Wirkungen waren gastrointestinale Störungen einschliesslich Übelkeit, Diarrhoe und Erbrechen. Diese Reaktionen waren im Allgemeinen leicht oder mittelschwer ausgeprägt, traten während der Dosissteigerung häufiger auf und nahmen im Laufe der Zeit ab.
Chronische Gewichtsregulierung
In 2 abgeschlossenen Studien der Phase 3 hatten 2'519 Patienten Tirzepatid allein oder in Kombination mit anderen blutzuckersenkenden Arzneimitteln erhalten. Die am häufigsten berichteten Nebenwirkungen waren gastrointestinale Störungen einschliesslich Übelkeit (sehr häufig), Diarrhoe (sehr häufig), Obstipation (sehr häufig) und Erbrechen (sehr häufig). Diese Reaktionen waren im Allgemeinen leicht oder mittelschwer ausgeprägt, traten während der Dosissteigerung häufiger auf und nahmen im Laufe der Zeit ab.
Liste der unerwünschten Wirkungen
Bei Auswertungen der klinischen Studien wurden die folgenden unerwünschten Wirkungen festgestellt und in MedDRA Terminologie nach Systemorganklasse und mit abnehmender Häufigkeit aufgeführt (sehr häufig: ≥1/10; häufig: ≥1/100 bis <1/10; gelegentlich: ≥1/1000 bis <1/100; selten: ≥1/10'000 bis <1/1000; sehr selten: <1/10'000).
Erkrankungen des Immunsystems
Häufig: Überempfindlichkeitsreaktionen
Stoffwechsel- und Ernährungsstörungen
Häufig: verminderter Appetita
Hypoglykämie bei Patienten mit Diabetes mellitus Typ 2b
Sehr häufig:
Hypoglykämieb bei gleichzeitiger Anwendung von Sulfonylharnstoff oder Insulin:
·Mit Sulfonylharnstoff (10-14%).
·Mit basalem Insulin (14-19%).
Häufig:
Hypoglykämieb bei Anwendung mit Metformin und SGLT2ic
Gelegentlich:
Hypoglykämieb bei Anwendung mit Metformin
Erkrankungen des Nervensystems
Häufig: Schwindeld
Gelegentlich: Dysgeusie
Gefässerkrankungen
Häufig: Hypotonied
Erkrankungen des Gastrointestinaltrakts
Sehr häufig: Übelkeit (18-28%), Diarrhoe (15-21%), Obstipationd (13.6%), Erbrechend (10.8%)
Häufig: abdominale Schmerzen, Erbrechena, Dyspepsie, Obstipationa, Meteorismus, Aufstossen, Flatulenz, gastroösophagealer Reflux
Gelegentlich: verzögerte Magenentleerung
Erkrankungen der Haut und des Unterhautgewebes
Häufig: Haarausfalld
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Müdigkeit, Reaktionen an der Injektionsstelle
a Nur in der Indikation Diabetes mellitus Typ 2
b Eine klinisch relevante Hypoglykämie wurde definiert als eine Blutglucose <3.0 mmol/l (<54 mg/dl) oder schwere Hypoglykämie (erfordert die Hilfe einer anderen Person)
c Natrium-Glucose Cotransporter-Inhibitor
d Nur in der Indikation chronische Gewichtsregulierung
Die folgenden Nebenwirkungen basieren auf Spontanberichten nach der Markteinführung von Tirzepatid:
Erkrankungen des Immunsystems
Selten: Anaphylaktische Reaktion und Angioödeme
Leber- und Gallenerkrankungen
Gelegentlich: Cholelithiasis und Cholezystitis.
Beschreibung spezifischer unerwünschter Wirkungen und Zusatzinformationen
Überempfindlichkeitsreaktionen
Überempfindlichkeitsreaktionen auf Tirzepatid wurden in den placebokontrollierten Studien zu Diabetes mellitus Typ 2 berichtet. Die Reaktionen waren gelegentlich schwerwiegend (z.B. Urtikaria und Ekzem).
Überempfindlichkeitsreaktionen wurden bei 3.2% der Patienten, die mit Tirzepatid behandelt wurden, und bei 1.7% der Patienten, die ein Placebo erhielten, berichtet.
Überempfindlichkeitsreaktionen mit Tirzepatid wurden in den placebokontrollierten Studien zur chronischen Gewichtsregulierung berichtet. Die Reaktionen waren manchmal schwer (z.B. Dermatitis und Hautausschlag). Überempfindlichkeitsreaktionen wurden bei 5.1% der Patienten mit Tirzepatid im Vergleich zu 3.1% der Patienten mit Placebo berichtet.
Hypoglykämie bei Patienten mit Diabetes mellitus Typ 2
Das Risiko einer schweren Hypoglykämie unter Tirzepatid ist gering. In klinischen Studien berichteten 10 (0.20%) Patienten über 12 Episoden einer schweren Hypoglykämie. Von diesen 10 Patienten hatten 5 (0.10%) im Hintergrund Insulin glargin oder Sulfonylharnstoff erhalten und berichteten jeweils 1 Episode.
Klinisch relevante Hypoglykämie trat bei 10 bis 14% (0.14 bis 0.16 Ereignisse/Patientenjahr) der Patienten auf, wenn Tirzepatid zusätzlich zu Sulfonylharnstoff angewendet wurde, und bei 14 bis 19% (0.43 bis 0.64 Ereignisse/Patientenjahr) der Patienten, wenn Tirzepatid zusätzlich zu Basalinsulin angewendet wurde.
Die Rate klinisch relevanter Hypoglykämien unter Tirzepatid bei Anwendung als Monotherapie oder als Zusatz zu anderen oralen Antidiabetika betrug bis zu 0.03 Ereignisse/Patientenjahr.
Gastrointestinale Nebenwirkungen
Gastrointestinale Ereignisse waren meist leicht oder mittelschwer. Das Auftreten von Übelkeit, Erbrechen und Diarrhoe war in der Phase der Dosissteigerung höher und nahm im Laufe der Zeit ab.
Immunogenität
Die beobachtete Inzidenz von Anti-Drug-Antikörpern (ADA) hängt stark von der Sensitivität und Spezifität des Assays ab. Unterschiede in den Testmethoden schliessen aussagekräftige Vergleiche der Inzidenz von ADAs in den unten beschriebenen Studien mit der Inzidenz von ADAs in anderen Studien aus, einschliesslich solchen mit Tirzepatid oder Glukagon-like Peptid-1 (GLP-1)-Rezeptor-Agonisten.
Diabetes mellitus Typ 2
In sieben klinischen Studien Phase 3 entwickelten 2'570 (51.1%) mit Tirzepatid behandelte Patienten gegen das Arzneimittel gerichtete Antikörper (ADAs). In diesen Studien zeigte die ADA-Bildung bei 34% bzw. 14% der mit Tirzepatid behandelten Patienten eine Kreuzreaktivität mit nativem Glucose-abhängigem insulinotropem Polypeptid (GIP) bzw. nativem GLP-1.
Von den 2'570 mit Tirzepatid behandelten Patienten hatten 1.9% und 2.1% neutralisierende Antikörper, die sich gegen die Aktivität von Tirzepatid an GIP und GLP-1-Rezeptoren richteten, und 0.9% bzw. 0.4% wiesen neutralisierende Antikörper gegen natives GIP bzw. GLP-1 auf. Es gab keine Hinweise auf ein verändertes pharmakokinetisches Profil oder einen Einfluss auf die Wirksamkeit im Zusammenhang mit der Entwicklung von ADA.
Bei mit Tirzepatid behandelten Patienten, die Anti-Tirzepatid-Antikörper entwickelten, traten häufiger Überempfindlichkeitsreaktionen oder Reaktionen an der Injektionsstelle auf als bei Patienten, die keine solchen Antikörper entwickelten.
Chronische Gewichtsregulierung
Über 2 klinische Studien Phase 3 hinweg entwickelten 64.5% der Patienten mit Adipositas oder Übergewicht ADAs. Von den mit Tirzepatid behandelten Patienten mit Adipositas oder Übergewicht hatten 2.8% und 2.7% neutralisierende Antikörper, die sich gegen die Aktivität von Tirzepatid an GIP- und GLP-1 Rezeptoren richteten, 0.8% und 0.1% hatten neutralisierende Antikörper gegen natives GIP bzw. GLP-1.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungIm Fall einer Überdosierung ist eine angemessene, unterstützende Behandlung einzuleiten, die sich an der klinischen Symptomatik des Patienten orientiert. Unter Berücksichtigung der Halbwertszeit von Tirzepatid (ungefähr 5 Tage) kann die Beobachtung und Behandlung dieser Symptome über einen Zeitraum erforderlich sein.
Eigenschaften/WirkungenATC-Code
A10BX16
Wirkungsmechanismus
Diabetes mellitus Typ 2 und chronische Gewichtsregulierung
Tirzepatid ist ein langwirksamer GIP- und GLP-1-Rezeptor-Agonist. Es besteht aus einer Aminosäurekette und einer C20-Fett-di-Säureeinheit, die die Albuminbindung ermöglicht und die Halbwertszeit verlängert.
Tirzepatid bindet hochselektiv an humane GIP- und GLP-1-Rezeptoren und hat eine hohe Affinität zu GIP- und GLP-1-Rezeptoren. Die Aktivität von Tirzepatid am GIP-Rezeptor ist ähnlich dem nativen GIP-Hormon. Die Aktivität von Tirzepatid am GLP-1-Rezeptor ist niedriger im Vergleich zu nativem GLP-1-Hormon.
Tirzepatid verbessert die Insulinsensitivität.
Tirzepatid verringert die Nahrungsaufnahme.
Diabetes mellitus Typ 2
Tirzepatid erhöht die Glucoseempfindlichkeit der β-Zellen. Es verbessert die erste und zweite Phase der Insulinausschüttung und senkt die Plasmaglukagonkonzentrationen, beides in Abhängigkeit der Glucosekonzentration.Tirzepatid verzögert die Magenentleerung, diese Wirkung lässt mit der Zeit nach.
Chronische Gewichtsregulierung
GIP- und GLP-1-Rezeptoren wurden beide in Gehirnregionen gefunden, die wichtig für die Appetitregulierung sind.
Tirzepatid reguliert den Appetit und verringert die Nahrungsaufnahme. Tirzepatid senkt das Körpergewicht und die Körperfettmasse.
Tierstudien haben gezeigt, dass Tirzepatid die Fettverwertung moduliert.
Pharmakodynamik
Glykämische Kontrolle
Tirzepatid verbessert die glykämische Kontrolle durch Senkung der nüchtern und postprandial gemessenen Glucosekonzentration bei Patienten mit Diabetes mellitus Typ 2 über verschiedene Mechanismen.
Nüchternblutzuckerspiegel
Die Behandlung mit Tirzepatid führte zu signifikanten Senkungen des Nüchternblutzuckerspiegels im Vergleich zum Ausgangswert (die Differenz zwischen dem Ausgangswert und Endwert betrug -2.4 mmol/L bis -3.8 mmol/L). Ab einem Zeitraum von zwei Wochen zeigten sich signifikante Senkungen des Nüchternblutzuckerspiegels im Vergleich zum Ausgangswert. Die Verbesserung des Nüchternblutzuckerspiegels setzte sich während der längsten Studiendauer von 104 Wochen fort.
Postprandialer Blutzuckerspiegel
Die Behandlung mit Tirzepatid führte zu signifikanten Senkungen des durchschnittlichen postprandialen Blutzuckerspielgels 2 Stunden nach der Verabreichung (Durchschnitt der drei Mahlzeiten pro Tag), im Vergleich zum Ausgangswert (die Differenz zwischen dem Ausgangswert und Endwert betrug -3.35 mmol/L bis -4.85 mmol/L)
Insulinsekretion
In einer hyperglykämischen Clamp-Studie bei Patienten mit Diabetes mellitus Typ 2 wurde die Insulinsekretion unter Tirzepatid mit Placebo und dem selektiven GLP-1-Rezeptoragonist Semaglutide 1 mg verglichen. Tirzepatid 15 mg verbesserte die Rate für die erste und zweite Phase der Insulinsekretion um 466% und 302% gegenüber dem Ausgangswert. Unter Placebo veränderte sich die Rate für die erste und zweite Phase der Insulinsekretion nicht, und unter Semaglutide 1 mg stiegen die Raten um 298% bzw. 223%.
Insulinsensitivität
Tirzepatid 15 mg verbesserte die Insulinempfindlichkeit des gesamten Körpers um 63%, gemessen anhand des M-Wert, ein Mass für die Glucoseaufnahme in das Gewebe unter Verwendung eines hyperinsulinämischen euglykämischen Clamp. Der M-Wert blieb unter Placebo unverändert und erhöhte sich unter Semaglutide 1 mg um 35%.
Tirzepatid senkt das Körpergewicht bei Patienten mit Adipositas und Übergewicht und bei Patienten mit Diabetes mellitus Typ 2 (unabhängig vom Körpergewicht), was zur Verbesserung der Insulinsensitivität beitragen kann. Die reduzierte Nahrungsaufnahme unter Tirzepatid trägt zur Gewichtsabnahme bei. Die Gewichtsabnahme ist überwiegend auf eine reduzierte Fettmasse zurückzuführen.
Glukagon-Konzentration
Tirzepatid reduzierte die nüchtern und postprandial gemessenen Glukagonkonzentrationen. Tirzepatid 15 mg reduzierte die nüchtern gemessene Glukagonkonzentration um 28% und die AUC von Glucagon nach einer gemischten Mahlzeit um 43%, verglichen mit keiner Veränderung unter Placebo und einer Abnahme des nüchtern gemessenen Glukagons unter Semaglutide 1 mg um 22% und der AUC von Glukagon um 29%.
Magenentleerung
Tirzepatid verzögert die Magenentleerung, dies kann die Glucoseabsorption nach einer Mahlzeit verlangsamen und zu einer günstigen Wirkung auf die postprandiale Glykämie führen. Tirzepatid verlangsamt die Glucoseabsorption nach einer Mahlzeit und reduziert dabei die postprandialen Glucosekonzentrationen. Die Verzögerung ist nach der ersten Anwendung am grössten; diese Wirkung lässt mit der Zeit nach. Die Reduktion der postprandialen Glucosekonzentrationen war bei Menschen mit Diabetes mellitus Typ 2 deutlicher als bei Menschen mit Adipositas oder Übergewicht, ohne Diabetes mellitus Typ 2.
Pankreasenzyme
Diabetes mellitus Typ 2
In den placebokontrollierten Studien Phase 3 führte die Behandlung mit Tirzepatid zu einem mittleren Anstieg der Pankreas-Amylase um 33% bis 38% und der Lipase um 31% bis 42% gegenüber dem Ausgangswert. Patienten unter Placebo zeigten einen Anstieg der Amylase um 4% gegenüber dem Ausgangswert und es wurden keine Veränderungen der Lipase beobachtet. Eine alleinige Erhöhung der Pankreasenzyme ohne weitere Symptome einer akuten Pankreatitis sagt eine akute Pankreatitis nicht voraus.
Chronische Gewichtsregulierung
Die Behandlung mit Tirzepatid führte zu einem mittleren Anstieg der Pankreas-Amylase von 20% bis 25% und der Lipase von 28% bis 35% gegenüber dem Ausgangswert.
Kardiale Elektrophysiologie (QTc Intervalle)
Bei einer Dosierung von bis zu 15 mg führt Tirzepatid nicht zu einer Verlängerung der QTc-Intervalle.
Klinische Wirksamkeit
Diabetes mellitus Typ 2
Glykämische Kontrolle und Körpergewicht
Die Sicherheit und Wirksamkeit von Tirzepatid wurden in fünf globalen, randomisierten, kontrollierten Phase 3 Studien (SURPASS 1-5) untersucht, welche insgesamt 6'263 Patienten mit Typ 2 Diabetes einschlossen, von denen 4'199 mit Tirzepatid behandelt wurden. Primärer Endpunkt für den Nachweis der glykämischen Wirksamkeit war die Änderung (Senkung) des HbA1c. Massgebliche Sekundärendpunkte waren die Änderung (Senkung) des Körpergewichts und der Nüchtern-Serumglucose (fasting serum glucose, FSG) sowie der Anteil der Patienten, die den Zielwert für den HbA1c erreichten (Responderrate). Alle Studien untersuchten Tirzepatid 5, 10 und 15 mg, wobei folgendes Titrationsschema angewendet wurde. Die Initialdosis betrug 2.5 mg pro Woche und konnte jeweils nach 4 Wochen um 2.5 mg erhöht werden, bis zum Erreichen der zugeordneten Zieldosis (5, 10 oder 15 mg).
Die Behandlung mit Tirzepatid bewirkte in allen Studien eine gegenüber dem Vergleichsarm (Placebo, Semaglutide, Insulin degludec oder Insulin glargin) überlegene Senkung des HbA1c und des Körpergewichts über einen Behandlungszeitraum von 40 – 104 Wochen. Die Ergebnisse der einzelnen Studien werden im Folgenden basierend auf einer modifizierten Intent-to-Treat (mITT) Population (alle randomisierten Patienten, welche ≥1 Dosis der Studienmedikation erhielten, ausgenommen solche, die die Behandlung aufgrund eines irrtümlichen Einschlusses beendeten) detailliert beschrieben. Zur Schätzung der Wirksamkeit wurde ein gemischtes Modell für wiederholte Messungen verwendet.
SURPASS 1 – Monotherapie
In einer über 40 Wochen durchgeführten, doppelblinden, placebokontrollierten Studie erhielten 478 Patienten (mittleres Alter zu Studienbeginn ~54 Jahre) mit einer unter Diät und Bewegung unzureichenden glykämischen Kontrolle (mittlerer HbA1c zu Studienbeginn ~7.94%) randomisiert Tirzepatid 5 mg, 10 mg oder 15 mg einmal wöchentlich oder Placebo. Die mittlere Diabetesdauer der Patienten zu Studienbeginn betrug ca. 4.7 Jahre.
Tabelle 1. SURPASS 1: Ergebnisse in Woche 40
|
|
Tirzepatid
5 mg
|
Tirzepatid
10 mg
|
Tirzepatid
15 mg
|
Placebo
| |
mITT Population (n)
|
121
|
121
|
120
|
113
| |
HbA1c (%)
|
Ausgangswert
(Mittel)
|
7.97
|
7.88
|
7.88
|
8.08
| |
|
Veränderung gegenüber Ausgangswert
|
-1.87##
|
-1.89##
|
-2.07##
|
+0.04
| |
|
Unterschied gegenüber Placebo [95% CI]
|
-1.91**
[-2.18, -1.63]
|
-1.93**
[-2.21, -1.65]
|
-2.11**
[-2.39, -1.83]
|
-
| |
HbA1c (mmol/mol)
|
Ausgangswert
(Mittel)
|
63.6
|
62.6
|
62.6
|
64.8
| |
|
Veränderung gegenüber Ausgangswert
|
-20.4##
|
-20.7##
|
-22.7##
|
+0.4
| |
|
Unterschied gegenüber Placebo [95% CI]
|
-20.8**
[-23.9, -17.8]
|
-21.1**
[-24.1, -18.0]
|
-23.1**
[-26.2, -20.0]
|
-
| |
Patienten (%) mit erreichtem Ziel-HbA1c
|
<7%
|
86.8**
|
91.5**
|
87.9**
|
19.6
| |
|
≤6.5%
|
81.8††
|
81.4††
|
86.2††
|
9.8
| |
|
<5.7%
|
33.9**
|
30.5**
|
51.7**
|
0.9
| |
Körpergewicht (kg)
|
Ausgangswert
(Mittel)
|
87.0
|
85.7
|
85.9
|
84.4
| |
|
Veränderung gegenüber Ausgangswert
|
-7.0##
|
-7.8##
|
-9.5##
|
-0.7
| |
|
Unterschied gegenüber Placebo [95% CI]
|
-6.3**
[-7.8, -4.7]
|
-7.1**
[-8.6, -5.5]
|
-8.8**
[-10.3, -7.2]
|
-
|
* p <0.05, ** p <0.001 für die Überlegenheit, bereinigt für Multiplizität.
† p <0.05, †† p <0.001 im Vergleich zu Placebo, nicht auf Multiplizität bereinigt.
#p <0.05, ## p <0.001 im Vergleich zum Ausgangswert, nicht auf Multiplizität bereinigt.
SURPASS 2 - Kombinationstherapie mit Metformin
In einer über 40 Wochen durchgeführten, aktiv kontrollierten, offenen Studie (doppelblind in Bezug auf die zugeordnete Dosis von Tirzepatid) erhielten 1'879 Patienten randomisiert Tirzepatid 5 mg, 10 mg oder 15 mg einmal wöchentlich oder Semaglutide 1 mg einmal wöchentlich, alle in Kombination mit Metformin. Die mittlere Diabetesdauer der Patienten zu Studienbeginn betrug 9 Jahre.
Tabelle 2. SURPASS 2: Ergebnisse in Woche 40
|
|
Tirzepatid
5 mg
|
Tirzepatid
10 mg
|
Tirzepatid
15 mg
|
Semaglutide
1 mg
| |
mITT Population (n)
|
470
|
469
|
469
|
468
| |
HbA1c (%)
|
Ausgangswert
(Mittel)
|
8.33
|
8.31
|
8.25
|
8.24
| |
|
Veränderung gegenüber Ausgangswert
|
-2.09##
|
-2.37##
|
-2.46##
|
-1.86##
| |
|
Unterschied gegenüber Semaglutide [95% CI]
|
-0.23**
[-0.36, -0.10]
|
-0.51**
[-0.64, -0.38]
|
-0.60**
[-0.73, -0.47]
|
-
| |
HbA1c (mmol/mol)
|
Ausgangswert
(Mittel)
|
67.5
|
67.3
|
66.7
|
66.6
| |
|
Veränderung gegenüber Ausgangswert
|
-22.8##
|
-25.9##
|
-26.9##
|
-20.3
| |
|
Unterschied gegenüber Semaglutide [95% CI]
|
-2.5**
[-3.9, -1.1]
|
-5.6**
[-7,0 -4.1]
|
-6.6**
[-8,0 -5.1]
|
N/A
| |
Patienten (%) mit erreichtem Ziel-HbA1c
|
<7%
|
85.5*
|
88.9**
|
92.2**
|
81.1
| |
|
≤6.5%
|
74.0†
|
82.1††
|
87.1††
|
66.2
| |
|
<5.7%
|
29.3††
|
44.7**
|
50.9**
|
19.7
| |
Körpergewicht (kg)
|
Ausgangswert
(Mittel)
|
92.6
|
94.9
|
93.9
|
93.8
| |
|
Veränderung gegenüber Ausgangswert
|
-7.8##
|
-10.3##
|
-12.4##
|
-6.2##
| |
|
Unterschied gegenüber Semaglutide [95% CI]
|
-1.7**
[-2.6, -0.7]
|
-4.1**
[-5.0, -3.2]
|
-6.2**
[-7.1, -5.3]
|
-
|
* p <0.05, ** p <0.001 für die Überlegenheit, bereinigt für Multiplizität.
† p <0.05, †† p <0.001 im Vergleich zu Semaglutide 1 mg, nicht bereinigt für Multiplizität.
# p <0.05, ## p <0.001 im Vergleich zum Ausgangswert, nicht bereinigt für Multiplizität.
SURPASS 3 – In Kombination zu Metformin mit oder ohne SGLT2i
In einer über 52 Wochen durchgeführten, aktiv kontrollierten, offenen Studie erhielten 1'444 Patienten randomisiert Tirzepatid 5 mg, 10 mg oder 15 mg einmal wöchentlich oder Insulin degludec, alle in Kombination mit Metformin mit oder ohne SGLT2i. Zu Studienbeginn erhielten 32% der Patienten SGLT2i. Patienten unter Insulin degludec starteten mit einer Dosis von 10 E/Tag und nachfolgender Anpassung anhand eines Algorithmus mit dem Ziel eines Nüchternblutzucker <5 mmol/l. Die mittlere Diabetesdauer der Patienten zu Studienbeginn betrug 8 Jahre.
Tabelle 3. SURPASS 3: Ergebnisse in Woche 52
|
|
Tirzepatid
5 mg
|
Tirzepatid
10 mg
|
Tirzepatid
15 mg
|
Insulin degludeca
titriert
| |
mITT Population (n)
|
358
|
360
|
358
|
359
| |
HbA1c (%)
|
Ausgangswert (Mittel)
|
8.17
|
8.19
|
8.21
|
8.13
| |
|
Veränderung gegenüber Ausgangswert
|
-1.93##
|
-2.20##
|
-2.37##
|
-1.34##
| |
|
Unterschied gegenüber Insulin degludec [95% CI]
|
-0.59**
[-0.73, -0.45]
|
-0.86**
[-1.00, -0.72]
|
-1.04**
[-1.17, -0.90]
|
-
| |
HbA1c (mmol/mol)
|
Ausgangswert (Mittel)
|
65.8
|
66.0
|
66.3
|
65.4
| |
|
Veränderung gegenüber Ausgangswert
|
-21.1##
|
-24.0##
|
-26.0##
|
-14.6##
| |
|
Unterschied gegenüber Insulin degludec [95% CI]
|
-6.4**
[-7.9, -4.9]
|
-9.4**
[-10.9, -7.9]
|
-11.3**
[-12.8, -9.8]
|
-
| |
Patienten (%) mit erreichtem Ziel-HbA1c
|
<7%
|
82.4**
|
89.7**
|
92.6**
|
61.3
| |
|
≤6.5%
|
71.4††
|
80.3††
|
85.3††
|
44.4
| |
|
<5.7%
|
25.8††
|
38.6††
|
48.4††
|
5.4
| |
Körpergewicht (kg)
|
Ausgangswert (Mittel)
|
94.5
|
94.3
|
94.9
|
94.2
| |
|
Veränderung gegenüber Ausgangswert
|
-7.5##
|
-10.7##
|
-12.9##
|
+2.3##
| |
|
Unterschied gegenüber Insulin degludec [95% CI]
|
-9.8**
[-10.8, -8.8]
|
-13.0**
[-14.0, -11.9]
|
-15.2**
[-16.2, -14.2]
|
-
|
a Die mittlere Dosis von Insulin degludec in Woche 52 betrug 49 Einheiten/Tag.
* p <0.05, ** p <0.001 für die Überlegenheit, bereinigt für Multiplizität.
† p <0.05, †† p <0.001 im Vergleich zu Insulin degludec, nicht bereinigt für Multiplizität.
# p <0.05, ## p <0.001 im Vergleich zum Ausgangswert, nicht bereinigt für Multiplizität.
Kontinuierliche Glucoseüberwachung (CGM)
Eine Untergruppe von Patienten (N=243) nahm an einer Auswertung der 24-Stunden-Glucoseprofile teil, die mit verblindetem CGM erfasst wurden. In Woche 52 verbrachten Patienten unter Tirzepatid (10 mg und 15 mg kombiniert ausgewertet) signifikant mehr Zeit im euglykämischen Bereich, definiert als Glucosewerte zwischen 71 bis 140 mg/dl (3.9 bis 7.8 mmol/l), im Vergleich zu Patienten unter Insulin degludec, mit 73% versus 48% des 24-Stunden-Zeitraums im Bereich.
Nach 52 Wochen verbrachten Patienten aller 3 Tirzepatid Dosierungen einen grösseren Teil des 24-Stunden-Zeitraums mit einem Blutzuckerspiegel im Bereich von 71 bis 180 mg/dl (3.9 bis 10.0 mmol/l) im Vergleich zu Patienten unter Insulin degludec: Tirzepatid (Bereich): 84.9% bis 91.2%; Insulin degludec, 75.0%.
Leberfettgehalt (liver fat content, LFC) und Fettgewebe
Eine Untergruppe von Patienten (N=296) nahm an einer Beurteilung von LFC, viszeralem Fettgewebe (visceral adipose tissue, VAT) und abdominalem subkutanem Fettgewebe (abdominal subcutaneous adipose tissue, ASAT) teil, die anhand von Magnetresonanztomographie beurteilt wurden. In Woche 52 zeigten Patienten unter Tirzepatid (10 mg und 15 mg kombiniert ausgewertet) eine statistisch signifikant grössere mittlere Reduktion des LFC im Vergleich zu Insulin degludec, -8.09% versus -3.38%, ausgehend von 15.67% und 16.58% zu Studienbeginn. Patienten unter Tirzepatid 5 mg, 10 mg und 15 mg zeigten eine signifikant grössere Reduktion des Volumens von VAT (-1.10, -1.53 bzw. -1.65 l) und ASAT (-1.40, -2.25 bzw. -2.05 l) gegenüber den Gesamt-Ausgangswerten von 6.6 l bzw. 10.4 l, jeweils nach 52 Wochen, im Vergleich zu einem Anstieg unter Insulins degludec (0.38 und 0.63 l).
SURPASS 4 – In Kombination mit 1-3 oralen Antidiabetika (Metformin, Sulfonylharnstoffe oder SGLT2i)
In einer aktiv kontrollierten, offenen Studie über einen Zeitraum von bis zu 104 Wochen (primärer Endpunkt nach 52 Wochen) wurden 2'002 Patienten mit Diabetes mellitus Typ 2 und erhöhtem kardiovaskulären Risiko randomisiert auf Tirzepatid 5 mg, 10 mg oder 15 mg einmal wöchentlich oder Insulin glargin einmal täglich bei Hintergrund mit Metformin (95%) und/oder Sulfonylharnstoffen (54%) und/oder SGLT2i (25%). Patienten, die mit Insulin glargin behandelt wurden, begannen mit einer Dosis von 10 E/Tag und nachfolgender Anpassung anhand eines Algorithmus mit dem Ziel eines Nüchternblutzuckers von <5.6 mmol/l. Die mittlere Diabetesdauer der Patienten zu Studienbeginn betrug 12 Jahre.
Tabelle 4. SURPASS 4: Ergebnisse in Woche 52
|
|
Tirzepatid
5 mg
|
Tirzepatid
10 mg
|
Tirzepatid
15 mg
|
Insulin glargina
titriert
| |
mITT Population (n)
|
328
|
326
|
337
|
998
| |
52 Wochen
| |
HbA1c (%)
|
Ausgangswert (Mittel)
|
8.52
|
8.60
|
8.52
|
8.51
| |
|
Veränderung gegenüber Ausgangswert
|
-2.24##
|
-2.43##
|
-2.58##
|
-1.44##
| |
|
Unterschied gegenüber Insulin glargin [95% CI]
|
-0.80**
[-0.92, -0.68]
|
-0.99**
[-1.11, -0.87]
|
-1.14**
[-1.26, -1.02]
|
-
| |
HbA1c (mmol/mol)
|
Ausgangswert (Mittel)
|
69.6
|
70.5
|
69.6
|
69.5
| |
|
Veränderung gegenüber Ausgangswert
|
-24.5##
|
-26.6##
|
-28.2##
|
-15.7##
| |
|
Unterschied gegenüber Insulin glargin [95% CI]
|
-8.8**
[-10.1, -7.4]
|
-10.9**
[-12.3, -9.6]
|
-12.5**
[-13.8, -11.2]
|
-
| |
Patienten (%) mit erreichtem Ziel-HbA1c
|
<7%
|
81.0**
|
88.2**
|
90.7**
|
50.7
| |
|
≤6.5%
|
66.0††
|
76.0††
|
81.1††
|
31.7
| |
|
<5.7%
|
23.0††
|
32.7††
|
43.1††
|
3.4
| |
Körpergewicht (kg)
|
Ausgangswert (Mittel)
|
90.3
|
90.7
|
90.0
|
90.3
| |
|
Veränderung gegenüber Ausgangswert
|
-7.1##
|
-9.5##
|
-11.7##
|
+1.9##
| |
|
Unterschied gegenüber Insulin glargin [95% CI]
|
-9.0**
[-9.8, -8.3]
|
-11.4**
[-12.1, -10.6]
|
-13.5**
[-14.3, -12.8]
|
-
|
a Die mittlere Dosis von Insulin glargin in Woche 52 betrug 44 Einheiten/Tag.
* p <0.05, ** p <0.001 für die Überlegenheit, bereinigt für Multiplizität.
† p <0.05, †† p <0.001 im Vergleich zu Insulin glargin, nicht bereinigt für Multiplizität.
# p <0.05, ## p <0.001 im Vergleich zum Ausgangswert, nicht bereinigt für Multiplizität.
SURPASS 5 – Als Add-on zu Basalinsulin mit oder ohne Metformin
In einer über 40 Wochen durchgeführten, doppelblinden, placebokontrollierten Studie wurden 475 Patienten mit unzureichender glykämischer Kontrolle unter Insulin glargin mit oder ohne Metformin randomisiert auf Tirzepatid 5 mg, 10 mg oder 15 mg einmal wöchentlich oder Placebo. Die Dosis von Insulin glargin wurde angepasst anhand eines Algorithmus mit dem Ziel eines Nüchternblutzuckers von <5.6 mmol/l. Bei Patienten mit einem HbA1c-Wert von ≤8.0% wurde die Dosis von Insulin glargin innerhalb der ersten Woche (bis zur Verabreichung der zweiten Tirzepatid-Dosis) um 20% reduziert. Bei Patienten mit einem HbA1c-Ausgangswert von >8.0% wurde die Dosis von Insulin glargin nicht verringert. Die mittlere Diabetesdauer der Patienten zu Studienbeginn betrug 13 Jahre.
Tabelle 5. SURPASS 5: Ergebnisse in Woche 40
|
|
Tirzepatid
5 mg
|
Tirzepatid
10 mg
|
Tirzepatid
15 mg
|
Placeboa
| |
mITT Population (n)
|
116
|
118
|
118
|
119
| |
HbA1c (%)
|
Ausgangswert
(Mittel)
|
8.29
|
8.34
|
8.22
|
8.39
| |
|
Veränderung gegenüber Ausgangswert
|
-2.23##
|
-2.59##
|
-2.59##
|
-0.93##
| |
|
Unterschied gegenüber Placebo [95% CI]
|
-1.30**
[-1.52, -1.07]
|
-1.66**
[-1.88, -1.43]
|
-1.65**
[-1.88, -1.43]
|
-
| |
HbA1c (mmol/mol)
|
Ausgangswert
(Mittel)
|
67.1
|
67.7
|
66.4
|
68.2
| |
|
Veränderung gegenüber Ausgangswert
|
-24.4##
|
-28.3##
|
-28.3##
|
-10.2##
| |
|
Unterschied gegenüber Placebo [95% CI]
|
-14.2**
[-16.6, -11.7]
|
-18.1**
[-20.6, -15.7]
|
-18.1**
[-20.5, -15.6]
|
-
| |
Patienten (%) mit erreichtem Ziel-HbA1c
|
<7%
|
93.0**
|
97.4**
|
94.0**
|
33.9
| |
|
≤6.5%
|
80.0††
|
94.7††
|
92.3††
|
17.0
| |
|
<5.7%
|
26.1††
|
47.8††
|
62.4††
|
2.5
| |
Körpergewicht (kg)
|
Ausgangswert
(Mittel)
|
95.5
|
95.4
|
96.2
|
94.1
| |
|
Veränderung gegenüber Ausgangswert
|
-6.2##
|
-8.2##
|
-10.9##
|
+1.7#
| |
|
Unterschied gegenüber Placebo [95% CI]
|
-7.8**
[-9.4, -6.3]
|
-9.9**
[-11.5, -8.3]
|
-12.6**
[-14.2, -11.0]
|
-
|
a Die insgesamt mediane Dosis von Insulin glargin zu Studienbeginn betrug 34 Einheiten/Tag. Die mediane Dosis von Insulin glargin in Woche 40 betrug 38, 36, 29 bzw. 59 Einheiten/Tag unter Tirzepatid 5 mg, 10 mg, 15 mg bzw. Placebo.
* p <0.05, ** p <0.001 für die Überlegenheit, bereinigt für Multiplizität.
† p <0.05, †† p <0.001 im Vergleich zu Placebo, nicht bereinigt für Multiplizität.
# p <0.05, ## p <0.001 im Vergleich zum Ausgangswert, nicht bereinigt für Multiplizität.
Chronische Gewichtsregulierung
Die Sicherheit und Wirksamkeit von Tirzepatid zur chronischen Gewichtsregulierung (Abnahme und Halten des Gewichts) in Kombination mit kalorienreduzierter Ernährung und verstärkter körperlicher Aktivität wurde in zwei randomisierten, doppelblinden, placebokontrollierten Studien Phase 3 bei Patienten ohne Diabetes mellitus (SURMOUNT-1) und mit Diabetes mellitus (SURMOUNT-2) untersucht.
SURMOUNT-1
In einer doppelblinden, placebokontrollierten Studie über 72 Wochen wurden 2'539 erwachsene Patienten (67.5% Frauen) mit Adipositas (BMI ≥30 kg/m2) oder mit Übergewicht (BMI ≥27 kg/m2 bis <30 kg/m2) und mindestens einer gewichtsbedingten Begleiterkrankung wie zum Beispiel behandelte oder unbehandelte Dyslipidämie, Hypertonie, obstruktive Schlafapnoe oder kardiovaskuläre Erkrankung auf Tirzepatid 5 mg, 10 mg oder 15 mg einmal wöchentlich, oder Placebo randomisiert. Patienten mit manifestem Diabetes mellitus Typ 2 waren ausgeschlossen. Jedoch wiesen 40.6% der Studienteilnehmer einen Prädiabetes auf. Das mittlere Alter der Patienten betrug 45 Jahre. Das mittlere Körpergewicht zu Beginn betrug 104.8 kg und der mittlere BMI 38 kg/m2.
In der SURMOUNT-1 Studie wurde die Dosierung von Tirzepatid oder entsprechendem (matching) Placebo in einer Phase über 20 Wochen auf 5 mg, 10 mg oder 15 mg subkutan einmal wöchentlich gesteigert, mit nachfolgender Erhaltungsphase.
Die Gewichtsabnahme unter Tirzepatid begann früh und setzte sich über die Studie hinweg fort. Am Ende der Behandlung (Woche 72) war die Gewichtsabnahme unter Tirzepatid überlegen und klinisch relevant im Vergleich zu Placebo (siehe Tabelle 7 und Abbildung 6). In Woche 72 hatten 89%, 96% und 96% der Patienten mit 5 mg, 10 mg und 15 mg Tirzepatid eine Gewichtsabnahme von ≥5% erreicht, im Vergleich zu 28% der Patienten unter Placebo (P <0.001 für alle Vergleiche mit Placebo). In den Tirzepatid-Gruppen zeigten mehr Patienten eine Gewichtsabnahme von ≥10%, ≥15% und ≥20% gegenüber dem Ausgangswert im Vergleich zu Patienten der Placebo-Gruppe (p <0.001).
Tabelle 7. SURMOUNT-1: Ergebnisse in Woche 72
|
|
Tirzepatid
5 mg
|
Tirzepatid
10 mg
|
Tirzepatid
15 mg
|
Placebo
| |
mITT-Population (n)
|
630
|
636
|
630
|
643
| |
Körpergewicht
| |
Ausgangswert (kg)
|
102.9
|
105.9
|
105.5
|
104.8
| |
Veränderung (%) ab Ausgangswert
|
-16.0††
|
-21.4††
|
-22.5††
|
-2.4
| |
Unterschied (%) zu Placebo
[95 % CI]
|
-13.5**
[-14.6, -12.5]
|
-18.9**
[-20.0, -17.8
|
-20.1**
[-21.2, -19.0]
|
-
| |
Unterschied (kg) ab Ausgangswert
|
-16.1††
|
-22.2††
|
-23.6††
|
-2.4††
| |
Unterschied (kg) zu Placebo
[95% CI]
|
-13.8##
[-15.0, -12.6]
|
-19.8##
[-21.0, -18.6]
|
-21.2##
[-22.4, -20.0]
|
-
| |
Patienten (%) mit erreichter Gewichtsabnahme
| |
≥5%
|
89.4**
|
96.2**
|
96.3**
|
27.9
| |
≥10%
|
73.4##
|
85.9**
|
90.1**
|
13.5
| |
≥15%
|
50.2##
|
73.6**
|
78.2**
|
6.0
| |
≥20%
|
31.6##
|
55.5**
|
62.9**
|
1.3
| |
Taillenumfang (cm)
| |
Ausgangswert
|
113.2
|
114.9
|
114.4
|
114.0
| |
Veränderung ab Ausgangswert
|
-14.6††
|
-19.4††
|
-19.9††
|
-3.4††
| |
Unterschied zu Placebo
[95% CI]
|
-11.2##
[-12.3, -10.0]
|
-16.0**
[-17.2, -14.9]
|
-16.5**
[-17.7, -15.4]
|
-
|
##p-Wert <0.001 versus Placebo, ohne Adjustierung für Multiplizität.
**p-Wert <0.001 versus Placebo, mit Adjustierung für Multiplizität.
††p-Wert <0.001 versus Ausgangswert.
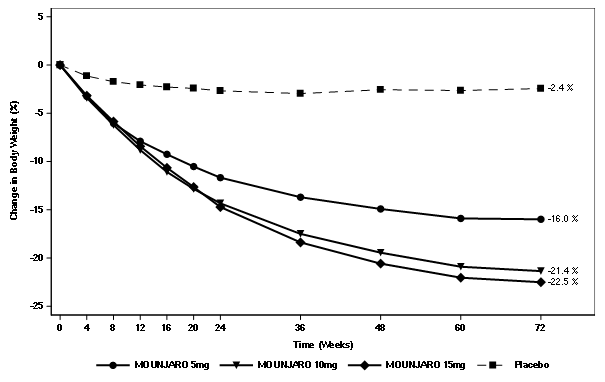
Abbildung 6. Mittlere Veränderung des Körpergewichts (%) gegenüber dem Ausgangswert bis Woche 72
In der Subgruppe mit Prädiabetes zu Studienbeginn (N=1'032) zeigte sich bei 95.3% der mit Tirzepatid behandelten Patienten eine Rückkehr zur Normoglykämie bis Woche 72, im Vergleich zu 61.9% der Patienten unter Placebobehandlung.
SURMOUNT-2
In einer doppelblinden, placebokontrollierten Studie über 72 Wochen wurden 938 erwachsene Patienten mit BMI ≥27 kg/m2 und Diabetes mellitus Typ 2 randomisiert auf Tirzepatid 10 mg oder 15 mg einmal wöchentlich, oder Placebo. Das mittlere Alter der Patienten betrug 54 Jahre und 50.7% waren Frauen. Das mittlere Körpergewicht zu Beginn betrug 100.7 kg und der mittlere BMI 36.1 kg/m2.
Die Dosierung von Tirzepatid oder entsprechendem (matching) Placebo wurde während einer Phase über 20 Wochen auf 10 mg oder 15 mg subkutan einmal wöchentlich gesteigert, mit nachfolgender Erhaltungsphase.
Die Gewichtsabnahme begann früh und setzte sich über die Studie hinweg fort. Am Ende der Behandlung (Woche 72) war die Gewichtsabnahme überlegen und klinisch relevant im Vergleich zu Placebo (siehe Tabelle 8 und Abbildung 7). In Woche 72 hatten 81.6% und 86.4% der Patienten in den Gruppen mit 10 mg und 15 mg Tirzepatid eine Gewichtsabnahme von ≥5%, im Vergleich zu 30.6% der Patienten unter Placebo (P <0.001 für alle Vergleiche mit Placebo). In den Tirzepatid-Gruppen zeigten mehr Patienten eine Gewichtsabnahme von ≥10%, ≥15% und ≥20% gegenüber dem Ausgangswert im Vergleich zu Patienten unter Placebo (p <0.001).
Tabelle 8. SURMOUNT-2: Ergebnisse in Woche 72
|
|
Tirzepatid
10 mg
|
Tirzepatid
15 mg
|
Placebo
| |
mITT-Population (n)
|
312
|
311
|
315
| |
Körpergewicht
| |
Ausgangswert (kg)
|
101.1
|
99.5
|
101.7
| |
Veränderung (%) ab Ausgangswert
|
-13.4††
|
-15.7††
|
-3.3††
| |
Unterschied (%) zu Placebo
[95 % CI]
|
-10.1**
[-11.5, -8.8]
|
-12.4**
[-13.7, -11.0]
|
-
| |
Unterschied (kg) ab Ausgangswert
|
-13.5††
|
-15.6††
|
-3.2††
| |
Unterschied (kg) zu Placebo
[95% CI]
|
-10.3**
[-11.7, -8.8]
|
-12.4**
[-13.8, -11.0]
|
-
| |
Patienten (%) mit erreichter Gewichtsabnahme
| |
≥5%
|
81.6**
|
86.4**
|
30.6
| |
≥10%
|
63.4**
|
69.6**
|
8.7
| |
≥15%
|
41.4**
|
51.8**
|
2.6
| |
≥20%
|
23.0**
|
34.0**
|
1.0
| |
Taillenumfang (cm)
| |
Ausgangswert
|
114.3
|
114.6
|
116.1
| |
Veränderung ab Ausgangswert
|
-11.2††
|
-13.8††
|
-3.4††
| |
Unterschied zu Placebo
[95% CI]
|
-7.8**
[-9.2, -6.4]
|
-10.4**
[-11.8, -8.9]
|
-
|
##p-Wert <0.001 versus Placebo, ohne Adjustierung für Multiplizität.
**p-Wert <0.001 versus Placebo, mit Adjustierung für Multiplizität.
††p-Wert <0.001 versus Ausgangswert.
Während der Studie brachen 9.3% und 13.8% der auf Tirzepatid 10 mg und 15 mg randomisierten Patienten die Behandlung ab, im Vergleich zu 14.9% unter Placebo.
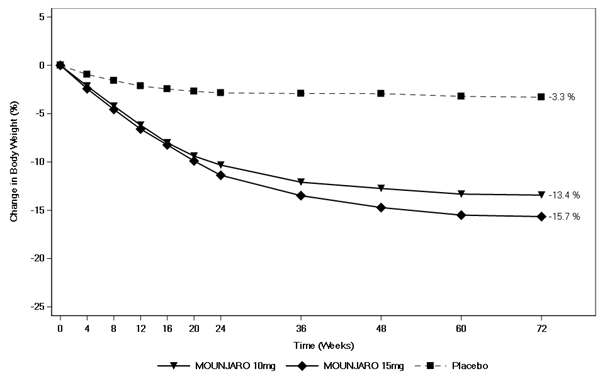
Abbildung 7. Mittlere Veränderung des Körpergewichts (%) gegenüber dem Ausgangswert bis Woche 72
Weitere Informationen
Veränderungen der Körperzusammensetzung
Die Veränderungen der Körperzusammensetzung wurden in einer Substudie zur SURMOUNT-1 mittels Dual-Röntgen-Absorptiometrie (DEXA) untersucht. Die Ergebnisse der DEXA-Untersuchung zeigten, dass die Behandlung mit Tirzepatid mit einer grösseren Reduktion der Fettmasse als der Lean-Body-Mass verbunden war, was zu einer verbesserten Körperzusammensetzung im Vergleich zu Placebo in Woche 72 führte. Darüber hinaus war diese Reduktion der Gesamtfettmasse von einer Reduktion des viszeralen Fetts begleitet. Diese Ergebnisse lassen vermuten, dass der grösste Teil der Gewichtsabnahme insgesamt auf eine Reduktion des Fettgewebes, einschliesslich des viszeralen Fetts, zurückzuführen war.
Kardiovaskuläre Beurteilung
Diabetes mellitus Typ 2
Das kardiovaskuläre (CV) Risiko wurde anhand einer Metaanalyse der Phase 2 und 3 Studien bewertet. Der kombinierte Endpunkt (major adverse cardiac event, MACE-4) umfasste kardiovaskulären Tod, nicht-tödlichen Myokardinfarkt, nicht-tödlichen Schlaganfall oder Hospitalisierung aufgrund instabiler Angina. Alle aufgetretenen Ereignisse wurden durch ein Gremium kardiologischer Spezialisten einer Adjudizierung unterzogen.
In einer primären Metaanalyse berichteten insgesamt 116 Patienten (Tirzepatid: 60 [n=4'410]; alle Komparatoren: 56 [n=2'169]) mindestens ein in der Adjudizierung bestätigtes MACE-4: Die Ergebnisse zeigten, dass Tirzepatid im Vergleich zu den kombiniert ausgewerteten Komparatoren nicht mit einem erhöhten Risiko für kardiovaskuläre Ereignisse verbunden war (HR: 0.81; KI: 0.52 bis 1.26).
Eine zusätzliche Auswertung wurde speziell für die SURPASS-4 Studie durchgeführt, hier eingeschlossen waren Patienten mit gesicherter CV Erkrankung. Insgesamt 109 Patienten (Tirzepatid: 47 [n=995]; Insulin glargin: 62 [n=1'000]) berichteten mindestens 1 in der Adjudizierung bestätigtes MACE-4: Die Ergebnisse zeigten, dass Tirzepatid nicht mit einem erhöhten Risiko für CV Ereignisse verbunden war im Vergleich zu Insulin glargin (HR: 0.74; KI: 0.51 bis 1.08).
Chronische Gewichtsregulierung
Für die SURMOUNT-1 Studie erfolgte eine Auswertung der insgesamt 14 Patienten (Tirzepatid: 9 (0.47%) von 1'896; Placebo: 5 (0.78%) von 643), bei welchen mindestens ein in der Adjudizierung bestätigtes MACE aufgetreten war. Die prozentualen Anteile der Patienten mit einem in der Adjudizierung bestätigten MACE waren ähnlich unter Placebo und Tirzepatid.
Die SURMOUNT-2 Studie wurde ausgewertet. Bei insgesamt 11 Patienten (Tirzepatid: 7 (1.12%) von 623; Placebo: 4 (1.27%) von 315) war mindestens ein in der Adjudizierung bestätigtes MACE aufgetreten. Die prozentualen Anteile der Patienten mit einem in der Adjudizierung bestätigten MACE waren ähnlich unter Placebo und Tirzepatid.
Blutdruck
Diabetes mellitus Typ 2
In den placebokontrollierten Studien Phase 3 führte die Behandlung mit Tirzepatid zu einer mittleren Abnahme des systolischen bzw. diastolischen Blutdrucks von 6 bis 9 mmHg bzw. 3 bis 4 mmHg. Bei Patienten unter Placebo sank der Blutdruck systolisch und diastolisch im Mittel um jeweils 2 mmHg.
Chronische Gewichtsregulierung
Die Behandlung mit Tirzepatid führte zu einer mittleren Abnahme des systolischen bzw. diastolischen Blutdrucks von 7 bis 8 mmHg bzw. 4 bis 5 mmHg. Bei Patienten unter Placebo sank der Blutdruck systolisch und diastolisch im Mittel um jeweils 1 mmHg.
Herzfrequenz
Diabetes mellitus Typ 2
In den placebokontrollierten Studien Phase 3 führte die Behandlung mit Tirzepatid zu einem mittleren Anstieg der Herzfrequenz von 2 bis 4 Schlägen pro Minute. Patienten unter Placebo wiesen einen mittleren Anstieg der Herzfrequenz um 1 Schlag pro Minute auf.
Chronische Gewichtsregulierung
Die Behandlung mit Tirzepatid führte zu einem mittleren Anstieg der Herzfrequenz von 1 bis 3 Schlägen pro Minute. Patienten unter Placebo wiesen einen mittleren Anstieg der Herzfrequenz von 0 Schlägen pro Minute auf.
Spezielle Populationen
Die Wirksamkeit von Tirzepatid zur Behandlung des Diabetes mellitus Typ 2 wurde nicht durch Alter, Geschlecht, Abstammung, ethnische Zugehörigkeit, Region oder durch Ausgangs-BMI, HbA1c, Diabetesdauer und Grad der Leber- oder Nierenfunktionseinschränkung beeinflusst.
Die Wirksamkeit von Tirzepatid zur chronischen Gewichtsregulierung wurde nicht durch Alter, Geschlecht, Abstammung, ethnische Zugehörigkeit, Region, Ausgangs-BMI oder vorhandenem bzw. nicht vorhandenem Prädiabetes beeinflusst.
PharmakokinetikAbsorption
Die maximale Konzentration von Tirzepatid wird 8 bis 72 Stunden nach der Anwendung erreicht. Die Steady-State-Exposition wird mit einmal wöchentlicher Anwendung nach 4 Wochen erreicht. Die Tirzepatid-Exposition steigt dosisproportional.
Bei subkutaner Anwendung von Tirzepatid an Bauch, Oberschenkel oder Oberarm wurde eine ähnliche Exposition erreicht.
Absolute Bioverfügbarkeit von subkutan angewendetem Tirzepatid beträgt 80%.
Distribution
Das mittlere scheinbare Verteilungsvolumen von Tirzepatid im Steady-State nach subkutaner Anwendung bei Patienten mit Diabetes mellitus Typ 2 beträgt ungefähr 10.3 l.
Tirzepatid ist stark an Plasmaalbumin gebunden (99%).
Metabolismus
Tirzepatid wird metabolisiert durch proteolytische Spaltung des Peptidgerüsts, Beta-Oxidation der C20-Fett-di-Säureeinheit und Amidhydrolyse.
Elimination
Die für die Population ermittelte scheinbare mittlere Clearance von Tirzepatid beträgt 0.06 l/h mit einer Eliminationshalbwertszeit von etwa 5 Tagen, was eine einmal wöchentliche Anwendung ermöglicht.
Tirzepatid wird durch Metabolismus eliminiert. Tirzepatid-Metabolite werden primär über Urin und Faeces ausgeschieden. Intaktes Tirzepatid wird in Urin oder Faeces nicht beobachtet.
Kinetik spezieller Patientengruppen
Alter, Geschlecht, Abstammung, ethnische Zugehörigkeit
Alter, Geschlecht, Abstammung oder ethnische Zugehörigkeit haben keinen klinisch relevanten Einfluss auf die Pharmakokinetik (PK) von Tirzepatid. Die Bewertung beruht auf einer populationspharmakokinetischen Analyse.
Typ 2 Diabetiker
Die PK von Tirzepatid ist bei Menschen mit Diabetes mellitus Typ 2 ähnlich wie bei Menschen mit Adipositas oder Übergewicht, ohne Diabetes mellitus Typ 2.
Leberfunktionsstörungen
Eine Leberfunktionsstörung hat keinen Einfluss auf die PK von Tirzepatid. Die PK von Tirzepatid wurde nach einer 5 mg Einzeldosis bei Patienten mit Leberfunktionsstörung unterschiedlicher Grade (leicht, mittelschwer, schwer) im Vergleich zu Patienten mit normaler Leberfunktion ausgewertet.
Nierenfunktionsstörungen
Eine Nierenfunktionsstörung hat keinen Einfluss auf die PK von Tirzepatid. Die PK von Tirzepatid wurde nach einer 5 mg Einzeldosis bei Patienten mit Nierenfunktionsstörung unterschiedlicher Grade (leicht, mittelschwer, schwer, ESRD) im Vergleich zu Patienten mit normaler Nierenfunktion ausgewertet. Dies wurde auch für Patienten mit Typ 2 Diabetes mellitus und Nierenfunktionsstörung gezeigt, basierend auf Daten aus klinischen Studien. Die Bewertung beruht auf einer populationspharmakokinetischen Analyse.
Ältere Patienten
Das Alter hatte keinen klinisch relevanten Effekt auf die pharmakokinetischen und pharmakodynamischen Eigenschaften von Tirzepatid.
Kinder und Jugendliche
Tirzepatid wurde bei pädiatrischen Patienten nicht untersucht.
Körpergewicht
Pharmakokinetische Analysen haben eine inverse Beziehung zwischen Körpergewicht und Tirzepatid-Exposition beschrieben, obwohl es keine klinisch relevante Auswirkung des Gewichts auf die glykämische Kontrolle gab.
Präklinische DatenBasierend auf den konventionellen Studien zur Sicherheitspharmakologie, Toxizität bei wiederholter Gabe oder Genotoxizität lassen die nicht-klinischen Daten keine besonderen Gefahren für den Menschen erkennen.
Kanzerogenität
Im Rahmen einer Kanzerogenitätsstudie über 2 Jahre erhielten männliche und weibliche Ratten Tirzepatid in Dosierungen von 0.15, 0.50 und 1.5 mg/kg (dem 0.12, 0.36 und 1.02-Fachen der empfohlenen Höchstdosis beim Menschen (MRHD) basierend auf der AUC), die zweimal wöchentlich durch subkutane Injektion verabreicht wurden. Tirzepatid verursachte bei allen Dosierungen einen Anstieg von C-Zelltumoren der Schilddrüse (Adenome und Karzinome) im Vergleich zu Kontrollen. Die Bedeutung dieser Ergebnisse für den Menschen ist unbekannt.
In einer Kanzerogenitätsstudie über 6 Monate an rasH2-transgenen Mäusen führte Tirzepatid bei Dosierungen von 1, 3 und 10 mg/kg (dem 1.2-, 3.4- und 10.6-fachen der wöchentlich empfohlenen Höchstdosis beim Menschen (MRHD) basierend auf der AUC), die zweimal wöchentlich als subkutane Injektion verabreicht wurden, bei keiner der Dosierungen zu einer erhöhten Inzidenz von Neoplasien.
Reproduktionstoxizität
Studien mit Tirzepatid an Tieren zeigten keine direkten schädigenden Wirkungen auf die Fertilität.
In Studien zu Fertilität und früher Embryonalentwicklung erhielten männliche und weibliche Ratten Dosen von 0.5, 1.5 und 3 mg/kg (dem 0.3, 1- und 2-Fachen bzw. 0.3, 0.9 und 2-Fachen der einmal wöchentlich empfohlenen Höchstdosis beim Menschen (MRHD) von 15 mg basierend auf der AUC), die zweimal wöchentlich durch subkutane Injektion verabreicht wurden. Es wurden keine Auswirkungen von Tirzepatid auf die Spermienmorphologie, das Paarungsverhalten, die Fertilität und Empfängnis festgestellt. Bei weiblichen Ratten wurde bei allen Dosen eine Zunahme der weiblichen Tiere mit verlängertem Diöstrus oder eine Abnahme der durchschnittlichen Anzahl Corpora lutea beobachtet, was zu einer Verringerung der durchschnittlichen Anzahl Implantationsorte und lebensfähiger Embryonen führte. Diese Auswirkungen wurden als sekundär zu den pharmakologischen Wirkungen von Tirzepatid auf Nahrungsaufnahme und Körpergewicht erachtet.
In Reproduktionsstudien wurde bei Ratten eine erhöhte Inzidenz externer, viszeraler und skelettaler Fehlbildungen sowie viszeraler und skelettaler Entwicklungsvariationen beobachtet. Bei Ratten und Kaninchen wurden Reduktionen des fötalen Wachstums beobachtet. Alle Auswirkungen auf die Entwicklung traten bei maternal toxischen Dosierungen auf. Die Exposition der Tiere war unterhalb der MRHD basierend auf der AUC. In Studien mit Jungtieren, analog zu den Studien mit erwachsenen Ratten, waren die Auswirkungen von Tirzepatid auf das Wachstum und die Entwicklung von Jungtieren auf die pharmakologische Wirkung von Körpergewicht und Nahrungsaufnahme begrenzt. Bei männlichen und weiblichen Tieren wurden Verzögerungen der balanopreputialen Trennung und der vaginalen Durchgängigkeit bemerkt, welche den Auswirkungen von Tirzepatid auf das Körpergewicht zugeschrieben wurden und nicht als direkte Reaktion auf Tirzepatid gewertet wurden.
Sonstige HinweiseInkompatibilitäten
Da keine Kompatibilitätsstudien durchgeführt wurden, darf das Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Ausser Reichweite von Kindern aufbewahren.
Fertigpen zum einmaligen Gebrauch; Durchstechflasche mit Einzeldosis:
Im Kühlschrank lagern (2 ºC – 8 ºC).
Nicht einfrieren.
In der Originalverpackung aufbewahren, zum Schutz vor Licht.
Fertigpen zum mehrmaligen Gebrauch, KwikPen
Im Kühlschrank lagern (2 ºC – 8 ºC).
Nicht einfrieren.
Temporäre Lagerung
Fertigpen zum einmaligen Gebrauch; Durchstechflasche mit Einzeldosis:
Mounjaro kann ungekühlt bis zu 21 Tage bei einer Temperatur von nicht über 30 °C gelagert werden.
Fertigpen zum mehrmaligen Gebrauch, KwikPen
Mounjaro kann ungekühlt insgesamt bis zu 30 Tage bei einer Temperatur von nicht über 30 °C gelagert werden. Danach muss der KwikPen entsorgt werden.
Hinweise für die Handhabung
Fertigpen zum einmaligen Gebrauch:
Der Fertigpen ist nur für den einmaligen Gebrauch.
Die der Packung beiliegende Bedienungsanleitung für den Fertigpen muss sorgfältig befolgt werden.
Mounjaro muss vor Gebrauch visuell geprüft und bei Partikeln oder Verfärbungen verworfen werden.
Mounjaro, das eingefroren war, darf nicht mehr verwendet werden.
Durchstechflasche mit Einzeldosis:
Die Durchstechflasche ist nur für den einmaligen Gebrauch. Die Hinweise zur Durchführung der Injektion von Mounjaro aus einer Durchstechflasche sind in der Packungsbeilage beschrieben und müssen sorgfältig beachtet werden.
Mounjaro muss vor Gebrauch visuell geprüft und bei Partikeln oder Verfärbungen verworfen werden.
Mounjaro, das eingefroren war, darf nicht mehr verwendet werden.
Fertigpen zum mehrmaligen Gebrauch, KwikPen
Der KwikPen ist ein Fertigpen zum mehrmaligen Gebrauch. Jeder KwikPen enthält 4 Dosen.
Die der Packung beiliegende Bedienungsanleitung für den Fertigpen muss sorgfältig befolgt werden.
Nadeln sind nicht enthalten.
Zulassungsnummer68726, 69415, 69696 (Swissmedic)
PackungenMounjaro 2.5 mg Injektionslösung in einem Fertigpen zum einmaligen Gebrauch: 4 Pens (B)
Mounjaro 5 mg Injektionslösung in einem Fertigpen zum einmaligen Gebrauch: 4 Pens (B)
Mounjaro 7.5 mg Injektionslösung in einem Fertigpen zum einmaligen Gebrauch: 4 Pens (B)
Mounjaro 10 mg Injektionslösung in einem Fertigpen zum einmaligen Gebrauch: 4 Pens (B)
Mounjaro 12.5 mg Injektionslösung in einem Fertigpen zum einmaligen Gebrauch: 4 Pens (B)
Mounjaro 15 mg Injektionslösung in einem Fertigpen zum einmaligen Gebrauch: 4 Pens (B)
Mounjaro 2.5 mg Injektionslösung in einer Durchstechflasche zum einmaligen Gebrauch: 1 Durchstechflasche und 4 Durchstechflaschen (B)
Mounjaro 5 mg Injektionslösung in einer Durchstechflasche zum einmaligen Gebrauch: 1 Durchstechflasche und 4 Durchstechflaschen (B)
Mounjaro 7.5 mg Injektionslösung in einer Durchstechflasche zum einmaligen Gebrauch: 1 Durchstechflasche und 4 Durchstechflaschen (B)
Mounjaro 10 mg Injektionslösung in einer Durchstechflasche zum einmaligen Gebrauch: 1 Durchstechflasche und 4 Durchstechflaschen (B)
Mounjaro 12.5 mg Injektionslösung in einer Durchstechflasche zum einmaligen Gebrauch: 1 Durchstechflasche und 4 Durchstechflaschen (B)
Mounjaro 15 mg Injektionslösung in einer Durchstechflasche zum einmaligen Gebrauch: 1 Durchstechflasche und 4 Durchstechflaschen (B)
Mounjaro 2.5 mg KwikPen Injektionslösung in einem Fertigpen zum mehrmaligen Gebrauch: 1 Pen (B)
Mounjaro 5 mg KwikPen Injektionslösung in einem Fertigpen zum mehrmaligen Gebrauch: 1 Pen (B)
Mounjaro 7.5 mg KwikPen Injektionslösung in einem Fertigpen zum mehrmaligen Gebrauch: 1 Pen (B)
Mounjaro 10 mg KwikPen Injektionslösung in einem Fertigpen zum mehrmaligen Gebrauch: 1 Pen (B)
Mounjaro 12.5 mg KwikPen Injektionslösung in einem Fertigpen zum mehrmaligen Gebrauch: 1 Pen (B)
Mounjaro 15 mg KwikPen Injektionslösung in einem Fertigpen zum mehrmaligen Gebrauch: 1 Pen (B)
ZulassungsinhaberinEli Lilly (Suisse) S.A., Vernier/Genève
Stand der InformationJuni 2025
|


