ZusammensetzungWirkstoffe
Finasterid.
Hilfsstoffe
Ethanol (96 %) 500 mg/ml, Propylenglykol, Hydroxypropyl Chitosan, gereinigtes Wasser.
Indikationen/AnwendungsmöglichkeitenFynzur wird angewendet zur topischen Behandlung von erwachsenen Männern im Alter von 18 bis 41 Jahren mit leichtem bis mässigem männlichem Haarausfall (androgenetische Alopezie), um den Haarwuchs zu steigern und weiterem Haarausfall vorzubeugen.
Dosierung/AnwendungÜbliche Dosierung
Fynzur sollte einmal täglich auf kahle Stellen der Kopfhaut appliziert werden. Je nach Grösse der kahlen Stellen können 1 bis 4 sich nicht überlappende Sprühstösse (50 bis 200 Mikroliter Lösung) angewendet werden.
Die für die Grösse der kahlen Stellen gewählte Dosis sollte nicht über das Maximum von 4 Sprühstössen hinaus erhöht werden. Wirksamkeit und Dauer der Behandlung sollten vom behandelnden Arzt laufend beurteilt werden.
Die Flasche enthält bis zu 180 Sprühstösse (zu je 50 Mikrolitern). Dies ist ausreichend für eine Behandlung über 45 Tage, wenn die Höchstdosis von 4 Sprühstössen einmal täglich angewendet wird.Bei 3 Sprühstössen einmal täglich reicht diese Menge für eine Behandlung über 60 Tage, bei 2 Sprühstössen einmal täglich für eine Behandlung über 90 Tage und bei 1 Sprühstoss einmal täglich für eine Behandlung über 180 Tage. Die Flasche sollte nicht für mehr als 180 Sprühstösse verwendet werden, weil dies zur Abgabe einer zu geringen Dosis führen kann. Die Patienten sollten entsprechend darauf hingewiesen werden.
Dauer der Anwendung
Im Allgemeinen ist eine einmal tägliche Behandlung über einen Zeitraum von 3 bis 6 Monaten erforderlich, bevor Anzeichen von Haarwachstum erwartet werden können. Eine kontinuierliche Anwendung wird empfohlen, um den Therapieerfolg aufrechtzuerhalten. Es liegen keine klinischen Erfahrungen mit der Anwendung von Fynzur über einen Zeitraum von mehr als 6 Monaten vor.
Patienten mit Leber- oder Nierenfunktionsstörungen
Bei Patienten mit eingeschränkter Nieren- oder Leberfunktion ist keine Dosisanpassung erforderlich (siehe Abschnitt „Pharmakokinetische Eigenschaften”).
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Fynzur bei Kindern und Jugendlichen unter 18 Jahren ist nicht erwiesen (siehe Abschnitt „Warnhinweise und Vorsichtsmassnahmen”).
Art der Anwendung
Fynzur ist zur Anwendung auf der Haut bestimmt. Es darf nur auf der Kopfhaut angewendet werden.
Zusammensetzen des Spray-Applikators
Die Packung von Fynzur enthält 2 separate Komponenten: eine Sprühflasche mit einer fest angebrachten Dosierpumpe und einen Konus. Diese Komponenten müssen vor der ersten Verwendung zusammengesetzt werden.
|
Komponenten
|
Zusammensetzen
| |
|
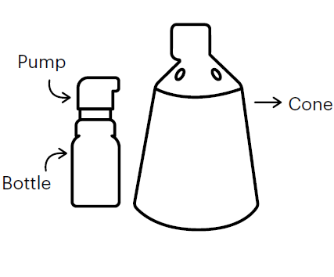
|
|

|
Vor der ersten Anwendung von Fynzur muss die Pumpe mit 4 vollen Sprühstössen vorgefüllt werden, indem der Sprühstoss in das Badezimmerwaschbecken gerichtet wird (das Waschbecken muss danach abgespült werden). Wenn Fynzur mindestens 2 Wochen lang nicht verwendet wurde, muss die Pumpe erneut mit 1 vollen Sprühstoss vorgefüllt werden. Abgesehen davon muss die Pumpflasche bei jeder Anwendung weder geschüttelt noch vorgefüllt werden.
Handhabung des Spray-Applikators
Fynzur sollte vom Patienten selbst angewendet werden. Das Haar und die Kopfhaut sollten vor der Anwendung der Lösung völlig trocken sein. Die Lösung sollte nicht ins Gesicht gesprüht werden und nicht mit den Händen oder anderen Teilen des Körpers als dem zu behandelnden Areal der Kopfhaut in Kontakt kommen. Bei versehentlichem Kontakt mit der Lösung sollte der betroffene Körperteil gründlich abgewaschen werden.
Beim Anwenden des Sprays muss der Konus mit der Kopfhaut in Kontakt sein, um zu vermeiden, dass Finasterid in der Luft zerstäubt wird. Das kahle Kopfhautareal, auf dem der Konus aufgesetzt wird, begrenzt die maximale Behandlungsfläche für 1 Sprühstoss. Um ein Areal zu behandeln, das grösser als der Konusdurchmesser ist, können 2, 3 oder 4 Sprühstösse verschrieben werden. Bevor in diesen Fällen der zweite, dritte oder vierte Sprühstoss appliziert wird, sollte der Konus jeweils auf das nächste zu behandelnde Kopfhautareal aufgesetzt werden, wobei darauf zu achten ist, dass sich die behandelten Bereiche nicht überlappen.
Unmittelbar nach der Anwendung sollte ein Kontakt der behandelten Kopfhaut mit Oberflächen (z. B. Kissen, Helme, Hüte usw.) vermieden werden, bis die Lösung getrocknet ist. Nach dem Auftragen sollte Fynzur mindestens 6 Stunden lang einwirken.
Hinweise für den Fall, dass der Patient mit einer Schwangeren oder einer Frau, die schwanger werden kann, oder mit Kindern und Jugendlichen in Kontakt kommt, siehe Abschnitt „Warnhinweise und Vorsichtsmassnahmen”.
KontraindikationenFynzur ist nicht zur Anwendung bei Frauen bestimmt.
Schwangere oder Frauen, die schwanger werden können (siehe Abschnitte „Warnhinweise und Vorsichtsmassnahmen”, „Schwangerschaft, Stillzeit” und „Präklinische Daten”).
Überempfindlichkeit gegen den Wirkstoff oder einen der im Abschnitt „Zusammensetzung” genannten sonstigen Bestandteile.
Warnhinweise und VorsichtsmassnahmenMögliche Übertragung von Fynzur
Schwangere oder Frauen, die schwanger werden können, dürfen nicht mit Fynzur, der behandelten Kopfhaut oder mit Oberflächen, die mit Fynzur besprüht wurden, in Kontakt kommen, weil die Möglichkeit einer Resorption von Finasterid und damit ein potenzielles Risiko für einen männlichen Fetus besteht (siehe „Präklinische Daten”). Bei versehentlichem Kontakt mit der Lösung sollte der betroffene Körperteil gründlich abgewaschen werden.
Kinder und Jugendliche unter 18 Jahren dürfen nicht mit Fynzur, der behandelten Kopfhaut oder mit Oberflächen, die mit Fynzur besprüht wurden, in Kontakt kommen, weil die Möglichkeit einer Resorption von Finasterid und dadurch ein potenzielles Risiko für Nebenwirkungen besteht (siehe Abschnitt „Eigenschaften/Wirkungen”). Bei versehentlichem Kontakt mit der Lösung sollte der betroffene Körperteil gründlich abgewaschen werden.
Wirkungen auf das prostataspezifische Antigen (PSA)
In klinischen Studien mit oral verabreichtem Finasterid 1 mg bei Männern zwischen 18 und 41 Jahren fiel der mittlere Serumspiegel des prostataspezifischen Antigens (PSA) von einem Ausgangswert von 0,7 ng/ml auf 0,5 ng/ml nach 12 Monaten. Die systemische Exposition gegenüber Finasterid nach topischer Anwendung ist zwar sehr gering im Vergleich zur oralen Verabreichung (siehe Abschnitt „Pharmakokinetik”), doch liegen keine Daten über die Wirkung von Fynzur auf die PSA-Serumspiegel vor, was bei der Interpretation der Ergebnisse von PSA-Tests berücksichtigt werden sollte.
Wirkungen auf das Dihydrotestosteron (DHT) im Serum
Dihydrotestosteron ist ein Androgen, ein Metabolit und die biologisch aktivste Form von Testosteron. In der klinischen Phase-III-Studie kam es in der Fynzur-Gruppe in Woche 24 zu einer Abnahme von DHT im Serum. Die prozentuale Abnahme der mittleren DHT-Serumkonzentration gegenüber dem Ausgangswert war in der oralen Finasterid-Gruppe höher, aber die Abnahme war sowohl bei Fynzur (34,5 %) als auch bei oralem Finasterid (55,6 %) klinisch signifikant, was auf die Möglichkeit systemischer Nebenwirkungen sexueller Art im Zusammenhang mit einer Abnahme des DHT hinweist, wenn auch mit geringerer Wahrscheinlichkeit für Fynzur als bei oralem Finasterid (siehe Abschnitte „Unerwünschte Wirkungen” und „Eigenschaften/Wirkungen”). Das Dosierungsschema sollte befolgt werden (siehe Abschnitt „Dosierung/Anwendung”).
Brustkrebs
Es gab keine Berichte über Brustkrebs bei Patienten, die in klinischen Studien mit Fynzur behandelt wurden. Da Brustkrebs bei Männern jedoch ein bekanntes Risiko unter oral verabreichtem Finasterid ist, sollten die Patienten angewiesen werden, jegliche Veränderungen des Brustgewebes wie Knoten, Schmerzen, Gynäkomastie oder Ausfluss aus der Brustwarze unverzüglich zu berichten.
Stimmungsänderungen und Depression
Es gab keine Berichte über Stimmungsänderungen oder Depression bei Patienten, die in klinischen Studien mit Fynzur behandelt wurden. Bei Patienten, die mit oral verabreichtem Finasterid 1 mg behandelt wurden, wurde über Stimmungsveränderungen einschliesslich depressiver Verstimmung, Depression und, seltener, Suizidgedanken berichtet. Daher sollten die Patienten angewiesen werden, ärztlichen Rat einzuholen, wenn psychiatrische Symptome bei ihnen auftreten.
Dieses Arzneimittel enthält 25 mg Alkohol pro Sprühstoss, was 0,5 mg/Mikroliter (55 Prozent) entspricht. Bei geschädigter Haut kann es ein brennendes Gefühl hervorrufen.
Ethanol ist entflammbar. Vermeiden Sie Feuer oder offene Flammen und vermeiden Sie das Rauchen, bis das Spray getrocknet ist.
InteraktionenEs wurden keine Studien zur Erfassung von Wechselwirkungen mit Fynzur durchgeführt. Topisches Finasterid führt zu geringen systemischen Konzentrationen von Finasterid (siehe Abschnitt „Pharmakokinetik”), das vom Cytochrom-P450-3A4 (CYP3A4) metabolisiert wird. Ein klinisch relevanter Einfluss von gleichzeitig angewendeten CYP3A4-Induktoren oder -Inhibitoren auf topisches Finasterid oder von topischem Finasterid auf andere Arzneimittel, die von diesem Enzym verstoffwechselt werden, ist unwahrscheinlich.
Die gleichzeitige Anwendung von Fynzur und anderen topischen Produkten wie Kosmetika, Sonnenschutzmittel oder andere topische Arzneimittel auf demselben Kopfhautbereich wurde nicht untersucht. Die Anwendung solcher Produkte auf den mit Fynzur behandelten Kopfhautarealen sollte vermieden werden.
Es liegen keine Daten zur gleichzeitigen Anwendung von Fynzur und oralem Finasterid 1 mg oder topischem Minoxidil bei androgenetischem Haarausfall vor.
Schwangerschaft, StillzeitFynzur ist nicht zur Anwendung bei Frauen bestimmt. Schwangerschaft
Aufgrund des Teratogenitätsrisikos für männliche Feten in der Schwangerschaft ist Fynzur bei Schwangeren oder Frauen, die schwanger werden können, kontraindiziert (siehe unter „Kontraindikationen”, „Warnhinweise und Vorsichtsmassnahmen” und „Präklinische Daten”). In klinischen Studien an Männern war die mittlere Finasterid-Exposition nach topischer Anwendung von 0,2 ml Fynzur einmal täglich über 24 Wochen (entsprechend 0,445 mg Finasterid einmal täglich, die empfohlene Tageshöchstdosis mit mittleren maximalen Finasterid-Plasmakonzentrationen von 48,0 pg/ml) doch 39-fach niedriger als die geschätzte Exposition durch den NOAEL in Tierstudien. Die systemischen Finasterid-Konzentrationen, denen eine schwangere Frau durch den Kontakt mit einem mit Finasterid behandelten Partner exponiert sein könnte, wären somit noch niedriger. Dennoch dürfen Schwangere oder Frauen, die schwanger werden können, nicht mit Fynzur, der behandelten Kopfhaut oder mit Oberflächen, die mit Fynzur besprüht wurden, in Kontakt kommen, weil die Möglichkeit einer Resorption von Finasterid und damit ein potenzielles Risiko für einen männlichen Fetus besteht. Bei versehentlichem Kontakt mit der Lösung sollte der betroffene Körperteil gründlich abgewaschen werden.
Stillzeit
Nicht zutreffend, da Fynzur zur topischen Behandlung von erwachsenen Männern angewendet wird. Es ist nicht bekannt, ob Finasterid in die Muttermilch übergeht.
Fertilität
Die Fertilität bei Menschen wurde bei Fynzur nicht untersucht. Tierstudien haben eine Wirkung auf die Fertilität gezeigt (siehe „Präklinische Daten”).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenFynzur hat keinen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Unerwünschte WirkungenZusammenfassung des Sicherheitsprofils
Das Sicherheitsprofil von Fynzur basiert auf Daten von 229 Patienten mit androgenetischer Alopezie und 97 gesunden Probanden, die im klinischen Entwicklungsprogramm mit Fynzur behandelt wurden. In der klinischen Phase-III-Studie wurden 181 Patienten für die Dauer von bis zu 6 Monaten mit Fynzur, 181 Patienten mit Placebo und 84 Patienten mit oral verabreichtem Finasterid behandelt. In dieser Studie wurde über Pruritus und Erytheme, die meist auf der Kopfhaut auftraten, berichtet. Pruritus trat bei 5 (2,8 %) und ein Erythem bei 4 (2,2 %) der 181 Patienten unter Fynzur auf.
Auflistung der Nebenwirkungen
Die Nebenwirkungen werden nach Systemorganklassen der MedDRA-Einstufung und nach der Häufigkeit gemäss der nachstehenden Konvention geordnet:
„sehr häufig” (≥1/10),
„häufig” (≥ 1/100 bis <1/10)
„gelegentlich” (≥1/1000 bis <1/100)
„selten” (≥1/10 000 bis <1/1000)
„sehr selten” (<1/10 000).
„nicht bekannt” (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
|
Systemorganklasse (SOC)
|
Häufigkeit
|
Nebenwirkung
| |
Untersuchungen
|
Erkrankungen der Haut und des Unterhautzellgewebes
|
Dihydrotestosteron vermindert (16 - 18 %)
| |
Erkrankungen der Haut und des Unterhautzellgewebes
|
Häufig:
|
Pruritus
| |
Häufig:
|
Erythem
|
Beschreibung spezifischer Nebenwirkungen und weitere Informationen
Für oral verabreichtes Finasterid werden Nebenwirkungen sexueller Art angegeben (verminderte Libido, erektile Dysfunktion und Ejakulationsstörungen [einschliesslich vermindertes Ejakulatvolumen]. In der pivotalen klinischen Phase-III-Studie mit Fynzur wurden ebenfalls solche behandlungsbedingten Nebenwirkungen sexueller Art (Libidoverlust, verminderte Libido, erektile Dysfunktion, sexuelle Funktionsstörung) berichtet. Ihre Gesamthäufigkeit betrug 2,8 % bei Patienten unter Fynzur, 3,3 % bei Patienten unter Placebo und 4,8 % bei Patienten unter oral verabreichtem Finasterid 1 mg. Bitte beachten Sie auch die Abschnitte „Warnhinweise und Vorsichtsmassnahmen” und „Eigenschaften/Wirkungen”.
Die folgenden weiteren systemischen Nebenwirkungen, die im Zusammenhang mit oral verabreichtem Finasterid in klinischen Studien und/oder nach der Markteinführung berichtet wurden, sind auch mit Fynzur möglich: Überempfindlichkeitsreaktionen, einschliesslich Hautausschlag, Pruritus, Urtikaria und Angioödem; Depression; Angst; Palpitationen; erhöhte Leberenzymwerte; Berührungsempfindlichkeit und Vergrösserung der Brust; Hodenschmerzen, Hämatospermie und Infertilität.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Bedeutung. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Medizinisches Fachpersonal ist dazu verpflichtet, jeden Verdacht auf eine neue oder schwerwiegende Nebenwirkung über das Online-Anzeigeportal ElViS (Electronic Vigilance System) zu melden. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungDie Resorption von topisch appliziertem Finasterid ist sehr gering. Im Falle einer Überdosierung ist eine Abnahme des DHT-Serumspiegels zu erwarten, was zu einer erhöhten Wahrscheinlichkeit für systemische Wirkungen führen kann.
Eine Empfehlung für eine spezifische Behandlung einer Überdosierung von Fynzur kann nicht gegeben werden.
Eigenschaften/WirkungenATC-Code
D11AX10
Wirkungsmechanismus
Finasterid ist ein kompetitiver und spezifischer Inhibitor der Typ-II-5α-Reduktase. Dieses Isoenzym konvertiert das Androgen Testosteron in seinen biologisch aktivsten Metaboliten Dihydrotestosteron (DHT). Bei Männern mit männlichem Haarausfall enthält die Kopfhaut mit Glatzenbildung verkleinerte Haarfollikel und erhöhte Konzentrationen von DHT. Finasterid hemmt einen Vorgang, der für die Verkleinerung der Haarfollikel der Kopfhaut verantwortlich ist, was zur Rückbildung des glatzenbildenden Prozesses führen kann.
Pharmakodynamik
In den klinisch-pharmakologischen Studien waren die wichtigsten pharmakodynamischen Endpunkte die DHT-Konzentrationen in der Kopfhaut als Ersatzmarker für die Wirksamkeit im Zielgewebe und die DHT-Konzentrationen im Serum als potenzieller Ersatzmarker für die Sicherheit, da verminderte systemische Konzentrationen von DHT mit dem Nebenwirkungsprofil von oralem Finasterid assoziiert sind. Unter Verwendung dieser Ersatzmarker wurde eine optimale Dosis von Fynzur von bis zu 200 Mikrolitern einmal täglich (4 Sprühstösse) ermittelt.
Bei den DHT-Serumkonzentrationen ist eine hohe interindividuelle Variabilität festzustellen. In der klinischen Phase-III-Studie war die prozentuale Abnahme der mittleren DHT-Serumkonzentration nach 24 Wochen gegenüber dem Ausgangswert in der Gruppe mit oralem Finasterid (55,6 %) höher als mit Fynzur (34,5 %), aber die Abnahme war für beide Gruppen klinisch signifikant. Von den Patienten, die zu Beginn der Behandlung im Normbereich lagen, entwickelte ein höherer Anteil der Patienten in der oralen Finasterid-Gruppe (55,2 %) im Vergleich zur Fynzur-Gruppe (15,3 %) DHT-Serumwerte, die nach 24 Wochen Behandlung unter den Normbereich absanken (DHT-Serum < 14 ng/dl), was auf die Möglichkeit systemischer unerwünschter Ereignisse im Zusammenhang mit vermindertem DHT in beiden Gruppen hinweist, wenn auch mit geringerer Wahrscheinlichkeit für Fynzur als für orales Finasterid.
Klinische Wirksamkeit
Die klinische Wirksamkeit und Sicherheit von Fynzur wurde in einer multizentrischen, doppelblinden, randomisierten, kontrollierten Double-Dummy-Studie der Phase III bei erwachsenen männlichen Patienten mit androgenetischer Alopezie beurteilt (PM1541). Die Patienten sollten einmal täglich für die Dauer von 24 Wochen behandelt werden und wurden im Verhältnis 2:2:1 wie folgt randomisiert: Fynzur -Gruppe (bis zu 200 Mikroliter Fynzur + orales Placebo), Placebogruppe (topisches Placebo + orales Placebo) und Gruppe mit oralem Finasterid (topisches Placebo + orales Finasterid 1 mg). Vor Behandlungsbeginn wurde ein kreisrundes kahles Zielareal von 1 cm² mit einem kleinen Punkt-Tattoo markiert. Dieses Areal diente als Referenzpunkt für die Messungen der Haarzahl.
Die Wirksamkeit wurde anhand der Haarzahl im Zielareal (primäre Wirksamkeitsvariable) und der mittels Makrofotografie bestimmten Haardicke im Zielareal, der Patientenselbstbeurteilung auf Basis des „Male Hair Growth Questionnaire” (mit Fragen zu Haarwuchs, Haarausfall und Erscheinungsbild der Haare) sowie der Beurteilung der Verbesserung durch den Prüfarzt und einen verblindeten Prüfer (auf Basis des Haarwuchses/-verlustes des Patienten) beurteilt.
Von 458 randomisierten Patienten erhielten 446 Patienten (97,4 %) mindestens 1 Dosis der Studienbehandlung und wurden in die Sicherheitspopulation einbezogen; 323 Patienten (70,5 %) schlossen die Studie vollständig ab. Der vorzeitige Abbruch war in allen Gruppen hoch und betrug 32,3 % der randomisierten Patienten in der Fynzur-Gruppe und 29,4 % in der oralen Finasterid-Gruppe. Insgesamt nur 250 Patienten (54,6 %) hatten sowohl vor Behandlungsbeginn als auch während der Behandlung auswertbare Messungen der Haarzahl und erfüllten definitionsgemäss die Kriterien für den Einschluss in die Intent-to-treat Population (ITT): 105 Patienten in der Fynzur-Gruppe, 97 Patienten in der Placebogruppe und 48 Patienten in der Gruppe mit oralem Finasterid. Fast alle Patienten waren Kaukasier (98,0 %). Das mittlere Alter betrug etwa 32 Jahre (Bereich 19 bis 41 Jahre), und das häufigste Muster des Haarausfalls im Scheitelbereich war Typ III Vertex (etwa 50 % der Patienten) gemäss der modifizierten Hamilton-Norwood-Skala. Der mittlere Ausgangswert der Haarzahl in der Fynzur- Gruppe betrug 201 Haare/cm² und war vergleichbar mit den anderen Gruppen.
Fynzur zeigte eine moderate klinische Wirksamkeit, die dem Placebo überlegen und numerisch mit der von oralem Finasterid, welches als explorativer, deskriptiver Vergleichsarm herangezogen wurde, vergleichbar war. In der ITT-Population war die mittlere Veränderung der Haarzahl im Zielareal nach 24 Wochen im Vergleich zum Ausgangswert (primärer Endpunkt) bei Patienten in der Fynzur-Gruppe statistisch signifikant grösser als in der Placebogruppe und numerisch vergleichbar mit der Gruppe unter oralem Finasterid. Ähnliche Ergebnisse wurden in der Sicherheitspopulation nach 24 Wochen, für die mittlere Veränderung der Haarzahl im Zielareal nach 12 Wochen im Vergleich zum Ausgangswert und in allen Sensitivitätsanalysen beobachtet, die mit verschiedenen Methoden zum Umgang mit fehlenden Daten durchgeführt wurden.
Veränderung der Haarzahl im Zielareal nach 12- und 24-wöchiger Behandlung im Vergleich zum Ausgangswert (ITT-Population)
|
Behandlungsdauer
|
Fynzur (n = 105)
|
Placebo
(n = 97)
|
Orales Finasterid (n = 48)
| |
12 Wochen
|
|
|
| |
LS mittlere Veränderung vs. Baseline (Haarzahl)
|
19,4
|
7,4
|
22,3
| |
LS mittlerer Unterschied vs. Placebo (95 % KI)
|
12,0 (5,7; 18,3)
|
-
| |
24 Wochen
|
|
|
| |
LS mittlere Veränderung vs. Baseline (Haarzahl)
|
16,3
|
6,3
|
18,7
| |
LS mittlerer Unterschied vs. Placebo (95 % KI)
|
10,0 (2,2; 17,7)
|
-
|
Grösse des Zielareals (kreisrund): 1 cm2
KI = Konfidenzintervall; ITT = Intent-to-treat; LS = Least Squares; n = Gesamtzahl der Patienten pro Behandlungsgruppe
Hinweis: Statistisch signifikante Unterschiede zugunsten von Fynzur vs. Placebo wurden sowohl nach 12- als auch nach 24wöchiger Behandlung beobachtet (p < 0,001 bzw. p = 0,012).
Für sekundäre Endpunkte wurde eine Post-hoc-Analyse durchgeführt, bei der das Ansprechen auf die Behandlung anhand jeglichen Grades einer Verbesserung ermittelt wurde. In der Sicherheitspopulation (446 Patienten) wurden Unterschiede zugunsten von Fynzur im Vergleich zu Placebo beim Anteil der Patienten beobachtet, die basierend auf der Bewertung durch den Prüfarzt und einen verblindeten Prüfer nach 24 Wochen Behandlung irgendeinen Grad an Verbesserung des Haarwuchses aufwiesen. In Woche 24 wurde kein Unterschied in der Selbsteinschätzung des Patienten hinsichtlich der Gesamtveränderung des Haarwuchses festgestellt. Insgesamt waren die Ergebnisse in der Fynzur -Gruppe bei der Auswertung der Befragung vergleichbar mit der Gruppe unter oralem Finasterid, aber die Unterschiede zu Placebo waren im Allgemeinen gering (siehe nachstehende Tabelle).
Prozentualer Anteil der Respondera für sekundäre Endpunkte in Woche 24 (Sicherheitspopulation)
|
Behandlungsgruppen
|
|
Responder (%)
| |
|
|
Beurteilung durch Prüfarzt
|
Beurteilung durch verblindeten Prüfer
|
MHGQ - Patientenbeurteilung
| |
|
Haar-Erscheinungsbild
|
Haarwuchs
|
Gesamtveränderung
| |
Fynzur
|
181
|
42,0b
|
26,0c
|
40,9c
|
39,8
|
26,5
| |
Orales Finasterid
|
84
|
35,7
|
28,6
|
36,9
|
31,0
|
25,0
| |
Placebo
|
181
|
27,6
|
16,0
|
28,7
|
32,0
|
19,9
|
MHGQ = Fragebogen zum Haarwachstum bei Männern („Male Hair Growth Questionnaire”)
a Response für jeden Parameter war definiert als beliebiger Grad der Verbesserung.
b Wert p < 0,005 im Rahmen eines Chi-Quadrat-Vergleichs von Fynzur vs. Placebo.
c Wert p < 0,05 im Rahmen eines Chi-Quadrat-Vergleichs von Fynzur vs. Placebo.
Kinder und Jugendliche
Die Europäische Arzneimittelagentur hat für Fynzur eine Freistellung von der Verpflichtung zur Vorlage von Ergebnissen zu Studien in allen pädiatrischen Altersklassen in der Behandlung von androgenetischer Alopezie gewährt. Siehe Abschnitt „Dosierung/Anwendung” bezüglich Informationen zur Anwendung bei Kindern und Jugendlichen.
PharmakokinetikAbsorption
Die systemische Resorption von Finasterid nach topischer Applikation von Fynzur auf gesunder, intakter Kopfhaut ist minimal. Nach Anwendung von Fynzur in der vorgesehenen Dosis (d. h. bis zu 200 Mikroliter einmal täglich) sind die mittleren maximalen Plasmakonzentrationen von Finasterid mehr als 100-fach niedriger als nach Einnahme von Finasterid 1 mg einmal täglich (etwa < 50 pg/ml vs. 7000 pg/ml); dies gilt zu allen Messzeitpunkten im Verlauf einer 6-monatigen Behandlung. Die relative Bioverfügbarkeit von Finasterid nach mehrfacher Anwendung von Fynzur verglichen mit oral verabreichtem Finasterid ist ebenfalls minimal (etwa 2 bis 3 %).
Distribution
Die Proteinbindung beträgt etwa 90 %. Das Verteilungsvolumen von Finasterid liegt bei etwa 76 Litern.
Metabolismus
Finasterid wird hauptsächlich über das Cytochrom-CYP3A4-Enzymsystem metabolisiert, beeinflusst diese Enzyme jedoch nicht. Bei Männern wurden nach einer oralen Dosis von 14C-Finasterid 2 Metabolite identifiziert, die nur einen Bruchteil der 5α-Reduktase-hemmenden Wirkung von Finasterid aufweisen. Verglichen mit oral verabreichtem Finasterid ist zu erwarten, dass die Plasmaspiegel dieser 2 Metabolite (und von unverändertem Finasterid) nach topischer Anwendung von Fynzur aufgrund der signifikant geringeren systemischen Exposition gegenüber Finasterid mit Fynzur vernachlässigbar sind.
Elimination
Nach oraler Gabe von 14C-Finasterid bei Männern wurden 39 % der Dosis in Form von Metaboliten im Urin ausgeschieden (praktisch kein unveränderter Wirkstoff wurde im Urin nachgewiesen) und 57 % der Gesamtdosis in den Fäzes. Nach topischer Anwendung von Fynzur werden unverändertes Finasterid und die davon abgeleiteten Metabolite ähnlich wie bei oraler Anwendung über Fäzes und Urin ausgeschieden.
Nach Beendigung der Anwendung von Fynzur werden etwa 95 % des nach topischer Anwendung resorbierten Wirkstoffs innerhalb von 24 bis 36 h ausgeschieden.
Bei mit oral verabreichtem Finasterid behandelten Männern wurden weniger als 0,001 % der 1mg-Dosis in der Samenflüssigkeit jeder Ejakulation nachgewiesen. Da die mittleren maximalen Plasmakonzentrationen von Finasterid nach topischer Anwendung von Fynzur >100-fach geringer sind als nach oraler Gabe von Finasterid 1 mg, ist es unwahrscheinlich, dass Finasterid aus Fynzur in der Samenflüssigkeit ausgeschieden wird.
Leber- oder Nierenfunktionsstörungen
Es wurden keine klinischen Studien mit Fynzur bei Patienten mit eingeschränkter Nieren- oder Leberfunktion durchgeführt. Aufgrund der sehr geringen systemischen Resorption von Finasterid bei topischer Anwendung ist keine Dosisanpassung erforderlich.
Präklinische DatenToxizität bei wiederholter Verabreichung
Die Ergebnisse von Toxizitätsstudien bei wiederholter oraler Verabreichung von Finasterid standen in Zusammenhang mit den pharmakologischen Wirkungen von Finasterid, die zu Störungen des Hormongleichgewichts führen. Dermale Toxizitätsstudien mit Fynzur bestätigten dessen Sicherheitsprofil und dessen Gesamtverträglichkeit nach wiederholter täglicher Anwendung auf der Haut für bis zu 39 Wochen.
Hautverfärbungen wurden nach topischer Anwendung in allen Gruppen der 4- und 13-wöchigen Studien an Minischweinen beobachtet, aber in keiner Gruppe der 39-wöchigen Studien an Minischweinen. Diese Verfärbungen wurden als bräunliches Gemisch der enthaltenen nicht-flüchtigen sonstigen Bestandteile interpretiert. Im klinischen Entwicklungsprogramm wurden keine Hautverfärbungen berichtet.
Genotoxizität
Studien zur Genotoxizität lassen bei der vorgesehenen Dosis von Fynzur keine Gefahren für den Menschen erkennen.
Karzinogenität
Studien zur Karzinogenität lassen bei der vorgesehenen Dosis von Fynzur keine Gefahren für den Menschen erkennen.
Reproduktionstoxizität
Die intravenöse Gabe von Finasterid an trächtige Rhesusaffen in Dosierungen von bis zu 800 ng einmal täglich (die zu einer geschätzten maternalen Plasmakonzentration von 1,86 ng/ml führte) während der gesamten Dauer der embryonalen und fetalen Entwicklung führte nicht zu Anomalien bei den männlichen Feten (No Observed Adverse Effect Level [NOAEL]). Bei Gabe von oral verabreichtem Finasterid in der höheren Dosis von 2 mg/kg Körpergewicht einmal täglich (>200-Faches der empfohlenen maximalen topischen Tagesdosis von Fynzur) an trächtige Affen wurden bei männlichen Feten Fehlbildungen der äusseren Geschlechtsorgane beobachtet. Andere Fehlbildungen männlicher Feten wurden bei keiner Dosis festgestellt. Bei weiblichen Feten wurden bei keiner Dosis Fehlbildungen in Zusammenhang mit Finasterid beobachtet.
Ratten zeigten nach Verabreichung von 20 bis 80 mg/kg einmal täglich oral eine leichte bis mittelschwere Reduktion der Fertilität, die jedoch nach Absetzen der Behandlung vollständig reversibel war. Diese Abnahme der Fertilität ist vermutlich eine Folge der Wirkungen auf Prostata und Samenbläschen, die dazu führen, dass sich kein Samenpfropfen bildet. Die Pfropfenbildung ist jedoch für die menschliche Fertilität nicht relevant.
Weitere Daten: Photosensibilisierung
4 von 10 behandelten Meerschweinchen zeigten eine Photosensibilisierungsreaktion (sehr leichtes Erythem (Score 1) bis zu 72 Stunden nach der Dosis) nach der dermalen Exposition mit topischer Finasteridlösung in Verbindung mit UV-Licht. Im klinischen Entwicklungsprogramm wurde jedoch bei 58 gesunden Probanden, die mit Fynzur behandelt wurden, kein Photosensibilisierungspotenzial festgestellt.
Sonstige HinweiseInkompatibilitäten
Da keine Kompatibilitätsstudien vorliegen, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung angegebenen Verfalldatum verwendet werden.
Haltbarkeit nach dem Öffnen
Nach Anbruch der Flasche innerhalb von 6 Monaten verwenden.
Besondere Lagerungshinweise
Bei Raumtemperatur (15-25°C) und ausserhalb der Reichweite von Kindern aufbewahren.
Fynzur enthält Ethanol, das entflammbar ist. Fynzur darf nicht in der Nähe von offenen Flammen oder während des Rauchens des Patienten versprüht werden.
Hinweise für die Handhabung
Fynzur sollte nicht für mehr als 180 Sprühstösse verwendet werden.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
Zulassungsnummer68794 (Swissmedic)
PackungenPolypropylen-Flasche, die 18 ml Lösung enthält, mit mechanischer Aufsteck-Spraypumpe und separatem Polypropylen-Konus. Diese Komponenten müssen vor der ersten Anwendung zusammengesetzt werden.
·1 Flasche (entsprechend 180 Sprühstössen) mit Spraypumpe und 1 separaten Konus (B).
·3 Flaschen (entsprechend 3 x 180 Sprühstössen) mit Spraypumpe und 3 separaten Konen (B).
Es werden möglicherweise nicht alle Packungsgrössen in Verkehr gebracht.
ZulassungsinhaberinBAILLEUL (Schweiz) SA, GENF
Hersteller
ALMIRALL HERMAL GmbH, DEUTSCHLAND
Stand der InformationOktober 2022
|


