Eigenschaften/WirkungenATC-Code
N02CD07
Wirkungsmechanismus/Pharmakodynamik
Atogepant ist ein Calcitonin Gene-Related Peptide (CGRP)-Rezeptorantagonist, der die Bindung von CGRP an den Rezeptor blockiert und der CGRP-Rezeptorfunktion entgegenwirkt. CGRP ist ein Neuropeptid, das mit der Pathophysiologie der Migräne in Zusammenhang gebracht wurde. Im trigeminovaskulären System moduliert CGRP die nozizeptive Signalgebung und Entzündung und fungiert zusätzlich als Vasodilatator.
Kardiale Elektrophysiologie
Bei einer Dosis, die 5mal höher ist als die empfohlene maximale Tagesdosis, verlängert AQUIPTA das QT-Intervall nicht.
Klinische Wirksamkeit
AQUIPTA wurde in zwei Zulassungsstudien zur Prophylaxe von Migräne über das gesamte Spektrum der chronischen und episodischen Migräne hinweg untersucht. In die Studie zur episodischen Migräne (ADVANCE) wurden Patienten aufgenommen, welche die Kriterien der International Classification of Headache Disorders (ICHD) für die Diagnose einer Migräne mit oder ohne Aura erfüllten. In die Studie zur chronischen Migräne (PROGRESS) wurden Patienten aufgenommen, welche auch die ICHD-Kriterien für chronische Migräne erfüllten. Beide Studien schlossen Patienten mit Myokardinfarkt, Schlaganfall oder transitorischen ischämischen Attacken innerhalb von sechs Monaten vor dem Screening aus.
Episodische Migräne
AQUIPTA wurde in einer randomisierten, multizentrischen, doppelblinden, placebokontrollierten Studie zur Prophylaxe episodischer Migräne (4 bis 14 Migränetage pro Monat) untersucht (ADVANCE). Die Patienten wurden randomisiert zu AQUIPTA 60 mg (N = 235) oder Placebo (N = 223) einmal täglich während 12 Wochen. Die Akutbehandlung von Kopfschmerzen (d.h. Triptane, Ergotaminderivate, NSAR, Paracetamol und Opioide) war den Patienten erlaubt.
Insgesamt schlossen 88% der Patienten die 12wöchige doppelblinde Studienphase ab. Das mittlere Alter der Patienten betrug 42 Jahre (zwischen 18 und 73); 89% waren weiblich und 83% waren weiss. Die mittlere Migränehäufigkeit bei Baseline betrug etwa 8 Migränetage pro Monat und war in beiden Behandlungsarmen vergleichbar.
Der primäre Endpunkt zur Wirksamkeit war die Veränderung der mittleren Anzahl monatlicher Migränetage (MMD) gegenüber Baseline über die 12wöchige Behandlungsphase.
Die Behandlung mit AQUIPTA zeigte in ADVANCE im Vergleich zu Placebo statistisch signifikante Verbesserungen der primären und bei wichtigen multiplizitätskontrollierten sekundären Ergebnissen zur Wirksamkeit, wie in Tabelle 4 zusammengefasst.
Tabelle 4: Endpunkte zur Wirksamkeit in ADVANCE
|
|
AQUIPTA 60 mg
N = 226
|
Placebo
N = 216
| |
Anzahl monatlicher Migränetage (MMD) über 12 Wochen
| |
Baseline
|
7,8
|
7,5
| |
Mittlere Veränderung gegenüber Baseline
|
-4,1
|
-2,5
| |
Unterschied gegenüber Placebo
|
-1,7
|
| |
p-Wert
|
< 0,001
|
| |
Monatliche Kopfschmerztage über 12 Wochen
| |
Baseline
|
9,0
|
8,5
| |
Mittlere Veränderung gegenüber Baseline
|
-4,2
|
-2,5
| |
Unterschied gegenüber Placebo
|
-1,7
|
| |
p-Wert
|
< 0,001
|
| |
Monatliche Behandlungstage mit Akutmedikation über 12 Wochen
| |
Baseline
|
6,9
|
6,5
| |
Mittlere Veränderung gegenüber Baseline
|
-3,8
|
-2,3
| |
Unterschied gegenüber Placebo
|
-1,4
|
| |
p-Wert
|
< 0,001
|
| |
≥50% MMD-Responder über 12 Wochen
| |
Responder (%)
|
59
|
29
| |
Odds-Ratio (95%-CI)
|
3,55 (2,39; 5,28)
|
| |
p-Wert
|
< 0,001
|
| |
MSQ v.2.1 RFRa in Woche 12
| |
Baseline
|
46,6
|
46,6
| |
Mittlere Veränderung gegenüber Baseline
|
31,0
|
20,0
| |
Unterschied gegenüber Placebo
|
11,0
|
| |
p-Wert
|
< 0,001
|
|
aSocre auf dem Migraine Specific Quality of Life Questionnaire Version 2.1 im Bereich Role Function Restrictive
Abbildung 1 zeigt die mittlere Veränderung der MMD gegenüber Baseline in ADVANCE. Patienten, die mit AQUIPTA 60 mg einmal täglich behandelt wurden, wiesen im Vergleich zu Patienten, die Placebo erhielten, während der 12wöchigen Behandlungsphase eine grössere mittlere Verringerung der MMD gegenüber Baseline auf. Während des ersten Behandlungsmonats ergab sich unter AQUIPTA 60 mg einmal täglich im Vergleich zu Placebo eine grössere mittlere Verringerung der Anzahl wöchentlicher Migränetage gegenüber Baseline.
Abbildung 1: Veränderung der Anzahl monatlicher Migränetage gegenüber Baseline in ADVANCE
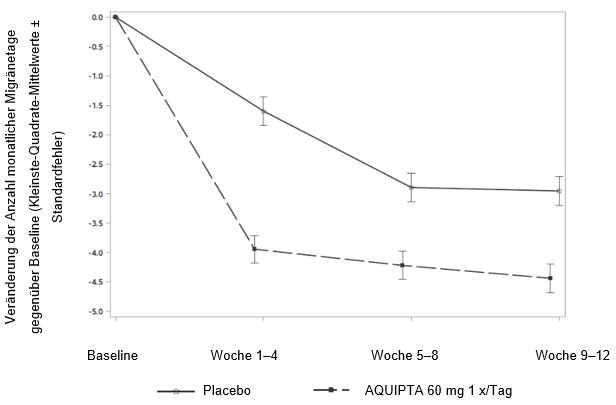
Langfristige Wirksamkeit
In einer offenen Studie, in der Patienten mit episodischer Migräne AQUIPTA 60 mg einmal täglich erhielten, wurde die Wirksamkeit bis zu 1 Jahr aufrechterhalten. 68,4% der Patienten schlossen die Behandlungsphase ab. Die Verringerung der mittleren Anzahl monatlicher Migränetage (Methode der kleinsten Quadrate) betrug im ersten Monat (Woche 1–4) -3,8 Tage und verbesserte sich im letzten Monat (Woche 49–52) auf eine mittlere Verringerung (Methode der kleinsten Quadrate) von -5,2 Tagen. Etwa 84%, 70% bzw. 48% der Patienten gaben in Woche 49–52 eine Verringerung der Anzahl monatlicher Migränetage um ≥50%, ≥75% bzw. 100% an.
Patienten mit vorherigem Versagen von zwei bis vier Klassen oraler prophylaktischer Behandlungen
In der ELEVATE-Studie wurden 315 erwachsene Patienten mit episodischer Migräne, bei denen zuvor zwei bis vier Klassen oraler prophylaktischer Behandlungen (z.B. Topiramat, trizyklische Antidepressiva, Betablocker) im Hinblick auf Wirksamkeit und/oder Verträglichkeit versagt hatten, im Verhältnis 1:1 randomisiert und erhielten zwölf Wochen lang entweder Atogepant 60 mg (n = 157) oder Placebo (n = 158). Die Ergebnisse dieser Studie stimmten mit den wichtigsten Ergebnissen früherer Studien zur Wirksamkeit bei episodischer Migräne überein und waren hinsichtlich der primären und sekundären Wirksamkeitsendpunkte statistisch signifikant, darunter mehrere Patientenfragebögen zur Bewertung der Funktionsfähigkeit. Die Behandlung mit Atogepant führte zu einer Verringerung der Anzahl MMD um 4,2 Tage im Vergleich zu 1,9 Tagen unter Placebo (p < 0,001) 50,6 % (78/154) der Patienten im Behandlungsarm mit Atogepant erreichten eine mindestens 50 %ige Reduktion der MMD gegenüber Baseline, verglichen mit 18,1 % (28/155) unter Placebo (Odds-Ratio [95%-CI]: 4,82 [2,85; 8,14]; p < 0,001).
Chronische Migräne
AQUIPTA wurde in einer randomisierten, multizentrischen, doppelblinden, placebokontrollierten Studie (PROGRESS) zur Prophylaxe chronischer Migräne (15 oder mehr Kopfschmerztage pro Monat mit mindestens 8 Migränetagen) untersucht. Die Patienten wurden randomisiert zu AQUIPTA 60 mg (N = 262) oder Placebo (N = 259) einmal täglich während 12 Wochen. Einer Untergruppe von Patienten (11%) wurde die Anwendung begleitender Migräneprophylaxe Medikamente (z.B. Amitriptylin, Propranolol, Topiramat) erlaubt. Die Akutbehandlung von Kopfschmerzen (d.h. Triptane, Ergotaminderivate, NSAR, Paracetamol und Opioide) war den Patienten erlaubt. Es wurden auch Patienten mit übermässiger Medikamentenanwendung der Akutmedikation und Kopfschmerzen infolge der übermässigen Medikamentenanwendung eingeschlossen.
Insgesamt schlossen 463 (89%) Patienten die 12wöchige doppelblinde Studie ab. Das mittlere Alter der Patienten betrug 42 Jahre (zwischen 18 und 74); 87% waren weiblich und 59% waren weiss. Die mittlere Migränehäufigkeit bei Baseline betrug etwa 19 Migränetage pro Monat und war in beiden Behandlungsarmen vergleichbar.
Der primäre Endpunkt zur Wirksamkeit war die Veränderung der mittleren MMD gegenüber Baseline über die 12wöchige Behandlungsphase.
Die Behandlung mit AQUIPTA zeigte in PROGRESS im Vergleich zu Placebo statistisch signifikante Verbesserung der primären und wichtigen multiplizitätskontrollierten sekundären Ergebnissen zur Wirksamkeit, wie in Tabelle 5 zusammengefasst.
Tabelle 5: Endpunkte zur Wirksamkeit in PROGRESS
|
|
AQUIPTA 60 mg
N = 257
|
Placebo
N = 249
| |
Anzahl monatlicher Migränetage (MMD) über 12 Wochen
| |
Baseline
|
19,2
|
19,0
| |
Mittlere Veränderung gegenüber Baseline
|
-6,8
|
-5,1
| |
Unterschied gegenüber Placebo
|
-1,7
|
| |
p-Wert
|
0,002
|
| |
Monatliche Kopfschmerztage über 12 Wochen
| |
Baseline
|
21,5
|
21,4
| |
Mittlere Veränderung gegenüber Baseline
|
-6,9
|
-5,2
| |
Unterschied gegenüber Placebo
|
-1,7
|
| |
p-Wert
|
0,002
|
| |
Monatliche Behandlungstage mit Akutmedikation über 12 Wochen
| |
Baseline
|
15,5
|
15,3
| |
Mittlere Veränderung gegenüber Baseline
|
-6,2
|
-4,1
| |
Unterschied gegenüber Placebo
|
-2,1
|
| |
p-Wert
|
0,002
|
| |
≥50% MMD-Responder über 12 Wochen
| |
Responder (%)
|
40
|
27
| |
Unterschied gegenüber Placebo (%)
|
14
|
| |
p-Wert
|
0,002
|
| |
MSQ v.2.1 RFRa in Woche 12
| |
Baseline
|
43,3
|
44,1
| |
Mittlere Veränderung gegenüber Baseline
|
23,1
|
17,3
| |
Unterschied gegenüber Placebo
|
5,8
|
| |
p-Wert
|
0,002
|
|
aScore auf dem Migraine Specific Quality of Life Questionnaire Version 2.1 im Bereich Role Function Restrictive
Abbildung 2 zeigt die mittlere Veränderung der MMD gegenüber Baseline in PROGRESS. Patienten, die mit AQUIPTA 60 mg einmal täglich behandelt wurden, wiesen im Vergleich zu Patienten, die Placebo erhielten, während der 12wöchigen Behandlungsphase eine grössere mittlere Verringerung der MMD gegenüber Baseline auf.
Abbildung 2: Veränderung der Anzahl monatlicher Migränetage gegenüber Baseline in PROGRESS
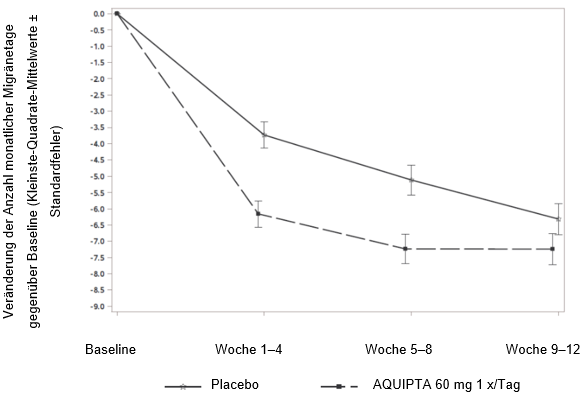
Pädiatrie
Es liegen keine Daten zur Anwendung bei Kindern und Jugendlichen unter 18 Jahren vor.
|


