Eigenschaften/WirkungenATC-Code
N07XX21
Wirkungsmechanismus
Eplontersen ist ein GalNAc-konjugiertes 2′-O-2-Methoxyethyl-(2′-MOE-)modifiziertes chimäres Gapmer-Antisense-Oligonukleotid (ASO) mit einem gemischten Grundgerüst aus Phosphorothioat-(PS-) und Phosphatdiester-(PO-)Internukleotidbindungen. Das GalNAc-Konjugat ermöglicht die zielgerichtete Einschleusung des ASO in Hepatozyten. Die selektive Bindung von Eplontersen an die TTR-Messenger-RNA (mRNA) in den Hepatozyten führt zum Abbau sowohl von mutierter als auch von (normaler) Wildtyp-TTR-mRNA. Dies verhindert die Synthese des TTR-Proteins in der Leber; die Folge ist eine signifikante Reduktion der Mengen von mutiertem und Wildtyp-TTR-Protein, die von der Leber in den Kreislauf sezerniert werden.
TTR ist ein Trägerprotein des retinolbindenden Proteins 4 (RBP4), des Hauptträgers von Vitamin A (Retinol). Deshalb ist zu erwarten, dass eine Reduktion von Plasma-TTR zu einer Senkung der Plasma-Retinolspiegel unter die Untergrenze des Normalbereichs führt.
Pharmakodynamik
In der klinischen Studie an Patienten mit ATTRv-PN, die Eplontersen erhielten, wurde eine Reduktion der TTR-Serumkonzentrationen bei der ersten Untersuchung (Woche 5) beobachtet, und die TTR-Konzentrationen nahmen bis Woche 35 weiter ab. Über die gesamte Behandlungsdauer (85 Wochen) hinweg wurde eine anhaltende Reduktion der TTR-Konzentration beobachtet. Der Mittelwert (SD) der prozentualen Reduktion der TTR-Serumkonzentration gegenüber dem Ausgangswert betrug 82,1 % (11,7) nach 35 Wochen, 83,0 % (10,4) nach 65 Wochen und 81,8 % (13,4) nach 85 Wochen unter Behandlung mit Eplontersen. Unabhängig von Geschlecht, ethnischer Abstammung, Alter, Region, Körpergewicht, Kardiomyopathie-Status, Vorbehandlung, Val30Met-Mutationsstatus, Krankheitsstadium und Diagnose einer familiären Amyloid-Kardiomyopathie (FAC) bei Studienbeginn wurde eine ähnliche Reduktion der TTR-Serumkonzentrationen gegenüber dem Ausgangswert im Vergleich zum Placebo beobachtet (Abbildung 1, a und b).
Abbildung 1: Forest-Plot der LSM-Behandlungsdifferenz für die prozentuale Veränderung vs. Ausgangswert von TTR (g/l) für wichtige Subgruppen (NEURO-TTRansform-Studie) (vollständiges Analysekollektiv)
a) in Woche 35
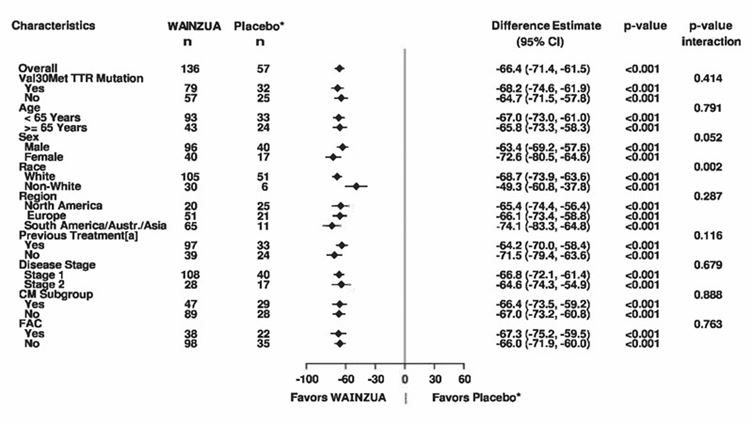
* Externe Placebogruppe aus einer anderen randomisierten, kontrollierten Studie (NEURO-TTR).
[a] Vorbehandelt mit Tafamidis oder Diflunisal.
Basierend auf MMRM adjustiert durch Propensity-Score-Gewichtung mit kategorischen Effekten für Behandlung, Zeit, Behandlung-Zeit-Interaktion und Krankheitsstadium, Val30Met-Mutation, Vorbehandlung sowie festen Kovariablen für die Baseline und die Baseline-Zeit-Interaktion.
Die Subgruppen-Modelle enthielten auch Behandlung-Subgruppe-, Zeit-Subgruppe- und Behandlung-Zeit-Subgruppe-Interaktionen. In die 35-Wochen-Zwischenanalyse wurden nur Daten bis Woche 35 einbezogen.
Die CM-Subgruppe umfasst Patienten mit entweder der Diagnose FAC bei Studieneintritt oder einer interventrikulären (IV) Septumwanddicke ≥13 mm zu Studienbeginn ohne Hypertonie [Anamnese oder Diagnose während der Studie].
Die LSM-Behandlungsdifferenzen nach 35 Wochen (WAINZUA – Placebo) sind mit 95%-KI (unadjustiert) aufgeführt.
KI = Konfidenzintervall, LSM = Least-Squares-Mittelwert, MMRM = Modell mit gemischten Effekten und Messwiederholung, TTR = Transthyretin, CM = Kardiomyopathie, FAC = familiäre Amyloid-Kardiomyopathie.
b) in Woche 65

* Externe Placebogruppe aus einer anderen randomisierten, kontrollierten Studie (NEURO-TTR).
[a] Vorbehandelt mit Tafamidis oder Diflunisal.
Basierend auf MMRM adjustiert durch Propensity-Score-Gewichtung mit kategorischen Effekten für Behandlung, Zeit, Behandlung-Zeit-Interaktion und Krankheitsstadium, Val30Met-Mutation, Vorbehandlung sowie festen Kovariablen für die Baseline und die Baseline-Zeit-Interaktion.
Die Subgruppen-Modelle enthielten auch Behandlung-Subgruppe-, Zeit-Subgruppe- und Behandlung-Zeit-Subgruppe-Interaktionen.
Die CM-Subgruppe umfasst Patienten mit entweder der Diagnose FAC bei Studieneintritt oder einer interventrikulären Septumwanddicke ≥13 mm zu Studienbeginn ohne Hypertonie [Anamnese oder Diagnose während der Studie].
Die LSM-Behandlungsdifferenzen nach 65 Wochen (WAINZUA – Placebo) sind mit 95%-KI (unadjustiert) aufgeführt.
KI = Konfidenzintervall, LSM = Least-Squares-Mittelwert, MMRM = Modell mit gemischten Effekten und Messwiederholung, TTR = Transthyretin, CM = Kardiomyopathie, FAC = familiäre Amyloid-Kardiomyopathie
Kardiale Elektrophysiologie
Formale QTc-Studien wurden mit WAINZUA nicht durchgeführt. Das Potenzial für eine QTc-Verlängerung durch Eplontersen wurde in einer randomisierten, placebokontrollierten Studie an gesunden Probanden untersucht. Bei einer Dosis in Höhe des 2,7-Fachen der empfohlenen Dosis von 45 mg Eplontersen wurde keine klinisch relevante Wirkung auf das QT-Intervall beobachtet.
Immunogenität
In der klinischen Studie an Patienten mit ATTRv-PN entwickelten nach einer 84wöchigen Behandlungszeit (mediane Behandlungsdauer 561 Tage (80 Wochen), Spannbreite 57 bis 582 Tage) 58 Patienten (40,3 %) behandlungsbedingte Anti-Drug-Antikörper (ADA).
Bei den Patienten, die positiv auf Anti-Eplontersen-Antikörper getestet wurden, zeigte sich keine klinisch bedeutsame Auswirkung auf die Wirksamkeit, Sicherheit, Pharmakokinetik oder Pharmakodynamik von WAINZUA.
Klinische Wirksamkeit
Die Wirksamkeit und Sicherheit von WAINZUA wurden in einer randomisierten, multizentrischen, offenen, extern kontrollierten Studie (NEURO-TTRansform) mit insgesamt 168 Patienten mit ATTRv PN untersucht. Die Patienten wurden im Verhältnis 6:1 für die Behandlung mit einer subkutanen Injektion von 45 mg WAINZUA (N = 144) alle 4 Wochen oder 284 mg Inotersen (N = 24) wöchentlich als Referenzgruppe randomisiert. Von den 144 Patienten, die für Eplontersen randomisiert wurden, durchliefen 140 (97,2 %) die Behandlung bis Woche 35, 135 (93,8 %) bis Woche 65 und 130 (90,3 %) bis Woche 85.
Eine externe Placebokontrolle bestand aus einer Placebokohorte von Patienten aus der zulassungsrelevanten Studie zu Inotersen, einer randomisierten, doppelblinden, placebokontrollierten, multizentrischen klinischen Studie an erwachsenen Patienten mit ATTRv-PN (NEURO-TTR). Diese Kohorte erhielt einmal wöchentlich subkutane Placebo-Injektionen. In beiden Studien galten identische Einschlusskriterien.
Die Merkmale der Eplontersen- und der externen Placebogruppe waren im Allgemeinen vergleichbar, und potenzielle Unausgewogenheiten der wesentlichen Ausgangsmerkmale (Val30Met-Mutationsstatus, Krankheitsstadium und Vorbehandlung) wurden in der vorgegebenen statistischen Analyse berücksichtigt. Die demografischen und krankheitsspezifischen Ausgangsmerkmale sind in Tabelle 2 aufgeführt.
Tabelle 2 Demografische und krankheitsspezifische Ausgangsmerkmale in der Studie NEURO-TTRansform (Sicherheitskollektiv)
|
|
Placebo
*(N = 60)
|
WAINZUA
(N = 144)
| |
Alter, Jahre
|
|
| |
Mittelwert (SD)
|
59,5 (14,1)
|
53,0 (15,0)
| |
Median (min, max)
|
63 (28, 81)
|
51,5 (24, 82)
| |
< 65, n (%)
|
34 (56,7)
|
100 (69,4)
| |
65-74, n (%)
|
17 (28,3)
|
36 (25,0)
| |
≥75, n (%)
|
9 (15,0)
|
8 (5,6)
| |
Männlich, n (%)
|
41 (68,3)
|
100 (69,4)
| |
Ethnie, n (%)
|
|
| |
Asiatisch
|
3 (5,0)
|
22 (15,4)
| |
Schwarz oder Afroamerikanisch
|
1 (1,7)
|
5 (3,5)
| |
Weiss
|
53 (88,3)
|
112 (78,3)
| |
Andere
|
2 (3,3)
|
3 (2,1)
| |
Mehrere
|
1 (1,7)
|
1 (0,7)
| |
Ethnische Zugehörigkeit, n (%)
|
|
| |
m
|
60
|
142
| |
Hispanisch oder Latino
|
7 (11,7)
|
22 (15,5)
| |
Vorbehandlung mit Tafamidis oder Diflunisal, n (%)
|
|
| |
Ja
|
36 (60,0)
|
100 (69,4)
| |
Krankheitsstadium der ATTRv-PN1, n (%)
|
|
| |
Stadium 1
|
42 (70,0)
|
115 (79,9)
| |
Stadium 2
|
18 (30,0)
|
29 (20,1)
| |
Kombinierter mNIS+7-Score, Mittelwert (SD)
|
74,8 (39,0)
|
81,3 (43,4)
| |
Norfolk QoL-DN-Gesamtscore,
|
|
| |
m
|
59
|
137
| |
Mittelwert (SD)
|
48,7 (26,8)
|
44,1 (26,6)
| |
Val30Met-TTR-Mutation, n (%)
|
|
| |
Ja2
|
33 (55,0)
|
85 (59,0)
| |
Nein3
|
27 (45,0)
|
59 (41,0)
| |
Glu89Gln, Glu109Gln
|
0
|
1 (0,7)
| |
Leu58His, Leu78His
|
3 (5,0)
|
4 (2,8)
| |
Phe64Leu, Phe84Leu
|
3 (5,0)
|
5 (3,5)
| |
Ser50Arg, Ser70Arg
|
1 (1,7)
|
2 (1,4)
| |
Ser77Tyr, Ser97Tyr, S97Y
|
5 (8,3)
|
3 (2,1)
| |
Thr49Ala, Thr69Ala
|
0
|
1 (0,7)
| |
Thr60Ala, Thr80Ala
|
8 (13,3)
|
4 (2,8)
| |
Val122Ile, Val142Ile
|
1 (1,7)
|
4 (2,8)
| |
Andere3
|
6 (10,0)
|
35 (24,3)
| |
NYHA-Klasse, n (%)
|
|
| |
I
|
40 (66,7)
|
105 (72,9)
| |
II
|
20 (33,3)
|
39 (27,1)
| |
Krankheitsdauer ab Diagnose der ATTRv-PN (Monate), Mittelwert (SD)
|
39,3 (40,3)
|
46,8 (58,1)
| |
Dauer seit Beginn der ATTRv-PN-Symptome (Monate), Mittelwert (SD)
|
64,0 (52,3)
|
67,7 (50,9)
| |
Diagnose Familiäre Amyloid-Kardiomyopathie (FAC)4, n (%)
|
|
| |
Kriterien zur Dokumentation der klinischen Diagnose einer FAC4, n (%)5
|
22 (36,7)
|
39 (27,1)
| |
Herzbiopsie
|
5 (22,7)
|
1 (2,6)
| |
Ergebnis der Echokardiographie
|
17 (77,3)
|
24 (61,5)
| |
Andere
|
0
|
24 (61,5)
| |
Krankheitsdauer ab der klinischen Diagnose einer FAC4 aus CRF (Monate), Mittelwert (SD)
|
21,0 (22,5)
|
18,5 (21,4)
| |
Dauer seit Beginn der FAC4-Symptome (Monate), Mittelwert (SD)
|
34,1 (29,3)
|
36,3 (63,8)
| |
NT-proBNP (pmol/l), Mittelwert (SD)
|
82,0 (159,2)
|
54,0 (122,6)
| |
Short Form 36 Item Health Survey (SF-36), Gesamtscore der körperlichen Komponente, Mittelwert (SD)
|
37,2 (9,8)
|
39,7 (9,3)
| |
Neuropathy Symptoms and Change (NSC), Gesamtscore, Mittelwert (SD)
|
23,0 (12,6)
|
23,1 (12,4)
| |
Polyneuropathy Disability (PND) Score, n (%)
|
|
| |
I
|
23 (38,3)
|
56 (39,2)
| |
II
|
19 (31,7)
|
61 (42,7)
| |
IIIa
|
15 (25,0)
|
16 (11,2)
| |
IIIb
|
3 (5,0)
|
10 (7,0)
| |
Body-Mass-Index (kg/m2)
|
|
| |
m
|
60
|
138
| |
Mittelwert (SD)
|
24,2 (4,9)
|
24,4 (4,9)
| |
Median (min, max)
|
23,8 (14,5, 39,8)
|
24,1 (15,4, 35,4)
| |
Modifizierter Body-Mass-Index (kg/m2 x g/l),
|
|
| |
m
|
60
|
138
| |
Mittelwert (SD)
|
1049,89 (228,43)
|
1025,78 (235,12)
| |
Median (min, max)
|
1027,55 (668,7, 1710,0)
|
1003,14 (615,7, 1714,0)
| |
Externe Placebogruppe aus einer anderen randomisierten, kontrollierten Studie (NEURO-TTR).
1 Das Krankheitsstadium ist definiert als Stadium 1 = benötigt keine Hilfe beim Gehen und Stadium 2 = benötigt Hilfe beim Gehen.
2 Umfasst die Genotypen V30M, V50M, V50M-MUTATION, VAL50MET und P.VAL50MET.
3 Basierend auf klinischer Datenbasis. Die Nicht-Val30Met-Mutationen umfassten: GLU89GLN, LEU58HIS, PHE64LEU, SER50ARG, SER77TYR, THR49ALA, THR60ALA, VAL122LLE und andere (darunter ALA97SER).
4 Familiäre Amyloid-Kardiomyopathie = Hereditäre Transthyretin-vermittelte Amyloidose mit Kardiomyopathie (ATTRv-CM).
5 Der Nenner für die Berechnung des Prozentsatzes ist die Anzahl an Patienten mit der Diagnose FAC.
Vom Datum der Einwilligungserklärung wurden nur Jahr und Monat erhoben, um die Krankheitsdauer ab der Diagnose und ab dem Beginn der Symptome der ATTRv-PN und FAC zu berechnen.
N = Anzahl an Patienten im Sicherheitskollektiv, n = Anzahl an Patienten in einer Subgruppe, m = Anzahl an Patienten mit nicht fehlenden Daten, falls verschieden von N, CRF = Prüfbogen, NT-proBNP = N-terminales natriuretisches Peptid vom proB-Typ, SD = Standardabweichung.
|
Von den 39 Patienten (27,1 %) in der Eplontersen-Gruppe, bei denen bei Studieneintritt eine TTR-Kardiomyopathie diagnostiziert wurde, wurden 41,0 % der Patienten der Klasse I der New York Heart Association (NYHA) und 59,0 % der Patienten der NYHA-Klasse II zugeordnet.
Analysen in Woche 35 (Zwischenanalysen)
Die primären Wirksamkeitsendpunkte waren die Veränderung der Transthyretin-(TTR) Serumkonzentration (siehe Abbildung 2) und des kombinierten modifizierten Neuropathy Impairment Scores + 7 (mNIS+7) bis Woche 35 gegenüber dem Ausgangswert. Der kombinierte mNIS+7-Score ist eine objektive Bewertung der Neuropathie und umfasst die kombinierten NIS- und Modified +7-Scores. In der in der Studie verwendeten Version des kombinierten mNIS+7-Scores misst der NIS objektiv die Defizite der Hirnnervenfunktion, Muskelkraft, Reflexe und Empfindungen, und der Modified +7 bewertet die Herzfrequenzreaktion auf tiefe Atmung, quantitative sensorische Tests (Berührungsdruck und Wärmeschmerz) und die Elektrophysiologie peripherer Nerven.
Die validierte Version des in der Studie verwendeten kombinierten mNIS+7-Scores reichte von -22,3 bis 346,3 Punkten, wobei höhere Scores für einen höheren Schweregrad der Erkrankung stehen.
Der sekundäre Endpunkt war die Veränderung des Gesamtscores des Fragebogens Norfolk Quality of Life – Diabetic Neuropathy (QoL-DN) gegenüber dem Ausgangswert. Die Norfolk QoL-DN-Skala ist eine Patientenselbstbeurteilung der subjektiven Erfahrung von Neuropathie in den folgenden Dimensionen: körperliche Funktionsfähigkeit/Large-Fibre-Neuropathie, Aktivitäten des täglichen Lebens, Symptomatik, Small-Fibre-Neuropathie und autonome Neuropathie. Die Version des in der Studie verwendeten Norfolk QoL-DN-Gesamtscores reichte von -4 bis 136 Punkten, wobei höhere Scores für eine stärkere Beeinträchtigung stehen.
WAINZUA zeigte eine statistisch signifikante Verbesserung im Vergleich zur externen Placebokontrolle nach 35 Wochen im Sinne einer Reduktion der TTR-Serumkonzentration mit einer prozentualen Veränderung von -66,43 % (95%-KI: --71,39 %, -61,47 %; p < 0,0001) (siehe Abbildung 2). WAINZUA zeigte eine statistisch signifikante Verbesserung im Vergleich zur externen Placebokontrolle nach 35 Wochen bezüglich des kombinierten mNIS+7-Scores mit einer LSM-Differenz von -9,0 (95%-KI: --13,5, -4,5; p < 0,0001) (siehe Abbildungen 3, 4a, 7a). WAINZUA zeigte eine statistisch signifikante Verbesserung im Vergleich zur externen Placebokontrolle nach 35 Wochen bezüglich des Norfolk QoL-DN-Gesamtscores mit einer LSM-Differenz von -11,8 (95%-KI: --16,8, -6,8; p < 0,0001) (Tabelle 3 und Abbildungen 5, 6a, 8a).
Analysen in Woche 65/66 (Abschlussanalysen)
Die koprimären Endpunkte für das primäre Studienziel bei der Abschlussanalyse in Woche 66 waren die prozentuale Veränderung der TTR-Serumkonzentration nach 65 Wochen gegenüber dem Ausgangswert, die Veränderung des kombinierten mNIS+7-Scores in Woche 66 gegenüber dem Ausgangswert und die Veränderung des Norfolk QoL-DN-Gesamtscores in Woche 66 gegenüber dem Ausgangswert. Die Reduktion der TTR-Serumkonzentration hielt bis Woche 65 an. Darüber hinaus entsprachen die Ergebnisse in Woche 66 für den kombinierten mNIS+7- und den Norfolk-Gesamtscore den Ergebnissen nach 35 Wochen (siehe Tabelle 3 und Abbildungen 3, 4b, 5, 6b).
Die sekundären Endpunkte waren die Veränderung der Neuropathy Symptoms and Change (NSC) in Woche 66 und Woche 35 gegenüber dem Ausgangswert, die Veränderung des körperlichen Komponenten-Scores (PCS) des Short Form 36 Item Health Survey (Version 2) (SF-36) in Woche 65 gegenüber dem Ausgangswert, die Veränderung des Polyneuropathy Disability (PND) Scores in Woche 65 gegenüber dem Ausgangswert und die Veränderung des modifizierten Body-Mass-Index (mBMI) bis Woche 65 gegenüber dem Ausgangswert.
Der NSC war ein patientenbeantworteter Fragebogen zur Quantifizierung der Art, Verteilung und Schwere der Muskelschwäche, sensorischen Symptome, Schmerzsymptome und autonomen Symptome. Höhere Scores stehen für stärkere Symptome.
Der SF-36 PCS umfasste 4 Skalen zur Bewertung der körperlichen Funktion, Rolleneinschränkungen durch körperliche Probleme, körperlichen Schmerzen und des allgemeinen Gesundheitszustands. Höhere Scores stehen für einen besseren allgemeinen Gesundheitszustand.
Der PND kategorisiert die Behinderung anhand der Mobilität (z.B. Notwendigkeit eines Gehstocks, einer Gehstütze, eines Rollstuhls oder Bettlägerigkeit). Höhere PND-Scores stehen für stärkere Behinderung.
Der modifizierte BMI (BMI × Serumalbumin) ist eine akzeptable Methode zur Bewertung des Ernährungsstatus bei ATTR. Höhere Scores stehen für einen besseren Ernährungsstatus und gelten als Indikator für ein längeres Überleben von Patienten mit ATTRv-PN.
Alle sekundären Endpunkte zeigten eine statistisch signifikante Überlegenheit gegenüber dem externen Placebo (siehe Tabelle 4).
Tabelle 3: Behandlungseffekt in Bezug auf die primären und wichtigsten sekundären Endpunkte (NEURO-TTRansform-Studie) (vollständiges Analysekollektiv)
|
Analyse/Endpunkt
|
Baseline, Mittelwert (SD)
|
LSM-Veränderung/Prozentuale Veränderung vs. Baseline, (SE) [95%-KI]
|
WAINZUA – Externes Placebo* LSM-Differenz
(95%-KI)
|
p-Wert
| |
Externes Placebo*
|
WAINZUA
|
Externes Placebo*
|
WAINZUA
| |
Woche 35
|
N = 59
|
N = 140
|
N = 59
|
N = 140
|
|
| |
Serum-TTR, g/l 1,
|
0,15 (0,04)
|
0,23 (0,08)
|
|
|
|
| |
Prozentuale Veränderung vs. Baseline
|
|
|
-14,8 % (2,0)
[-18,73, -10,80]
|
-81,2 % (1,7)
[-84,55, -77,84]
|
-66,4 %
(-71,39, -61,47)
|
p < 0,0001
| |
Kombinierter mNIS+7-Score 2,3
|
74,1 (39,0)
|
79,6 (42,3)
|
|
|
|
| |
Veränderung vs. Baseline
|
|
|
9,2 (1,9)
[5,54, 12,91]
|
0,2 (1,9)
[-3,46, 3,89]
|
-9,0
(-13,48, -4,54)
|
p < 0,0001
| |
Norfolk QoL-DN-Gesamtscore 2,3
|
48,6
(27,0)
|
43,5
(26,3)
|
|
|
|
| |
Veränderung vs. Baseline
|
|
|
8,7 (2,1)
[4,53, 12,81]
|
-3,1 (2,1)
[-7,19, 0,96]
|
-11,8
(-16,82, -6,76)
|
p < 0,0001
| |
Woche 65/66
|
N = 59
|
N = 141
|
N = 59
|
N = 141
|
|
| |
Serum-TTR, g/l 1
|
0,15 (0,04)
|
0,23 (0,08)
|
|
|
|
| |
Prozentuale Veränderung vs. Baseline
|
|
|
-11,2 % (1,9)
[-15,06, -7,41]
|
-81,7 % (1,6)
[-84,82, -78,48]
|
-70,4 %
(-75,17, -65,66)
|
p < 0,00014
| |
Kombinierter mNIS+7-Score 1
|
74,1 (39,0)
|
79,8 (42,3)
|
|
|
|
| |
Veränderung vs. Baseline
|
|
|
25,1 (2,4)
[20,23, 29,88]
|
0,3 (2,4)
[-4,46, 5,06]
|
-24,8
(-30,96, -18,56)
|
p < 0,00014
| |
Norfolk QoL-DN-Gesamtscore 1
|
48,6 (27,0)
|
43,3 (26,2)
|
|
|
|
| |
Veränderung vs. Baseline
|
|
|
14,2 (2,4)
[9,51, 18,97]
|
-5,5 (2,3)
[-10,03, -0,96]
|
-19,7
(-25,63, -13,84)
|
p < 0,00014
|
* Externe Placebogruppe aus einer anderen randomisierten, kontrollierten Studie (NEURO-TTR).
1 Basierend auf MMRM adjustiert durch Propensity-Score-Gewichtung mit festen kategorischen Effekten für Behandlung, Zeit, Behandlung-Zeit-Interaktion und Krankheitsstadium, Val30M-Mutation, Vorbehandlung sowie festen Kovariablen für den Ausgangswert und die Baseline-Zeit-Interaktion. In die Analyse nach 66 Wochen wurden nur Daten bis Woche 66 einbezogen.
2 Basierend auf einem ANCOVA-Modell adjustiert durch Propensity Score mit den Effekten Behandlung, Krankheitsstadium, Val30M-Mutation, Vorbehandlung und Ausgangswert. In die Zwischenanalyse wurden nur Daten bis Woche 35 einbezogen.
3 Bei Teilnehmenden mit fehlendem mNIS+7 oder Norfolk QoL-DN in Woche 35 wurde der Wert unter Verwendung eines Imputationsmodells nach dem Verfahren der der multiplen Imputation erzeugt. Jeder von 500 imputierten Datensätzen wurde mittels einfachem ANCOVA-Modell analysiert, und die 500 Ergebnisse des ANCOVA-Modells wurden unter Verwendung der Rubin-Regeln kombiniert.
4 Nicht formal getestet aufgrund von statistisch signifikanten Ergebnissen in Woche 35.
Die Analyse basierte auf Daten, die bis zu 52 Tage nach der letzten Dosis des Studienpräparates erfasst wurden. Daten aus der Zwischenanalyse in Woche 35 und Daten aus Woche 65/66 aus der Analyse in Woche 66. Im vollständigen Analysekollektiv umfasste die Eplontersen-Gruppe 140 Teilnehmende nach 35 Wochen und 141 Teilnehmende nach 66 Wochen. Ein Teilnehmer hatte keine mNIS+7- oder Norfolk QoL-DN-Bewertung in Woche 35, aber eine Bewertung für mindestens einen dieser Parameter in Woche 66.
ANCOVA = Kovarianzanalyse, KI = Konfidenzintervall, LSM = Least-Squares-Mittelwert, MMRM = Modell mit gemischten Effekten und Messwiederholung, mNIS+7 = modifizierter Neuropathy Impairment Score +7, N = Anzahl an Teilnehmenden in der Gruppe, Norfolk QoL-DN = Norfolk Quality of Life – Diabetic Neuropathy Questionnaire, SD = Standardabweichung, SE = Standardfehler, TTR = Transthyretin.
Tabelle 4: Hierarchische Prüfung der sekundären Endpunkte (NEURO-TTRansform-Studie)
|
|
|
|
Vergleich WAINZUA vs. externes Placebo*
| |
Sekundärer Endpunkt/
Behandlungsgruppe (N)
|
n
|
Veränderung vs. Baseline
LSM (95%-KI)
|
Schätzung
|
95%-KI
|
p-Wert
| |
LSM-Veränderung des NSC vs. Baseline in Woche 66
| |
WAINZUA (N = 141)
|
132
|
0,0 (-1,92, 1,86)
|
-8,2
|
-10,65, -5,76
|
< 0,0001
| |
Externes Placebo* (N = 59)
|
52
|
8,2 (6,24, 10,12)
| |
LSM-Veränderung des NSC vs. Baseline in Woche 35
| |
WAINZUA (N = 141)
|
141
|
0,8 (-0,92, 2,50)
|
-3,9
|
-6,08, -1,80
|
0,0005
| |
Externes Placebo* (N = 59)
|
56
|
4,7 (2,98, 6,48)
| |
LSM-Veränderung des SF-36 PCS vs. Baseline in Woche 65
| |
WAINZUA (N = 141)
|
136
|
0,85 (-0,711, 2,412)
|
5,31
|
3,195, 7,416
|
< 0,0001
| |
Externes Placebo* (N = 59)
|
50
|
-4,46 (-6,139, -2,770)
| |
LSM-Veränderung des PND-Scores vs. Baseline in Woche 65
| |
WAINZUA (N = 141)
|
134
|
0,1 (0,0, 0,2)
|
-0,2
|
-0,4, 0,0
|
0,0241
| |
Externes Placebo* (N = 59)
|
51
|
0,3 (0,2, 0,4)
| |
LSM-Veränderung des mBMI vs. Baseline in Woche 65
| |
WAINZUA (N = 141)
|
130
|
-8,1 (-28,55, 12,42)
|
82,7
|
54,64, 110,76
|
< 0,0001
| |
Externes Placebo* (N = 59)
|
49
|
-90,8 (-112,84, -68,69)
|
* Externe Placebogruppe aus einer anderen randomisierten, kontrollierten Studie (NEURO-TTR).
N = Anzahl an Patienten im vollständigen Analysekollektiv in Woche 66.
n = Anzahl an Patienten mit nicht fehlenden Daten für Baseline-Kovariablen und Veränderung vs. Baseline zum betreffenden Zeitpunkt.
Die Analyse basierte auf Daten, die bis zu 28 Tage nach der letzten Dosis des Studienpräparates erfasst wurden. Das Analyse-Besuchszeitfenster von Woche 65 erstreckt sich von Tag 419 bis Tag 479.
Basierend auf einem Modell mit gemischten Effekten und Messwiederholung (MMRM) adjustiert durch Propensity-Score-Gewichtung mit festen kategorischen Effekten für Behandlung, Zeit, Behandlung-Zeit-Interaktion und Krankheitsstadium, Val30M-Mutation, Vorbehandlung sowie festen Kovariablen für den Ausgangswert und die Baseline-Zeit-Interaktion. In die Abschlussanalyse nach 66 Wochen wurden nur Daten bis Woche 65 einbezogen.
KI = Konfidenzintervall, LSM = Least-Squares-Mittelwert, mBMI = modifizierter Body-Mass-Index, NSC = Neuropathy Symptoms and Change, PND = Polyneuropathy Disability, PCS = körperlicher Komponenten-Score, SF-36 PCS = Short Form-36 Health Survey Questionnaire Physical Component Score.
Abbildung 2: Prozentuale LSM-Veränderung der TTR-Serumkonzentration von Baseline bis Woche 65, WAINZUA vs. externes Placebo* bis Woche 65 (NEURO-TTRansform-Studie) (vollständiges Analysekollektiv)
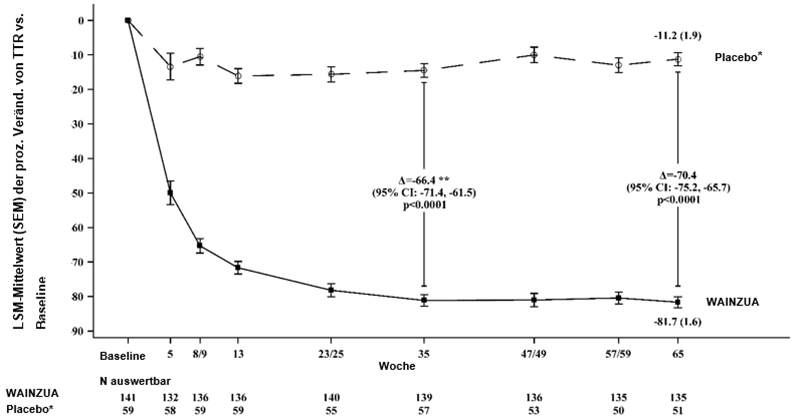
* Externe Placebogruppe aus einer anderen randomisierten, kontrollierten Studie (NEURO-TTR).
** Behandlungsdifferenz entspricht den Ergebnissen der formalen Zwischenanalyse in Woche 35. In die Zwischenanalyse in Woche 35 wurden nur Daten bis Woche 35 einbezogen.
Basierend auf MMRM adjustiert durch Propensity-Score-Gewichtung mit festen kategorischen Effekten für Behandlung, Zeit, Behandlung-Zeit-Interaktion und Krankheitsstadium, Val30Met-Mutation, Vorbehandlung sowie festen Kovariablen für den Ausgangswert und die Baseline-Zeit-Interaktion.
Die Analyse basierte auf Daten, die bis zu 28 Tage nach der letzten Dosis des Studienpräparates erfasst wurden. Daten bis Woche 65 sind einbezogen. Placebo wurde zur Baseline sowie in den Wochen 5, 8, 13 23, 35, 47, 59 und 65 bewertet; WAINZUA wurde zur Baseline sowie in den Wochen 5, 9, 13, 25, 35, 49, 57 und 65 bewertet.
Die LS-Mittelwert-Behandlungsdifferenzen nach 35 Wochen und 65 Wochen (WAINZUA – Placebo) sind mit 95%-KI (unadjustiert) aufgeführt.
KI = Konfidenzintervall, LSM = Least-Squares-Mittelwert, SEM = Standardfehler des Mittelwertes, MMRM = Modell mit gemischten Effekten und Messwiederholung, TTR = Transthyretin.
Abbildung 3: LSM-Veränderung des kombinierten mNIS+7-Scores vs. Baseline (NEURO-TTRansform-Studie) (vollständiges Analysekollektiv)
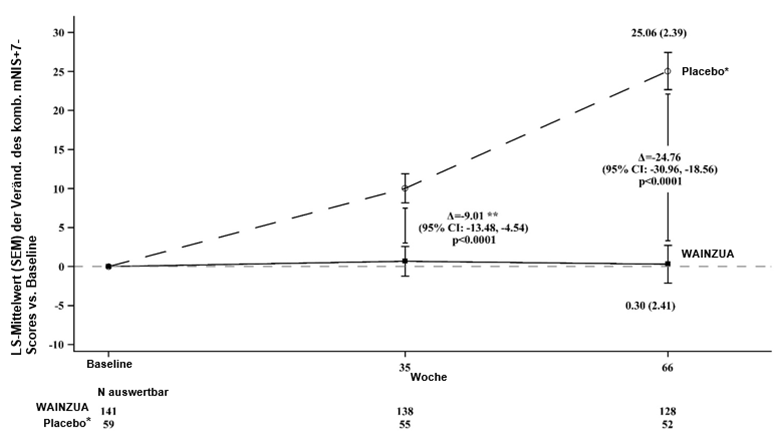
* Externe Placebogruppe aus einer anderen randomisierten, kontrollierten Studie (NEURO-TTR).
** Behandlungsdifferenz entspricht den Ergebnissen der formalen Zwischenanalyse in Woche 35. Basierend auf MI ANCOVA adjustiert durch Propensity-Score-Gewichtung mit festen kategorischen Effekten für Behandlung, Krankheitsstadium, Val30Met-Mutation, Vorbehandlung sowie festen Kovariablen für den Ausgangswert. In die Zwischenanalyse in Woche 35 wurden nur Daten bis Woche 35 einbezogen.
Die Analyse in Woche 66 basierte auf MMRM adjustiert durch Propensity Score-Gewichtung mit kategorischen Effekten für Behandlung, Zeit, Behandlung-Zeit-Interaktion und Krankheitsstadium, Val30Met-Mutation, Vorbehandlung sowie festen Kovariablen für die Baseline und die Baseline-Zeit-Interaktion.
Die Analyse basierte auf Daten, die bis zu 52 Tage nach der letzten Dosis des Studienpräparates erfasst wurden. Daten bis Woche 66 sind einbezogen.
Die LS-Mittelwert-Behandlungsdifferenzen nach 35 Wochen und 66 Wochen (WAINZUA – Placebo) sind mit 95%-KI (unadjustiert) aufgeführt.
KI = Konfidenzintervall, LS-Mittelwert = Least-Squares-Mittelwert, SEM = Standardfehler des Mittelwertes, MI ANCOVA = Kovarianzanalyse mit multipler Imputation, MMRM = Modell mit gemischten Effekten und Messwiederholung.
Abbildung 4: Histogramm der Veränderung des kombinierten mNIS+7-Scores vs. Baseline (NEURO-TTRansform-Studie) (Sicherheitsanalysekollektiv)
a) in Woche 35
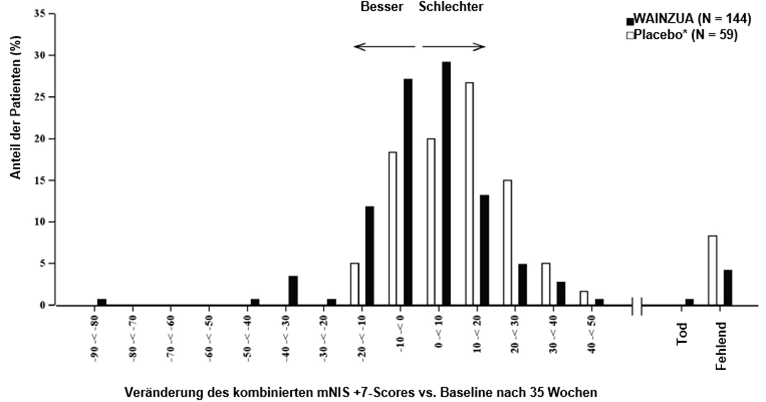
* Externe Placebogruppe aus einer anderen randomisierten, kontrollierten Studie (NEURO-TTR).
b) in Woche 66
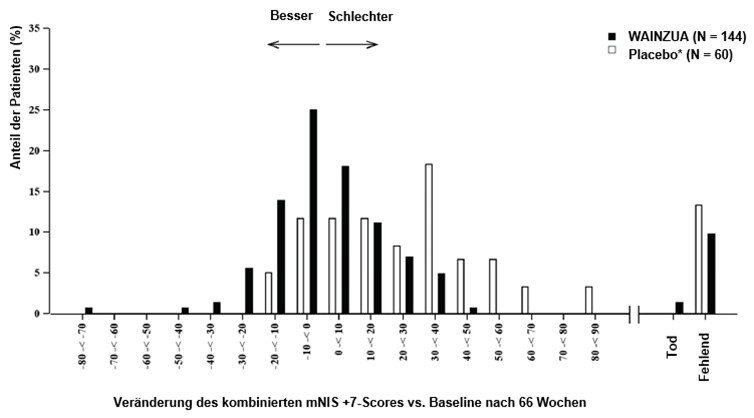
* Externe Placebogruppe aus einer anderen randomisierten, kontrollierten Studie (NEURO-TTR).
Abbildung 5: LSM-Veränderung des Norfolk QoL-DN-Gesamtscores vs. Baseline (NEURO-TTRansform-Studie)
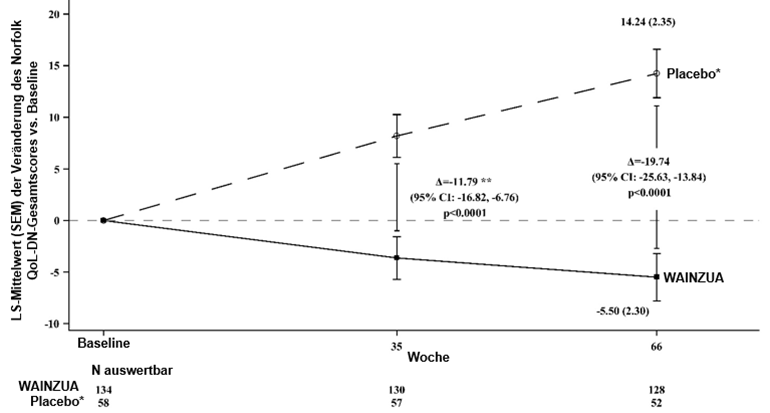
* Externe Placebogruppe aus einer anderen randomisierten, kontrollierten Studie (NEURO-TTR).
** Behandlungsdifferenz entspricht den Ergebnissen der formalen Zwischenanalyse in Woche 35. Basierend auf MI ANCOVA adjustiert durch Propensity-Score-Gewichtung mit festen kategorischen Effekten für Behandlung, Krankheitsstadium, Val30Met-Mutation, Vorbehandlung sowie festen Kovariablen für den Ausgangswert. In die Zwischenanalyse in Woche 35 wurden nur Daten bis Woche 35 einbezogen.
Die Analyse in Woche 66 basierte auf MMRM adjustiert durch Propensity-Score-Gewichtung mit kategorischen Effekten für Behandlung, Zeit, Behandlung-Zeit-Interaktion und Krankheitsstadium, Val30Met-Mutation, Vorbehandlung sowie festen Kovariablen für die Baseline und die Baseline-Zeit-Interaktion.
Die Analyse basierte auf Daten, die bis zu 52 Tage nach der letzten Dosis des Studienpräparates erfasst wurden. Daten bis Woche 66 sind einbezogen.
Die LS-Mittelwert-Behandlungsdifferenzen nach 35 Wochen und 66 Wochen (WAINZUA – Placebo) sind mit 95%-KI (unadjustiert) aufgeführt.
KI = Konfidenzintervall, LS-Mittelwert = Least-Squares-Mittelwert, SEM = Standardfehler des Mittelwertes, MI ANCOVA = Kovarianzanalyse mit multipler Imputation, MMRM = Modell mit gemischten Effekten und Messwiederholung.
Abbildung 6: Histogramm der Veränderung des Norfolk QoL-DN-Gesamtscores vs. Baseline (NEURO-TTRansform-Studie) (Sicherheitsanalysekollektiv)
a) in Woche 35
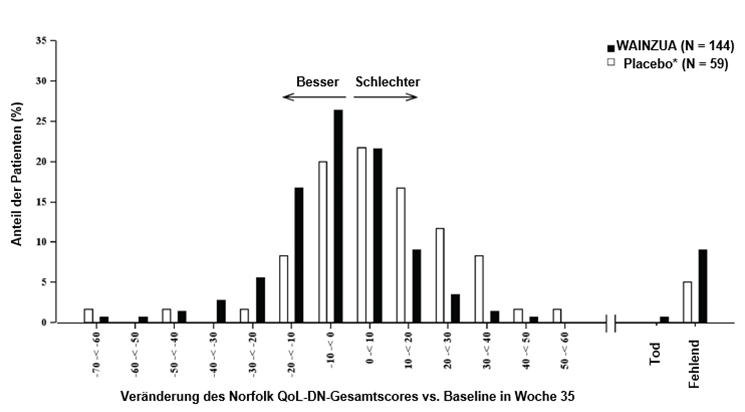
* Externe Placebogruppe aus einer anderen randomisierten, kontrollierten Studie (NEURO-TTR).
b) in Woche 66
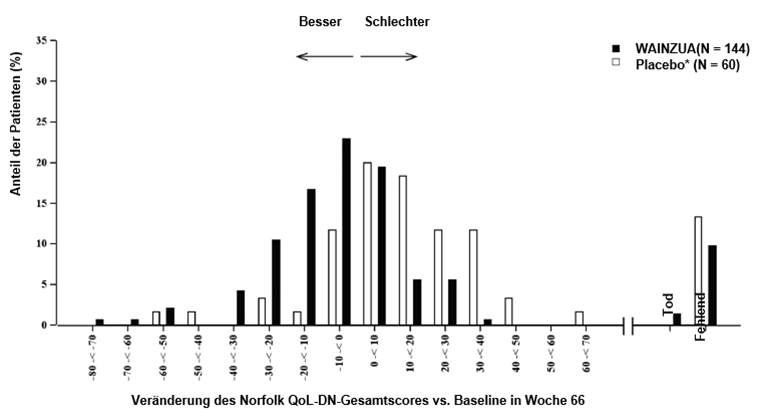
* Externe Placebogruppe aus einer anderen randomisierten, kontrollierten Studie (NEURO-TTR).
Sowohl in Woche 35 als auch in Woche 65/66 zeigten Patienten unter WAINZUA ähnliche Verbesserungen gegenüber Placebo in Bezug auf die Reduktion der TTR-Serumkonzentration, den kombinierten mNIS+7- und den Norfolk QoL-DN-Gesamtscore in allen Subgruppen einschliesslich Alter, Geschlecht, Ethnie, Region, Val30Met-Mutationsstatus, Kardiomyopathie-Status, Baseline-FAC-Diagnose und Krankheitsstadium (Abbildungen 1a und b, 7a und b sowie 8a und b).
Abbildung 7: Forest-Plot der LSM-Behandlungsdifferenz bezüglich der Veränderung des kombinierten mNIS+7-Scores vs. Baseline für wichtige Subgruppen (NEURO-TTRansform-Studie) (vollständiges Analysekollektiv)
a) in Woche 35
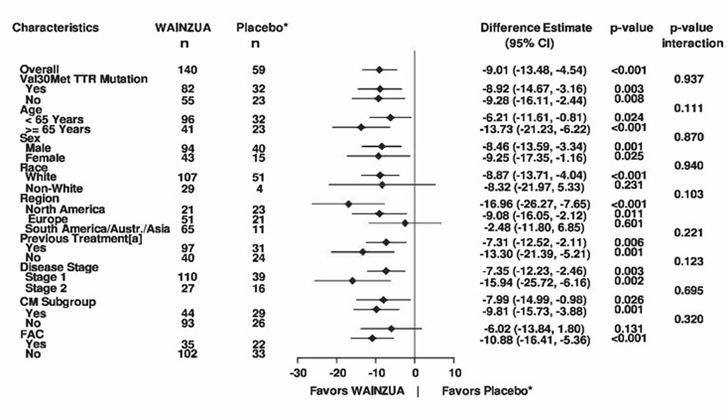
* Externe Placebogruppe aus einer anderen randomisierten, kontrollierten Studie (NEURO-TTR).
[a] Vorbehandelt mit Tafamidis oder Diflunisal.
Die CM-Subgruppe umfasst Patienten mit der Diagnose einer FAC bei Studieneintritt oder einer IV-Septumwanddicke ≥13 mm zu Studienbeginn ohne Hypertonie [Anamnese oder Diagnose während der Studie].
Die LS-Mittelwert-Differenz, Konfidenzintervalle und p-Werte basieren auf einem ANCOVA-Modell adjustiert durch Propensity Score mit den Effekten Behandlung, Subgruppenfaktoren, Krankheitsstadium, Val30Met-Mutation, Vorbehandlung, Behandlung-Subgruppe-Interaktion und Ausgangswert. In die 35-Wochen-Analyse wurden Daten bis Woche 35 einbezogen.
b) in Woche 66
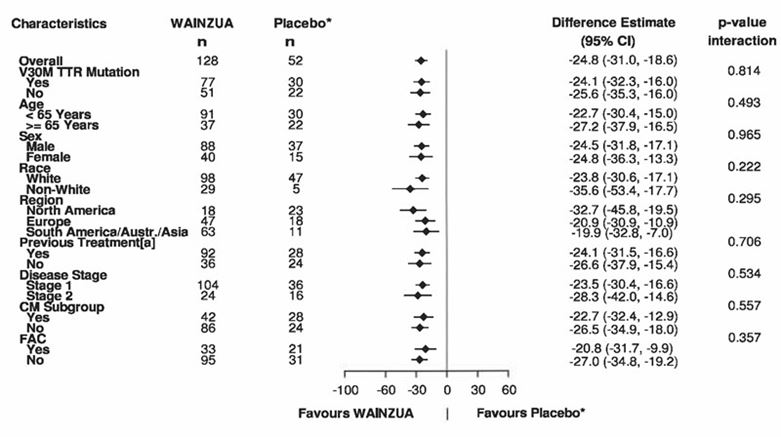
* Externe Placebogruppe aus einer anderen randomisierten, kontrollierten Studie (NEURO-TTR).
[a] Vorbehandelt mit Tafamidis oder Diflunisal.
Basierend auf MMRM adjustiert durch Propensity-Score-Gewichtung mit kategorischen Effekten für Behandlung, Zeit, Behandlung-Zeit-Interaktion und Krankheitsstadium, Val30Met-Mutation, Vorbehandlung sowie festen Kovariablen für die Baseline und die Baseline-Zeit-Interaktion.
Die Subgruppen-Modelle enthielten auch Behandlung-Subgruppe-, Zeit-Subgruppe- und Behandlung-Zeit-Subgruppe-Interaktionen. Daten bis Woche 66 sind einbezogen.
Die CM-Subgruppe umfasst Patienten mit der Diagnose einer FAC bei Studieneintritt oder einer IV-Septumwanddicke ≥13 mm zu Studienbeginn ohne Hypertonie [Anamnese oder Diagnose während der Studie].
Die LSM-Behandlungsdifferenzen nach 66 Wochen (WAINZUA – Placebo) sind mit 95%-KI (unadjustiert) aufgeführt.
KI = Konfidenzintervall, LSM = Least-Squares-Mittelwert, MMRM = Modell mit gemischten Effekten und Messwiederholung, CM = Kardiomyopathie, FAC = familiäre Amyloid-Kardiomyopathie.
Abbildung 8: Forest-Plot der LSM-Behandlungsdifferenz bezüglich der Veränderung des Norfolk QoL-DN-Gesamtscores vs. Baseline für wichtige Subgruppen (NEURO-TTRansform-Studie) (vollständiges Analysekollektiv)
a) in Woche 35
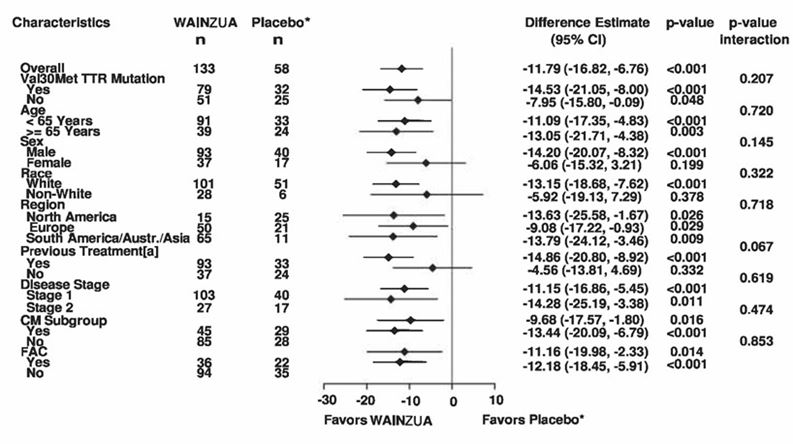
* Externe Placebogruppe aus einer anderen randomisierten, kontrollierten Studie (NEURO-TTR).
[a] Vorbehandelt mit Tafamidis oder Diflunisal.
Die CM-Subgruppe umfasst Patienten mit der Diagnose einer FAC bei Studieneintritt oder einer IV-Septumwanddicke ≥13 mm zu Studienbeginn ohne Hypertonie [Anamnese oder Diagnose während der Studie].
Die LS-Mittelwert-Differenz, Konfidenzintervalle und p-Werte basieren auf einem ANCOVA-Modell adjustiert durch Propensity Score mit den Effekten Behandlung, Subgruppenfaktoren, Krankheitsstadium, Val30Met-Mutation, Vorbehandlung, Behandlung-Subgruppe-Interaktion und Ausgangswert. In die 35-Wochen-Zwischenanalyse wurden nur Daten bis Woche 35 einbezogen.
b) in Woche 66

* Externe Placebogruppe aus einer anderen randomisierten, kontrollierten Studie (NEURO-TTR).
[a] Vorbehandelt mit Tafamidis oder Diflunisal.
Basierend auf MMRM adjustiert durch Propensity-Score-Gewichtung mit kategorischen Effekten für Behandlung, Zeit, Behandlung-Zeit-Interaktion und Krankheitsstadium, Val30Met-Mutation, Vorbehandlung sowie festen Kovariablen für die Baseline und die Baseline-Zeit-Interaktion.
Die Subgruppen-Modelle enthielten auch Behandlung-Subgruppe-, Zeit-Subgruppe- und Behandlung-Zeit-Subgruppe-Interaktionen. Daten bis Woche 66 sind einbezogen.
Die CM-Subgruppe umfasst Patienten mit der Diagnose einer FAC bei Studieneintritt oder einer IV-Septumwanddicke ≥13 mm zu Studienbeginn ohne Hypertonie [Anamnese oder Diagnose während der Studie].
Die LSM-Behandlungsdifferenzen nach 66 Wochen (WAINZUA – Placebo) sind mit 95%-KI (unadjustiert) aufgeführt.
KI = Konfidenzintervall, LSM = Least-Squares-Mittelwert, MMRM = Modell mit gemischten Effekten und Messwiederholung, CM = Kardiomyopathie, FAC = familiäre Amyloid-Kardiomyopathie.
In einer explorativen Analyse der kardialen Untersuchungen mittels serieller Echokardiogramme zeigte WAINZUA eine Verbesserung im E/e'-Verhältnis (ein Mass für die linksventrikuläre diastolische Funktion) nach 65-wöchiger Behandlung in der Kardiomyopathie-Subgruppe (adjustierte placebokontrollierte LS-Mittelwert-Differenz: 3,94 [95%-KI 6,46, 1,42]). Veränderungen in Richtung eines Nutzens von WAINZUA gegenüber Placebo in Woche 66 wurden auch beobachtet bezüglich der vorgegebenen explorativen kardialen Endpunkten mittlere LV-linksventrikuläre (LV) Wanddicke (LSM-Differenz -0,04 cm [95%-KI -0,12, 0,04]), Wanddicke des Ventrikelseptums (LSM-Differenz -0,05 cm [95%-KI -0,16, 0,06]) und NT proBNP, ein prognostischer Biomarker der kardialen Dysfunktion (geometrischer LSM 0,88, [95%-KI 0,68, 1,14]) beobachtet. Trotz dieser beobachteten Werte ist ein klinischer Nutzen bei Kardiomyopathie noch zu bestätigen.
Analyse in Woche 85 (Analyse bei Behandlungsende)
Daten aus Woche 85 liegen für die externe Placebogruppe nicht vor, da die Behandlungsdauer in der Studie NEURO-TTR nur 66 Wochen betrug.
Der beobachtete Effekt in der mit WAINZUA behandelten Gruppe bezüglich des kombinierten mNIS+7-Scores war gleichbleibend und hielt bis zum Behandlungsende in Woche 85 an. Die mittlere (SD) Veränderung des kombinierten mNIS+7-Scores vs. Baseline betrug -0,04 % (16,2) in Woche 35, -0,21 % (17,6) in Woche 66 und -2,9 % (20,5) in Woche 85. Der mittlere Norfolk QoL-DN-Gesamtscore blieb bis Woche 85 stabil. In der Eplontersen-Gruppe betrug die mittlere (SD) Veränderung des Norfolk QoL-DN-Gesamtscores vs. Baseline -4,8 (16,5) in Woche 35, -7,2 (18,5) in Woche 66 und 6,2 (18,0) in Woche 85.
Die Parameter NSC, PND und mBMI blieben bis Woche 85 stabil, während der SF-36 weiterhin eine Tendenz zur Verbesserung zeigte.
|













