Eigenschaften/WirkungenATC-Code
D11AH10
Wirkungsmechanismus
Lebrikizumab ist ein monoklonaler Immunglobulin(IgG4)-Antikörper, der mit hoher Affinität an Interleukin(IL)-13 bindet und selektiv die IL-13-Signalübertragung über den IL-4-Rezeptor-alpha(IL-4Rα)/IL-13-Rezeptor-alpha-1(IL-13Rα1)-Heterodimer hemmt, wodurch die nachgelagerten Wirkungen von IL-13 inhibiert werden. Es wird erwartet, dass die Inhibition der IL-13-Signaltransduktion bei Krankheiten von Nutzen sein wird, bei denen IL-13 wesentlich zur Pathogenese der Krankheit beiträgt. Lebrikizumab verhindert nicht die Bindung von IL-13 an den IL-13-Rezeptor alpha 2 (IL-13Rα2 oder Decoy-Rezeptor), was die Internalisierung von IL-13 in die Zelle ermöglicht.
Pharmakodynamik
In klinischen Studien zu Lebrikizumab reduzierte Lebrikizumab die Konzentrationen von Periostin im Serum, Gesamt-Immunglobulin E (IgE), CC-Chemokin-Ligand(CCL)17 [thymus and activation-regulated chemokine (TARC)], CCL18 [[pulmonary and activation-regulated chemokine (PARC)] und CCL13 [monocyte chemotactic protein-4 (MCP-4)]. Die Abnahme der Typ-2-Entzündungsmediatoren liefert indirekte Hinweise auf eine Hemmung des IL-13-Signalwegs durch Lebrikizumab.
Klinische Wirksamkeit
Erwachsene und Jugendliche mit atopischer Dermatitis
Die Wirksamkeit und Sicherheit von Lebrikizumab als Monotherapie (ADvocate-1, ADvocate-2) und mit begleitenden TCS (ADhere) wurden in drei randomisierten, doppelblinden, placebokontrollierten pivotalen Studien bei 1062 Erwachsenen und Jugendlichen (im Alter von 12 bis 17 Jahren und mit einem Gewicht von ≥40 kg) mit mittelschwerer bis schwerer atopischer Dermatitis, definiert als Eczema Area and Severity Index (EASI) ≥16, Investigator's Global Assessment (IGA) ≥3 und betroffener Körperoberfläche (BSA) ≥10 %, untersucht. Patienten, die in die drei Studien aufgenommen wurden, hatten zuvor ein unzureichendes Ansprechen auf topische Medikamente oder topische Behandlungen kamen aus medizinischen Gründen nicht in Frage (letzteres Kriterium galt nicht für die Studie ADhere).
In allen drei Studien erhielten die Patienten eine Anfangsdosis von 500 mg Lebrikizumab (zwei 250mg-Injektionen) in Woche 0 und 2, gefolgt von 250 mg alle zwei Wochen (Q2W) bis Woche 16 oder entsprechend Placebo im Verhältnis 2:1. In ADhere erhielten die Studienpatienten auch begleitend TCS mit niedriger bis mittlerer Wirkstärke oder TCI auf aktive Läsionen. Die Patienten durften nach Ermessen des Prüfarztes eine Rescue-Therapie zur Behandlung unzumutbarer Symptome der atopischen Dermatitis erhalten. Bei Patienten, die eine systemische Rescue-Therapie benötigten, wurde die Behandlung abgesetzt.
Patienten, die IGA 0 oder 1 oder eine mindestens 75%ige Reduktion des EASI (EASI 75) ohne Erhalt einer Rescue-Therapie erreichten, wurden erneut randomisiert, um verblindet bis zu 52 Wochen (i) Lebrikizumab 250 mg alle zwei Wochen (Q2W), (ii) Lebrikizumab 250 mg alle 4 Wochen (Q4W) oder (iii) entsprechend Placebo zu erhalten.
In ADvocate-1 und ADvocate-2 wurde den Patienten nach Abschluss der 52-wöchigen Studie bzw. nach Abschluss der 16-wöchigen Studie in ADhere die Möglichkeit angeboten, die Behandlung in einer separaten Langzeit-Verlängerungsstudie (ADjoin) fortzusetzen.
Endpunkte
In allen drei Studien waren die co-primären Endpunkte der Anteil der Patienten mit IGA 0 oder 1 («erscheinungsfrei» oder «fast erscheinungsfrei») mit einer Reduktion um ≥2 Punkte gegenüber Baseline und der Anteil der Patienten, der eine Reduktion des EASI-Werts um mindestens 75% (EASI 75) von Baseline bis Woche 16 erreichten. Zu den wichtigsten sekundären Endpunkten gehörte der Prozentsatz der Patienten, der eine Reduktion des EASI-Werts um mindestens 90% (EASI 90), der Prozentsatz der Patienten mit einer Verbesserung um mindestens 4 Punkte gegenüber Baseline auf der numerischen Pruritus-Bewertungsskala (Pruritus-NRS), der Prozentsatz der Patienten mit einer Verbesserung um mindestens 4 Punkte gegenüber Baseline im Dermatology Life Quality Index (DLQI) erreichte und Beeinträchtigung des Schlafes durch Juckreiz (Schlafverlust-Skala). Ein zusätzlicher sekundärer Endpunkt war die Veränderung des POEM-Wertes (Patient Oriented Eczema Measure) gegenüber Baseline.
Patienten
Baseline-Merkmale
Die demografischen Merkmale und Ausgangsdaten der Patienten aus den Studien ADvocate-1, ADvocate-2 und ADhere sind in Tabelle 2 dargestellt.
Tabelle 2. Demografische Daten und Baseline-Merkmale nach Studie
|
|
ADvocate-1 N = 424
|
ADvocate-2 N = 427
|
ADhere N = 211
| |
Alter (Mittelwert, Jahre)
|
35,5
|
36,2
|
37,2
| |
Jugendliche (12 bis 17 Jahre) (%)
|
13,0
|
11,0
|
21,8
| |
Ältere Patienten (≥65 Jahre) (%)
|
7,3
|
7,7
|
9,5
| |
Gewicht (Mittelwert, kg)
|
77,7
|
76,5
|
76,2
| |
Weiblich (%)
|
50,5
|
49,4
|
48,8
| |
Ethnische Zugehörigkeit
|
|
|
| |
Weiss (%)
|
68,2
|
59,3
|
61,6
| |
Asiatisch (%)
|
16,5
|
28,6
|
14,7
| |
Schwarz (%)
|
11,6
|
8,2
|
13,3
| |
IGA 3 (mittelschwere AD) (%)
|
59,7
|
63,2
|
69,2
| |
IGA 4 (schwere AD) (%)
|
40,3
|
36,8
|
30,8
| |
Vorherige systemische Behandlung (%)*
|
54,0
|
55,5
|
47,4
| |
EASI (Mittelwert)
|
29,6
|
29,7
|
27,3
| |
Pruritus-NRS (Mittelwert)
|
7,3
|
7,1
|
7,1
| |
DLQI (Mittelwert)
|
15,4
|
15,5
|
14,4
| |
Schlafverlust-Skala (Mittelwert)
|
2,3
|
2,2
|
2,0
| |
POEM (Mittelwert)
|
20,8
|
20,8
|
19,5
|
*Kortikosteroide, Cyclosporine, Phototherapie und Dupilumab (nur ADhere)
Klinisches Ansprechen
Monotherapiestudien (ADvocate-1 und ADvocate-2) – Induktionsphase, Woche 0-16
In ADvocate-1 und ADvocate-2 erreichten in Woche 16 unter Lebrikizumab 250 mg Q2W signifikant mehr Patienten IGA 0 oder 1 mit einer Verbesserung um ≥2 Punkte gegenüber Baseline, EASI 75, EASI 90 und eine Verbesserung um ≥4 Punkte auf der Pruritus-NRS im Vergleich zu Placebo (siehe Tabelle 3).
Tabelle 3. Ergebnisse zur Wirksamkeit der Lebrikizumab-Monotherapie in ADvocate-1 und ADvocate-2 in Woche 16
|
|
ADvocate-1
|
ADvocate-2
| |
|
Woche 16
| |
|
Placebo
N = 141
|
LEB 250 mg Q2W
N = 283
|
Placebo
N = 146
|
LEB
250 mg Q2W
N = 281
| |
IGA 0 oder 1, %a
|
12,7
|
43,1*
|
10,8
|
33,2*
| |
EASI 75, %b
|
16,2
|
58,8*
|
18,1
|
52,1*
| |
EASI 90, %b
|
9,0
|
38,3*
|
9,5
|
30,7*
| |
Pruritus-NRS (Verbesserung um ≥4 Punkte), %c
|
13,0
|
45,9*
|
11,5
|
39,8*
|
LEB = Lebrikizumab; N = Anzahl an Patienten
a Patienten mit einem IGA von 0 oder 1 («erscheinungsfrei» oder «beinahe erscheinungsfrei») mit einer Reduktion um >2 Punkte gegenüber Baseline auf einer IGA-Skala von 0-4
b Patienten mit einer Reduktion des EASI um 75% oder 90% von Baseline to Week 16.
c Der Prozentsatz wird relativ zur Anzahl der Patienten mit einer Baseline-Pruritus-NRS ≥4 berechnet.
* p<0,001 vs. Placebo
In den beiden Studien benötigten weniger Patienten, die auf Lebrikizumab randomisiert wurden, eine Rescue-Therapie (topische Kortikosteroide, systemische Kortikosteroide, Immunsuppressiva) als Patienten, die nach Randomisierung Placebo erhielten (14,7% bzw. 36,6% in beiden Studien).
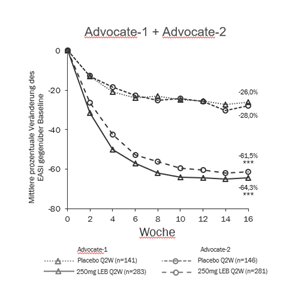
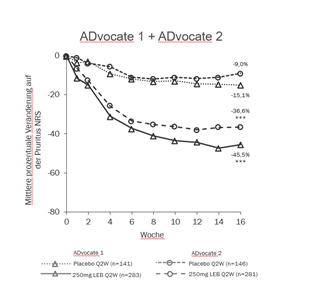
Abbildung 1 und Abbildung 2 zeigen die mittlere prozentuale Veränderung in EASI und Pruritus-NRS von Baseline bis Woche 16.
|
Abbildung 1. Mittlere prozentuale EASI-Veränderung von Baseline bis Woche 16 in ADvocate 1 und 2
|
Abbildung 2. Mittlere prozentuale Veränderung auf der Pruritus-NRS von Baseline bis Woche 16 in ADvocate 1 und 2
| |
|
|
|
|
***p<0,001 vs. Placebo
Die Behandlungseffekte in Untergruppen (Gewicht, Alter, Geschlecht, ethnische Zugehörigkeit, Schweregrad der Erkrankung und vorherige Anwendung von systemischen Therapien) in ADvocate-1 und ADvocate-2 stimmten mit den Ergebnissen in der gesamten Studienpopulation während der Induktionsphase überein.
Monotherapiestudien (ADvocate-1 und ADvocate-2) – Erhaltungszeitraum, Wochen 16-52
Zur Beurteilung der Aufrechterhaltung des Ansprechens wurden 157 Patienten aus ADvocate-1 und 134 Patienten aus ADvocate-2, die mit Lebrikizumab 250 mg Q2W behandelt wurden und in Woche 16 IGA 0 oder 1 bzw. EASI 75 ohne topische oder systemische Rescue-Therapie erreichten, erneut verblindet im Verhältnis 2:2:1 randomisiert. Die Patienten erhielten über weitere 36 Wochen verblindet entweder (i) Lebrikizumab 250 mg Q2W, (ii) Lebrikizumab 250 mg Q4W oder (iii) Placebo. Die Gesamtdauer der Studie betrug 52 Wochen (siehe Tabelle 4).
Tabelle 4. Ergebnisse zur Wirksamkeit der Lebrikizumab-Monotherapie in ADvocate-1 und ADvocate-2 in Woche 52 bei Patienten, die in ADvocate-1 und ADvovate-2 in Woche 16 auf die Behandlung ansprachen (gepoolte Analyse)
|
|
ADvocate-1 und ADvocate-2 (gepoolt)
| |
|
Woche 52
| |
|
Placebod
(LEB Absetzen)
N=60
|
LEB 250 mg
Q2W
N=113
|
LEB 250 mg
Q4W
N=118
| |
IGA 0 oder 1, %a
|
47,9
|
71,2*
|
76,9**
| |
EASI 75, %b
|
66,4
|
78,4
|
81,7*
| |
EASI 90, %b
|
41,9
|
64,0*
|
66,4**
| |
Pruritus-NRS (Verbesserung um ≥4 Punkte), %c
|
66,3
|
84,6
|
84,7
|
a Patienten mit IGA 0/1 mit einer Verbesserung um ≥2 Punkte gegenüber Baseline in Woche 16, die in Woche 52 weiterhin IGA 0/1 mit einer Verbesserung um ≥2 Punkte aufwiesen.
b Patienten, die in Woche 16 EASI 75 erreichten und in Woche 52 weiterhin EASI 75 aufwiesen oder Patienten, die in Woche 16 EASI 75 erreichten und in Woche 52 EASI 90 aufwiesen.
c Der Prozentsatz wird relativ zur Anzahl der Patienten mit einer Baseline-Pruritus-NRS ≥4 berechnet.
d Patienten, die in Woche 16 auf Lebrikizumab 250 mg Q2W ansprachen (IGA 0 oder 1 oder EASI 75) und dann auf Placebo randomisiert wurden.
*p<0.05; ** p<0.01 versus placebo.
Begleitende TCS-Studie (ADhere)
In ADhere erreichte von Baseline bis Woche 16 ein signifikant grösserer Anteil der Patienten, die nach Randomisierung Lebrikizumab 250 mg Q2W + TCS erhielten, IGA 0 oder 1, EASI 75 und Verbesserungen um ≥4 Punkte in der Pruritus-NRS als unter Placebo + TCS (siehe Tabelle 5).
Tabelle 5. Ergebnisse zur Wirksamkeit der Lebrikizumab-Kombinationstherapie mit TCS in Woche 16 in ADhere
|
|
ADhere
| |
|
Woche 16
| |
|
Placebo + TCS
N = 66
|
LEB
250 mg Q2W + TCS
N = 145
| |
IGA 0 oder 1, %a
|
22,1
|
41,2*
| |
EASI 75, %b
|
42,2
|
69,5**
| |
EASI 90, %b
|
21,7
|
41,2**
| |
Pruritus-NRS (Verbesserung um ≥4 Punkte), %c
|
31,9
|
50,6*
|
a Patienten mit einem IGA von 0 oder 1 («erscheinungsfrei» oder «fast erscheinungsfrei») mit einer Reduktion um ≥2 Punkte gegenüber Baseline auf einer IGA-Skala von 0-4
b Patienten mit einer Reduktion des EASI um 75% oder 90% von Baseline bis Woche 16.
c Der Prozentsatz wird relativ zur Anzahl der Patienten mit einem Baseline-Pruritus NRS ≥4 berechnet.
*p<0,05; **p<0,001 vs. Placebo
In ADhere wendeten Patienten, die von Woche 0 bis 16 Lebrikizumab 250 mg Q2W+TCS erhielten, seltener TCS an, als Patienten, die Placebo + TCS erhielten (1,4% bzw. 4,5%).
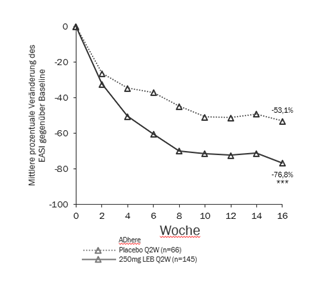
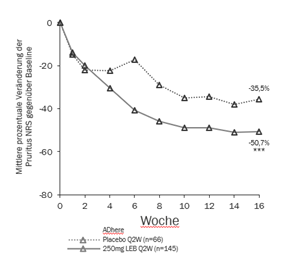
Abbildung 3 und Abbildung 4 zeigen die mittlere prozentuale Veränderung des EASI gegenüber Baseline und die mittlere prozentuale Veränderung auf der Pruritus NRS im Vergleich zur Baseline bis Woche 16.
|
Abbildung 3. Mittelwert der prozentualen Veränderung der Least squares (kleinsten Quadrate) des EASI gegenüber Baseline aus der ADhere
|
Abbildung 4. Mittelwert der prozentualen Veränderung der Least squares (kleinsten Quadrate) der Pruritus NRS gegenüber Baseline aus der ADhere
| |
|
|
|
|
***p<0.001 vs Placebo ***p<0.001 vs Placebo
In ADhere stimmten die Behandlungseffekte in Untergruppen (Gewicht, Alter, Geschlecht, ethnische Zugehörigkeit, Schweregrad der Erkrankung und vorherige Anwendung von systemischen Therapien) mit den Ergebnissen in der gesamten Studienpopulation überein.
Bei Patienten, die in ADhere in Woche 16 ansprachen und in ADjoin eintraten und entweder mit Lebrikizumab 250 mg Q2W oder Q4W behandelt wurden, blieb das Ansprechen bis zu 56 Wochen erhalten (75,4% bzw. 86,8% für IGA 0 oder 1 sowie 85,6% bzw. 81,2% für EASI 75).
Patient-reported outcome und gesundheitsbezogene Lebensqualität
In beiden Monotherapiestudien (ADvocate-1 und ADvocate-2) verbesserte Lebrikizumab 250 mg Q2W signifikant die von den Patienten subjektiv angegebenen Ergebnisse in Bezug auf den Schweregrad der Erkrankung (POEM), die Beeinträchtigung des Schlafs durch Juckreiz (Schlafverlust-Skala) und die gesundheitsbezogene Lebensqualität (DLQI) in Woche 16 im Vergleich zu Placebo. Ein signifikant grösserer Anteil der mit Lebrikizumab behandelten Patienten erzielte klinisch bedeutsame Verbesserungen im DLQI (definiert als ≥4-Punkte-Reduktion gegenüber Baseline), POEM und der Schlafverlust-Skala von Baseline bis Woche 16 im Vergleich zur Placebogruppe (siehe Tabelle 6).
In der TCS-Studie (ADhere) verbesserte Lebrikizumab 250 mg Q2W + TCS die Beeinträchtigung des Schlafes durch Juckreiz (Schlafverlust-Skala), den vom Patienten angegebenen Schweregrad der Erkrankung (POEM) und die gesundheitsbezogene Lebensqualität (DLQI) in Woche 16 gegenüber Placebo + TCS (siehe Tabelle 6).
Tabelle 6. Patient-reported outcomes (gesundheitsbezogene Lebensqualitätsergebnisse) der Lebrikizumab-Monotherapie in Woche 16 in ADvocate-1 und ADvocate-2 oder mit begleitender TCS-Therapie in Woche 16 in ADhere
|
|
ADvocate-1
|
ADvocate-2
|
ADhere
| |
|
Woche 16
| |
|
Placebo
N = 141
|
LEB 250 mg Q2W
N = 283
|
Placebo
N = 146
|
LEB 250 mg Q2W
N = 281
|
Placebo + TCS
N = 66
|
LEB 250 mg Q2W + TCS
N = 145
| |
DLQI (Erwachsene) (Verbesserung um ≥4 Punkte), %a
|
33,8
|
75,6**
|
33,6
|
66,3**
|
58,7
|
77,4*
| |
Schlafverlust-Skala (Sleep-Loss-Scale) (Verbesserung um ≥2 Punkte), %b
|
4,7
|
39.0**
|
8,2
|
28,0**
|
18,4
|
34,5*
| |
POEM; Veränderung des LS-Mittelwerts gegenüber Baseline (± SE)
|
-3,9
(± 0,72)
|
-11,3**
(± 0,47)
|
-3,5
(± 0,77)
|
-9,5**
(± 0,52)
|
-6,24
(± 1,04)
|
-10,23**
(± 0,73)
|
LS = least squares (mittlere Quadrate), SE = Standardfehler
a Teilnehmer mit DLQI ≥4 Punkten bei Baseline
b Teilnehmer mit ≥2 Punkten in der Schlafverlust-Skala bei Baseline
*p<0,05; **p<0,001 vs. Placebo
Jugendliche (von 12 bis 17 Jahren)
In den Monotherapiestudien ADvocate-1 und ADvocate-2 lag das Durchschnittsalter der jugendlichen Patienten bei 14,6 Jahren, das Durchschnittsgewicht bei 68,2 kg, und 56,9% waren weiblich. In diesen Studien hatten 63,7% einen IGA-Ausgangswert von 3 (mittelschwere atopische Dermatitis ), 36,3% hatten einen IGA-Ausgangswert (Baseline) von 4 (schwere atopische Dermatitis) und 47,1% hatten zuvor eine systemische Behandlung erhalten. In der begleitenden Studie mit TCS (ADhere) lag das Durchschnittsalter der jugendlichen Patienten bei 14,6 Jahren, das Durchschnittsgewicht bei 62,2 kg, und 50,0% waren weiblich. In dieser Studie hatten 76,1% einen IGA-Ausgangswert von 3 (mittelschwere atopische Dermatitis), 23,9% einen IGA-Ausgangswert von 4 (schwere atopische Dermatitis), und 23,9% hatten zuvor eine systemische Behandlung erhalten.
Die Ergebnisse zur Wirksamkeit in Woche 16 bei jugendlichen Patienten sind in Tabelle 7 dargestellt.
Tabelle 7. Ergebnisse zur Wirksamkeit der Lebrikizumab-Monotherapie in ADvocate-1, ADvocate-2 und der Lebrikizumab-Kombinationstherapie mit TCS in ADhere der jugendlichen Patienten in Woche 16
|
|
ADvocate-1
|
ADvocate-2
|
ADhere
| |
|
Woche 16
| |
|
Placebo
N=18
|
LEB
250 mg Q2W
N=37
|
Placebo
N=17
|
LEB
250 mg Q2W
N=30
|
Placebo + TCS
N=14
|
LEB
250 mg Q2W + TCS
N=32
| |
IGA 0 oder 1, %a
|
22.2
|
48.6
|
5.9
|
44.1**
|
28.6
|
57.3
| |
EASI 75, %a
|
22.2
|
62.2**
|
12.0
|
61.7**
|
57.1
|
88.0*
| |
EASI 90, %a
|
16.7
|
45.9*
|
6.1
|
34.3*
|
28.6
|
55.1
| |
Pruritus NRS (Verbesserung um ≥4-Punkte), %b
|
22.8
|
54.3*
|
0.3
|
42.1
|
13.8
|
45.8
| |
a
In Woche 16, Patienten mit einem IGA von 0 oder 1 («erscheinungsfrei» oder «fast erscheinungsfrei») mit einer Reduktion um ≥2 Punkte gegenüber Baseline auf einer IGA-Skala von 0-4 oder Reduktion des EASI um 75% oder 90% von Baseline bis Woche 16.
b Der Prozentsatz wird relativ zur Anzahl der Patienten mit einem Baseline-Pruritus NRS ≥4 berechnet.
*p<0.05; **p<0.01 versus placebo.
|
Bei jugendlichen Patienten, die mit Lebrikizumab bzw. Lebrikizumab + TCS behandelt wurden, wurden klinisch bedeutsame Verbesserungen des Schweregrads der Erkrankung erzielt und das Ansprechen blieb bis Woche 52 erhalten. Zusätzliche Daten aus der einarmigen ADore-Studie mit Lebrikizumab bei 206 Jugendlichen untermauern die Wirksamkeit von Lebrikizumab bei jugendlichen Patienten bis zu 52 Behandlungswochen.
|




