ZusammensetzungWirkstoffe
Insulinum icodecum (gentechnisch hergestellt mithilfe rekombinanter DNA-Technologie in Saccharomyces cerevisiae).
Hilfsstoffe
Glycerolum, Metacresolum, Phenolum, Zinci acetas, Natrii chloridum, Acidum hydrochloridum (zur pH-Einstellung), Natrii hydroxidum (zur pH-Einstellung), Aqua ad iniectabile pro 1 ml.
Die Injektionslösung enthält 0.46 mg/ml Natrium.
Indikationen/AnwendungsmöglichkeitenBehandlung des Diabetes mellitus bei Erwachsenen.
Dosierung/AnwendungDieses Arzneimittel ist ein Basalinsulin für die einmal wöchentliche subkutane Verabreichung. Es ist dafür bestimmt, immer am selben Wochentag angewendet zu werden.
Awiqli ist in einer Stärke, nämlich 700 Einheiten/ml, verfügbar. Die benötigte Dosis wird in Einheiten eingestellt. Es können Dosen zwischen 10 und 700 Einheiten pro Injektion in Schritten von 10 Einheiten verabreicht werden.
Bei Patienten mit Diabetes mellitus Typ 2 kann dieses Arzneimittel allein oder in Kombination mit oralen Antidiabetika, GLP-1-Rezeptoragonisten und Bolusinsulin verabreicht werden (siehe «Klinische Wirksamkeit»). Bei Beginn der Therapie mit diesem Arzneimittel wird empfohlen, den Bedarf oder die Dosierung von blutzuckersenkenden Mitteln wie Sulfonylharnstoffen und Gliniden neu zu bewerten.
Bei Patienten mit Diabetes mellitus Typ 1 muss dieses Arzneimittel mit Bolusinsulin kombiniert werden, um den Insulinbedarf zu den Mahlzeiten zu decken.
Dokumentation der Chargennummer
Um die Rückverfolgbarkeit von biotechnologisch hergestellten Arzneimitteln sicherzustellen, wird empfohlen Handelsname und Chargennummer bei jeder Behandlung zu dokumentieren.
Übliche Dosierung
Awiqli ist gemäss dem Bedarf des jeweiligen Patienten zu dosieren. Es wird empfohlen, die glykämische Kontrolle durch eine Dosisanpassung auf der Basis des Nüchternglukosewerts im Plasma zu optimieren.
Aufgrund der langen Halbwertszeit von Insulin icodec wird eine Anpassung der Dosis während einer akuten Erkrankung oder bei kurzfristigen Abweichungen vom körperlichen Aktivitätsniveau oder der üblichen Ernährung des Patienten nicht empfohlen. Für diese Situationen sollten die Patienten angewiesen werden, ihren behandelnden Arzt bzw. ihre behandelnde Ärztin zu konsultieren, um weitere Instruktionen zu anderen möglichen Anpassungen zu erhalten, z.B. Glukoseaufnahme oder Änderungen bei anderen blutzuckersenkenden Arzneimitteln.
Therapieeinleitung
Patienten mit Diabetes mellitus Typ 2 (Insulin-naiv)
Die empfohlene wöchentliche Startdosis beträgt 70 Einheiten. Danach sollten einmal wöchentlich individuelle Dosisanpassungen erfolgen.
Patienten mit neu diagnostiziertem Diabetes mellitus Typ 1
Die Sicherheit und Wirksamkeit von Awiqli bei neu diagnostizierten, insulin-naiven Typ-1-Diabetes-mellitus-Patienten wurde nicht nachgewiesen. Es liegen keine Daten vor (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Umstellung von einmal oder zweimal täglich angewendeten Basalinsulinprodukten auf Awiqli bei Diabetes mellitus Typ 2 und Typ 1
Die erste einmal wöchentliche Dosis von Awiqli sollte am Tag nach der letzten Dosis des einmal oder zweimal täglich angewendeten Basalinsulins angewendet werden.
Bei der Umstellung von Patienten von einem einmal oder zweimal täglich angewendeten Basalinsulin beträgt die empfohlene einmal wöchentliche Dosis von Awiqli das 7-Fache der Gesamt-Tagesdosis des vorherigen Basalinsulins. Je nach glykämischer Kontrolle und Behandlungsziel des Patienten kann zu Beginn der Umstellung einmalig eine zusätzlich um 50 % erhöhte Awiqli Dosis verabreicht werden (d.h. die initiale Dosis beträgt dann, wie in Tabelle 1 illustriert, das 1.5-Fache der vorherigen täglichen Basalinsulindosis x 7, auf die nächste 10er-Einheit gerundet). Bei der Beurteilung des möglichen Bedarfs einer einmaligen zusätzlichen Dosis sollten die Risiken hypoglykämischer Ereignisse (inklusive durch Medikationsfehler) gegenüber einer temporären Verschlechterung der Glykämie (Hyperglykämie) abgewogen werden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Ab der zweiten Injektion darf diese einmalige Zusatzdosis nicht mehr angewendet werden. Die zweite einmal wöchentliche Dosis von Awiqli beträgt das 7-Fache der Gesamt-Tagesdosis des bisherigen Basalinsulins.
Die dritte und alle weiteren einmal wöchentlichen Dosen sollten abhängig vom metabolischen Bedarf des Patienten, den Glukosemessergebnissen im Blut und dem Ziel der glykämischen Kontrolle eingestellt werden, bis der gewünschte Nüchternglukosewert im Plasma erreicht ist. Die Dosisanpassungen sollten basierend auf den Nüchternglukosewerten am Tag der Titration und den beiden vorherigen Tagen vorgenommen werden.
Während der Umstellung und in den nachfolgenden Wochen wird eine engmaschige Überwachung der Glukosewerte empfohlen. Bei Patienten, die initial einmalig eine zusätzliche Dosis Awiqli anwenden, können Medikationsfehler bei der darauffolgenden Injektion in Woche 2 auftreten (siehe «Warnhinweise und Vorsichtsmassnahmen»). Darüber hinaus ist es eventuell erforderlich, die Dosen und Verabreichungszeiten gleichzeitig angewendeter Bolusinsuline oder anderer begleitender Antidiabetika anzupassen.
Tabelle 1: Dosis von Awiqli bei der Umstellung von einmal oder zweimal täglich angewendetem Basalinsulin bei Patienten mit Diabetes mellitus Typ 2 und Typ 1, falls initial (Woche 1) einmalig eine zusätzliche Dosis verabreicht wird
|
Bisherige Gesamt-Tagesdosis des einmal oder zweimal täglich angewendeten Basalinsulins (Einheiten)
|
Einmal wöchentliche Dosis von Awiqli a
| |
Woche 1b
(Einheiten)
|
Woche 2 (Einheiten)c
| |
10
|
110
|
70
| |
11
|
120
|
80
| |
12
|
130
|
80
| |
13
|
140
|
90
| |
14
|
150
|
100
| |
15
|
160
|
110
| |
16
|
170
|
110
| |
17
|
180
|
120
| |
18
|
190
|
130
| |
19
|
200
|
130
| |
20
|
210
|
140
| |
21
|
220
|
150
| |
22
|
230
|
150
| |
23
|
240
|
160
| |
24
|
250
|
170
| |
25
|
260
|
180
| |
26
|
270
|
180
| |
27
|
280
|
190
| |
28
|
290
|
200
| |
29
|
300
|
200
| |
30
|
320
|
210
| |
40
|
420
|
280
| |
50
|
530
|
350
| |
100
|
1050d
|
700
|
a Alle Dosen sind auf die nächsten 10 Einheiten gerundet.
b Bisherige Gesamt-Tagesdosis Basalinsulin multipliziert mit 7 plus einmalige Zusatzdosis von 50 %
c Bisherige Gesamt-Tagesdosis Basalinsulin multipliziert mit 7
d Wenn die erforderliche Dosis grösser ist als die maximale Dosiseinstellung des Fertigpens (700 Einheiten), kann eine geteilte Dosis mit zwei Injektionen notwendig sein.
Verspätete Dosisgabe
Bei Versäumen einer Dosis wird empfohlen, die Gabe so bald wie möglich nachzuholen. Geschieht dies innerhalb von 3 Tagen nach dem regulären Verabreichungstag, kann die darauffolgende Dosis wieder gemäss dem vorherigen wöchentlichen Dosierschema (am gewohnten Wochentag) verabreicht werden. Bei über 3 Tagen Verzögerung soll das wöchentlichen Dosierschema auf den Tag verschoben werden, an dem die versäumte Dosis nachgeholt wurde.
Patienten, die zum ursprünglichen Dosierungstag zurückkehren möchten, können die Zeit zwischen den nachfolgenden Dosen um 1 bis 3 Tage verlängern.
Die Patienten müssen dann angewiesen werden, ihr einmal wöchentliches Dosierschema fortzusetzen. Die Überwachung des Nüchternglukosewerts im Plasma wird empfohlen.
Ändern des Verabreichungsschemas
Wenn nötig, kann der Tag der einmal wöchentlichen Verabreichung gewechselt werden, sofern zwischen zwei Dosen mindestens 4 Tage liegen. Nach der Auswahl eines neuen Verabreichungstags sollte das einmal wöchentliche Dosierschema fortgesetzt werden.
Spezielle Dosierungsanweisungen
Ältere Patienten
Awiqli kann bei älteren Patienten angewendet werden. Eine häufigere Überwachung der Glukosewerte wird empfohlen. Die therapeutische Erfahrung bei Patienten im Alter von ≥75 Jahren ist begrenzt (siehe Rubrik «Pharmakokinetik»).
Patienten mit Nierenfunktionsstörungen
Awiqli kann bei Patienten mit Nierenfunktionsstörungen angewendet werden. Bei Patienten mit Nierenfunktionsstörungen wird eine häufigere Überwachung der Glukosewerte empfohlen (siehe «Pharmakokinetik»).
Patienten mit Leberfunktionsstörungen
Awiqli kann bei Patienten mit Leberfunktionsstörungen angewendet werden. Bei Patienten mit Leberfunktionsstörungen wird eine häufigere Überwachung der Glukosewerte empfohlen (siehe «Pharmakokinetik»).
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Awiqli bei Kindern und Jugendlichen unter 18 Jahren ist nicht gezeigt. Es liegen keine Daten vor.
Art der Anwendung
Nur zur subkutanen Anwendung.
Awiqli darf nicht intravenös verabreicht werden, da dies zu einer schweren Hypoglykämie führen kann.
Dieses Arzneimittel darf nicht intramuskulär verabreicht werden, da sich dadurch die Absorption ändern kann.
Dieses Arzneimittel darf nicht in Insulin-Infusionspumpen verwendet werden.
Awiqli wird durch subkutane Injektion in den Oberschenkel, den Oberarm oder die Bauchwand verabreicht. Die Injektionsstellen sollten innerhalb desselben Körperbereichs stets gewechselt werden, um das Risiko einer Lipodystrophie und einer kutanen Amyloidose zu minimieren (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Die Patienten sind anzuweisen, stets eine neue Nadel zu benutzen. Bei Wiederverwendung von Nadeln eines Fertigpens steigt das Risiko von verstopften Nadeln, was Unter- oder Überdosierungen verursachen kann. Im Falle einer verstopften Nadel muss der Patient die Hinweise für die Anwendung in der Packungsbeilage befolgen.
Awiqli liegt in Fertigpens vor. Die Dosisanzeige zeigt die Anzahl der Einheiten von Awiqli an, die injiziert werden. Es ist keine Dosisumrechnung erforderlich.
Awiqli darf nicht aus der Patrone des Fertigpens in eine Spritze aufgezogen werden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Weitere Informationen zur Vorgehensweise vor der Verabreichung siehe «Hinweise für die Handhabung» im Abschnitt «Sonstige Hinweise».
KontraindikationenÜberempfindlichkeit gegenüber dem Wirkstoff oder einem der unter «Zusammensetzung» aufgeführten Hilfsstoffe.
Warnhinweise und VorsichtsmassnahmenHypoglykämie
Eine Hypoglykämie kann auftreten, wenn die Insulindosis im Vergleich zum Insulinbedarf zu hoch ist (siehe «Interaktionen», «Unerwünschte Wirkungen» und «Überdosierung»).
Das Hypoglykämie-Risiko mit Awiqli schwankt über das Dosierungsintervall übereinstimmend mit dem wöchentlichen Verlauf seiner glukosesenkenden Wirkung, welche ca. 2-4 Tage nach jeder wöchentlichen Injektion ihr Maximum erreicht (siehe «Beschreibung spezifischer unerwünschter Wirkungen und Zusatzinformationen» in «Unerwünschte Wirkungen» und «Pharmakodynamik» in «Eigenschaften/Wirkungen»).
Patienten, die initial einmalig eine zusätzliche Dosis Awiqli anwenden (siehe «Dosierung/Anwendung») sollten angemessen hinsichtlich möglicher Medikationsfehler bei der darauffolgenden Injektion in Woche 2 aufgeklärt und instruiert werden.
Bei Patienten, deren Blutzuckerkontrolle sich stark verbessert (z.B. durch eine intensivierte Insulintherapie), können sich deren übliche Warnsymptome einer Hypoglykämie verändern. Die Patienten müssen entsprechend instruiert werden. Bei Patienten mit langjährigem Diabetes können die üblichen Warnsymptome ausbleiben.
Für die Minimierung des Hypoglykämierisikos ist die Einhaltung des Dosierschemas und des Ernährungsplans, die korrekte Verabreichung des Insulins sowie das Bewusstsein für Hypoglykämiesymptome vonseiten des Patienten unerlässlich. Bei Vorliegen von Faktoren, die die Hypoglykämieneigung verstärken, ist eine besonders enge Überwachung erforderlich. Dazu gehören:
·Änderung des Injektionsbereichs
·verbesserte Insulinsensitivität (z. B durch Wegfall von Stressfaktoren)
·ungewohnte, erhöhte oder verlängerte körperliche Aktivität
·zwischenzeitlich auftretende Erkrankungen (z.B. Erbrechen, Diarrhoe, Fieber)
·unzureichende Nahrungsaufnahme und verpasste Mahlzeiten
·Alkoholkonsum
·bestimmte unkompensierte endokrine Erkrankungen (z.B. bei Hypothyreose und bei Hypophysenvorderlappen- oder Nebennierenrindeninsuffizienz)
·gleichzeitige Behandlung mit bestimmten anderen Arzneimitteln (siehe «Interaktionen»)
Bei Patienten mit Diabetes mellitus Typ 1, die mit Awiqli behandelt werden, kann ein höheres Risiko für Hypoglykämie bestehen. Wenn bei einem Patienten mit Diabetes mellitus Typ 1 rezidivierende Hypoglykämie auftritt, sollte er mit seinem behandelnden Arzt bzw. seiner behandelnden Ärztin Anpassungen der Behandlung oder andere Behandlungsoptionen besprechen.
Die Sicherheit und Wirksamkeit von Insulin icodec bei neu diagnostizierten, insulin-naiven Typ-1-Diabetes-mellitus-Patienten wurde nicht nachgewiesen. Es liegen keine Daten vor.
Die Sicherheit von Insulin icodec bei Patienten mit verringerter oder fehlender Wahrnehmung von Hypoglykämie-Warnzeichen wurde nicht etabliert. Die Behandlung solcher Patienten mit Awiqli wird daher nicht empfohlen.
Hyperglykämie
In Situationen mit schwerer Hyperglykämie wird die Verabreichung eines schnell wirksamen Insulins empfohlen. Eine unzureichende Dosierung und/oder ein Absetzen der Behandlung bei insulinpflichtigen Patienten kann zu einer Hyperglykämie und potenziell zu einer diabetischen Ketoazidose führen. Bei der Umstellung von Patienten mit Diabetes mellitus Typ 1 auf Awiqli könnten Patienten, die bei Behandlungsbeginn keine einmalige zusätzliche Dosis von Awiqli anwenden, in den ersten Wochen einem Risiko für vorübergehende Hyperglykämie ausgesetzt sein.
Ausserdem können auftretende Begleiterkrankungen, die den Insulinbedarf erhöhen (z.B. Infektionen) zu einer Hyperglykämie führen.
Marihuana-Konsum kann möglicherweise eine Verschlechterung der Glukosetoleranz bewirken (andere illegale Substanzen wurden nicht getestet).
In der Regel entwickeln sich die ersten Symptome einer Hyperglykämie allmählich über Stunden oder Tage. Dazu gehören Durst, erhöhte Miktionsfrequenz, Übelkeit, Erbrechen, Benommenheit, gerötete und trockene Haut, Mundtrockenheit, Appetitverlust sowie Acetongeruch des Atems. Eine unbehandelte Hyperglykämie kann schliesslich in eine diabetische Ketoazidose münden, die potenziell tödlich ist.
Überempfindlichkeit
Bei allen Insulinpräparaten können allergische Reaktionen auftreten. Allergische Reaktionen vom Soforttyp auf das Insulin selbst oder auf die Hilfsstoffe sind potenziell lebensbedrohlich. In den klinischen Studien mit Insulin icodec wurden bei Patienten, die mit Insulin icodec behandelt wurden, Überempfindlichkeitsreaktionen gemeldet (siehe «Unerwünschte Wirkungen»).
Umstellung von anderen Insulinen auf Awiqli
Die Umstellung der Behandlung eines Patienten von einem Insulin eines anderen Typs oder Herstellers oder einer anderen Marke auf Awiqli sollte unter medizinischer Aufsicht erfolgen und erfordert möglicherweise eine Dosisänderung (siehe «Dosierung/Anwendung»).
Bei der Umstellung von einem täglich angewendeten Basalinsulin auf die wöchentliche Anwendung von Awiqli kann es zu Medikationsfehlern z.B. in Form von Überdosierungen oder Dosierungsfehlern kommen. Diese Fehler können zu Hypoglykämie oder Hyperglykämie führen (siehe «Hypoglykämie» und «Hyperglykämie» in «Warnhinweise und Vorsichtsmassnahmen»). Daher wird während der Umstellung und in den folgenden Wochen eine engmaschige Überwachung des Blutzuckerspiegels empfohlen.
Patienten, die initial (1. Woche) eine zusätzliche Dosis erhalten haben, könnten bei der nächsten Injektion (2. Woche) vergessen, auf diese Zusatzdosis zu verzichten. Daher müssen die Patienten, die die einmalige zusätzliche Dosis erhalten, instruiert werden, zu überprüfen, dass sie die richtige Dosis injizieren, insbesondere bei der ersten und zweiten Injektion (siehe «Dosierung/Anwendung» und «Überdosierung»).
Patienten, die sich über die richtige Dosis nicht sicher sind, müssen angewiesen werden, sich an Ihren Arzt bzw. Ihre Ärztin zu wenden.
Lipodystrophie und kutane Amyloidose
Die Patienten müssen angewiesen werden, die Injektionsstelle ständig zu wechseln, um das Risiko der Entwicklung einer Lipodystrophie und einer kutanen Amyloidose zu minimieren. Bei Injektionen an Stellen, die solche Reaktionen aufweisen, besteht potenziell das Risiko einer verzögerten Insulinabsorption und einer verschlechterten glykämischen Kontrolle. Bei einem plötzlichen Wechsel der Injektionsstelle zu einem nicht betroffenen Bereich wurde über eine darauffolgende Hypoglykämie berichtet. Nach dem Wechsel der Injektionsstelle von einem betroffenen zu einem nicht betroffenen Bereich wird die Überwachung der Glukosewerte im Blut empfohlen, und es ist eventuell eine Anpassung der Dosis von Antidiabetika zu erwägen.
Augenerkrankungen
Die Intensivierung der Insulintherapie mit einer abrupten Verbesserung der glykämischen Kontrolle kann mit einer vorübergehenden Verschlechterung der diabetischen Retinopathie einhergehen. Eine langfristige Verbesserung der glykämischen Kontrolle senkt dagegen das Risiko einer Progression der diabetischen Retinopathie.
Vermeidung von Medikationsfehlern
Die Patienten sind anzuweisen, vor jeder Injektion das Etikett auf dem Insulin-Pen zu prüfen, um eine versehentliche Verwechslung des einmal wöchentlich anzuwendenden Awiqli mit anderen Insulinprodukten zu vermeiden. Die Patienten müssen die eingestellten Einheiten auf der Dosisanzeige des Fertigpens visuell überprüfen. Patienten, die blind sind oder schlecht sehen, müssen angewiesen werden, sich immer von einer anderen Person helfen/unterstützen zu lassen, die gut sehen kann und in der Benutzung des Fertigpens geschult ist.
Um Dosierungsfehler und eine mögliche Überdosis zu vermeiden, dürfen Patienten und Angehörige von Gesundheitsberufen das Arzneimittel niemals aus der Patrone des Fertigpens in eine Spritze aufziehen.
Im Falle einer verstopften Nadel muss der Patient die Hinweise für die Anwendung in der Packungsbeilage befolgen.
Kombination von Pioglitazon mit Insulinarzneimitteln
Bei der Anwendung von Pioglitazon in Kombination mit Insulin wurde von Fällen von Herzinsuffizienz berichtet, insbesondere bei Patienten mit Risikofaktoren für die Entwicklung einer Herzinsuffizienz. Dies sollte beachtet werden, wenn eine Behandlung mit der Kombination von Pioglitazon und Awiqli erwogen wird. Wenn die Kombination angewendet wird, sind die Patienten auf Anzeichen und Symptome von Herzinsuffizienz, Gewichtszunahme und Ödemen zu beobachten. Bei auftretenden Verschlechterungen kardialer Symptome sollte Pioglitazon abgesetzt werden.
Natrium
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Dosis, d.h. es ist nahezu «natriumfrei».
InteraktionenEs ist eine Reihe von Arzneimitteln bekannt, die mit dem Glukosestoffwechsel wechselwirken.
Der Insulinbedarf kann vermindert sein in Gegenwart von Substanzen, welche die Insulinwirkung verbessern (Insulinsensitivität erhöhen), die Insulinsekretion steigern, die hepatische Gluconeogenese hemmen oder die intestinale Glukoseaufnahme beeinflussen. Bei gleichbleibender Insulinmenge besteht somit erhöhte Hypoglykämie-Gefahr durch gleichzeitige Einnahme/Anwendung von:
Oralen Antidiabetika; GLP-1 Rezeptor-Agonisten; ACE-Hemmern (z.B. Captopril und Enalapril); antiarrhythmischen Substanzen wie Disopyramid; α-Blockern und Clonidin; SSRI; Fenfluramine; MAO-Hemmern; trizyklischen Antidepressiva; Salicylaten und (selten) anderen NSAIDs; Fibraten; Tetracyclinen; Pentamidin (Hypoglykämie; gelegentlich mit nachfolgender Hyperglykämie); Anti-Malariamitteln (Chinin, Chloroquin, Mefloquin); Sulfonamiden (z.B. Cotrimoxazol); Cimetidin und Ranitidin.
Der Insulinbedarf kann erhöht sein bei gleichzeitiger Einnahme/Anwendung der folgenden Substanzen bzw. Substanzgruppen:
Orale Kontrazeptiva und andere Östrogen- oder Progestagen-Präparate, Kortikosteroide und ACTH; GH (Somatotropin); Danazol; Schilddrüsenhormone; Sympathikomimetika (vor allem β2-Sympathikomimetika wie Ritodrin, Salbutamol, Terbutalin, aber auch α-selektive Sympathikomimetika, sowie nicht selektive wie Epinephrin); Diazoxid; Nikotinsäure und -derivate; Chlorpromazin (vor allem in hohen Dosen) und andere Phenothiazin-Derivate; Diuretika (z.B. Thiazid-Diuretika, Indapamid und Furosemid); Anti-retrovirale Substanzen; Immunsuppressive Substanzen (Ciclosporin, Tacrolimus, Sirolimus), atypische Antipsychotika.
Bei Anwendung der folgenden Substanzen kann die Insulinwirkung je nach Dosis verstärkt bzw. abgeschwächt werden:
Lanreotid-, Octreotid-, Salicylsäure-Derivate, Lithium-Salze (selten).
β-Blocker können zu einer Verstärkung der Insulinresistenz aber auch, in gewissen Fällen, zu einer Hypoglykämie führen. Ausserdem können die Hypoglykämie-Warnsymptome abgeschwächt bzw. maskiert werden.
Alkohol kann die hypoglykämische Wirkung von Insulin intensivieren oder abschwächen.
Die Ergebnisse der In-vitro-Proteinbindungsstudien zeigen, dass es keine klinisch relevante Interaktion zwischen Insulin icodec und der häufigsten Fettsäure im menschlichen Blut, Palmitat, gibt. Die Wahrscheinlichkeit einer Wechselwirkung mit anderen an Proteine gebundenen Arzneimitteln ist gering.
Schwangerschaft, StillzeitSchwangerschaft
Es liegen keine klinischen Erfahrungen mit der Anwendung von Insulin icodec bei Schwangeren vor.
Tierexperimentelle Studien mit Insulin icodec haben negative Auswirkungen auf die Entwicklung des Embryos/Fötus gezeigt, die als sekundär zu einer mütterlichen Hypoglykämie angesehen werden und nicht als direkte Wirkung von Insulin icodec auf den sich entwickelnden Embryo/Fötus (siehe «Präklinische Daten»). Dementsprechend wird eine begrenzte klinische Relevanz gesehen.
Die Anwendung von Awiqli während der Schwangerschaft und bei Frauen im gebärfähigen Alter, die nicht verhüten, wird nicht empfohlen.
Stillzeit
Es liegen keine klinischen Erfahrungen mit der Anwendung von Insulin icodec in der Stillzeit vor. Es liegen keine Informationen über den Übergang von Insulin icodec in die Muttermilch vor. Allerdings wurde Insulin icodec in tierexperimentellen Studien in geringen Mengen im Plasma von gesäugten Jungtieren nachgewiesen. Ein Risiko für den gestillten Säugling kann nicht ausgeschlossen werden. Awiqli soll während der Stillzeit nicht angewendet werden.
Fertilität
Tierstudien mit Insulin icodec haben keine unerwünschten Wirkungen auf die Fertilität gezeigt.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenDie Konzentrations- und Reaktionsfähigkeit des Patienten kann infolge einer Hypoglykämie oder Hyperglykämie oder beispielsweise aufgrund der Sehverschlechterung beeinträchtigt sein. Dies kann in Situationen, in denen diese Fähigkeiten besonders wichtig sind (z.B. beim Autofahren oder beim Bedienen von Maschinen), ein Risiko darstellen.
Die Patienten müssen angewiesen werden, Vorsichtsmassnahmen zur Vermeidung von Hypoglykämien beim Autofahren zu treffen. Dies ist besonders wichtig bei Patienten mit einer verringerten oder fehlenden Wahrnehmung der Warnzeichen einer Hypoglykämie oder mit häufigen Hypoglykämie-Episoden. Unter diesen Umständen sollte überlegt werden, ob das Autofahren ratsam ist.
Unerwünschte WirkungenZusammenfassung des Sicherheitsprofils
Das allgemeine Sicherheitsprofil von Insulin icodec beruht auf 6 Phase-III-Studien, in denen insgesamt 2170 Patienten Insulin icodec erhielten, davon 1880 mit Diabetes mellitus Typ 2 und 290 mit Diabetes mellitus Typ 1.
Die während der klinischen Studien mit Insulin icodec am häufigsten gemeldete unerwünschte Wirkung ist Hypoglykämie (siehe «Warnhinweise und Vorsichtsmassnahmen» sowie «Eigenschaften/Wirkungen»).
Liste der unerwünschten Wirkungen
Die unerwünschten Wirkungen sind nach MedDRA-Systemorganklassen und Häufigkeit gemäss folgender Konvention geordnet:
«sehr häufig» (≥1/10)
«häufig» (≥1/100, <1/10)
«gelegentlich» (≥1/1000, <1/100)
«selten» (≥1/10'000, <1/1000)
«sehr selten» (<1/10'000)
Tabelle 2: Tabellarische Liste der unerwünschten Wirkungen
|
MedDRA-Systemorganklassen
|
Sehr häufig
|
Häufig
|
Gelegentlich
| |
Erkrankungen des Immunsystems
|
|
|
Überempfindlichkeitb
| |
Stoffwechsel- und Ernährungsstörungen
|
Hypoglykämiea
|
|
| |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
|
|
Reaktion an der Injektionsstellec
Peripheres Ödemd
|
|
a «Hypoglykämie» ist bei den «spezifischen unerwünschten Wirkungen» weiter unten definiert.
b Die unter «Überempfindlichkeit» gruppierten bevorzugten Begriffe (Preferred Terms): Urtikaria, Lippe geschwollen und schwellendes Gesicht.
c Die unter «Reaktion an der Injektionsstelle» gruppierten bevorzugten Begriffe (Preferred Terms): Reaktion an der Injektionsstelle, Erythem an der Injektionsstelle, Schmerzen an der Injektionsstelle, blauer Fleck an der Injektionsstelle, Überempfindlichkeit an der Injektionsstelle, Jucken an der Injektionsstelle, Schwellung an der Injektionsstelle, Urtikaria an der Injektionsstelle, Raumforderung an der Injektionsstelle, blauer Fleck an der Applikationsstelle, Pruritus an der Applikationsstelle.
d Die unter «Peripheres Ödem» gruppierten bevorzugten Begriffe (Preferred Terms): Ödem peripher und periphere Schwellung.
Beschreibung spezifischer unerwünschter Wirkungen und Zusatzinformationen
Hypoglykämie
Hypoglykämie ist die am häufigsten beobachtete unerwünschte Arzneimittelwirkung bei Patienten, die Insulin icodec anwenden (siehe «Warnhinweise und Vorsichtsmassnahmen» sowie «Pharmakodynamik»).
In klinischen Phase-III-Studien mit Insulin icodec wurde eine schwere Hypoglykämie als Hypoglykämie definiert, die mit einer schweren kognitiven Beeinträchtigung einherging, für deren Aufhebung Hilfe von aussen notwendig war, und eine klinisch bedeutsame Hypoglykämie wurde definiert als Glukosewert im Plasma von unter 54 mg/dl (3.0 mmol/l).
Diabetes mellitus Typ 2
Der Anteil an Patienten, die schwere oder klinisch signifikante hypoglykämische Episoden unter Insulin icodec im Vergleich zu täglich anzuwendendem Basalinsulin meldeten, lag bei 9–12 % ggü. 6–11 % bei Insulin-naiven Patienten mit Diabetes mellitus Typ 2 (ONWARDS 1, 3 und 5), 14 % ggü. 7 % bei mit Basalinsulin behandelten Patienten mit Diabetes mellitus Typ 2 (ONWARDS 2), 51 % ggü, 56 % bei Patienten mit Diabetes mellitus Typ 2, die zuvor ein Basal-Bolusinsulin-Schema erhielten (ONWARDS 4).
Die Raten schwerer oder klinisch signifikanter hypoglykämischer Episoden pro Patientenjahr für Insulin icodec gegenüber täglich anzuwendendem Basalinsulin betrugen: ONWARDS 1: 0.30 ggü. 0.16; ONWARDS 3: 0.31 ggü. 0.15; ONWARDS 5: 0.19 ggü. 0.14 (Insulin-naive Patienten mit Diabetes mellitus Typ 2); ONWARDS 2: 0.73 ggü. 0.27 (Patienten mit Diabetes mellitus Typ 2, die zuvor mit Basalinsulin behandelt wurden); und ONWARDS 4: 5.64 ggü. 5.62 (Patienten mit Diabetes mellitus Typ 2, die zuvor ein Basal-Bolusinsulin-Schema erhalten hatten).
Für Informationen zu den täglichen Basalinsulin-Vergleichspräparaten, die in jeder Studie verwendet wurden, siehe «Klinische Wirksamkeit».
Diabetes mellitus Typ 1
Der Anteil an Patienten, die schwere oder klinisch signifikante hypoglykämische Episoden unter Insulin icodec im Vergleich zu Insulin degludec meldeten, lag bei 85 % ggü. 76 % bei Patienten mit Diabetes mellitus Typ 1, die zuvor mit Basalinsulin behandelt wurden (ONWARDS 6).
Die Raten schwerer oder klinisch signifikanter hypoglykämischer Episoden pro Patientenjahr für Insulin icodec gegenüber Insulin degludec betrugen 19.93 ggü. 10.37.
In allen ONWARDS-Studien wurden die meisten hypoglykämischen Episoden in Übereinstimmung mit dem Profil der glukosesenkenden Wirkung an Tag 2–4 nach der wöchentlichen Verabreichung beobachtet (vgl. «Pharmakodynamik» in «Eigenschaften/Wirkungen»).
Eine schwere Hypoglykämie kann zu Bewusstlosigkeit und/oder Krampfanfällen führen und eine vorübergehende oder bleibende Schädigung der Gehirnfunktion oder sogar den Tod zur Folge haben. Die Symptome einer Hypoglykämie treten in der Regel plötzlich auf. Dazu können kalter Schweiss, kühle und blasse Haut, Ermüdung, Nervosität oder Tremor, Angst, ungewöhnliche Müdigkeit oder Schwäche, Verwirrtheit, Konzentrationsschwierigkeiten, Benommenheit, übermässiger Hunger, Veränderungen der Sehkraft, Kopfschmerzen, Übelkeit und Palpitationen gehören.
Reaktionen an der Injektionsstelle
In den Phase-III-Studien wurden Reaktionen an der Injektionsstelle bei 1.6% der mit Insulin icodec behandelten Patienten im Vergleich zu 1.4% der mit täglichem Basalinsulin behandelten Patienten berichtet. Die Mehrheit der Reaktionen an der Injektionsstelle bei den mit Insulin icodec behandelten Patienten (75%) wurde in der doppelblinden, «double-dummy», aktiv kontrollierten Studie (ONWARDS 3) berichtet. Bei den mit täglichem Basalinsulin behandelten Patienten wurden in dieser Studie 21% der Reaktionen an der Injektionsstelle berichtet.
Insgesamt waren in den Phase-III-Studien die häufigsten Anzeichen und Symptome von Reaktionen an der Injektionsstelle Erythem und Pruritus. Die maximale Schwere von Reaktionen an der Injektionsstelle bei Patienten, die mit Insulin icodec behandelt wurden, war mild (94%) oder moderat (6%). Es wurden keine schwerwiegenden Reaktionen an der Injektionsstelle berichtet.
Insulinantikörper
Bei der Verabreichung von Insulin kann es zur Bildung von Insulinantikörpern kommen. In seltenen Fällen kann durch das Vorhandensein solcher Insulinantikörper die Anpassung der Insulindosis notwendig werden, um eine Neigung zu Hyper- oder Hypoglykämie auszugleichen.
Während der 26-wöchigen Behandlungsperioden in drei klinischen Phase-III-Studien an Erwachsenen mit Diabetes mellitus Typ 2 mit Anti-Drug-Antikörper (ADA)-Probenentnahme bis zu 31 Wochen waren zwischen 1.6% und 31.5% der mit Insulin icodec behandelten Patienten zu Beginn (Baseline) positiv und zwischen 70.2% und 79.0% waren mindestens einmal während der Studie positiv für Anti-Insulin-Icodec-Antikörper.
In einer Phase-III-Studie an Erwachsenen mit Diabetes mellitus Typ 1 mit ADA-Probenentnahme bis zu 57 Wochen betrug die ADA-Positivrate zu Beginn (Baseline) 50.2% und zu irgendeinem Zeitpunkt nach der Ausgangsmessung 80.6%.
In keiner der Phase-III-Studien wurde ein klinisch signifikanter Effekt von Anti-Insulin-Icodec-Antikörpern auf die Pharmakokinetik, Wirksamkeit oder Sicherheit von Insulin Icodec festgestellt.
Bei der Interpretation von Unterschieden zwischen der Inzidenz von Antikörpern gegen Insulin icodec und Antikörpern gegen andere Produkte aus früheren Studien sollte berücksichtigt werden, dass der Nachweis und die Quantifizierung der Antikörperbildung von der Empfindlichkeit und Spezifität des jeweiligen Assays abhängt und durch weitere Faktoren (z.B. Zeitpunkt der Probenentnahme, Begleitmedikation, Komorbiditäten) beeinflusst werden kann, die möglicherweise divergieren.
Spezialpopulationen
Die Ergebnisse aus klinischen Studien weisen bezüglich Häufigkeit, Art und Schweregrad der unerwünschten Wirkungen bei älteren Patienten und bei Patienten mit Nieren- oder Leberfunktionsstörungen nicht auf Unterschiede zur allgemeinen Datenlage in der Gesamtpopulation hin (siehe «Eigenschaften/Wirkungen»).
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungEine bestimmte Überdosis kann für Insulin nicht definiert werden. Wenn ein Patient jedoch mehr Insulin erhält als notwendig, kann sich über mehrere Stufen eine Hypoglykämie entwickeln:
·Leichte hypoglykämische Episoden können durch die orale Verabreichung von Glukose oder anderen zuckerhaltigen Produkten behandelt werden. Es wird daher empfohlen, dass der Patient immer zuckerhaltige Produkte mit sich führt.
·Schwere hypoglykämische Episoden, in denen der Patient sich nicht selbst behandeln kann, können durch die intramuskuläre, subkutane oder intranasale Gabe von Glukagon durch eine geschulte Person oder durch die intravenöse Gabe von Glukose durch eine medizinische Fachperson behandelt werden. Wenn der Patient nicht innerhalb von 10 bis 15 Minuten auf Glukagon anspricht, muss Glukose intravenös gegeben werden. Nach dem Wiedererlangen des Bewusstseins wird die orale Verabreichung von Kohlehydraten empfohlen, um einen Rückfall zu vermeiden.
Bei der Umstellung von einem einmal oder zweimal täglich angewendeten Basalinsulin auf Awiqli kann es zu Überdosierungen kommen, insbesondere wenn die einmalige Zusatzdosis entgegen der Empfehlung auch nach der ersten Injektion weiterhin angewendet wird (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Überdosierungen wurden in einer klinischen Studie untersucht, in der eine doppelte oder dreifache Dosis Insulin icodec mit einer doppelten oder dreifachen Dosis Insulin glargin (100 Einheiten/ml) verglichen wurde. Mit Insulin icodec wurde dabei weder ein erhöhtes Gesamtrisiko noch eine längere Hypoglykämiedauer im Vergleich zu Insulin glargin beobachtet, vorausgesetzt, die nächste Wochendosis wurde übersprungen. Während der Behandlungszeiträume traten keine schweren hypoglykämischen Episoden (Grad 3) auf. Während der durch doppelte oder dreifache Insulindosen hervorgerufenen Hypoglykämien wurden durch Insulin icodec im Vergleich zu Insulin glargin vergleichbare symptomatische Reaktionen und moderat stärkere hormonelle gegenregulative Reaktionen ausgelöst.
Eigenschaften/WirkungenATC-Code
A10AE07
Wirkungsmechanismus
Die primäre Wirkung von Insulin, also auch von Insulin icodec, ist die Regelung des Glukosestoffwechsels. Insulin und seine Analoga senken die Glukosekonzentration im Blut durch die Aktivierung spezifischer Insulinrezeptoren, wodurch die periphere Glukoseaufnahme, insbesondere in Skelettmuskel- und Fettzellen, stimuliert und die Glukoseproduktion in der Leber gehemmt wird. Insulin hemmt ausserdem die Lipolyse und die Proteolyse und steigert die Proteinsynthese. Wenn Insulin icodec an den menschlichen Insulinrezeptor bindet, hat es dieselben pharmakologischen Wirkungen wie Humaninsulin.
Insulin icodec bindet stark, aber reversibel an Albumin. Dadurch entsteht im Blutkreislauf und im interstitiellen Raum ein Depot von im Wesentlichen inaktivem Insulin icodec. Hieraus wird Insulin icodec langsam und kontinuierlich freigesetzt und bindet spezifisch an den Insulinrezeptor, was zu einer glukosesenkenden Wirkung führt. Darüber hinaus ist die Clearance von Insulin icodec aufgrund einer reduzierten Insulinrezeptorbindung und reduzierter enzymatischen Degradation sehr langsam.
Pharmakodynamik
Die glukosesenkende Wirkung von Insulin icodec hält bei klinisch relevanten Dosierungen über das gesamte Dosierungsintervall von einer Woche an. Die maximale blutzuckersenkende Wirkung von Insulin icodec tritt während der Tage 2-4 nach der Injektion auf und ein flacheres pharmakodynamisches Profil wird für Diabetes mellitus Typ 2 im Vergleich zu Diabetes mellitus Typ 1 beobachtet. (Abbildung 1).
Abbildung 1: Profil der Glukoseinfusionsrate von Insulin icodec über eine volle Woche im Steady-State bei Diabetes mellitus Typ 2 (A) und Typ 1 (B).
A)

B)
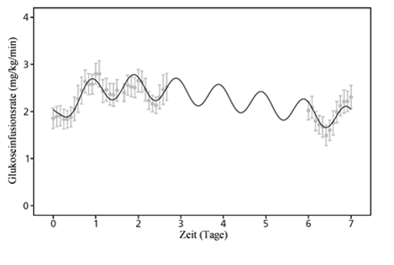
Hinweise: Die Linie ist der Mittelwert der einzelnen im Modell vorhergesagten Glukoseinfusionsraten (GIR)-Profile. Die Punkte und Fehlerbalken sind Mittelwerte und 95% Konfidenzintervalle der individuellen geglätteten GIR-Profile. A: Diabetes mellitus Typ 2 GIR-Profil; B: Diabetes mellitus Typ 1 GIR-Profil.
Auf der Grundlage von Daten mit Injektion von Insulin icodec um 20:00 Uhr (bezogen auf Tag 0).
Der klinische Steady-State war nach 2–4 Wochen erreicht, wenn die Gabe von Insulin icodec ohne einmalige Zusatzdosis begonnen wurde, und nach 2–3 Wochen, wenn zusätzlich zur ersten Dosis eine einmalige Dosis von 50 % gegeben wurde.
Klinische Wirksamkeit
Die Sicherheit und Wirksamkeit von Insulin icodec wurde in sechs multinationalen, randomisierten, aktiv kontrollierten, offenen oder verblindeten klinischen Parallelgruppenstudien der Phase III mit einer Dauer von 26 oder 52 Wochen (ONWARDS 1–6) untersucht. In den Studien erhielten 2170 Patienten Insulin icodec (1880 mit Diabetes mellitus Typ 2 und 290 mit Diabetes mellitus Typ 1). In allen Studien wurde ein Treat-to-Target-Ansatz verfolgt, mit Ausnahme von ONWARDS 5, die so konzipiert war, dass ein klinisches Praxisumfeld simuliert wurde, in dem Insulin icodec zusammen mit einer Dosierungshilfe-App verwendet wurde.
Die Wirkung von Insulin icodec wurde bei Insulin-naiven Patienten (Insulin-Ersttherapie bei Diabetes mellitus Typ 2, Tabellen 3 und 4), bei Patienten, die zuvor nur mit Basalinsulin behandelt worden waren (Insulin-Intensivierung bei Diabetes mellitus Typ 2, Tabelle 5), bei Patienten, die zuvor ein Basal-Bolus-Schema erhalten hatten (Insulin-Intensivierung bei Diabetes mellitus Typ 2, Tabelle 6) sowie bei Patienten mit Diabetes mellitus Typ 1 (Tabelle 7) untersucht.
Bezüglich Senkung des HbA1c-Werts zwischen Baseline und Studienende konnte in allen 6 Studien gegenüber den täglich angewendeten Basalinsulinen Nicht-Unterlegenheit bestätigt werden. Die Überlegenheit von Insulin icodec gegenüber täglich angewendeten Basalinsulinen hinsichtlich der Senkung des HbA1c-Werts wurde in vier Studien bei Diabetes mellitus Typ 2 gezeigt. Die Verbesserung des HbA1c-Werts wurde nicht von Geschlecht, Ethnie, Alter, Dauer der Diabeteserkrankung (<10 Jahre und ≥10 Jahre), HbA1c-Wert bei Baseline (<8 % oder ≥8 %) oder Body-Mass-Index (BMI) bei Baseline beeinflusst.
Patienten mit Diabetes mellitus Typ 2
In den drei Studien unter Einschluss von Insulin-naiven Patienten mit Diabetes mellitus Typ 2 (ONWARDS 1, 3 und 5) zeigte Insulin icodec im Vergleich mit den täglich angewendeten Basalinsulinen eine überlegene glykämische Kontrolle (HbA1c) (Tabellen 3 und 4). Bei Patienten mit Diabetes mellitus Typ 2, die zuvor nur mit einem Basalinsulin behandelt worden waren (ONWARDS 2), zeigte Insulin icodec auch eine überlegene glykämische Kontrolle (HbA1c) im Vergleich mit Insulin degludec (Tabelle 5).
Die Ergebnisse aus allen klinischen Studien bei Patienten mit Diabetes mellitus Typ 2 zeigten, dass die Rate bestätigter Hypoglykämien bei Patienten, die mit Insulin icodec behandelt wurden, sich nicht statistisch signifikant von derjenigen von Patienten unterschied, die mit Insulin degludec oder Insulin glargin behandelt wurden (Tabellen 3, 4, 5, 6).
Anteil der Patienten, die ohne schwere oder klinisch signifikante Hypoglykämie einen HbA1c-Wert <7 % erreichten
In den 4 Studien mit Insulin-naiven Patienten und zuvor nur mit Basalinsulin behandelten Patienten erreichten 36.7 % bis 52.6 % der mit Insulin icodec behandelten Patienten in den ersten 12 Wochen des geplanten Behandlungszeitraums ohne schwere (Grad 3) oder klinisch signifikante (Grad 2) Hypoglykämie einen HbA1c-Wert <7 %. Der Anteil lag bei den mit Insulin degludec oder Insulin glargin behandelten Patienten bei 26.8 % bis 42.6 % (Tabellen 3, 4, 5).
Tabelle 3: Ergebnisse aus doppelt verblindeten (26 Wochen) und offenen (52 Wochen) klinischen Studien mit Erwachsenen mit Diabetes mellitus Typ 2 (Insulin-naiv) – ONWARDS 3 und ONWARDS 1
|
|
26 Wochen Behandlung – ONWARDS 3
|
52 Wochen Behandlung –
ONWARDS 1
| |
|
Insulin icodec
|
Insulin degludec
|
Insulin icodec
|
Insulin glargin 100 Einheiten/ml
| |
N (Full-Analysis-Set)
|
294
|
294
|
492
|
492
| |
HbA1c (%)
| |
Studienende*
|
6.95
|
7.16
|
6.93
|
7.12
| |
Veränderung gegenüber Baseline*
|
−1.57
|
−1.36
|
−1.55
|
−1.35
| |
Geschätzte Differenz
|
−0.21 [−0.34; −0.08]
|
−0.19 [−0.36; −0.03]
| |
Patienten (%), die folgenden HbA1c-Wert erreichten
| |
<7 %*
|
56.83
|
41.64
|
57.57
|
45.44
| |
Geschätzte Odds Ratio
|
1.85 [1.29; 2.64]
|
1.63 [1.24; 2.14]
| |
<7 % ohne Hypoglykämie Grad 2 oder 3*
|
52.13
|
39.86
|
52.56
|
42.58
| |
Geschätzte Odds Ratio
|
1.64 [1.16; 2.33]a
|
1.49 [1.15; 1.94]a
|
* Kleinste-Quadrate-Mittel (KQ-Mittel)
a Höhere Wahrscheinlichkeit für das Erreichen des HbA1c-Ziels ohne Hypoglykämie Grad 3 oder 2 in den ersten 12 Wochen bei den mit Insulin icodec behandelten Patienten
Tabelle 4: Ergebnisse aus der offenen klinischen Studie mit Insulin-naiven Erwachsenen mit Diabetes mellitus Typ 2 – ONWARDS 5
|
|
52 Wochen Behandlung
| |
|
Insulin icodec mit Dosierungshilfe-App
|
Tägliche Basalinsuline**
| |
N (Full-Analysis-Set)
|
542
|
543
| |
HbA1c (%)
| |
Studienende*
|
7.24
|
7.61
| |
Veränderung gegenüber Baseline*
|
−1.68
|
−1.31
| |
Geschätzte Differenz
|
−0.38 [−0.66; −0.09]
| |
Patienten (%), die folgenden HbA1c-Wert erreichten
| |
<7 %*
|
46.76
|
34.65
| |
Geschätzte Odds Ratio
|
1.66 [1.24; 2.21]
| |
<7 % ohne Hypoglykämie Grad 2 oder 3*
|
40.53
|
31.61
| |
Geschätzte Odds Ratio
|
1.47 [1.13; 1.92]a
|
* Kleinste-Quadrate-Mittel (KQ-Mittel)
** Die täglichen Basalinsuline waren Insulin degludec und Insulin glargin (100 Einheiten/ml und 300 Einheiten/ml).
a Höhere Wahrscheinlichkeit für das Erreichen des HbA1c-Ziels ohne Hypoglykämie Grad 2 oder 3 in den ersten 12 Wochen bei den mit Insulin icodec behandelten Patienten
Tabelle 5: Ergebnisse aus der offenen klinischen Studie mit Erwachsenen mit Diabetes mellitus Typ 2 (zuvor nur mit Basalinsulin behandelte Patienten) – ONWARDS 2
|
|
26 Wochen Behandlung
| |
|
Insulin icodec
|
Insulin degludec
| |
N (Full-Analysis-Set)
|
263
|
263
| |
HbA1c (%)
| |
Studienende*
|
7.20
|
7.42
| |
Veränderung gegenüber Baseline*
|
−0.93
|
−0.71
| |
Geschätzte Differenz
|
−0.22 [−0.37; −0.08]
| |
Patienten (%), die folgenden HbA1c-Wert erreichten
| |
<7 %*
|
40.32
|
26.49
| |
Geschätzte Odds Ratio
|
1.88 [1.26; 2.79]
| |
<7 % ohne Hypoglykämie Grad 2 oder 3*
|
36.73
|
26.79
| |
Geschätzte Odds Ratio
|
1.59 [1.07; 2.36]a
|
* Kleinste-Quadrate-Mittel (KQ-Mittel)
a Höhere Wahrscheinlichkeit für das Erreichen des HbA1c-Ziels ohne Hypoglykämie Grad 2 oder 3 in den ersten 12 Wochen bei den mit Insulin icodec behandelten Patienten
Tabelle 6: Ergebnisse aus der offenen klinischen Studie mit Erwachsenen mit Diabetes mellitus Typ 2 (zuvor mit Basal-Bolus-Schema behandelte Patienten) – ONWARDS 4
|
|
26 Wochen Behandlung
| |
|
Insulin icodec
|
Insulin glargin 100 Einheiten/ml
| |
N (Full-Analysis-Set)
|
291
|
291
| |
HbA1c (%)
| |
Studienende*
|
7.14
|
7.12
| |
Veränderung gegenüber Baseline*
|
−1.16
|
−1.18
| |
Geschätzte Differenz
|
0.02 [−0.11; 0.15]
| |
Patienten (%), die folgenden HbA1c-Wert erreichten
| |
<7 %*
|
40.69
|
45.48
| |
Geschätzte Odds Ratio
|
0.82 [0.58; 1.17]
| |
<7 % ohne Hypoglykämie-Episoden Grad 2 oder 3*
|
26.48
|
25.24
| |
Geschätzte Odds Ratio
|
1.07 [0.73; 1.55]
|
* Kleinste-Quadrate-Mittel (KQ-Mittel)
Patienten mit Diabetes mellitus Typ 1
In einer 26-wöchigen offenen Studie mit einer 26-wöchigen Verlängerung (ONWARDS 6) wurden 582 Basal-Bolus behandelte Patienten mit Diabetes mellitus Typ 1 randomisiert auf Insulin icodec und Insulin degludec (100 Einheiten/ml). Zu Beginn (Baseline) hatten die Patienten eine durchschnittliche Diabetesdauer von 19.5 Jahren, einen durchschnittlichen HbA1c-Wert von 60 mmol/mol (7.6 %), einen durchschnittlichen Nüchtern-Glukosewert im Plasma von 9.8 mmol/l und einen durchschnittlichen BMI von 26.5 kg/m2. Die Studie wurde vor Studienbeginn nach Basalinsulinbehandlung (entweder zweimal täglich/Insulin glargin 300 Einheiten/ml oder einmal täglich) und HbA1c (entweder <8 % oder ≥8 %) bei der Vorselektion stratifiziert (Tabelle 7).
In dieser Patientenpopulation war die Hypoglykämierate statistisch signifikant höher bei Patienten unter Insulin icodec im Vergleich mit Insulin degludec (Tabelle 7).
Die Wahrscheinlichkeit, einen HbA1c-Wert von <7 % zu erreichen, war zwischen den Behandlungsarmen nicht statistisch signifikant unterschiedlich. Die Behandlung mit Insulin icodec zeigte eine nicht unterlegene Reduktion des HbA1c im Vergleich zu Insulin degludec bei Patienten mit Diabetes mellitus Typ 1.
Tabelle 7: Ergebnisse aus der offenen klinischen Studie mit Erwachsenen mit Diabetes mellitus Typ 1 – ONWARDS 6
|
|
26 Wochen Behandlung
| |
|
Insulin icodec
|
Insulin degludec
| |
N (Full-Analysis-Set)
|
290
|
292
| |
HbA1c (%)
| |
Studienende*
|
7.15
|
7.10
| |
Veränderung gegenüber Baseline*
|
−0.47
|
−0.51
| |
Geschätzte Differenz
|
0.05 [−0.13; 0.23]
| |
Patienten (%), die folgenden HbA1c-Wert erreichten
| |
<7 %*
|
40.20
|
45.72
| |
Geschätzte Odds Ratio
|
0.80 [0.53; 1.19]
| |
<7 % ohne Hypoglykämie-Episoden Grad 2 oder 3*
|
9.55
|
16.74
| |
Geschätzte Odds Ratio
|
0.52 [0.33; 0.85]a
| |
Nüchtern-Glukosewert im Plasma (mmol/l)
| |
Studienende*
|
8.91
|
7.88
| |
Veränderung gegenüber Baseline*
|
−0.84
|
−1.87
| |
Geschätzte Differenz
|
1.03 [0.48; 1.59]b
| |
Zeit im Zielbereich (3.9–10.0 mmol/l) (%)**
| |
Wochen 22–26
|
59.10
|
60.85
| |
Geschätzte Differenz
|
−2.00 [−4.38; 0.38]b,c
|
* Kleinste-Quadrate-Mittel (KQ-Mittel)
** Unverblindete CGM-Daten wurden in einer Studie mit Patienten mit Diabetes mellitus Typ 1 erfasst.
a Höhere Wahrscheinlichkeit für das Erreichen des HbA1c-Ziels ohne Hypoglykämie Grad 3 oder 2 in den ersten 12 Wochen bei den mit Insulin degludec behandelten Patienten
b Keine Korrektur für Mehrfachtests (Multiplicity)
c −2.00 % entspricht etwa 29 Minuten weniger pro Tag innerhalb des Zielbereichs.
Kontinuierliche Blutzuckerüberwachung (CGM – Continuous Glucose Monitoring))
In einer offenen klinischen Studie (ONWARDS 1) waren Insulin-naive Patienten mit Diabetes mellitus Typ 2, die einmal wöchentlich mit Insulin icodec behandelt wurden, laut Messung mittels verblindeter CGM 71.94 % der Zeit im Zielbereich (3.9–10 mmol/l), verglichen mit 66.90 % bei Insulin glargin 100 Einheiten/ml. Die geschätzte Behandlungsdifferenz zwischen den beiden Armen war mit 4.27 % [1.92; 6.62] statistisch signifikant. Dies entspricht ungefähr 61 Minuten mehr pro Tag innerhalb des Zielbereichs im Insulin-icodec-Arm. Beide Gruppen wurden in den letzten vier Wochen der geplanten Behandlungszeit ausgewertet (Tabelle 3).
Von Patienten berichtete Ergebnisse (PROs – Patient Reported Outcomes)
Der DTSQs-Fragebogen wurde bei Patienten mit Diabetes mellitus Typ 2 in zwei Studien angewendet: in einer Studie mit Behandlung von Insulin-naiven Patienten mit ausschliesslich Basalinsulin (in Verbindung mit einer Dosierungshilfe-App) und in einer Studie mit Patienten, die zuvor ausschliesslich mit Basalinsulin behandelt worden waren. Die Ergebnisse zeigen anhand der Summe aus sechs Item-Scores, dass Insulin icodec die Gesamtzufriedenheit mit der Behandlung im Vergleich mit täglich angewendeten Basalinsulinen signifikant erhöhte. Ausserdem war unter den Insulin-naiven Patienten mit Diabetes mellitus Typ 2 der gemessene Bereichs-Score für die Compliance im Fragebogen TRIM-D bei den mit Insulin icodec in Verbindung mit einer Dosierungshilfe-App behandelten Patienten höher als bei denjenigen, die tägliches Basalinsulin erhielten.
Die Patienten mit Diabetes mellitus Typ 1 mit einem Basal-Bolus-Schema berichteten in beiden Behandlungsarmen eine verbesserte Behandlungszufriedenheit gegenüber Baseline. Unter Insulin degludec wurde eine grössere Verbesserung der Behandlungszufriedenheit berichtet als unter Insulin icodec.
Kardiovaskuläre Beurteilung
Bei den mit Insulin icodec behandelten Patienten wurde eine ähnliche Inzidenz schwerer unerwünschter kardiovaskulärer Ereignisse (major adverse cardiovascular events, MACE) berichtet wie bei denjenigen, die ein täglich anzuwendendes Basalinsulin erhielten. Die geschätzte Hazard Ratio aus der Analyse der Zeit bis zum ersten durch das Ereignisbeurteilungskomitee (event adjudication committee, EAC) bestätigten MACE im Phase-III-Pool betrug HR: 0.84; 95 %-KI [0.48; 1.49] für Insulin icodec verglichen mit täglich angewendeten Basalinsulinen.
Pädiatrie
Die Sicherheit und Wirksamkeit von Awiqli bei Kindern und Jugendlichen unter 18 Jahren ist nicht gezeigt. Es liegen keine Daten vor.
PharmakokinetikAbsorption
Insulin icodec ist ein Basalinsulin, das reversibel an Albumin bindet, was zu einer langsamen Freisetzung von Insulin icodec aus dem im Wesentlichen inaktiven Depot im Blutkreislauf und im interstitiellen Raum führt. Der Insulinrezeptor wird durch Insulin icodec aktiviert, was zu einer gleichmässig verteilten glukosesenkenden Wirkung über das Dosierungsintervall von einer Woche führt.
Der klinische Steady-State war nach 2–4 Wochen erreicht, wenn die Gabe von Insulin icodec ohne einmalige Zusatzdosis begonnen wurde, und nach 2–3 Wochen, wenn zusätzlich zur ersten Dosis eine einmalige Dosis von 50 % gegeben wurde.
Nach der subkutanen Injektion von Insulin icodec wird die intraindividuelle Variabilität der Gesamtexposition von Woche zu Woche als gering angesehen (der Variationskoeffizient für Insulin icodec betrug bei Personen mit Diabetes mellitus Typ 2 im Steady-State 5.90 %).
Distribution
Die Affinität von Insulin icodec zum Serumalbumin entspricht einer Plasmaproteinbindung von >99 % im menschlichen Plasma.
Metabolismus
Der Abbau von Insulin icodec ähnelt dem von Humaninsulin; die Metabolite im Serum werden aufgrund der fehlenden A-Kette als pharmakologisch inaktiv erachtet.
Elimination
Die Halbwertszeit nach der subkutanen Verabreichung beträgt unabhängig von der Dosis ungefähr eine Woche.
Linearität
Nach einer subkutanen Verabreichung im therapeutischen Dosisbereich wird Dosisproportionalität in der Gesamtexposition beobachtet.
Kinetik spezieller Patientengruppen
Insgesamt blieben die pharmakokinetischen Eigenschaften von Insulin icodec basierend auf populationskinetischen Analysen erhalten und es bestand kein klinisch relevanter Unterschied bei der Exposition zwischen weiblichen und männlichen Personen, zwischen älteren und jüngeren Erwachsenen.
Die Auswirkungen von Nieren- oder Leberfunktionsstörungen auf die Pharmakokinetik von Insulin icodec wurden in zwei offenen Parallelgruppen-Einzeldosisstudien untersucht. Die Insulin-icodec-Exposition war bei Patienten mit Nieren- oder Leberfunktionsstörungen im Vergleich zu Patienten mit normaler Nieren- oder Leberfunktion leicht erhöht (16-21%, resp. 13-15%). Die klinische Relevanz dieser geringfügigen Unterschiede ist jedoch begrenzt, da Insulin icodec gemäss dem individuellen Bedarf zu dosieren ist (siehe «Dosierung/Anwendung»). Zudem blieben die pharmakokinetischen Eigenschaften von Insulin icodec über ein breites Spektrum an Serumalbuminspiegeln erhalten (2.72–5.08 g/dl).
Präklinische DatenBasierend auf den Studien zur Sicherheitspharmakologie, Toxizität bei wiederholter Gabe und Kanzerogenität lassen die präklinischen Daten ausser Hypoglykämie keine Sicherheitsbedenken für den Menschen erkennen.
Reproduktionstoxizität
In Studien mit Ratten wurden keine Auswirkungen von Insulin icodec auf die Fertilität beobachtet; die höchste Exposition der Tiere entsprach ca. dem 4.5-Fachen (Männchen) und 1.5-Fachen (Weibchen) der klinischen Plasmaexposition.
In Studien mit trächtigen Ratten führte die Behandlung mit Insulin icodec nicht zu Effekten auf die embryofetale Entwicklung. Bei Kaninchen traten Aborte und erhöhte Prä- und Postimplantationsverluste bei einer Dosis auf, die mit maternaler Toxizität sekundär zu einer Hypoglykämie assoziiert war; die Exposition der Muttertiere entsprach etwa dem 1.7-Fachen der klinischen Plasmaexposition.
In einer Studie zur prä-/postnatalen Entwicklung in Ratten traten in der Hochdosisgruppe (50 nmol/kg/Tag) bei den gesäugten Jungtieren adverse Effekte (klinische Befunde, vermindertes Körpergewicht und Mortalität) auf. Diese Effekte werden auf das Vorhandensein von maternaler Toxizität sekundär zu einer Hypoglykämie zurückgeführt. Die Exposition der Muttertiere bei der Dosis ohne unerwünschte Wirkungen auf die Jungtiere (35 nmol/kg/Tag) war unterhalb der klinischen Plasmaexposition.
Sonstige HinweiseInkompatibilitäten
Dieses Arzneimittel darf nicht mit anderen Arzneimitteln gemischt werden.
Zu Awiqli hinzugefügte Substanzen können einen Abbau von Insulin icodec verursachen.
Awiqli darf nicht zu Infusionslösungen hinzugefügt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Haltbarkeit nach Anbruch des Pens
Nach dem Anbruch oder bei Mitführung als Ersatz darf das Arzneimittel höchstens 12 Wochen gelagert werden. Unterhalb von 30°C lagern. Kann im Kühlschrank (2–8°C) gelagert werden. Schutzkappe auf dem Pen belassen, um den Inhalt vor Licht zu schützen.
Besondere Lagerungshinweise
Ausser Reichweite von Kindern aufbewahren.
Vor der ersten Verwendung
Im Kühlschrank (2–8°C) lagern.
Nicht einfrieren. Vom Kühlelement fernhalten.
Schutzkappe auf dem Pen belassen, um den Inhalt vor Licht zu schützen.
Nach Anbruch oder wenn als Ersatz mitgeführt
Lagerbedingungen nach dem Anbruch des Arzneimittels, siehe «Haltbarkeit nach Anbruch des Pens».
Hinweise für die Handhabung
Dieses Arzneimittel ist für die Verwendung nur durch eine einzige Person bestimmt.
Awiqli darf nicht verwendet werden, wenn die Lösung nicht klar und farblos aussieht.
Awiqli, das einmal gefroren war, darf nicht verwendet werden.
Vor jeder Injektion muss immer eine neue Nadel angebracht werden. Die Nadeln dürfen nicht mehrmals verwendet werden. Die Nadeln müssen unmittelbar nach dem Gebrauch entsorgt werden.
Im Falle einer verstopften Nadel muss der Patient die Hinweise für die Anwendung in der Packungsbeilage befolgen.
Abfallmaterialien sind entsprechend den örtlichen Regelungen zu entsorgen.
Ausführliche Hinweise für die Anwendung finden Sie in der Packungsbeilage.
Zulassungsnummer69389 (Swissmedic)
PackungenAwiqli Fertigpen (FlexTouch) mit 700 Einheiten Insulin icodec in 1 ml Lösung.
·1 Fertigpen (mit oder ohne NovoFine® Plus Einwegnadeln). (B)
Awiqli Fertigpen (FlexTouch) mit 1050 Einheiten Insulin icodec in 1.5 ml Lösung.
·1 Fertigpen (mit oder ohne NovoFine® Plus Einwegnadeln). (B)
Awiqli Fertigpen (FlexTouch) mit 2100 Einheiten Insulin icodec in 3 ml Lösung.
·1 Fertigpen (mit oder ohne NovoFine® Plus Einwegnadeln). (B)
Es werden möglicherweise nicht alle Packungsgrössen in den Verkehr gebracht.
ZulassungsinhaberinNovo Nordisk Pharma AG, Kloten
Domizil: Zürich
Stand der InformationDezember 2024
|


