ZusammensetzungWirkstoffe
Lidocaini hydrochloridum anhydricum (ut Lidocaini hydrochloridum monohydricum)
Hilfsstoffe
Natrii chloridum, Natrii hydroxidum, Acidum hydrochloridum concentratum, Aqua ad iniectabile.
Lidocain Aguettant 10 mg/ml enthält 3,2 mg Natrium pro ml (32 mg Natrium pro 10 ml Fertigspritze).
Lidocain Aguettant 20 mg/ml enthält 2,3 mg Natrium pro ml (23 mg Natrium pro 10 ml Fertigspritze)
Indikationen/AnwendungsmöglichkeitenLidocain Aguettant wird zur Infiltrationsanästhesie und für periphere Nervenblockaden angewendet.
Lidocain Aguettant 10 mg/ml wird bei Erwachsenen und Kindern über 2 Jahren angewendet.
Lidocain Aguettant 20 mg/ml wird bei Erwachsenen angewendet.
Dosierung/AnwendungLidocain Aguettant darf nur von oder unter Aufsicht von Ärzten, die in Lokalanästhesie und Wiederbelebungsmaßnahmen erfahren sind, angewendet werden. Bei der Anwendung von Lokalanästhetika muss eine Ausrüstung zur Wiederbelebung zur Verfügung stehen.
Dosierung
Es sollte die niedrigste Konzentration und Dosis verabreicht werden, die den gewünschten Effekt erzielt.
Erwachsene
Die Dosis ist dem Ansprechen des Patienten, dem Ort der Anwendung und der zu erwartenden Dauer des chirurgischen Eingriffs anzupassen.
Die übliche zu berücksichtigende Gesamtdosis von Lidocain beträgt 3 bis 5 mg/kg, was Volumina von 2 bis 20 ml (bei 10 mg/ml) und 1 bis 10 ml (bei 20 mg/ml) entspricht.
Die allgemein empfohlene maximale Dosis von Lidocain sollte bei Erwachsenen für die Infiltration und periphere Nervenblockade 200 mg nicht übersteigen, jedoch könnte abhängig von Eingriff und patientenspezifischen Faktoren eine höhere Maximaldosis erforderlich sein.
Das Volumen der angewendeten Lösung spielt eine Rolle bei der Größe des Ausbreitungsbereichs des Anästhetikums.
Spezielle Patientengruppen
Ältere Patienten
Bei älteren Patienten werden die Dosierungen individuell auf Grundlage von Alter und Körpergewicht des Patienten berechnet. Eine Dosisanpassung könnte erforderlich sein, da Herzzeitvolumen und Leberdurchblutung mit zunehmendem Alter abnehmen, was auf eine verringerte Clearance von Lidocain schließen lässt (siehe Abschnitt „Pharmakokinetik“).
Patienten mit Niereninsuffizienz
Die Patienten sollten überwacht werden, da eine Niereninsuffizienz aufgrund der Akkumulation aktiver Metabolite toxische Wirkungen hervorrufen kann (siehe Abschnitte „Warnhinweise und Vorsichtsmaßnahmen“ und „Pharmakokinetik“). Aufgrund der verringerten Clearance und der erhöhten Halbwertszeit von Lidocain könnte eine Dosisanpassung erforderlich sein.
Patienten mit Leberinsuffizienz
Bei Patienten mit Herz- oder Leberinsuffizienz könnte es erforderlich sein, die Dosis um die Hälfte zu reduzieren (siehe Abschnitt „Warnhinweise und Vorsichtsmaßnahmen“).
Patienten mit Herzinsuffizienz
Bei Patienten mit Herz- oder Leberinsuffizienz könnte es erforderlich sein, die Dosis um die Hälfte zu reduzieren (siehe Abschnitt „Warnhinweise und Vorsichtsmaßnahmen“).
Andere spezielle Populationen
Bei Patienten mit einem schlechten Allgemeinzustand oder verringerter Proteinbindungskapazität (zum Beispiel aufgrund von Nieren- oder Leberfunktionsstörungen, Krebs, Schwangerschaft) muss die Dosis möglicherweise verringert werden.
Pädiatrische Population
Lidocain darf bei Kindern unter 2 Jahren nicht angewendet werden, da derzeit keine hinreichenden Daten vorliegen, die die Sicherheit und Wirksamkeit dieses Arzneimittels bei dieser Patientenpopulation belegen.
Bei der Behandlung von Kindern im Alter von 2 bis 4 Jahren ist besondere Vorsicht geboten.
Es sollte nur die niedrige Konzentration (10 mg/ml) verwendet werden.
Die Dosis wird individuell nach Alter, Körpergewicht und Art des Eingriffs berechnet. Die übliche Dosis bei Kindern (über 2 Jahren) beträgt 3–4 mg/kg Körpergewicht (unter Verwendung einer 10-mg/ml-Lösung). Für die Berechnung ist bei übergewichtigen Kindern das dem Alter entsprechende Durchschnittsgewicht zu berücksichtigen.
Bei kleinen Kindern kann die anzuwendende Dosis weniger als das Volumen einer halben Fertigspritze betragen. Bei kleinen Kindern darf die erforderliche Dosis 3–4 mg/kg nicht überschreiten und der Überschuss muss vor der Injektion aus der Spritze entfernt werden. Für die in der Spritze verbleibende Dosis werden langsame fraktionierte Injektionen empfohlen.
Anwendung
Infiltrationsinjektion in die Umgebung von peripheren Nerven (intradermale, subkutane, submuköse Anwendung).
Lidocain Aguettant ist eine gebrauchsfertige Fertigspritze, die nicht mit einer elektronischen Spritzenpumpe (für Dauerinfusion oder patientenkontrollierte wiederholte Bolus-Epidural-Anwendung) angewendet werden darf.
KontraindikationenÜberempfindlichkeit gegen den Wirkstoff, gegen amidgebundene Lokalanästhetika oder einen der sonstigen Bestandteile.
Warnhinweise und VorsichtsmassnahmenLidocain sollte bei Patienten mit folgenden Erkrankungen mit Vorsicht angewendet werden:
•Epilepsie: Patienten mit zerebralen Anfallsleiden müssen sehr genau auf die Manifestation von zentralnervösen Symptomen überwacht werden. Niedrige Dosen von Lidocain können außerdem eine erhöhte Krampfbereitschaft hervorrufen;
•Nieren- oder Leberinsuffizienz;
•Myasthenia gravis;
•Blockade des Reizleitungssystem des Herzens, da Lokalanästhetika die myokardiale Erregungsleitung beeinträchtigen können;
•eingeschränkte kardiovaskuläre Funktion
•Bradykardie;
•Atemdepression;
•ältere und allgemein geschwächte Patienten;
•Gerinnungsstörung oder Behandlung mit Antikoagulanzien (z. B. Heparin), NSAIDs oder Plasmaersatzmitteln, da unbeabsichtigte Verletzungen von Blutgefäßen zu schwerwiegenden Blutungen führen können.
Eine unbeabsichtigte intravaskuläre Injektion oder Überdosierungen können hohe Lidocainkonzentrationen im Blut verursachen, die akute toxische Symptome des ZNS und des kardiovaskulären Systems hervorrufen können.
Versehentliche intravaskuläre Injektionen in den Kopf- und Nackenbereich können selbst bei niedrigen Dosen zerebrale Symptome hervorrufen.
Wenn das Lokalanästhetikum in entzündetes (infiziertes) Gewebe injiziert werden soll, ist aufgrund von erhöhter systemischer Resorption durch höheren Blutfluss und verringerter Wirkung aufgrund eines niedrigeren pH-Wertes des infizierten Gewebes ebenfalls Vorsicht geboten.
Nach der Markteinführung wurden von einigen Fällen von Chondrolyse bei Patienten berichtet, die postoperativ eine kontinuierliche intraartikuläre Infusion von Lokalanästhetika erhielten. In den meisten berichteten Fällen von Chondrolyse war das Schultergelenk betroffen. Aufgrund multipler Einflussfaktoren und Unstimmigkeiten in der wissenschaftlichen Literatur bezüglich des Wirkmechanismus ist ein ursächlicher Zusammenhang nicht erwiesen.
Da eine Paracervical-Blockade eine fötale Bradykardie oder Tachykardie verursachen kann, ist eine sorgfältige Überwachung der fötalen Herzfrequenz notwendig (siehe Abschnitt „Schwangerschaft/Stillzeit“).
Natrium
Lidocain Aguettant 10 mg/ml enthält 32 mg Natrium pro Spritze, was 1,6 % der von der WHO empfohlenen maximalen täglichen Nahrungsaufnahme von 2 g Natrium pro Erwachsenen entspricht.
Lidocain Aguettant 20 mg/ml enthält 23 mg Natrium pro Spritze, was 1,2 % der von der WHO empfohlenen maximalen täglichen Nahrungsaufnahme von 2 g Natrium pro Erwachsenen entspricht.
InteraktionenPharmakodynamische Interaktionen
Antiarrhythmika der Klasse I
Die gleichzeitige Verabreichung von Lidocain und anderen Antiarrhythmika der Klasse I sollte aufgrund des Risikos schwerwiegender kardialer Nebenwirkungen vermieden werden.
Andere Antiarrhythmika
Wenn Lidocain mit anderen antiarrhythmisch wirkenden Arzneimitteln wie Betablockern oder Calciumkanalblocker kombiniert wird, kann der Hemmeffekt auf die atrioventrikuläre und intraventrikuläre Reizleitung und auf die Kontraktilität verstärkt werden.
Kombination mit anderen Lokalanästhetika
Durch die Kombination verschiedener Lokalanästhetika kann es zu additiven Wirkungen auf das Herz-Kreislauf-System und das Zentralnervensystem kommen.
Muskelrelaxanzien
Die Wirkung von Muskelrelaxanzien (z. B. Suxamethonium) wird durch Lidocain verlängert.
Beruhigungsmittel, Hypnotika
Lidocain ist bei Patienten, die Beruhigungsmittel erhalten, die auch die ZNS-Funktion beeinträchtigen und daher die Lidocain-Toxizität verändern können, mit Vorsicht zu verabreichen. Es kann ein additiver Effekt zwischen der lokalanästhetischen Wirkung und Sedativa oder Hypnotika auftreten.
Inhalationsnarkotika
Bei gleichzeitiger Anwendung von Lidocain und Inhalationsnarkotika können sich die depressiven Wirkungen gegenseitig verstärken.
Arzneimittel, die die Krampfschwelle senken können
Da Lidocain selbst die Krampfschwelle senken kann, könnte die gleichzeitige Verabreichung anderer Arzneimittel, die die Krampfschwelle senken (z. B. Tramadol oder Bupropion), das Risiko für Krampfanfälle erhöhen.
Arzneimittel, die die Krampfschwelle erhöhen können
Die gleichzeitige Gabe von Diazepam erhöht die Krampfschwelle von Lidocain. Dies muss bei der Überwachung der Patienten auf Anzeichen einer Toxizität von Lidocain beachtet werden.
Vasokonstriktoren
Die lokalanästhetische Wirkung wird in Kombination mit einem Vasokonstriktor, z. B. Adrenalin, verlängert. Wenn Lidocain als Antiarrhythmikum angewendet wird, kann die zusätzliche Behandlung mit Adrenalin oder Noradrenalin zur Verstärkung der unerwünschten kardialen Wirkungen führen.
Pharmakokinetische Interaktionen
Lidocain wird hauptsächlich durch die Cytochrom P 450-Isoenzyme CYP 3A4 und CYP 1A2 metabolisiert (siehe Abschnitt „Pharmakokinetik“). Die gleichzeitige Anwendung von Wirkstoffen, die Substrate, Inhibitoren oder Induktoren der hepatischen Isoenzyme CYP3A4 und CYP1A2 sind, kann die Pharmakokinetik von Lidocain und daher auch seine Wirkung beeinflussen.
CYP 3A4- und/oder CYP 1A2-Inhibitoren
Die gleichzeitige Verabreichung von Lidocain und CYP3A4- und/oder CYP1A2-Inhibitoren kann zu erhöhten Plasmakonzentrationen von Lidocain führen. Über erhöhte Plasmakonzentrationen wurde beispielsweise berichtet bei:
•Amiodaron (CYP3A4-Inhibitor): Amiodaron vermindert den Lebermetabolismus von Lidocain und führt so zum Risiko einer Erhöhung des Lidocain-Spiegels mit anschließender Zunahme der neurologischen und kardiovaskulären Toxizität. Eine klinische Überwachung, EKG-Kontrollen und auch eine Kontrolle der Plasmakonzentration von Lidocain sind durchzuführen. Bei Bedarf sollten die Plasma-Lidocain-Spiegel während und nach der Amiodaron-Behandlung überwacht werden.
•Cimetidin (CYP3A4- und CYP1A2-Inhibitor): Cimetidin in Dosen von 800 mg/Tag oder mehr: erhöhte Plasmakonzentration von Lidocain mit anschließender Zunahme der neurologischen und kardiovaskulären Toxizität. Eine klinische Überwachung, EKG-Kontrollen und auch eine Kontrolle der Plasmakonzentration von Lidocain sind durchzuführen. Bei Bedarf sollten die Plasma-Lidocain-Spiegel während und nach der Behandlung mit Cimetidin überwacht werden.
•Fluvoxamin (CYP3A4- und CYP1A2-Inhibitor): Erhöhte Lidocainspiegel, wodurch das Risiko einer neurologischen und kardiovaskulären Toxizität steigt. Eine klinische Überwachung, EKG-Kontrollen und auch eine Kontrolle der Plasmakonzentration von Lidocain sind durchzuführen. Bei Bedarf sollten die Plasma-Lidocain-Spiegel während und nach der Kombination überwacht werden.
•Betablocker (außer Esmolol): Intravenöses Lidocain: Anstieg der Lidocainspiegel mit nachfolgendem Anstieg neurologischer und kardiovaskulärer Toxizität. Eine klinische Überwachung, EKG-Kontrollen und auch eine Kontrolle der Plasmakonzentration von Lidocain sind durchzuführen. Bei Bedarf sollten die Plasma-Lidocain-Spiegel während und nach der Behandlung mit Betablockern überwacht werden.
•Andere bekannte CYP3A4-Inhibitoren: Protease-Inhibitoren (z. B. Ritonavir), Makrolid-Antibiotika (z. B. Erythromycin), Antimykotika (z. B. Ketoconazol, Itraconazol).
•Andere bekannte CYP1A2-Inhibitoren: Ciprofloxacin.
CYP 3A4- und/oder CYP 1A2-Induktoren
Wirkstoffe, die CYP3A4 und/oder CYP 1A2 induzieren, wie Barbiturate (hauptsächlich Phenobarbital), Carbamazepin, Phenytoin oder Primidon, beschleunigen die Plasmaclearance von Lidocain und verringern so die Wirksamkeit von Lidocain.
Andere pharmakokinetische Interaktionen
Arzneimittel, die den Stoffwechsel, die Leberdurchblutung, das Herzzeitvolumen oder die periphere Distribution von Lidocain verändern, können die Plasmakonzentrationen von Lidocain beeinflussen.
Arzneimittel, die eine Hypokaliämie verursachen
Die elektrophysiologischen Wirkungen von Lidocain hängen stark von der extrazellulären Kaliumkonzentration ab und können durch eine Hypokaliämie fast vollständig blockiert werden. Die gleichzeitige Anwendung von Arzneimitteln, die eine schwere Hypokaliämie verursachen können (z. B. Acetazolamid, Schleifendiuretika und Thiazide), sollte daher vermieden werden oder nur unter sorgfältiger Überwachung der Kaliumkonzentration im Serum erfolgen.
Schwangerschaft, StillzeitSchwangerschaft
Es liegen keine ausreichenden Daten über die Anwendung von Lidocain bei Schwangeren vor.
Lidocain passiert die Plazentaschranke (siehe Abschnitt „Pharmakokinetik“). Es ist davon auszugehen, dass eine große Zahl schwangerer Frauen und Frauen im gebärfähigen Alter Lidocain erhielt. Bisher wurden keine spezifischen Störungen des Fortpflanzungsprozesses gemeldet, beispielsweise kein erhöhtes Auftreten von Missbildungen oder direkte oder indirekte Auswirkungen auf den Fötus. Jedoch sind die Risiken für den Menschen noch nicht vollständig untersucht.
Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt (siehe Abschnitt „Präklinische Daten“).
Das Nutzen-Risiko-Verhältnis einer kurzfristigen Anwendung während der Schwangerschaft und Geburt sollte sorgfältig geprüft werden. Eine parazervikale oder pudendale Blockade mit Lidocain erhöht das Risiko von Reaktionen wie Bradykardie/Tachykardie beim Fötus. Daher ist es unbedingt erforderlich, die Herzfrequenz des Fötus sorgfältig zu überwachen.
Stillzeit
Lidocain geht in geringen Mengen in die Muttermilch über. Bei Anwendung in den empfohlenen Dosen sind Auswirkungen auf den Säugling unwahrscheinlich. Daher kann während der Behandlung mit Lidocain weiterhin gestillt werden.
Fertilität
Es liegen keine Daten zur Wirkung von Lidocain auf die Fertilität beim Menschen vor.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenLidocain Aguettant hat einen mäßigen Einfluss auf die Fahrtüchtigkeit oder die Fähigkeit, Maschinen zu bedienen. Nach der Injektion eines Lokalanästhetikums können vorübergehende sensorische und/oder motorische Störungen auftreten. Patienten dürfen kein Fahrzeug führen oder Maschinen bedienen, bis die Wirkungen abgeklungen sind.
Unerwünschte WirkungenZusammenfassung des Sicherheitsprofils
Häufigkeit und Schweregrad der unerwünschten Wirkungen von Lidocain hängen von Dosis, Art der Anwendung und individueller Empfindlichkeit des Patienten ab.
Die Nebenwirkungen im Zusammenhang mit der Lokalanästhesie treten selten auf, sofern nicht überdosiert wird, keine anormal schnelle systemische Resorption erfolgt oder versehentlich intravaskulär injiziert wird. In diesen Fällen können die Nebenwirkungen schwerwiegend sein, vor allem im Hinblick auf kardiale und neurologische Funktionen.
Durch Lidocain verursachte unerwünschte Wirkungen können möglicherweise schwer von den physiologischen Wirkungen der Nervenblockade (z. B. Hypotonie, Bradykardie) und Ereignissen, die direkt (z. B. neurologische Läsionen) oder indirekt durch die Nadelstiche hervorgerufen werden, unterschieden werden.
Nach der Verabreichung von Lidocain können Symptome einer lokalen Toxizität auftreten. Bei Lidocain-Plasmakonzentrationen über 5–10 mg/l sind systemische unerwünschte Wirkungen zu erwarten. Sie manifestieren sich sowohl in Form von ZNS-Symptomen als auch von kardiovaskulären Symptomen.
Mögliche unerwünschte Wirkungen nach der Anwendung von Lidocain als Lokalanästhetikum sind weitgehend die gleichen wie die von anderen Lokalanästhetika des Amidtyps.
Liste der unerwünschten Wirkungen
Die in diesem Abschnitt aufgeführten unerwünschte Wirkungen fallen in die folgenden Häufigkeitskategorien: Sehr häufig (≥ 1/10); häufig (≥ 1/100 bis < 1/10); gelegentlich (≥ 1/1000 bis < 1/100); selten (≥ 1/10‘000 bis < 1/1000); sehr selten (< 1/10‘000); nicht bekannt (kann aus den verfügbaren Daten nicht abgeschätzt werden).
In der folgenden Tabelle sind unerwünschte Wirkungen aufgeführt, die mit der Verwendung von Lidocain als Anästhetikum verbunden sind.
|
Systemorganklassen
|
Sehr häufig
|
Häufig
|
Gelegentlich
|
Selten
|
Sehr selten
|
Häufigkeit nicht bekannt
| |
Störungen des Blut- und Lymphsystems
|
|
|
|
|
|
Methämo-Globinämie
| |
Störungen des Immunsystems
|
|
|
|
allergische Reaktion*, anaphylaktoide Reaktionen, Bronchospasmus und in schweren Fällen anaphylaktischer Schock.
|
|
| |
Erkrankungen des Nervensystems
|
|
Parästhesie, Bewusstlosigkeit.
Vorübergehende neurologische Symptome.
|
|
Neuropathie, Krämpfe (Überdosis), andauernde Anästhesie, Paresis, Kopfschmerz begleitet von Tinnitus und Lichtempfindlichkeit.
Schädigungen der Gehirnnerven, neurosensorische Taubheit. Regionale Anwendungen im Brust- oder Kopf-/Nackenbereich können Sympathikusblockaden induzieren, die zu vorübergehenden Symptomen wie Horner-Syndrom oder Harlequin-Syndrom führen.
|
|
| |
Augenerkrankungen:
|
|
|
|
Diplopie
|
|
| |
Herzerkrankungen
|
|
Bradykardie
|
|
Herzrhythmusstörungen, elektrokardiografische Depression oder möglicherweise Herzstillstand (Überdosis oder unbeabsichtigte intravaskuläre Injektion).
|
|
| |
Gefäßerkrankungen
|
|
Hypotonie, Hypertension
|
|
|
|
| |
Erkrankungen der Atemwege, des Brustraums und Mediastinums
|
|
|
|
Atemdepression
|
|
| |
Erkrankungen des Gastrointestinaltrakts
|
Übelkeit
|
Erbrechen
|
|
|
|
| |
Erkrankungen der Haut und des Unterhautzellgewebes
|
|
|
|
Ausschlag, Urtikaria, Ödem
|
|
|
* Hauttests auf Lidocain-Allergie werden nicht als verlässlich eingestuft.
Pädiatrische Population
Es wird erwartet, dass Häufigkeit, Art und Schwere der unerwünschten Wirkungen bei Kindern die gleichen sind wie bei Erwachsenen.
Weitere Spezialpopulationen
Bei älteren Menschen kann die Inzidenz von unerwünschten Wirkungen erhöht sein.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungAbhängig von der individuellen Empfindlichkeit kommt es ab einer Konzentration von etwa 5–10 mg Lidocain pro Liter venösem Blut zu toxischen Reaktionen.
Die letale Plasmakonzentration beim Menschen liegt im Bereich von 6–33 mg Lidocain pro Liter.
Eine Überdosierung oder versehentliche intravaskuläre Injektion kann zu übermäßigen Plasmakonzentrationen von Lidocain führen, was zu Anzeichen einer akuten Toxizität führen kann, die wiederum zu sehr schwerwiegenden unerwünschten Wirkungen führen kann. Die toxischen Wirkungen von Lidocain hängen von der Höhe der Plasmakonzentration ab; je höher die Plasmakonzentration und je schneller ihr Anstieg, desto häufiger und schwerwiegender sind die toxischen Reaktionen. Derartige toxischen Reaktionen wirken sich auf das Zentralnervensystem und das Herz-Kreislauf-System aus.
Symptome
Leichte toxische Überdosierungen von Lidocain führen zu einer ZNS-Stimulation. Eine starke Überdosierung, die zu hohen toxischen Plasmakonzentrationen führt, verursacht eine Depression der zentralen Funktionen.
Die Toxizität des Zentralnervensystems ist eine fortschreitende Reaktion mit Symptomen und Anzeichen zunehmender Schwere.
Die ersten beobachteten Symptome sind wie folgt: Benommenheit, Schwindel, Erregung, Halluzination, Euphorie, Angst, Gähnen, Logorrhö, Kopfschmerzen, Übelkeit, Erbrechen, Parästhesie der Lippen, Taubheitsgefühl an der Zunge, Tinnitus und Dysarthrie, Hör- und Sehstörungen.
Zu den weiteren subjektiven Symptomen des Zentralnervensystems gehören: Orientierungslosigkeit, gelegentliches Schläfrigkeitsgefühl. Es wurden auch Fälle von Tachykardie, Bluthochdruck und Gesichtsrötung berichtet.
Bei diesen Alarmzeichen ist eine sorgfältige Überwachung erforderlich: Muskelzucken, Tremor, Schüttelfrost und generalisierte Krampfanfälle. Die gleichzeitige Gabe von Diazepam erhöht die Krampfschwelle von Lidocain. Dies muss bei der Überwachung der Patienten auf Anzeichen einer Toxizität von Lidocain beachtet werden.
Bei Verabreichung sehr hoher Dosen: generalisierte Depression des ZNS, Atemdepression, Koma und Atemstillstand.
In schweren Fällen kann eine kardiovaskuläre Toxizität auftreten: Herzrhythmusstörungen (wie z. B. ventrikuläre Extrasystolen, Kammerflimmern), nicht tastbarer Puls, Blässe, erhebliche Bradykardie, atrioventrikuläre Erregungsleitungsstörungen, Abnahme der kardialen Kontraktilität, Hypotonie und Herzstillstand.
Behandlung
Falls während der Anwendung des Lokalanästhetikums Anzeichen einer akuten Toxizität auftreten, muss die Anwendung des Anästhetikums sofort beendet werden. Intravenöse Flüssigkeit sollte zur Prävention von Hypoxie und Azidose, die die systemische Toxizität des Lokalanästhetikum verstärken und das Fortschreiten zu einem kardiovaskulären Kollaps und Krampfanfall begünstigen, gegeben werden.
Beim Auftreten von Krämpfen sollte die Sauerstoffzufuhr aufrechterhalten und der Blutkreislauf unterstützt werden. Falls erforderlich muss ein krampflösendes Mittel verabreicht werden. Die Verabreichung einer intravenösen Lipidemulsion sollte in Erwägung gezogen werden.
Ist eine kardiovaskuläre Depression offensichtlich (Hypotonie, Bradykardie), sollte eine Behandlung mit intravaskulärem Blutvolumenersatz, blutdrucksteigernden, chronotropen und/oder inotropen Arzneimitteln erwogen werden.
Im Falle eines Kreislaufstillstands muss umgehend eine Herz-Lungen-Wiederbelebung begonnen werden. Für einen erfolgreichen Ausgang müssen die Wiederbelebungsbemühungen möglicherweise ausgedehnt werden.
Patienten, die Symptome von LAST zeigten, sollten mindestens 12 Stunden überwacht werden, da eine kardiovaskuläre Depression nach der Behandlung anhalten oder erneut auftreten kann.
Zentral wirkende Analeptika sind kontraindiziert.
Es existiert kein spezifisches Gegenmittel.
Lidocain kann nicht mittels Hämodialyse entfernt werden.
Eigenschaften/WirkungenATC-Code
N01BB02
Wirkungsmechanismus
Pharmakodynamik
Lidocain ist ein Lokalanästhetikum vom Amidtyp.
Lidocain verringert die Durchlässigkeit von Zellmembranen für Kationen, vor allem für Natriumionen und bei höheren Konzentrationen auch für Kaliumionen. Dies führt in Abhängigkeit der Lidocainkonzentration zu verringerter Erregbarkeit der Nervenfasern, weil die Steigerung der Natriumdurchlässigkeit, die das Aktionspotenzial bewirkt, verlangsamt ist. Vom Inneren der Zelle tritt das Lidocainmolekül in den offenen Natriumkanal und blockiert ihn, indem es sich an einen spezifischen Rezeptor bindet. Eine direkte Aufnahme von Lidocain in die Zellmembran ist viel weniger relevant für die Wirkung.
Weil Lidocain, bevor es seinen Wirkort erreicht, in die Zelle eintreten muss, hängt seine Wirkung von seinem pKa-Wert und dem pH-Wert der Umgebung ab, d. h. vom Anteil der freien Base, die den vorrangig durch die lipophilen Membranen der Nervenfasern migrierenden Anteil ausmacht.
In entzündetem Gewebe ist die Wirkung des Lokalanästhetikums aufgrund des niedrigeren pH-Wertes in solchen Bereichen reduziert.
Klinische Wirksamkeit
Keine Daten verfügbar.
PharmakokinetikAbsorption
Die Plasmaspiegel hängen vom Ort und der Art der Anwendung ab. Jedoch besteht ein schlechtes Verhältnis zwischen der Menge des injizierten Lokalanästhetikums und den maximalen Plasmakonzentrationen.
Die höchsten Konzentrationen werden nach spätestens 30 Minuten erreicht, beim Großteil der Patienten werden die höchsten Konzentrationen innerhalb von 10 bis 20 Minuten erreicht.
Nach einer intramuskulären Injektion von 400 mg Lidocainhydrochlorid-Monohydrat für einen Interkostalblock wurde die maximale Plasmakonzentration (Cmax) mit 6,48 mg/l bestimmt und nach 5 bis 15 Minuten (tmax) erreicht.
Nach subkutaner Anwendung erreichten die Cmax-Werte 4,91 mg/l (vaginale Injektion) bzw. 1,95 mg/l (abdominale Injektion). In einer Studie mit 5 gesunden Freiwilligen erreichte der Cmax-Wert nach maxillar-bukkaler Infiltrationsanästhesie mit 36 mg Lidocain und unter Verwendung einer 20-mg/ml-Lösung einen Wert von 0,31 mg/l.
Distribution
Lidocain folgt einer biphasischen Eliminationskinetik. Nach intravenöser Verabreichung verteilt sich der Wirkstoff zuerst schnell von dem zentralen Kompartiment in stark durchblutete Gewebe und Organe (Alpha-Distributionsphase). Auf diese Phase folgt eine Umdistribution in die Skelettmuskulatur und das Fettgewebe. Die Halbwertszeit während der Alpha-Distributionsphase beträgt etwa 4 bis 8 Minuten. Die Distribution in periphere Gewebe erfolgt voraussichtlich innerhalb von 15 Minuten.
Die Plasmaproteinbindungsrate beträgt bei Erwachsenen etwa 60–80 %. Sie hängt von der Wirkstoffkonzentration und der Konzentration des sauren Alpha-1-Glykoproteins (AGP) ab. AGP ist ein Akute-Phase-Protein, das freies Lidocain bindet und je nach pathophysiologischem Zustand des Patienten, beispielsweise nach Traumata, Operationen oder Verbrennungen, erhöht sein kann. Im Gegensatz dazu wurde gezeigt, dass die AAG-Konzentrationen bei Neugeborenen und bei Patienten mit Leberfunktionsstörungen niedrig sind, was zu einer deutlichen Abnahme der Plasmaproteinbindung von Lidocain führt.
Das Distributionsvolumen im Steady-State beträgt 91 Liter. Das Distributionsvolumen kann bei Patienten mit weiteren Erkrankungen verändert sein, z. B. bei Patienten mit Herzinsuffizienz, Leberinsuffizienz oder Niereninsuffizienz.
Metabolismus
Lidocain wird in der Leber schnell durch Monooxygenasen metabolisiert. Dies erfolgt in erster Linie durch die oxidative N-Desalkylierung, die Hydroxylierung am aromatischen Ring und die Hydrolyse der Amidbindung. Hydroxylderivate unterliegen einer Konjugation.
Insgesamt werden etwa 90 % des Lidocains zu 4-Hydroxy-2,6-Xylidin, 4-Hydroxy-2,6-Xylidinglucuronid und in geringerem Maße zu den aktiven Metaboliten Monoethylglycinxylidid (MEGX) und Glycin-Xylidid (GX) verstoffwechselt.
Diese können sich bei länger dauernden Infusionen oder bei schwerer Nierenfunktionsstörung ansammeln, da ihre Halbwertszeit länger ist als die von Lidocain selbst. Bei Lebererkrankungen kann die Stoffwechselrate um 10–50 % des Normalwerts reduziert sein.
Ergebnisse mit menschlichen Lebermikrosomen und rekombinanten menschlichen CYP-Isoformen zeigten, dass die Enzyme CYP1A2 und CYP3A4 die wichtigsten CYP-Isoformen sind, die an der N-Deethylierung von Lidocain beteiligt sind.
Elimination
Weniger als 10 % der Lidocain-Dosis werden unverändert im Urin ausgeschieden. Der restliche Anteil wird in Form von Metaboliten eliminiert.
Die Eliminationshalbwertszeit beträgt bei Erwachsenen 1,5 bis 2 Stunden und bei Neugeborenen etwa 3 Stunden. Die Eliminationshalbwertszeit kann bei schwerer Herzinsuffizienz (bis zu 4 bis 12 Stunden) oder chronischer Lebererkrankung (bis zu 4,5 bis 6 Stunden) verlängert sein.
Die Halbwertszeiten der aktiven Metaboliten Monoethylglycinxylidid (MEGX) und Glycinxylidid (GX) betragen 2 bis 6 Stunden bzw. 10 Stunden. Da ihre Plasmahalbwertszeit länger ist als die von Lidocain, ist bei längerer Infusion eine Akkumulation von Metaboliten, insbesondere GX, möglich.
Darüber hinaus hängt die Ausscheidungsgeschwindigkeit vom pH-Wert ab und kann durch Ansäuerung des Urins erhöht werden. Die Plasma-Clearance beträgt ca. 0,95 ml/min.
Die Leberdurchblutung scheint den Lidocain-Metabolismus zu begrenzen.
Kinetik spezieller Patientengruppen
Patienten mit Niereninsuffizienz
Die Plasma-Halbwertszeit von Lidocain scheint bei diesen Patienten unverändert zu sein. Lediglich bei einer Infusion über 12 Stunden oder länger kam es zu einer gewissen Kumulation von GX. Diese Kumulation stand offenbar in Zusammenhang mit der langdauernden Verabreichung des Arzneimittels. Allerdings ist bei Patienten mit schwerer Nierenfunktionsstörung die Lidocain-Clearance um etwa die Hälfte reduziert und die Halbwertszeit von Lidocain ist etwa doppelt so lang wie bei gesunden Patienten.
Patienten mit Leberinsuffizienz
Die Plasma-Halbwertszeit von Lidocain und seinen Metaboliten kann verlängert sein und es ist mit erheblichen Auswirkungen auf die Pharmakokinetik zu rechnen. Eine Dosisanpassung ist bei Patienten mit eingeschränkter Leberperfusion erforderlich, z. B. nach einem akuten Herzinfarkt, bei Herzinsuffizienz oder Lebererkrankungen.
Ältere Patienten
Die Eliminationshalbwertszeit und das Verteilungsvolumen können bei älteren Patienten aufgrund einer verminderten Herzleistung und/oder einer verringerten Leberdurchblutung verlängert sein.
Schwangerschaft, Stillzeit
Lidocain passiert die Placentaschranke durch einfache Diffusion und erreicht innerhalb weniger Minuten nach der Verabreichung den Fötus.
Nach einer Paracervical-Blockade wurden im Nabelschnurblut deutlich erhöhte Lidocainkonzentrationen gefunden.
Der Fötus kann Lidocain metabolisieren. Die Spiegel im fetalen Blut betragen ungefähr 60 % der Konzentrationen im mütterlichen Blut. Aufgrund einer geringeren Plasmaproteinbindung im fötalen Blut beträgt die Konzentration von pharmakologisch aktivem freiem Lidocain etwa das 1,4-Fache der mütterlichen Konzentration.
Lidocain geht in geringen Mengen in die Muttermilch über.
Pädiatrische Population
Bei Neugeborenen sind die Spiegel des sauren Alpha-1-Glykoproteins niedrig und die Proteinbindung kann eingeschränkt sein. Da der freie Anteil höher liegen kann, wird von der Anwendung von Lidocain bei Neugeborenen abgeraten.
Präklinische DatenIn tierexperimentellen Studien führte die nach Verabreichung hoher Lidocain-Dosen berichtete Toxizität zu Auswirkungen auf das ZNS und das Herz-Kreislauf-System.
Gentoxizität
Lidocain zeigte in In-vitro- und In-vivo-Genotoxizitätstests kein genotoxisches Potenzial. Jedoch zeigte 2,6-Xylidin, ein Metabolit von Lidocain, Hinweise auf genotoxische Aktivität.
Kanzerogenität
Es wurden keine Studien zur Bewertung des krebserzeugenden Potenzials von Lidocain durchgeführt. In einer Krebsstudie, die an Ratten mit transplazentarer Exposition und einer zweijährigen postpartalen Behandlung von Tieren mit hohen Dosen von 2,6-Xylidin durchgeführt wurde, wurden bösartige und gutartige Tumoren, hauptsächlich in der Nasenhöhle (Ethmoturbinalia), beobachtet. Die klinische Relevanz dieser Ergebnisse wurde nicht bestimmt.
Reproduktionstoxizität
In Studien zur Reproduktionstoxizität wurden embryotoxische oder fetotoxische Wirkungen von Lidocain beim Kaninchen für subkutane Dosen von 25 mg/kg beobachtet. Bei Ratten hat Lidocain in Dosen, die unter den maternaltoxischen Werten liegen, keinen Einfluss auf die postnatale Entwicklung der Nachkommen. Es wurde keine Beeinträchtigung der Fertilität von männlichen oder weiblichen Ratten durch Lidocain beobachtet.
Sonstige HinweiseInkompatibilitäten
Da keine Kompatibilitätsstudien durchgeführt wurden, darf das Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum
verwendet werden.
Nach dem Öffnen muss das Arzneimittel sofort verwendet werden.
Besondere Lagerungshinweise
Außer Reichweite von Kindern aufbewahren.
Einmaliger Gebrauch bei einem einzelnen Patienten. Die Spritze nach Gebrauch entsorgen. Nicht verwenden, wenn die Verschlussspitze der Fertigspritze beschädigt ist.
Die Fertigspritze bis zur Verwendung im ungeöffneten Blister aufbewahren. Bei 15-30 °C lagern. Nicht einfrieren.
Hinweise für die Handhabung
Die Fertigspritze bitte sorgfältig wie folgt vorbereiten.
Die Fertigspritze ist nur zur Verwendung bei einem einzelnen Patienten bestimmt. Die Fertigspritze nach Gebrauch entsorgen. NICHT WIEDERVERWENDEN.
Der Inhalt der ungeöffneten und unbeschädigten Blisterpackung ist steril und darf bis zur Verwendung nicht geöffnet werden.
Das Arzneimittel sollte vor der Verabreichung visuell auf Schwebeteilchen und Verfärbungen geprüft werden. Es darf nur klare und farblose Lösung frei von Schwebeteilchen oder Ausfällungen verwendet werden.
Das Arzneimittel darf nicht verwendet werden, wenn der Originalitätsverschluss auf der Spritze beschädigt ist.
Die Außenfläche der Fertigspritze ist bis zum Öffnen der Blisterpackung steril.
Bei Handhabung unter aseptischen Bedingungen kann dieses Arzneimittel auf eine sterile Fläche gelegt werden.
|
1) Die Fertigspritze aus der sterilen Blisterpackung entnehmen.
| |
2
|
|
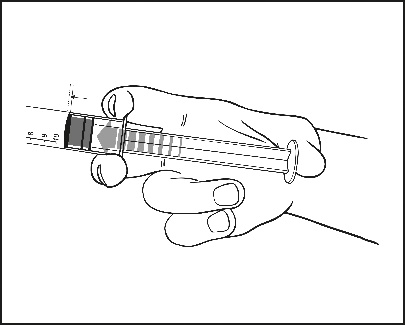
2) Auf den Kolben drücken, um den Stopfen zu lösen. Der Sterilisationsprozess kann zur Adhäsion des Stopfens an den Körper der Fertigspritze geführt haben.
| |
3
|
|
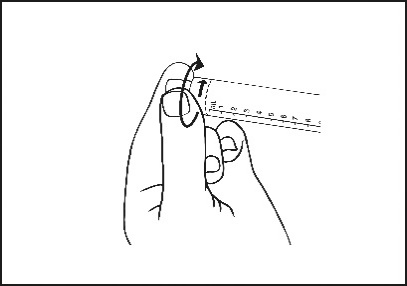
3) Den Deckel abdrehen, um den Verschluss aufzubrechen. Die exponierte Luer-Verbindung nicht berühren, um eine Kontamination zu vermeiden.
| |
4
|
|
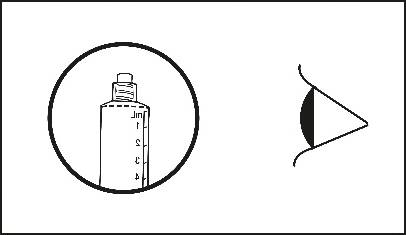
4) Überprüfen, dass die Spitze des Verschlusses der Fertigspritze vollständig entfernt wurde. Falls dies nicht der Fall ist, den Deckel wieder aufsetzen und erneut abdrehen.
| |
5
|
|
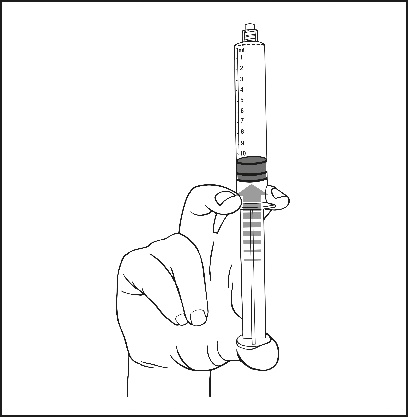
5) Durch vorsichtiges Drücken des Kolbens die Luft entfernen.
| |
6) Setzen Sie die Zugang oder Nadel auf die Fertigspritze. Den Kolben langsam herunterdrücken, um das benötigte Volumen zu injizieren.
|
Zulassungsnummer69435 (Swissmedic)
PackungenLidocain Aguettant 10 mg/ml: 10 Fertigspritzen à 10 ml (B)
Lidocain Aguettant 20 mg/ml: 10 Fertigspritzen à 10 ml (B)
ZulassungsinhaberinAguettant Suisse SA, Thônex
Stand der InformationDezember 2023
|




