Eigenschaften/WirkungenATC-Code
D11AH09
Wirkungsmechanismus / Pharmakodynamik
Ruxolitinib ist ein Inhibitor der Januskinasen (JAK) mit Selektivität für die Isoformen JAK1 und JAK2. Die intrazelluläre JAK-Signalgebung umfasst die Rekrutierung von STAT-Proteinen (Signaltransducer und Transkriptionsaktivatoren) an Zytokinrezeptoren und die anschliessende Modulation der Genexpression. Es wird angenommen, dass autoimmune, IFNγ-produzierende zytotoxische T-Lymphozyten direkt für die Zerstörung von Melanozyten bei Vitiligo beim Menschen verantwortlich sind. Die Rekrutierung zytotoxischer Lymphozyten in die Hautläsionen wird durch IFNγ-abhängige Chemokine wie CXCL10 vermittelt. Die nachgeschaltete Signalgebung von IFNγ ist JAK1/2-abhängig und die Behandlung mit Ruxolitinib senkt die CXCL10-Spiegel bei Vitiligo-Patienten.
Klinische Wirksamkeit
Es wurden insgesamt 674 Patienten mit Vitiligo mit Beteiligung des Gesichts und einer Gesamtkörper-Vitiligofläche (Gesicht und ausserhalb des Gesichts) von nicht mehr als 10 % der Körperoberfläche, mit einem Krankheitsausmass zu Beginn von 3,2% bis 10,1% der Körperoberfläche, in zwei identisch angelegte doppelblinde, randomisierte, vehikelkontrollierte Studien (TRuE-V1, INCB 18424-306 und TRuE-V2, INCB 18424-307) aufgenommen. Die Patienten waren 12 Jahre und älter (10,7 % der Patienten waren 12 bis 17 Jahre alt und 6,7 % waren 65 Jahre oder älter). Der Frauenanteil betrug 53,1 %, 81,9 % der Patienten waren weisser Hautfarbe, 4,7 % waren schwarzer Hautfarbe und 4,2 % waren asiatischer Herkunft. Die Mehrheit der Patienten hatte die Fitzpatrick-Hauttypen III, IV, V oder VI (67,5 %).
In beiden Studien wurden Patienten mit einer betroffenen Körperoberfläche von nicht mehr als 10 % im Verhältnis 2:1 randomisiert und erhielten 24 Wochen lang zweimal täglich entweder Ruxolitinib-Creme oder Vehikel, wenn die betroffene Körperoberfläche nicht mehr als 10 % betrug. Auf diese erste Phase folgt eine Behandlungsphase von weiteren 28 Wochen, während der alle Patienten zweimal täglich mit Ruxolitinib-Creme behandelt werden. Der primäre Endpunkt war der Anteil der Patienten, die in Woche 24 eine Repigmentierung von 75 % erreichten, bewertet mit dem Vitiligo Area Scoring Index (F-VASI75) für das Gesicht. Zu den wichtigsten sekundären Endpunkten gehörten der Anteil der Patienten, die eine 90 %ige Repigmentierung F-VASI (F-VASI90), eine 50 %ige Verbesserung des Gesamtkörper-Vitiligo-Area-Scoring-Index (T-VASI50) und einen Wert von 4 oder 5 auf der Vitiligo Noticeability Scale (VNS) (Vitiligo «deutlich unauffälliger» oder «nicht mehr wahrnehmbar») erreichten.
In beiden Studien wurden eine Repigmentierung der behandelten Vitiligo-Läsionen und eine Überlegenheit der Ruxolitinib-Creme gegenüber der Vehikel-Creme beobachtet, was durch statistisch signifikante Unterschiede in den Ansprechraten für F-VASI75/90, T-VASI50 und den VNS-Score von 4 oder 5 in Woche 24 belegt wurde (Tabelle 2).
Der Unterschied der therapeutischen Wirkung im Vergleich zum Vehikel zeigt sich numerisch ab Woche 12. Eine anhaltende Repigmentierung, die anhand der VASI- und VNS-Scores bewertet wurde, wurde bis Woche 52 bei den Patienten beobachtet, die Ruxolitinib-Creme seit Beginn der Studie zweimal täglich angewendet hatten. Der Anteil der Patienten, die während des 52-wöchigen Behandlungszeitraums in den konsolidierten Daten der Studien TRuE-V1 und TRuE-V2 den F-VASI75-Score erreichten, ist in Abbildung 1 dargestellt.
Ein ähnliches Ansprechen auf die Behandlung wurde in Woche 52 bei den Patienten beobachtet, die von der Behandlung mit dem Vehikel auf Ruxolitinib umgestellt wurden (Abbildung 1).
Tabelle 2: Prozentualer Anteil der Patienten mit Vitiligo, die die primären und wichtigsten sekundären Endpunkte in Woche 24 erreichten (intent-to-treat)a
|
|
TRuE-V1 (INCB 18424-306)
|
TRuE-V2 (INCB 18424-307)
| |
OPZELURA
|
Vehikel
|
OPZELURA
|
Vehikel
| |
(N = 221)
|
(N = 109)
|
(N = 222)
|
(N = 109)
| |
F-VASI75 (%)
|
29,8
|
7,4
|
30,9
|
11,4
| |
Unterschied in der Antwortrate (95 %-KI)
|
22,3b
(14.214, 30.471)
|
-
|
19,5c
(10.537, 28.420)
|
-
| |
F-VASI90 (%)
|
15,3
|
2,2
|
16,3
|
1,3
| |
Unterschied in der Antwortrate (95 %-KI)
|
13,2d
(7.497, 18.839)
|
-
|
15,0e
(9.250, 20.702)
|
-
| |
T-VASI50 (%)
|
20,6
|
5,1
|
23,9
|
6,8
| |
Unterschied in der Antwortrate (95 %-KI)
|
15,5d
(8.339, 22.592)
|
-
|
17,1c
(9.538, 24.721)
|
-
| |
VNS 4 oder 5 (%)
|
24,5
|
3,3
|
20,5
|
4,9
| |
Unterschied in der Antwortrate (95 %-KI)
|
21,2c
(14.271, 28.143)
|
-
|
15,5d
(8.515, 22.561)
|
-
|
a Die primären und wichtigsten sekundären Endpunkte wurden nach der Methode der multiplen Imputation korrigiert.
b p-Wert < 0,0001
c p-Wert < 0,001
d p-Wert < 0,005
e p-Wert < 0,01
Abbildung 1: Anteil der Patienten, die während des 52-wöchigen Behandlungszeitraums einen F-VASI75-Score erreichen (Intent-to-treat) – gepoolte Daten der StudienTRuE-V1 (INCB 18424-306) und TRuE-V2 (INCB 18424-307)
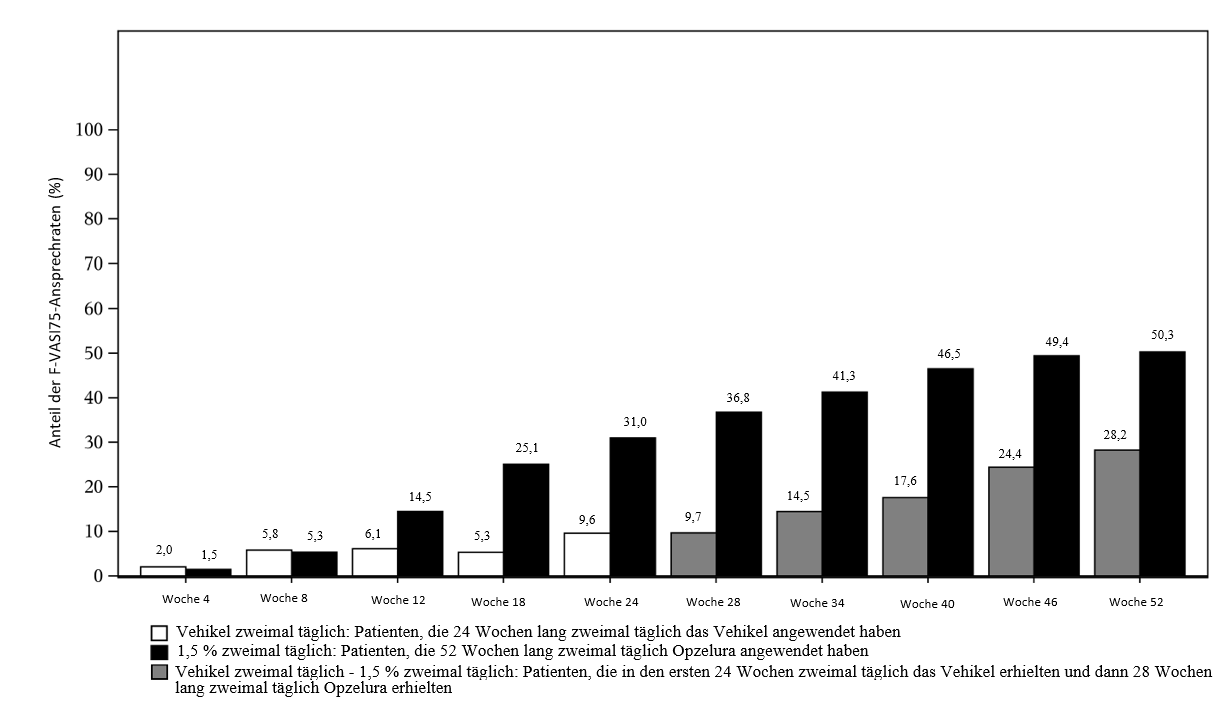
In Woche 52 betrug die beobachtete Ansprechrate für F-VASI90, T-VASI50 und VNS 30,3 %, 51,1 % bzw. 36,3 % für die gepoolte ITT-Population.
Pädiatrie
Insgesamt wurden 72 Jugendliche (12 bis < 18 Jahre; n = 55 Ruxolitinib-Creme, n = 17 Vehikel) in die Zulassungsstudien aufgenommen. Jugendliche zeigten bei der Behandlung mit Ruxolitinib-Creme nach 24 Wochen die gleichen Ansprechraten bei primären und wichtigen sekundären Endpunkten wie Erwachsene im Alter von 18 bis 65 Jahren.
|

