Eigenschaften/WirkungenATC-Code
M03AX01
Wirkungsmechanismus
Der bekannte Wirkmechanismus von Botulinumtoxin Typ A-Produkten besteht in der Blockierung der Freisetzung von Acetylcholin aus der präsynaptischen neuronalen Synapse. Die schwere Kette von Botulinumtoxin Typ A vermittelt die Bindung und Internalisierung des Toxinproteins, während die leichte Kette ein Enzym ist, das das synaptosom-assoziierte Protein von 25 kDa (SNAP-25) spaltet.
Bei intramuskulärer Injektion führt das Toxin zu einer teilweisen Lähmung des betroffenen Muskels, wodurch die Muskelaktivität vorübergehend reduziert wird, was zu einer vorübergehenden Verringerung der Glabellafalten oder der seitlichen Canthalfalten führt. Botulinumtoxin-Typ-A-Produkte haben bei Tieren und Menschen eine lange Wirkungsdauer, die in Wochen bis Monaten gemessen wird. Die Muskelfunktion kehrt allmählich zurück, wenn die Nervenfasern mit neuen Nervenendigungen nachwachsen, um die Muskeln zu innervieren und die Denervierung durch die Verabreichung des Toxins rückgängig zu machen.
Pharmakodynamik
Zu den bekannten Wirkungen von Botulinumtoxin-Typ-A-Produkten gehört die Blockierung der Freisetzung von Acetylcholin aus der präsynaptischen neuronalen Synapse.
Klinische Wirksamkeit
Die im Folgenden beschriebenen Daten spiegeln die Ergebnisse der placebokontrollierten Phase-III-Studien READY- 1, READY- 2 und READY- 3 wider. Insgesamt wurden 1.012 Patienten in drei Zulassungsstudien behandelt, darunter 806 Patienten, die mit Relfydess behandelt wurden, und 206 Patienten, die mit Placebo behandelt wurden. Weitere 902 Patienten, die mit Relfydess behandelt wurden, nahmen an einer offenen Langzeitsicherheitsstudie teil (READY- 4). Insgesamt wurden in allen Phase-III-Studien 1708 Patienten mit Relfydess behandelt.
Die psychologischen Funktionen der Probanden wurde anhand der FACE-Q™-Skala zum psychischen Wohlbefinden beobachtet (die die Bewertungen der Probanden zu den Themen Selbstliebe, positives Gefühl, gutes Gefühl, Glücksgefühl, Zufriedenheit mit sich selbst, Selbstakzeptanz, Selbstvertrauen, Attraktivität und des Gefühls der eigenen Grossartigkeit umfasst).
Die FLTSQ-Skala (Facial Line Treatment Satisfaction Questionnaire - Fragebogen zur Zufriedenheit mit der Gesichtslinienbehandlung) wurde verwendet, um die Zufriedenheit der Probanden mit dem Aussehen der GL und/oder der LCL zu ermitteln (die Probanden bewerteten, ob sie sich mit bestimmten Gesichtsausdrücken oder -positionen wohlfühlen, ob die Gesichtslinien sichtbar sind, ob die Haut glatt ist, ob sie jugendlich aussieht, ob sie für ihr Alter gut aussieht, ob sie entspannt aussieht, ob sie attraktiv aussieht, ob sie ausgeruht aussieht und ob sie erneuert aussieht), aber auch, um die Zufriedenheit der Probanden mit der Behandlung zu ermitteln (die Probanden bewerteten, ob sie mit einer erneuten Behandlung, einer Behandlungsempfehlung, den erwarteten Ergebnissen, der Natürlichkeit, der richtigen Behandlungswahl, der Zufriedenheit mit den Behandlungsergebnissen, aber auch mit dem Behandlungsergebnis selbst und der Zufriedenheit mit der Behandlungsverbesserung zufrieden sind).
Die Antworten auf die FACE-Q™-Skala für psychologische Funktionen und die FLTSQ-Skala zeigten, dass die mit Relfydess behandelten Probanden zu allen Nachbehandlungszeitpunkten eine Verbesserung der psychologischen Funktionen zeigten und mit ihrer Behandlung und ihrem Aussehen zufriedener waren als die Probanden unter Placebo. Wie anhand der FACE-Q™- und FLTSQ-Skala festgestellt wurde, blieben die positive psychologische Funktion und die Zufriedenheit der Probanden auch noch 6 Monate nach der Behandlung erhalten.
Patienten, die Relfydess erhielten (insgesamt 1699), wurden zu Beginn und nach jeder Behandlung auf die Bildung von Antikörpern gegen das Arzneimittel getestet. Kein Patient wurde positiv auf Toxin-neutralisierende Antikörper getestet.
Glabellafalten (READY-1 und READY-3)
In zwei zulassungsrelevanten, multizentrischen, doppelblinden, placebokontrollierten Phase-III-Studien wurden 451 Patienten in den Glabellafalten (GL) mit der empfohlenen Dosis von 50 Einheiten behandelt. READY- 1 untersuchte Relfydess nur für die Behandlung von Glabellafalten; READY- 3 untersuchte die Kombinationsbehandlung von Glabellafalten und latheralen Canthallinien (LCL). Die Ergebnisse von READY-3 werden für die Patienten beschrieben, die Relfydess sowohl in der GL als auch in der LCL in Kombination erhielten.
Primärer Wirksamkeitsendpunkt war der Anteil der Probanden, die auf die Behandlung ansprachen, definiert als Erreichen einer Punktzahl von 0 oder 1 beim Schweregrad der Glabellafalten auf der GL-ILA 4-Punkteskala (Investigator Live Assessment) für den Schweregrad der Glabellafalten bei maximalem Stirnrunzeln bei der Visite in Monat 1. Die Mehrheit der Probanden sowohl in der Relfydess- als auch in der Placebogruppe hatte zu Studienbeginn schwere Glabellafalten, wie vom Prüfarzt festgestellt (74,5% bzw. 75,8%).
Der vom Prüfarzt gemessene Behandlungserfolg für GL (GL-ILA, unter Verwendung einer 4-Punkte-Skala- [0 = keine, 1 = leicht, 2 = mittelschwer, 3 = schwer], bei maximalem Stirnrunzeln) war in der Relfydess-Gruppe im Vergleich zur Placebo-Gruppe nach einem Monat statistisch signifikant grösser (p < 0,001) (Tabelle 4).
Tabelle 4: Bewertung des Prüfarztes zum Behandlungserfolg der Glabellarliniena (% und Anzahl der Probanden) im Monat 1b in doppelblinden, placebokontrollierten klinischen Studien
|
Studie
|
Relfydess 50 Einheiten GL
|
Relfydess 50 Einheiten GL und 60 Einheiten LCL
|
Placebo
| |
READY- 1, nur GL
|
96.3%
N = 199
|
-
|
4.5%
N = 67
| |
READY- 3 LCL & GL Behandlung
|
94.3%
N = 106
|
96.3%
N = 108
|
1.8%
N = 55
|
a auf der GL-ILA einen Wert von 0 oder 1 für den Schweregrad der GL erreicht haben
b Primärer Wirksamkeitsendpunkt an Tag 30; p < 0,001
Subgruppenanalysen des primären Wirksamkeitsendpunkts der Ansprechraten auf der Grundlage der GL-ILA 4-Punkteskala bei maximalem Stirnrunzeln im Monat 1 zeigten die Wirksamkeit von Relfydess unabhängig von Alter, Rasse, früherer Botulinumtoxin-Anwendung oder dem Ausgangsschweregrad auf der GL-ILA bei maximalem Stirnrunzeln.
Bei den Probanden, die sowohl auf der fotografischen GL-ILA 4-Punkteskala als auch auf der statischen GL-SLA 4-Punkteskala bei maximalem Stirnrunzeln einen Wert von 0 oder 1 erreichten, betrug die mittlere Anzahl von Tagen bis zum Verlust eines Wertes von 0 oder 1 168 Tage (24 Wochen) bei READY-1 und 140 Tage (20 Wochen) bei READY-3.
Einen Monat nach der Injektion zeigten 98 % der mit Relfydess behandelten Patienten in READY-1 und READY-3 eine Verbesserung der Glabellafalten um mindestens einen Grad bei maximaler Stirnrunzelung, basierend auf der Bewertung des Schweregrads der Glabellafalten durch die Prüfärzte. Sechs Monate nach der Injektion wiesen 58 % der mit Relfydess behandelten Patienten in der Studie READY-1 und 46 % der Patienten in der Studie READY-3 immer noch eine Verbesserung auf, verglichen mit den mit Placebo behandelten Patienten (10 % in der Studie READY-1 und 4 % in der Studie READY-3, p < 0,001).
Für diese READY-1 Probanden konnte der Median der Tage bis zur Rückkehr zum Ausgangswert für den Schweregrad der GL nicht berechnet werden, da mehr als die Hälfte der Probanden bis zum Ende der Studie (≥ 24 Wochen) nicht zum Ausgangswert zurückgekehrt war. 75 % der Probanden in der Relfydess-Gruppe erreichten nach 169 Tagen (> 24 Wochen) wieder den Ausgangswert. Bei den Probanden von READY-3 betrug die mediane Anzahl der Tage bis zur Rückkehr zum Ausgangswert in der Relfydess -Gruppe 179 Tage (26 Wochen) im Glabellar Lines Treatment Pool und 172 Tage (25 Wochen) in der GL-Relfydess/LCL-Placebogruppe und 189 Tage (27 Wochen) in der GL-Relfydess-/LCL Relfydess-Gruppe.
In der Relfydess-Gruppe wurde im Vergleich zur Placebogruppe über einen Zeitraum von 6 Monaten eine vom Prüfarzt bewertete Verbesserung des Schweregrads der GL festgestellt (Abbildung 3).
Abbildung 3: Relfydess Prüfarzt- und Probandenbeurteilung der Glabellarlinien-Ansprechrate (Erreichen einer Punktzahl von keinea oder leichterb im Schweregrad der GL) im Vergleich zu Placebo im Laufe der Zeit (READY- 1)c, d
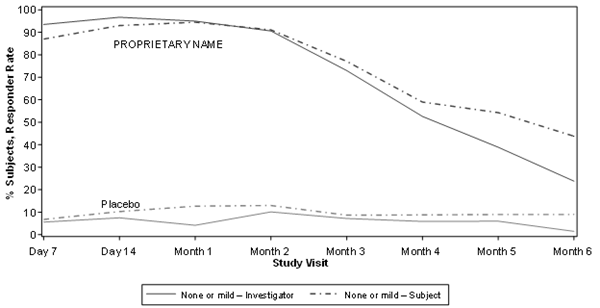
a keine Punkte = 0
b Wertung von mild = 1
c Statistisch signifikant höhere Responder-Rate (basierend auf GL-ILA 4-Punkteskala bei maximalem Stirnrunzeln in der Relfydess-Gruppe) im Vergleich zu Placebo (p- Wert < 0,001) zu allen Zeitpunkten bis Monat 6.
d Statistisch signifikant höhere Responder-Rate (basierend auf der GL- SLA 4- Punkteskala bei maximalem Stirnrunzeln in der Relfydess-Gruppe) im Vergleich zu Placebo (p- Wert < 0,001) zu allen Zeitpunkten bis Monat 6
Bei kombinierter Behandlung mit LCL war das Ansprechen (Erreichen von 0 oder 1 auf dem GL-ILA bei maximalem Stirnrunzeln) in der Relfydess-GL/Relfydess LCL-Gruppe im Vergleich zur Placebo-GL/Placebo-LCL-Gruppe während der gesamten 6 Monate nach der Behandlung statistisch signifikant höher.
Seitliche Canthallinien (READY-2 und READY-3)
In zwei zulassungsrelevanten multizentrischen, doppelblinden, placebokontrollierten Phase-III-Studien wurden 471 Patienten in den lateralen Canthallinien (LCL) mit der empfohlenen Dosis von 60 Einheiten behandelt. READY-2 untersuchte Relfydess nur für die Behandlung von LCL; READY-3 untersuchte die Kombinationsbehandlung von GL und LCL. Die Ergebnisse für READY-3 werden für die Patienten beschrieben, die Relfydess sowohl in der GL als auch in den LCL in Kombination erhielten.
Primärer Wirksamkeitsnachweis war der Anteil der Probanden, die bei der Visite im Monat 1 auf der LCL-ILA 4-Punkteskala (LCL-Investigator Live Assessment) für den Schweregrad der lateralen Canthallinien bei maximalem Lächeln einen Wert von 0 oder 1 erreichten. Etwa 40 % der Probanden sowohl in der Relfydess- als auch in der Placebogruppe hatten zu Studienbeginn schwere beidseitig symmetrische seitliche Canthallinien, wie vom Prüfarzt festgestellt (42,3 % bzw. 42,7 %).
Der vom Prüfarzt gemessene Behandlungserfolg bei LCL (LCL-Investigator Live Assessment, unter Verwendung einer 4-Punkte-Skala- [0 = keine, 1 = leicht, 2 = mittelschwer, 3 = schwer], bei maximalem Lächeln) war in der Relfydess-Gruppe im Vergleich zur Placebo-Gruppe nach einem Monat statistisch signifikant grösser (p < 0,001) (Tabelle 5).
Tabelle 5: Bewertung des Prüfarztes zum Behandlungserfolg der lateralen Canthalliniena (% und Anzahl der Probanden) im Monat 1b in doppelblinden, placebokontrollierten klinischen Studien
|
Studie
|
Relfydess 60 Einheiten LCL
|
Relfydess 60 Einheiten LCL & 50 Einheiten GL
|
Placebo
| |
READY-2, nur LCL
|
87.2%
N = 204
|
-
|
11.9%
N = 69
| |
READY- 3, LCL & GL Behandlung
|
78.1%
N = 117
|
83.3%
N = 108
|
19.3%
N = 55
|
a einen LCL-Schweregrad von 0 oder 1 auf der LCL-ILA erreicht haben
b Primärer Wirksamkeitsendpunkt an Tag 30; p < 0,001
Untergruppenanalysen des primären Wirksamkeitsendpunkts der Responder-Raten auf der Grundlage der LCL--ILA 4-Punkte-Fotoskala bei maximalem Lächeln im Monat 1 zeigten die Wirksamkeit von Relfydess unabhängig von Alter, Rasse, vorheriger Botulinumtoxin-Anwendung oder dem Ausgangsschweregrad auf der LCL-ILA bei maximalem Lächeln.
Bei Probanden, die sowohl auf der LCL-ILA 4-Punkteskala als auch auf der LCL-SLA Static 4-Punkteskala bei maximalem Lächeln einen Wert von 0 oder 1 erreichten, betrug die mediane Anzahl der Tage bis zum Verlust eines Wertes von 0 oder 1 in der Relfydess-Gruppe 144 Tage (21 Wochen) im Lateral Canthal Lines Treatment Pool und 162 Tage (23 Wochen) in READY-2, 140 Tage (20 Wochen) in der GL Placebo/LCL Relfydess-Gruppe und 142 Tage (20 Wochen) in der GL Relfydess/LCL Relfydess-Gruppe in READY-3.
Einen Monat nach der Injektion wiesen 93 % der mit Relfydess behandelten Patienten in READY-2 und 3 eine Verbesserung der LCL um mindestens einen Grad bei maximalem Lächeln auf, basierend auf der Bewertung der Schwere der lateralen Canthallinie durch den Prüfarzt. Sechs Monate nach der Injektion zeigten 36 % der mit Relfydess behandelten Patienten in der Studie READY-2 und 33 % der Patienten in der Studie READY-3 immer noch eine Verbesserung, verglichen mit den mit Placebo behandelten Patienten (15 % in der Studie READY-2 und 13 % in der Studie READY-3, p < 0,003).
Bei diesen Probanden betrug die mediane Anzahl der Tage bis zur Rückkehr zum Ausgangswert des LCL-Schweregrads in der Relfydess-Gruppe 173 Tage (25 Wochen) im Behandlungspool für laterale Canthal-Linien und in der READY-2-Studie, 168 Tage (24 Wochen) in der GL-Placebo/LCL Relfydess-Gruppe und 174 Tage (25 Wochen) in der GL Relfydess/LCLRelfydess-Gruppe in READY-3. In der Studie READY-2 kehrten 75 % der Probanden in der Relfydess-Gruppe nach 147 Tagen (21 Wochen) zum Ausgangswert zurück, in der LCL-Gruppe nach 141 Tagen (20 Wochen). In der Studie READY-3 kehrten 75 % der Probanden in der Gruppe GL Placebo/LCL Relfydess nach 139 Tagen (20 Wochen) zum Ausgangswert zurück, und nach 147 Tagen (21 Wochen) für die Probanden in der Gruppe GL Relfydess/LCLRelfydess.
Die von Prüfärzten und Probanden bewertete Verbesserung des Schweregrads der LCL wurde in der Relfydess-Gruppe im Vergleich zur Placebogruppe über 6 Monate hinaus gezeigt (Abbildung 4).
Abbildung 4: Relfydess - Von Prüfern und Probanden bewertete Ansprechrate der lateralen Canthallinie (Erreichen einer Punktzahl von keinera oder leichterb im Schweregrad der LCL) im Vergleich zu Placebo im Zeitverlauf (READY-2)c, d
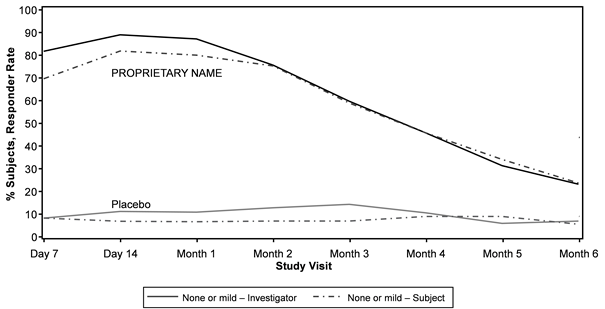
a keine Punkte = 0
b Wertung von mild = 1
c Statistisch signifikant höhere Responder-Rate (basierend auf LCL- ILA 4- Punkteskala bei maximalem Lächeln in der Relfydess-Gruppe) im Vergleich zu Placebo (p < 0,001) zu allen Zeitpunkten bis Monat 5; Monat 6, p- Wert = 0,002
d Statistisch signifikant höhere Responderrate (basierend auf der LCL- SLA 4- Punkteskala bei maximalem Lächeln in der Relfydess-Gruppe) im Vergleich zu Placebo (p < 0,001) zu allen Zeitpunkten bis Monat 6.
Bei kombinierter Behandlung mit GL war das Ansprechen (Erreichen von 0 oder 1 auf dem LCL-ILA bei maximalem Lächeln) in der Gruppe Relfydess-GL/Relfydess -LCL im Vergleich zu Placebo-GL/Placebo-LCL zu allen Nachbehandlungszeitpunkten ausser Monat 6 statistisch signifikant höher (p = 0,052).
Offene Studie (READY-4)
READY-4 war eine multizentrische, offene Phase-III-Studie zur Untersuchung der Sicherheit wiederholter Injektionen von Relfydess für die Langzeitbehandlung von mittelschweren bis schweren Glabellafalten und seitlichen Canthalfalten (mit einem Abstand von mindestens 12 Wochen zwischen den Behandlungszyklen).
In der Studie READY-4 zeigte die Verabreichung von Relfydess bis zu 110 IU und bis zu 7 GL- und/oder LCL-Behandlungen über einen Studienzeitraum von 52- Wochen günstige Wirksamkeitsergebnisse sowohl bei Glabellafalten als auch bei seitlichen Canthalfalten, unabhängig davon, ob sie gleichzeitig oder unabhängig voneinander behandelt wurden.
|


