ZusammensetzungWirkstoffe
Aripiprazol Monohydrat
Hilfsstoffe
Carmellose-Natrium (E466), Macrogol 400, Povidon K17 (E1201), Natriumchlorid, Natriumdihydrogenphosphat-Monohydrat (E339), Natriumhydroxid (zur Einstellung des pH-Werts), Wasser für Injektionszwecke
Eine Fertigspritze zu 720 mg enthält maximal 7,13 mg Natrium.
Eine Fertigspritze zu 960 mg enthält maximal 9,51 mg Natrium.
Indikationen/AnwendungsmöglichkeitenAbilify Asimtufii wird für die Erhaltungstherapie von Schizophrenie bei erwachsenen Patienten,
die zuvor stabil mit Aripiprazol eingestellt wurden, angewendet.
Dosierung/AnwendungBei Patienten, die Aripiprazol nie eingenommen haben, muss vor Beginn der Behandlung mit Abilify Asimtufii eine Verträglichkeit von Aripiprazol nachgewiesen werden.
Eine Titration der Dosis für Abilify Asimtufii ist nicht erforderlich.
Schemata zu Behandlungsbeginn
Das empfohlene Schema zu Behandlungsbeginn beim Wechsel von Abilify Maintena 400 mg einmal monatlich ist Abilify Asimtufii 960 mg nicht früher als 26 Tage nach der letzten Injektion von Abilify Maintena 400 mg. Abilify Asimtufii 960 mg sollte danach einmal alle 2 Monate verabreicht werden (alle 56 Tage).
Die Anfangsdosis kann auch nach einem von zwei weiteren Schemata verabreicht werden:
·Start mit einer Injektion: Am Tag des Behandlungsbeginns nach der oralen Therapie sollte eine Injektion mit Abilify Asimtufii 960 mg verabreicht und die Behandlung mit 10 mg bis 20 mg oral angewendetem Aripiprazol pro Tag an 14 aufeinander folgenden Tagen fortgesetzt werden, um während der Einleitung der Behandlung die therapeutischen Aripiprazol-Konzentrationen aufrechtzuerhalten.
·Start mit zwei Injektionen: Am Tag des Behandlungsbeginns nach der oralen Therapie sollte eine Injektion mit Abilify Asimtufii 960 mg und eine Injektion mit Abilify Maintena 400 mg an zwei unterschiedlichen Injektionsstellen (siehe Art der Anwendung) verabreicht werden, zusammen mit einer einmalig oral angewendeten Aripiprazol-Dosis von 20 mg.
Dosisanpassung/Titration
Nach Behandlungsbeginn beträgt die empfohlene Erhaltungsdosis eine Injektion Abilify Asimtufii 960 mg jeden zweiten Monat. Abilify Asimtufii 960 mg ist einmal alle 2 Monate als Einzelinjektion zu verabreichen (56 Tage nach der letzten Injektion). Patienten kann die Injektion bis zu 2 Wochen vor oder 2 Wochen nach der geplanten 2-monatigen Dosisgabe verabreicht werden.
Treten nach Verabreichung von Abilify Asimtufii 960 mg Nebenwirkungen auf, ist eine Verringerung auf Abilify Asimtufii 720 mg einmal alle 2 Monate zu erwägen.
Versäumte Dosen
Sind seit der letzten Injektion mehr als 8 Wochen und weniger als 14 Wochen vergangen, sollte die nächste Dosis Abilify Asimtufii 960 mg/720 mg so schnell wie möglich verabreicht werden. Anschliessend sollte mit dem Behandlungsschema von einmal alle 2 Monate fortgefahren werden. Liegt die letzte Injektion länger als 14 Wochen zurück, sollte die nächste Dosis Abilify Asimtufii 960 mg/720 mg verabreicht und gleichzeitig die Behandlung mit oral angewendetem Aripiprazol 14 Tage lang fortgesetzt werden oder mit 2 separaten Injektionen (einmal Abilify Asimtufii 960 mg und einmal Abilify Maintena 400 mg oder einmal Abilify Asimtufii 720 mg und einmal Abilify Maintena 300 mg) gemeinsam mit einer Dosis 20 mg oral angewendetem Aripiprazol. Anschliessend sollte mit dem Behandlungsschema von einmal alle 2 Monate fortgefahren werden.
Spezielle Dosierungsanweisungen
Patienten mit Leberfunktionsstörungen
Keine Dosisanpassung ist erforderlich bei Patienten mit leichter oder mittelschwerer Leberinsuffizienz. Bei Patienten mit schwerer Leberinsuffizienz genügen die vorliegenden Daten nicht für eine Dosisempfehlung. Bei diesen Patienten, die eine vorsichtige Dosierung benötigen, sollte eine orale Darreichungsform bevorzugt werden (siehe Pharmakokinetik).
Patienten mit Nierenfunktionsstörungen
Keine Dosisanpassung ist erforderlich bei Patienten mit Niereninsuffizienz (siehe Pharmakokinetik).
Ältere Patienten
Die Sicherheit und Wirksamkeit von Abilify Asimtufii 960 mg/720 mg bei der Behandlung von Schizophrenie bei Patienten ab 65 Jahren ist nicht erwiesen (siehe Warnhinweise und Vorsichtsmassnahmen). Eine Dosierungsempfehlung kann nicht gegeben werden.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Abilify Asimtufii 960 mg/720 mg bei Kindern und Jugendlichen im Alter von 0 bis 17 Jahren ist nicht belegt. Es liegen keine Daten vor.
Genotyp/Genetische Polymorphismen
Langsame Metabolisierer für CYP2D6
Bei Patienten mit bekanntermassen langsamer CYP2D6-Metabolisierung:
·Patienten, die von Abilify Maintena 300 mg einmal monatlich wechseln: Die Anfangsdosis sollte eine Injektion Abilify Asimtufii 720 mg betragen und nicht früher als 26 Tage nach der letzten Injektion von Abilify Maintena 300 mg verabreicht werden.
·Start mit einer Injektion (nach Wechsel von einer oralen Therapie): Die Anfangsdosis sollte eine Injektion Abilify Asimtufii 720 mg betragen und die Behandlung mit der verschriebenen Dosis von oral angewendetem Aripiprazol pro Tag an 14 aufeinander folgenden Tagen fortgesetzt werden.
·Start mit zwei Injektionen (nach Wechsel von einer oralen Therapie): Die Anfangsdosis sollte aus 2 separaten Injektionen bestehen: eine Injektion mit Abilify Asimtufii 720 mg und eine Injektion mit Abilify Maintena 300 mg, zusammen mit einer oral angewendeten Aripiprazol-Einzeldosis von 20 mg (siehe Art der Anwendung).
Danach sollte eine Erhaltungsdosis von Abilify Asimtufii 720 mg als Einzelinjektion einmal alle 2 Monate gegeben werden.
Anpassung der Erhaltungsdosis aufgrund von Wechselwirkungen mit CYP2D6- und/oder CYP3A4-Inhibitoren und/oder CYP3A4-Induktoren
Wenn Patienten gleichzeitig mehr als 14 Tage hochwirksame CYP3A4- oder CYP2D6-Inhibitoren einnehmen, sollte eine Anpassung der Erhaltungsdosis erfolgen. Wenn der CYP3A4- oder CYP2D6-Inhibitor abgesetzt wird, muss die Dosis eventuell auf die vorherige Dosis gesteigert werden (siehe Rubrik «Interaktionen»). Im Falle von Nebenwirkungen durch Abilify Asimtufii 960 mg trotz Dosisanpassungen, sollte die Notwendigkeit einer gleichzeitigen Anwendung von CYP2D6- oder CYP3A4- Inhibitoren erneut geprüft werden.
Eine gleichzeitige Anwendung von CYP3A4-Induktoren mit Abilify Asimtufii 960 mg/720 mg länger als 14 Tage sollte vermieden werden, weil der Blutspiegel von Aripiprazol verringert wird und unter die wirksamen Konzentrationen sinken kann (siehe Rubrik «Interaktionen»).
Abilify Asimtufii 960 mg/720 mg sollte nicht bei Patienten mit bekanntermassen langsamer CYP2D6-Metabolisierung angewendet werden, die gleichzeitig einen starken CYP2D6- und/oder CYP3A4-Inhibitor anwenden.
Tabelle 1: Anpassung der Erhaltungsdosis von Abilify Asimtufii bei Patienten, die gleichzeitig hochwirksame CYP2D6-Inhibitoren, CYP3A4-Inhibitoren und/oder CYP3A4-Induktoren länger als 14 Tage einnehmen
|
|
Angepasste 2-Monats-Dosis
| |
Patienten, die Abilify Asimtufii 960 mg erhalten*
| |
Hochwirksame CYP2D6- oder CYP3A4-Inhibitoren
|
720 mg
| |
Hochwirksame CYP2D6- und CYP3A4-Inhibitoren
|
Anwendung vermeiden.
| |
CYP3A4-Induktoren
|
Anwendung vermeiden.
|
* Ist bei Patienten, die bereits 720 mg einnehmen, zu vermeiden, z.B. aufgrund von Nebenwirkungen aufgrund der höheren Dosis
Art der Anwendung
Abilify Asimtufii 960 mg und 720 mg ist nur für die Injektion in den Glutealmuskel bestimmt und darf weder intravenös noch subkutan angewendet werden. Es darf ausschliesslich von medizinischem Fachpersonal verabreicht werden.
Die Suspension muss langsam als Einzelinjektion (Dosen dürfen nicht geteilt werden) in den Glutealmuskel verabreicht werden, wobei die Injektionen abwechselnd rechts und links zu verabreichen sind. Es ist darauf zu achten, nicht versehentlich in ein Blutgefäss zu injizieren.
Erfolgt eine Einleitung der Behandlung mit einer der Optionen, die zwei Injektionen beinhalten (einmal Abilify Asimtufii 960 mg oder 720 mg und einmal Abilify Maintena 400 mg oder 300 mg), müssen die Injektionen an zwei unterschiedlichen Stellen verabreicht werden. Es dürfen NICHT beide Injektionen gemeinsam in denselben Glutealmuskel injiziert werden.
KontraindikationenÜberempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe (siehe Zusammensetzung).
Warnhinweise und VorsichtsmassnahmenAripiprazol war in einer klinischen Studie nach Gabe einer Einzeldosis bis zu 34 Wochen im Plasma nachweisbar. Für die Standarddosierung von 960 mg ist eine noch über 34 Wochen hinausgehende Nachweisdauer von Aripiprazol im Plasma wahrscheinlich. Die langandauernde Freisetzung von Aripiprazol bei Anwendung von Abilify Asimtufii 960 mg/720 mg sollte in die therapeutischen Überlegungen miteinbezogen werden, insbesondere hinsichtlich unerwünschter Wirkungen, pharmakokinetischer und pharmakodynamischer Wechselwirkungen sowie bezüglich Schwangerschaft und Stillzeit.
Es kann unter einer antipsychotischen Behandlung mehrere Tage bis zu einigen Wochen dauern, bis sich der klinische Zustand des Patienten verbessert. Die Patienten sollen während dieser Zeit sorgfältig überwacht werden.
Suizidalität
Suizidales Verhalten ist Teil von psychotischen Erkrankungen und wurde in einigen Fällen kurz nach Beginn oder nach einem Wechsel einer antipsychotischen Behandlung berichtet, einschliesslich einer Behandlung mit Aripiprazol (siehe Unerwünschte Wirkungen). Patienten mit hohem Risiko sollten während einer Antipsychotika-Therapie engmaschig überwacht werden. Die Ergebnisse einer epidemiologischen Studie bei Patienten mit Schizophrenie signalisieren kein erhöhtes Suizidalitätsrisiko unter Aripiprazol verglichen mit anderen Antipsychotika.
Kardiovaskuläre Erkrankungen
Aripiprazol soll mit Vorsicht angewendet werden bei Patienten mit bekannter kardiovaskulärer Erkrankung (Krankheitsgeschichte mit Myokardinfarkt oder ischämischer Herzerkrankung, Herzinsuffizienz oder Überleitungsstörungen), zerebrovaskulären Erkrankungen, Prädispositionen für Hypotonie (Dehydratation, Hypovolämie und Behandlung mit blutdrucksenkenden Arzneimitteln), oder Hypertonie, einschliesslich akzelerierter und maligner Form.
Unter Behandlung mit Antipsychotika sind Fälle von venösen Thromboembolien (VTE) berichtet worden. Patienten, die mit Antipsychotika behandelt werden, zeigen oftmals erworbene Risikofaktoren für VTE. Deshalb sollten alle möglichen Risikofaktoren für VTE vor und während der Behandlung mit Aripiprazol identifiziert und präventive Massnahmen ergriffen werden (siehe Unerwünschte Wirkungen).
QT-Verlängerung
In klinischen Studien mit oraler Aripiprazol Behandlung war die Inzidenz einer QT-Verlängerung vergleichbar zu Placebo. Wie mit anderen Antipsychotika ist bei der Anwendung von Aripiprazol bei Patienten mit QT-Verlängerung in der Familienanamnese Vorsicht geboten (siehe Unerwünschte Wirkungen).
Spätdyskinesien
In klinischen Studien, die bis zu einem Jahr dauerten, wurde über Dyskinesien während der Behandlung mit Aripiprazol berichtet. Wenn bei einem Patienten unter Aripiprazol Anzeichen und Symptome einer Spätdyskinesie auftreten, sollte eine Dosisreduktion oder das Absetzen der Behandlung erwogen werden (siehe Unerwünschte Wirkungen). Diese Symptome können sich vorübergehend verschlechtern oder sogar erst nach Absetzen der Behandlung auftreten.
Malignes neuroleptisches Syndrom (MNS)
Das MNS ist ein potenziell tödlicher Symptomkomplex, der in Zusammenhang mit der Einnahme von Antipsychotika auftreten kann. In klinischen Studien wurden seltene Fälle von MNS während der Behandlung mit Aripiprazol berichtet. Klinische Manifestationen eines MNS sind sehr hohes Fieber, Muskelrigidität, veränderte Bewusstseinslage und Anzeichen autonomer Instabilität (unregelmässiger Puls oder Blutdruck, Tachykardie, starkes Schwitzen und Herzrhythmusstörungen). Weitere Anzeichen können ein Anstieg der Kreatinphosphokinase, eine Myoglobinurie (Rhabdomyolyse) und akutes Nierenversagen sein. Erhöhte Kreatinphosphokinase und Rhabdomyolyse, die nicht unbedingt mit einem MNS in Verbindung standen, wurden allerdings auch berichtet. Falls ein Patient Anzeichen und Symptome entwickelt, die auf ein MNS hinweisen, oder hohes Fieber unklarer Genese ohne weitere klinische Manifestationen von MNS zeigt, müssen alle Antipsychotika, einschliesslich Aripiprazol, abgesetzt werden (siehe Unerwünschte Wirkungen).
Krampfanfälle
In klinischen Studien wurde gelegentlich über Krampfanfälle während der Behandlung mit Aripiprazol berichtet. Aripiprazol sollte daher bei Patienten mit Krampfanfällen in der Vorgeschichte oder bei Krankheitsbildern, die mit Krampfanfällen in Zusammenhang stehen, mit Vorsicht angewendet werden (siehe Unerwünschte Wirkungen).
Ältere Patienten mit demenzbedingter Psychose
Erhöhte Mortalität
In drei Placebo-kontrollierten Studien mit oralem Aripiprazol bei älteren Patienten mit einer Psychose aufgrund von Alzheimer-Demenz (n = 938, Alter: 56-99 Jahre, Durchschnittsalter: 82,4 Jahre), war das Sterberisiko bei den mit Aripiprazol behandelten Patienten höher als unter Placebo. Die Mortalitätsrate betrug bei den Patienten unter oralem Aripiprazol 3,5% verglichen mit 1,7% unter Placebo. Obwohl die Todesursachen unterschiedlich waren, schienen die meisten Todesfälle entweder kardiovaskulärer (z.B. Herzinsuffizienz, plötzlicher Tod) oder infektiöser (z.B. Lungenentzündung) Natur zu sein (siehe Abschnitt Unerwünschte Wirkungen).
Unerwünschte zerebrovaskuläre Ereignisse:
In denselben Studien mit oralem Aripiprazol wurden unerwünschte zerebrovaskuläre Wirkungen (z.B. Schlaganfall, transitorische ischämische Attacke), einschliesslich Todesfälle, berichtet bei Patienten im Alter von 78-88 Jahren (Durchschnittsalter: 84 Jahre). Insgesamt berichteten in diesen Studien 1,3% der Patienten unter oralem Aripiprazol über unerwünschte zerebrovaskuläre Wirkungen verglichen mit 0,6% unter Placebo. Diese Differenz war statistisch nicht signifikant. In einer dieser Studien mit fixer Dosierung wurde jedoch eine signifikante Dosis-Wirkungs-Beziehung für unerwünschte zerebrovaskuläre Ereignisse bei Patienten unter Aripiprazol gefunden (siehe Unerwünschte Wirkungen).
Aripiprazol ist nicht für die Behandlung demenzbedingter Psychosen zugelassen.
Hyperglykämie und Diabetes mellitus
Bei Patienten, die mit atypischen Antipsychotika, einschliesslich Aripiprazol, behandelt wurden, wurde über Hyperglykämie berichtet, die in einigen Fällen sehr ausgeprägt war und mit einer Ketoazidose oder einem hyperosmolaren Koma oder Tod einherging. Adipositas und Diabetes in der Familienanamnese gehören zu den Risikofaktoren, die Patienten für schwerwiegende Komplikationen prädisponieren können. In klinischen Studien mit Aripiprazol gab es keine signifikanten Unterschiede im Vergleich zu Placebo bei den Inzidenzraten von unerwünschten Ereignissen in Bezug auf Hyperglykämie (einschliesslich Diabetes) oder bei anormalen Glukose-Laborwerten. Es liegen keine genauen Risikoschätzungen für Hyperglykämie-bezogene unerwünschte Ereignisse bei Patienten unter Aripiprazol und anderen atypischen Antipsychotika vor, so dass direkte Vergleiche nicht möglich sind. Patienten, die mit Antipsychotika einschliesslich Abilify Asimtufii behandelt werden, sollten auf Anzeichen und Symptome einer Hyperglykämie (wie z.B. Polydipsie, Polyurie, Polyphagie und Schwäche) beobachtet werden und Patienten mit Diabetes mellitus oder mit Risikofaktoren für Diabetes mellitus sollten regelmässig auf eine Verschlechterung der Glukosewerte überwacht werden (siehe Unerwünschte Wirkungen).
Überempfindlichkeit
Wie auch bei anderen Arzneimitteln können unter Aripiprazol Überempfindlichkeitsreaktionen auftreten, die sich in allergischen Symptomen äussern.
Gewichtszunahme
Bei Patienten mit Schizophrenie wird häufig eine Gewichtszunahme beobachtet, durch den Gebrauch von Antipsychotika, die bekanntermassen eine Gewichtszunahme verursachen, durch Komorbiditäten oder durch nachlässigen Lebensstil. Dies könnte zu schweren Komplikationen führen. Über eine Gewichtszunahme wurde nach Markteinführung bei Patienten berichtet, denen orales Aripiprazol verschrieben wurde. In den beobachteten Fällen weisen die Patienten gewöhnlich signifikante Risikofaktoren wie Diabetes, Schilddrüsenerkrankung oder Hypophysenadenom in der Vorgeschichte auf. In klinischen Studien hat Aripiprazol nicht zu einer klinisch relevanten Gewichtszunahme geführt (siehe Unerwünschte Wirkungen).
Dysphagie
Motilitätsstörungen der Speiseröhre und Aspiration wurden mit der Einnahme von Antipsychotika, einschliesslich Aripiprazol, in Verbindung gebracht. Aripiprazol und andere Antipsychotika sollten bei Patienten mit einem Risiko für Aspirationspneumonie mit Vorsicht angewendet werden.
Stürze
Aripiprazol kann Schläfrigkeit, orthostatische Hypotonie und motorische und sensorische Instabilität verursachen, die zu Stürzen führen können. Bei der Behandlung von Patienten mit höherem Risiko ist Vorsicht geboten, und eine niedrigere Anfangsdosis sollte in Betracht gezogen werden (z.B. ältere oder geschwächte Patienten; siehe Abschnitt Dosierung / Anwendung).
Pathologische Spielsucht
Unter der Einnahme von Aripipazol können sich bei Patienten Süchte, insbesondere Spielsucht, und die Unfähigkeit, diese zu kontrollieren, verstärken. Andere Süchte, die berichtet wurden, umfassen: verstärkten Sexualtrieb, zwanghafte Kaufsucht, Heisshunger oder Esssucht und andere impulsive oder zwanghafte Verhalten. Es ist wichtig für den verordnenden Arzt/Ärztin, Patienten unter der Therapie mit Aripiprazol oder deren Betreuer speziell nach einem neuen Auftreten oder einer Verstärkung von Spielsucht, des Sexualtriebes, von Kaufsucht oder von Heisshunger oder Esssucht zu befragen. Es ist darauf hinzuweisen, dass Symptome von Impulskontrollstörungen auch mit der Grunderkrankungen in Zusammenhang stehen können; jedoch wurden einige Fälle berichtet, bei denen die Süchte abnahmen oder aufhörten, nachdem die Dosis reduziert oder das Medikament abgesetzt wurde. Impulskontrollstörungen können dem Patienten oder anderen Personen Schaden zufügen, wenn sie nicht erkannt werden. Ziehen Sie eine Dosisreduktion oder ein Absetzen des Medikamentes in Betracht, falls ein Patient oben genannte Süchte unter der Medikation mit Aripiprazol entwickeln sollte. (siehe Unerwünschte Wirkungen).
Natrium
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Dosis, d.h., es ist nahezu «natriumfrei».
InteraktionenEs wurden keine Studien zur Erfassung von Wechselwirkungen mit Abilify Asimtufii durchgeführt. Die nachfolgenden Informationen wurden aus Studien mit oral angewendetem Aripiprazol erhalten. Das 2-monatige Dosierungsintervall und die lange Halbwertszeit von Aripiprazol nach der Dosisgabe von Abilify Asimtufii 960 mg oder 720 mg sollten bei der Beurteilung des Potenzials für Arzneimittelwechselwirkungen ebenfalls berücksichtigt werden.
Aufgrund seines α1-adrenergen Rezeptorantagonismus kann Aripiprazol die Wirkung bestimmter antihypertensiver Arzneimittel verstärken.
Aufgrund der primären Wirkung von Aripiprazol auf das Zentralnervensystem (ZNS) ist Vorsicht geboten, wenn Aripiprazol in Kombination mit Alkohol oder anderen zentral wirksamen Arzneimitteln mit sich überlagernden unerwünschten Reaktionen wie Sedierung angewendet wird (siehe Unerwünschte Wirkungen).
Aripiprazol sollte mit Vorsicht zusammen mit anderen Arzneimitteln, die eine QT-Verlängerung oder Störungen des Elektrolythaushalts verursachen, angewendet werden.
Enzyminduktoren
Carbamazepin und andere CYP3A4-Induktoren
Nach gemeinsamer Anwendung mit Carbamazepin, einem hochwirksamen Induktor von CYP3A4, und oral angewendetem Aripiprazol bei Patienten mit Schizophrenie oder schizoaffektiver Störung waren die geometrischen Mittel von Cmax und AUC von Aripiprazol um 68 % bzw. 73 % niedriger im Vergleich zur Monotherapie mit oral angewendetem Aripiprazol (30 mg). Ebenso waren für Dehydro-Aripiprazol die geometrischen Mittel von Cmax und AUC nach der gemeinsamen Anwendung mit Carbamazepin um 69 % bzw. 71 % niedriger als nach Monotherapie mit oral angewendetem Aripiprazol. Es ist zu erwarten, dass die gleichzeitige Anwendung von Abilify Asimtufii 960 mg/720 mg mit anderen hochwirksamen Induktoren von CYP3A4 (wie Rifampicin, Rifabutin, Phenytoin, Phenobarbital, Primidon, Efavirenz, Nevirapin und Johanniskraut) ähnliche Wirkungen hat. Die gleichzeitige Anwendung von CYP3A4-Induktoren mit Abilify Asimtufii 960 mg/720 mg sollte vermieden werden, weil der Blutspiegel von Aripiprazol sich verringern und unter die wirksamen Konzentrationen sinken kann.
Enzyminhibitoren
Chinidin (in der Schweiz nicht zugelassen) und andere starke CYP2D6-Inhibitoren
In einer klinischen Studie mit oralem Aripiprazol bei gesunden Probanden, erhöhte ein starker Inhibitor von CYP2D6 (Chinidin) die AUC von Aripiprazol um 107%, während die Cmax unverändert blieb. Die AUC und Cmax von Dehydro-Aripiprazol, dem aktiven Metaboliten, verringerte sich um 32% bzw. 47%. Es ist zu erwarten, dass andere starke Inhibitoren von CYP2D6, wie Fluoxetin und Paroxetin, ähnliche Effekte haben und deshalb sollten ähnlich Dosisreduktionen vorgenommen werden (siehe Dosierung / Anwendung für Dosisanpassungen von Abilify Asimtufii).
Ketoconazol und andere starke CYP3A4-Inhibitoren
In einer klinischen Studie mit oralem Aripiprazol bei gesunden Probanden erhöhte ein starker Inhibitor von CYP3A4 (Ketoconazol) die AUC und Cmax von Aripiprazol um 63% bzw. 37%. Die AUC und Cmax von Dehydro-Aripiprazol stiegen um 77% bzw. 43%. Bei langsamen CYP2D6 Metabolisierern kann die gleichzeitige Anwendung von starken CYP3A4-Inhibitoren zu höheren Plasmakonzentrationen von Aripiprazol führen im Vergleich zu extensiven CYP2D6 Metabolisierern (siehe Dosierung / Anwendung für Dosisanpassungen von Abilify Asimtufii).
Falls die gleichzeitige Gabe von Ketoconazol oder anderen starken CYP3A4- Inhibitoren mit Aripiprazol in Betracht gezogen wird, sollte der potenzielle Nutzen die potenziellen Risiken für den Patienten überwiegen. Es ist zu erwarten, dass andere CYP3A4- Inhibitoren, wie Itraconazol und HIV-Proteaseinhibitoren, ähnliche Effekte haben und deshalb sollten ähnliche Dosisreduktionen vorgenommen werden (siehe Dosierung / Anwendung für Dosisanpassungen von Abilify Asimtufii).
Nach Absetzen des CYP2D6- oder CYP3A4-Inhibitors sollte die Dosis von Aripiprazol wieder auf die Dosis vor Beginn der Begleittherapie angehoben werden. Bei gleichzeitiger Anwendung von schwachen CYP3A4-Inhibitoren (z.B. Diltiazem) oder schwachen CYP2D6-Inhibitoren (z.B. Escitalopram) mit Abilify Asimtufii kann ein mässiger Anstieg der Aripiprazol-Plasmakonzentrationen erwartet werden.
Wirkung anderer Arzneimittel auf Abilify Asimtufii
Serotonin Syndrom
Bei Patienten unter Aripiprazol wurden Fälle eines Serotonin Syndroms berichtet. Mögliche Anzeichen und Symptome dieses Syndroms können vor allem auftreten bei gleichzeitigem Gebrauch von anderen serotonergen Arzneimitteln, wie SSRIs/SNRIs, oder von Arzneimitteln, die bekanntermassen die Aripiprazol-Konzentrationen erhöhen (siehe Unerwünschte Wirkungen).
Schwangerschaft, StillzeitFrauen im gebärfähigen Alter
Nach einer Einzeldosis Abilify Asimtufii wird erwartet, dass Aripiprazol bis zu 34 Wochen im Plasma verbleibt (siehe Warnhinweise und Vorsichtsmassnahmen). Dies ist zu Beginn der Behandlung von Frauen im gebärfähigen Alter, hinsichtlich einer möglichen zukünftigen Schwangerschaft oder beim Stillen zu berücksichtigen. Bei Frauen, die eine Schwangerschaft planen, sollte Abilify Asimtufii nur angewendet werden, wenn dies eindeutig erforderlich ist.
Schwangerschaft
Es liegen keine hinreichenden und kontrollierten Studien mit Aripiprazol bei Schwangeren vor. Es liegen Berichte von kongenitalen Anomalien vor; ein kausaler Zusammenhang mit Aripiprazol wurde jedoch nicht nachgewiesen. Tierexperimentelle Studien konnten eine potenzielle Entwicklungstoxizität nicht ausschliessen (siehe Präklinische Daten). Patientinnen müssen darauf hingewiesen werden, ihren Arzt zu benachrichtigen, wenn sie schwanger werden oder eine Schwangerschaft während der Behandlung mit Aripiprazol planen.
Verordnende Ärzte müssen sich der langanhaltenden Wirkung von Abilify Asimtufii bewusst sein. Aripiprazol war bei erwachsenen Patienten bis zu 34 Wochen nach Anwendung einer Einzeldosis der Depot-Suspension im Plasma nachweisbar (siehe Warnhinweise und Vorsichtsmassnahmen).
Neugeborene, die während des dritten Trimenons der Schwangerschaft Antipsychotika (einschließlich Aripiprazol) exponiert sind, sind durch Nebenwirkungen einschließlich extrapyramidaler Symptome und/oder Absetzerscheinungen gefährdet, deren Schwere und Dauer nach der Entbindung variieren können. Es gab Berichte über Agitiertheit, erhöhten oder erniedrigten Muskeltonus, Tremor, Somnolenz, Atemnot oder Störungen bei der Nahrungsaufnahme. Infolgedessen sollten Neugeborene sorgfältig überwacht werden (siehe Unerwünschte Wirkungen).
Die maternale Exposition gegenüber Abilify Asimtufii vor und während der Schwangerschaft kann zu Nebenwirkungen beim Neugeborenen führen. Abilify Asimtufii sollte nicht während der Schwangerschaft angewendet werden, ausser dies ist eindeutig erforderlich.
Stillzeit
Aripiprazol/Metabolite werden in die Muttermilch in solchen Mengen ausgeschieden, dass Auswirkungen auf das gestillte Kind wahrscheinlich sind, wenn Abilify Asimtufii bei stillenden Müttern angewendet wird. Da nach einer Einzeldosis Abilify Asimtufii erwartet wird, dass es bis zu 34 Wochen im Plasma verbleibt (siehe Warnhinweise und Vorsichtsmassnahmen), kann ein Risiko für gestillte Säuglinge auch dann bestehen, wenn die Gabe von Abilify Asimtufii lange vor dem Stillen stattfand. Patientinnen, die derzeit mit Abilify Asimtufii behandelt werden oder in den vergangenen 34 Wochen damit behandelt wurden, sollten nicht stillen (siehe Warnhinweise und Vorsichtsmassnahmen).
Fertilität
Studien zur Reproduktionstoxizität von Aripiprazol ergaben keine Beeinträchtigung der Fertilität durch Aripiprazol.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenAufgrund der potentiellen zentralnervösen und visuellen Effekte wie Sedierung, Somnolenz, Synkope, verschwommenes und doppeltes Sehen, kann Aripiprazol die Fahrtüchtigkeit und das Bedienen von Maschinen geringfügig bis mässig beeinträchtigen (siehe Unerwünschte Wirkungen). Daher sollte den Patienten vom Lenken von Fahrzeugen und Bedienen von Maschinen abgeraten werden, bis ihre persönliche Reaktion auf Abilify Asimtufii feststeht.
Unerwünschte WirkungenZusammenfassung des Sicherheitsprofils
Das Sicherheitsprofil von Abilify Asimtufii 960 mg und Abilify Asimtufii 720 mg zur Behandlung von Schizophrenie bei Erwachsenen basiert auf adäquaten und gut kontrollierten Studien zu Abilify Maintena 400 mg und Abilify Maintena 300 mg. Im Allgemeinen waren die beobachteten unerwünschten Arzneimittelwirkungen (UAW) in Studien zu Abilify Asimtufii 960 mg/720 mg vergleichbar mit den UAW, die in Studien zu Abilify Maintena 400 mg/300 mg beobachtet wurden.
Die am häufigsten beobachteten unerwünschten Arzneimittelwirkungen (UAW), die bei ≥5% der Patienten in zwei doppelblinden Langzeitstudien zu Abilify Asimtufii berichtet wurden, waren Gewichtszunahme (9,0%), Akathisie (7,9%), Schlaflosigkeit (5,8%) und Schmerzen an der Injektionsstelle (5,1%).
In den klinischen Studien zu Abilify Asimtufii 960 mg/720 mg waren Gewicht erhöht (22,7 %), Schmerzen an der Injektionsstelle (18,2 %), Akathisie (9,8 %), Angst (8,3 %), Kopfschmerzen (7,6 %), Schlaflosigkeit (7,6 %) und Obstipation (6,1 %) die am häufigsten beobachteten UAW.
Die im Zusammenhang mit einer Aripiprazol-Therapie aufgetretenen unerwünschten Arzneimittelwirkungen sind nachfolgend aufgeführt. Die unerwünschten Wirkungen wurden während klinischen Studien und/oder nach Markteinführung berichtet.
Die unerwünschten Wirkungen sind nach Systemorganklassen und Häufigkeit geordnet:
«sehr häufig» (≥1/10), «häufig» (≥1/100, <1/10), «gelegentlich» (≥1/1000, <1/100), «selten» (≥1/10'000, <1/1000), «sehr selten» (<1/10'000) und unbekannt (Häufigkeit aufgrund der vorliegenden Daten nicht abschätzbar).
Innerhalb jeder Häufigkeitsgruppe werden die unerwünschten Wirkungen nach abnehmendem Schweregrad aufgelistet.
Die Häufigkeit unerwünschter Reaktionen nach Markteinführung kann nicht abgeschätzt werden, da diese auf Spontanberichten beruhen. Deshalb sind sie unter «unbekannt» aufgeführt.
Erkrankungen des Blutes und des Lymphsystems
Gelegentlich: Neutropenie, Anämie, Thrombozytopenie, verminderte Neutrophilenzahl, verminderte Leukozytenzahl
Häufigkeit unbekannt: Leukopenie
Erkrankungen des Immunsystems
Gelegentlich: Überempfindlichkeit
Häufigkeit unbekannt: allergische Reaktion (z.B. anaphylaktische Reaktion, Angioödem einschliesslich geschwollener Zunge, Zungenödem, Gesichtsödem, Pruritus oder Urtikaria)
Endokrine Erkrankungen
Gelegentlich: verminderter Prolaktinspiegel, Hyperprolaktinämie
Häufigkeit unbekannt: diabetisches hyperosmolares Koma, diabetische Ketoazidose
Stoffwechsel- und Ernährungsstörungen
Häufig: Gewichtszunahmea, Diabetes mellitus, Gewichtsabnahme
Gelegentlich: Hyperglykämie, Hypercholesterinämie, Hyperinsulinismus, Hyperlipidämie, Hypertriglyceridämie
Häufigkeit unbekannt: Anorexie, Appetitstörungenb, Hyponatriämie
a In klinischen Studien zu Abilify Asimtufii 960 mg/720 mg als sehr häufig berichtet.
b Nur im klinischen Studienprogramm zu Abilify Asimtufii 960 mg/720 mg berichtet.
Psychiatrische Erkrankungen
Häufig: Agitiertheit, Angst, Ruhelosigkeit, Schlaflosigkeit
Gelegentlich: Suizidgedanken, psychotische Störung, Halluzinationen, Wahnvorstellungen, Hypersexualität, Panikreaktionen, Depression, Affektlabilität, Apathie, Dysphorie, Schlafstörungen, Bruxismus, verminderte Libido, veränderte Stimmung
Häufigkeit unbekannt: vollendeter Suizid, Suizidversuch, pathologisches Spielen, Impuls-kontrollstörungen, Nervosität, Aggression
Erkrankungen des Nervensystems
Häufig: extrapyramidale Störung, Akathisie, Tremor, Dyskinesie, Sedierung, Somnolenz, Schwindelgefühl, Kopfschmerzen
Gelegentlich: Dystonie, Spätdyskinesie, Parkinsonismus, Bewegungsstörung, psychomotorische Hyperaktivität, Restless-Legs-Syndrom, Zahnradphänomen, erhöhter Muskeltonus, Speichelausfluss, Störungen des Geschmacksempfindens, Störungen des Geruchsempfindens, Krampfanfall, Bradykinesie
Häufigkeit unbekannt: malignes neuroleptisches Syndrom, Grand-Mal-Krampfanfall, Serotonin Syndrom, Sprachstörung
Augenerkrankungen
Gelegentlich: Blickkrampf, verschwommenes Sehen, Augenschmerzen, Diplopie, Photophobia
Herzerkrankungen
Gelegentlich: Ventrikuläre Extrasystolen, Bradykardie, Tachykardie, verminderte T- Wellenamplitude im Elektrokardiogramm (EKG), abnormales EKG, T-Wellen-Inversion im EKG
Häufigkeit unbekannt: plötzlicher unerwarteter Tod, Herzstillstand, Torsades de Pointes, ventrikuläre Arrhythmien, QT-Verlängerung
Gefässerkrankungen
Gelegentlich: erhöhter Blutdruck, orthostatische Hypotonie
Häufigkeit unbekannt: Synkope, venöse Thromboembolie (einschliesslich Lungenembolie und tiefer Venenthrombose)
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Gelegentlich: Husten, Schluckauf
Häufigkeit unbekannt: Oropharyngealer Spasmus, Laryngospasmus, Aspirationspneumonie
Erkrankungen des Gastrointestinaltrakts
Häufig: Mundtrockenheit
Gelegentlich: Gastroösophageale Refluxkrankheit, Dyspepsie, Erbrechen, Durchfall, Übelkeit, Schmerzen im Oberbauch, abdominale Beschwerden, häufiger Stuhlgang, Speichelhypersekretion, Verstopfung
Häufigkeit unbekannt: Pankreatitis, Dysphagie
Leber- und Gallenerkrankungen
Gelegentlich: abnormer Leberfunktionstest, erhöhte Leberenzyme, erhöhte Alanin-Aminotransferase, erhöhte Gamma-Glutamyltransferase, erhöhtes Blut Bilirubin, erhöhte Aspartat-Aminotransferase
Häufigkeit unbekannt: Leberversagen, Gelbsucht, Hepatitis, erhöhte alkalische Phosphatase
Erkrankungen der Haut und des Unterhautgewebes
Gelegentlich: Alopezie, Akne, Rosacea, Ekzem, Hautverhärtungen
Sehr selten: Arzneimittelexanthem mit Eosinophilie und systemischen Symptomen (DRESS)
Häufigkeit unbekannt: Hautausschlag, Photosensibilitätsreaktion, Hyperhidrose
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Häufig: Steifigkeit des Bewegungsapparates
Gelegentlich: Muskelrigidität, Muskelkrämpfe, Muskelzuckungen, Muskelverspannungen, Myalgie, Schmerzen in den Extremitäten, Arthralgie, Rückenschmerzen, eingeschränkte Beweglichkeit der Gelenke, Nackensteifigkeit, Trismus
Häufigkeit unbekannt: Rhabdomyolyse
Erkrankungen der Nieren und Harnwege
Gelegentlich: Nephrolithiasis, Glykosurie
Häufigkeit unbekannt: Harnretention, Harninkontinenz
Schwangerschaft, Wochenbett und perinatale Erkrankungen
Häufigkeit unbekannt: Arzneimittelentzugssyndrom beim Neugeborenen (siehe Schwangerschaft / Stillzeit)
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Häufig: erektile Dysfunktion
Gelegentlich: Galaktorrhoe, Gynäkomastie, empfindliche Brüste, vulvovaginale Trockenheit
Häufigkeit unbekannt: Priapismus
Allgemeine Erkrankungen
Häufig: Ermüdung
Gelegentlich: Pyrexie, Asthenie, Gangstörung, Brustbeschwerden, Durst, Trägheit
Häufigkeit unbekannt: Störungen der Temperaturregulation (z.B. Hypothermie, Pyrexie), Brustschmerzen, periphere Ödeme
Beschwerden am Verabreichungsort
Häufig: Schmerzen an der Injektionsstellea, Induration an der Einstichstelle
Gelegentlich: Reaktion an der Einstichstelle, Erythem an der Einstichstelle, Schwellung an der Einstichstelle, Beschwerden an der Einstichstelle, Juckreiz an der Einstichstelle
a In klinischen Studien zu Abilify Asimtufii 960 mg/720 mg als sehr häufig berichtet.
Untersuchungen
Häufig: erhöhte Kreatin-Phosphokinase im Blut
Gelegentlich: erhöhter Blutzucker, verminderter Blutzucker, erhöhtes glykosyliertes Hämoglobin, Zunahme des Taillenumfangs, vermindertes Blutcholesterin, verminderte Triglyceride im Blut
Häufigkeit unbekannt: Blutzuckerschwankung
Beschreibung ausgewählter Nebenwirkungen
Reaktionen an der Injektionsstelle
Der Anteil der Patienten in einer unverblindeten Studie, der Nebenwirkungen jeglicher Art an der Injektionsstelle berichtete (alle als Schmerzen an der Injektionsstelle berichtet), betrug 18,2 % bei mit Abilify Asimtufii 960 mg behandelten Patienten und 9,0 % bei mit Abilify Maintena 400 mg behandelten Patienten. In beiden Behandlungsgruppen trat die Mehrheit der berichteten Schmerzen an der Injektionsstelle bei der ersten Injektion von Abilify Asimtufii 960 mg (21 von 24 Patienten) bzw. Abilify Maintena 400 mg (7 von 12 Patienten) auf, verschwand innerhalb von 5 Tagen und Häufigkeit und Schwere nahmen bei den darauffolgenden Injektionen ab. Die Durchschnittswerte der mittleren visuellen gesamten Analogskala (0 = kein Schmerz bis 100 = unerträglicher Schmerz) bei Patienten, die den Schmerz an der Injektionsstelle beurteilten, waren in beiden Behandlungsgruppen bei der letzten Injektion vergleichbar: 0,8 vor Gabe und 1,4 nach Gabe in der Abilify Asimtufii -960-mg-Gruppe im Vergleich zu 1,3 nach Gabe in der Abilify Maintena-400-mg-Gruppe.
Neutropenie
Während des klinischen Programms mit Abilify Asimtufii wurden auch Fälle von Neutropenie gemeldet, die typischerweise um den Tag 16 nach einer Erstinjektion begannen mit einer medianen Dauer von 18 Tagen.
Extrapyramidale Symptome (EPS)
In Studien in stabilen Patienten mit Schizophrenie, traten EPS häufiger auf unter Abilify Asimtufii (18,4%) als unter Behandlung mit oralem Aripiprazol (11,7%). Akathisie war das am häufigsten beobachtete Symptom (8,2%), mit einem typischen Beginn um den Tag 10 nach der Erstinjektion, und einer medianen Dauer von 56 Tagen. Studienteilnehmer mit Akathisie wurden normalerweise mit anticholinergen Medikamenten behandelt, vor allem mit Benztropinmesylat und Trihexyphenidyl. Weniger häufig wurden Substanzen wie Propranolol und Benzodiazepine (Clonazepam und Diazepam) eingesetzt, um die Akathisie zu kontrollieren. Zweithäufigstes Symptom war Parkinsonimus (6,9% unter Abilify Asimtufii, 4,15% unter oralem Aripiprazol 10-30 mg und 3,0% unter Placebo).
Daten aus einer unverblindeten Studie, in der Patienten mit Abilify Asimtufii 960 mg behandelt wurden, zeigten minimale Änderungen der EPS-Scores im Vergleich zu den Ausgangswerten, beurteilt anhand der Simpson-Angus Rating Scale (SAS), der Abnormal Involuntary Movement Scale (AIMS) und der Barnes Akathisia Rating Scale (BARS). Die Inzidenz von mit EPS im Zusammenhang stehenden berichteten Ereignissen bei mit Abilify Asimtufii 960 mg behandelten Patienten betrug 18,2 %, während die Inzidenz bei mit Abilify Maintena 400 mg behandelten Patienten 13,4 % betrug.
Dystonie
Klasseneffekt: Symptome einer Dystonie, verlängerte abnormale Kontraktionen von Muskelgruppen, können bei empfindlichen Personen während der ersten Behandlungstage auftreten. Dystonie-Symptome umfassen Spasmen der Genickmuskulatur, die sich zu einem Schlundkrampf entwickeln können, Schluckbeschwerden, Atembeschwerden und/oder Protrusion der Zunge. Obwohl diese Symptome bereits bei niedrigen Dosen auftreten können, sind sie häufiger und stärker ausgeprägt bei hochpotenten und bei höheren Dosen von Antipsychotika der ersten Generation. Ein erhöhtes Risiko für eine akute Dystonie wird bei Männern und jüngeren Altersgruppen beobachtet.
Gewicht
Während der doppelblinden, aktiv-kontrollierten Phase der 38-Wochen Langzeitstudie zur Schizophrenie betrug die Inzidenz einer Gewichtszunahme um ≥7% vom Ausgangswert bis zum letzten Studienbesuch 9,5% für Abilify Asimtufii und 11,7% für orales Aripiprazol 10-30 mg. Die Inzidenz eines Gewichtsverlusts um ≥7% von Studienbeginn bis zum letzten Studienbesuch betrug 10,2% unter Abilify Asimtufii und 4,5% unter oralem Aripiprazol 10-30 mg.
Während der doppelblinden, Placebo-kontrollierten Phase der 52-Wochen Langzeitstudie betrug die Inzidenz einer Gewichtszunahme um ≥7% von Studienbeginn bis zum letzten Studienbesuch 6,4% für Abilify Asimtufii, und 5,2% für Placebo. Die Inzidenz eines Gewichtsverlusts um ≥7% von Studienbeginn bis zum letzten Studienbesuch betrug 6,4% unter Abilify Asimtufii und 6,7% unter Placebo. Während der doppelblinden Behandlung betrug die durchschnittliche Veränderung des Körpergewichts von Baseline bis zur letzten Visite −0,2 kg für Abilify Asimtufii und −0,4 kg für Placebo (p = 0,812).
In einer offenen, randomisierten Studie mit Mehrfachgabe bei erwachsenen Patienten mit Schizophrenie (und Bipolar-I-Störung), in der eine alle zwei Monate verabreichte Dosis von Abilify Asimtufii 960 mg mit Abilify Maintena 400 mg jeden Monat verglichen wurde, war die Gesamtinzidenz der Gewichtszunahme um ≥7 % gegenüber dem Ausgangswert zwischen Abilify Asimtufii 960 mg (40,6 %) und Abilify Maintena 400 mg (42,9 %) vergleichbar. Die mittlere Veränderung beim Körpergewicht zwischen Ausgangswert und letztem Besuchstermin betrug 3,6 kg bei Abilify Asimtufii 960 mg und 3,0 kg bei Abilify Maintena 400 mg.
Prolaktin
In klinischen Studien zu dem/den genehmigten Anwendungsgebiet(en) und nach Marktzulassung wurden bei Anwendung von Aripiprazol sowohl erhöhte als auch verminderte Serum-Prolaktinspiegel im Vergleich zum Ausgangswert beobachtet (siehe Abschnitt «Klinische Wirksamkeit»).
Spielsucht-Störung und andere Störungen der Impulskontrolle
Bei Patienten, die mit Aripiprazol behandelt werden, können Spielsucht-Störung, Hypersexualität, zwanghaftes Kaufverhalten, Essattacken und zwanghaftes Essen auftreten (siehe Warnhinweise und Vorsichtsmassnahmen).
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungIn den klinischen Studien mit Abilify Asimtufii wurden keine Fälle von Überdosierung gemeldet, die von unerwünschten Reaktionen begleitet waren. Vorsicht ist geboten, um eine versehentliche Injektion von Abilify Asimtufii in ein Blutgefäss zu vermeiden. Nach einer vermuteten oder bestätigten versehentlichen Überdosierung/versehentlicher i.v. Administration, ist eine engmaschige Beobachtung des Patienten erforderlich. Falls sich potentiell medizinisch schwerwiegende Anzeichen oder Symptome entwickeln, ist eine Überwachung inklusive kontinuierlichem EKG Monitoring nötig. Die medizinische Überwachung und Kontrolle muss fortgesetzt werden, bis sich der Patient erholt hat.
Eine Simulation von Dose Dumping zeigte, dass die erwartete mediane Konzentration von Aripiprazol eine Spitze von 4'500 ng/ml erreicht, was ungefähr der 9-fachen oberen therapeutischen Breite entspricht. Im Falle von Dose Dumping wird erwartet, dass die Aripiprazol-Konzentrationen nach ungefähr 3 Tagen schnell bis zum oberen Grenzwert des therapeutischen Fensters fallen. Bis zum siebten Tag sinken die medianen Aripiprazol-Konzentrationen weiter ab, bis sie ähnliche Konzentrationen erreichen, wie sie nach einer Depot-Injektion ohne Dose Dumping auftreten.
Das Potenzial des Dose dumping wurde untersucht durch das Simulieren der Plasmakonzentrationen von Aripiprazol nach einer vollständigen Resorption einer Dosis von Abilify Asimtufii 960 mg in den Blutkreislauf. Gemäss der Simulationsergebnisse können die Konzentrationen von Aripiprazol nach einem Dose dumping bis auf das 13,5-Fache der Konzentrationen ansteigen, die unter einer therapeutischen Dosis Abilify Asimtufii 960 mg ohne Dose dumping erreicht werden. Des Weiteren würden die Konzentrationen von Aripiprazol nach Dose dumping innerhalb von 5 Tagen auf die Konzentrationen absinken, die normalerweise nach Gabe von Abilify Asimtufii 960 mg beobachtet werden.
Obwohl Überdosierungen bei parenteralen Präparaten weniger wahrscheinlich sind als bei oralen Arzneimitteln, wird im Folgenden auf Informationen zu Überdosierung mit oralem Aripiprazol hingewiesen.
Anzeichen und Symptome
Es ist darauf zu achten, dass dieses Arzneimittel nicht versehentlich in ein Blutgefäss injiziert wird. Nach einer bestätigten oder vermuteten unabsichtlichen Überdosierung/versehentlichen intravenösen Verabreichung von Aripiprazol muss der Patient engmaschig überwacht werden. Die bei einer Überdosierung beobachteten möglichen medizinisch signifikanten Anzeichen und Symptome sind unter anderem Lethargie, Hypertonie, Somnolenz, Tachykardie, Übelkeit, Erbrechen und Diarrhoe.
Behandlung
Ein spezielles Gegenmittel für Aripiprazol ist nicht verfügbar. Die Behandlung der Überdosierung sollte sich auf unterstützende Massnahmen konzentrieren, darunter engmaschige medizinische Aufsicht und Überwachung. Freie Atemwege, ausreichende Sauerstoffsättigung und Beatmung sind sicherzustellen. Herzrhythmus und Vitalzeichen sind zu überwachen. Sowohl unterstützende als auch symptomatische Massnahmen sind zu ergreifen. Die Behandlung sollte aus allgemeinen Massnahmen bestehen, wie sie bei der Behandlung jeder Überdosierung mit einem Arzneimittel ergriffen werden. Die Möglichkeit einer Überdosierung mit mehreren Arzneimitteln ist in Erwägung zu ziehen.
Bei der Bewertung der Behandlungsbedürfnisse und Genesung sind die langwirksamen Eigenschaften des Arzneimittels und die lange Eliminationshalbwertszeit von Aripiprazol zu berücksichtigen.
Eigenschaften/WirkungenATC-Code
N05AX12
Wirkungsmechanismus
Es wird vermutet, dass die Wirksamkeit von Aripiprazol bei Schizophrenie über die Kombination einer partiell agonistischen Aktivität auf Dopamin D2- und Serotonin 5-HT1A-Rezeptoren und einer antagonistischen Aktivität auf Serotonin 5-HT2A-Rezeptoren vermittelt wird. Aripiprazol zeigte in Tiermodellen für dopaminerge Hyperaktivität antagonistische Eigenschaften und agonistische Eigenschaften in Modellen für dopaminerge Hypoaktivität. Aripiprazol zeigt eine hohe Bindungsaffinität in vitro zu Dopamin D2 und D3, Serotonin 5-HT1A und 5-HT2A Rezeptoren sowie eine mässige Affinität zu Dopamin D4, Serotonin 5-HT2C und 5-HT7, alpha-1-adrenergen und Histamin-H1-Rezeptoren. Aripiprazol zeigte auch eine mässige Bindungsaffinität zur Stelle der Serotonin-Wiederaufnahme, und keine nennenswerte Affinität zu cholinergen muscarinischen Rezeptoren. Die Interaktion mit anderen Rezeptoren als den Dopamin- und Serotonin-Subtypen könnte einige der anderen klinischen Effekte von Aripiprazol erklären.
Eine Verabreichung von oralem Aripiprazol in Dosierungen von 0,5 bis 30 mg einmal täglich während zwei Wochen an gesunde Versuchspersonen, bewirkte eine dosisabhängige Reduktion der Bindung von 11C-Racloprid, ein D2/D3 Rezeptor Ligand, am Nukleus Caudatus und am Putamen, die mit der Positronen-Emissions-Tomographie ermittelt wurde.
Pharmakodynamik
Klinische Wirksamkeit
Erhaltungstherapie bei Erwachsenen mit Schizophrenie
Die Wirksamkeit von Abilify Asimtufii 960 mg, einmal alle zwei Monate angewendet, wurde teilweise anhand eines pharmakokinetischen Bridgings in einer unverblindeten, randomisierten, multizentrischen Parallelgruppenstudie mit wiederholter Gabe untersucht. Die Studie zeigte, dass Abilify Asimtufii 960 mg über das gesamte Dosierungsintervall zu ähnlichen Aripiprazol-Konzentrationen, und damit einer vergleichbaren Wirksamkeit, führt wie Abilify Maintena 400 mg (siehe Abschnitt «Pharmakokinetik»).
Die Ähnlichkeit der Plasmakonzentrationen von Aripiprazol unter Abilify Asimtufii 960 mg und Abilify Maintena 400 mg ist in Tabelle 2 dargestellt.
Tabelle 2: Geometrisches mittleres Verhältnis und Konfidenzintervall (KI) nach der 4. Anwendung von Abilify Asimtufii 960 mg oder der 7. und 8. Anwendung von Abilify Maintena 400 mg in der unverblindeten Studie
|
Parameter
|
Verhältnis
(Abilify Asimtufii 960 mg/Abilify Maintena 400 mg)
|
90 % KI
| |
AUC0-56a
|
1,006c
|
0,851 - 1,190
| |
C56/C28b
|
1,011d
|
0,893 - 1,145
| |
Cmaxb
|
1,071c
|
0,903 - 1,270
|
a AUC0-56 nach der 4. Anwendung von Abilify Asimtufii 960 mg oder der Summe von AUC0-28 nach der 7. und 8. Anwendung von Abilify Maintena 400 mg.
b Plasmakonzentrationen von Aripiprazol nach der 4. Anwendung von Abilify Asimtufii 960 mg (C56) oder der 8. Anwendung von Abilify Maintena 400 mg (C28).
c Abilify Asimtufii 960 mg (n = 34), Abilify Maintena 400 mg (n = 32).
d Abilify Asimtufii 960 mg (n = 96), Abilify Maintena 400 mg (n = 82).
Die Wirksamkeit von Abilify Asimtufii 960 mg/720 mg bei der Behandlung von Schizophrenie wird des Weiteren gestützt durch die bekannte Wirksamkeit von Abilify Maintena 400 mg/300 mg, die nachfolgend zusammengefasst wird:
Wirksamkeit von Abilify Maintena 400 mg/300 mg
Die Wirksamkeit von Abilify Maintena in der Erhaltungstherapie von Patienten mit Schizophrenie wurde in zwei randomisierten, doppelblinden Langzeitstudien gezeigt.
Die erste Studie war eine 38-Wochen, randomisierte, doppelblinde, aktiv-kontrollierte Studie und diente dem Nachweis der Wirksamkeit, Sicherheit und Verträglichkeit von monatlichen Abilify Maintena Injektionen im Vergleich zur einmal täglichen Anwendung von oralem Aripiprazol 10-30 mg als Erhaltungstherapie bei erwachsenen Patienten mit Schizophrenie. Diese Studie umfasste eine Screening-Phase und 3 Behandlungs-Phasen: Umstellungs-Phase, orale Stabilisierungs-Phase und doppelblinde, aktiv-kontrollierte Phase.
662 Patienten, die für die 38-Wochen doppelblinde, aktiv-kontrollierte Phase in Frage kamen, wurden im Verhältnis 2:2:1 randomisiert einer von drei doppelblinden Behandlungsgruppen zugeteilt: 1) Abilify Maintena, 2) Stabilisierungsdosis von oralem Aripiprazol 10-30 mg oder 3) Aripiprazol langwirksame Injektion 50 mg/25 mg. Die Aripiprazol langwirksame Injektion 50 mg/25 mg wurde als niedrige Aripiprazol-Dosisgruppe aufgenommen, um die Testempfindlichkeit für das Non-Inferiority-Design zu prüfen.
Die Resultate der Auswertung des primären Wirksamkeitsendpunkts, geschätzter Anteil der Patienten mit drohendem Rückfall am Ende von Woche 26 der doppelblinden, aktiv-kontrollierten Phase zeigten, dass Abilify Maintena 400 mg/300 mg dem oralen Aripiprazol 10-30 mg nicht unterlegen ist.
Die geschätzte Rückfallrate am Ende von Woche 26 betrug 7,12% unter Abilify Maintena, und 7,76% unter oralem Aripiprazol 10-30 mg, ein Unterschied von -0,64%. Das 95%-Konfidenzintervall (-5.,6, 3,99) für die Differenz im geschätzten Anteil der Patienten mit drohendem Rückfall am Ende von Woche 26 schloss die vordefinierte Grenze für non-inferiority aus (11,5%). Daher ist Abilify Maintena oralem Aripiprazol 10-30 mg nicht unterlegen.
Der geschätzte Anteil der Patienten mit drohendem Rückfall Ende Woche 26 betrug unter Abilify Asimtufii 7,12% und war damit statistisch signifikant niedriger als in der Gruppe mit Aripiprazol langwirksamer Injektion 50 mg/25 mg (21,80%; p = 0,0006). Somit wurde die Überlegenheit von Abilify Asimtufii gegenüber der Aripiprazol langwirksamen Injektion 50 mg/25 mg nachgewiesen und die Validität des Studiendesigns bestätigt.
Die Kaplan-Meier-Kurven der Zeit von der Randomisierung bis zum drohenden Rückfall während der 38-wöchigen, doppelblinden aktiv kontrollierten Phase für Abilify Maintena 400 mg/300 mg, 10 mg bis 30 mg oral angewendetes Aripiprazol und langwirkender Injektionslösung mit 50 mg/25 mg Aripiprazol sind in Abbildung 1 dargestellt.
Abbildung 1: Kaplan-Meier-Kurve für die Zeit bis zur Exazerbation psychotischer Symptome/drohendem Rückfall
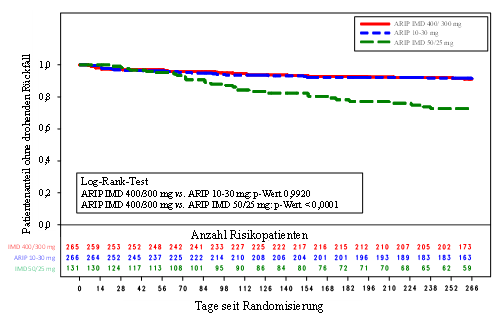
HINWEIS: ARIP IMD 400/300 mg = Abilify Maintena; ARIP 10 mg bis 30 mg = oral angewendetes Aripiprazol; ARIP IMD 50/25 mg = Aripiprazol, langwirkende Injektionslösung
Ferner wird die Nicht-Unterlegenheit von Abilify Asimtufii im Vergleich zu 10 mg bis 30 mg oral angewendetem Aripiprazol durch die Ergebnisse der Analyse der Positive and Negative Syndrome Scale Score (PANSS) gestützt.
Tabelle 3: PANSS Gesamtpunktzahl - Veränderung vom Ausgangswert bis Woche 38-LOCF (Last Observation Carried Forward): Randomisierte Wirksamkeitsstichprobea, b
|
|
Abilify Maintena
400 mg/300 mg
(n = 263)
|
Oral angewendetes Aripiprazol
10 mg bis 30 mg/Tag
(n = 266)
|
Aripiprazol, langwirkende Injektionslösung
50 mg/25 mg
(n = 131)
| |
Durchschnittlicher Ausgangswert (SD)
|
57,9 (12,94)
|
56,6 (12,65)
|
56,1 (12,59)
| |
Durchschnittliche Änderung (SD)
|
−1,8 (10,49)
|
0,7 (11,60)
|
3,2 (14,45)
| |
P-Wert
|
Nicht zutreffend
|
0,0272
|
0,0002
|
a Negative Veränderung des Werts gibt eine Verbesserung an.
b Ausschliesslich Patienten, die sowohl einen Ausgangswert als auch mindestens einen Wert nach dem Ausgangswert hatten, wurden eingeschlossen. P-Werte wurden aus dem Vergleich der Veränderung vom Ausgangswert innerhalb eines Kovarianzanalysemodells mit der Behandlung als Term und dem Ausgangswert als Kovariate abgeleitet.
Die zweite Studie war eine 52-wöchige, randomisierte, doppelblinde Absetzungsstudie bei US-amerikanischen erwachsenen Patienten mit der aktuellen Diagnose einer Schizophrenie. Diese Studie bestand aus einer Screeningphase und 4 Behandlungsphasen: Umstellung, orale Stabilisierung, i.m. Stabilisierung und doppelblinde, placebokontrollierte Phase. Patienten, die die orale Stabilisierungsanforderung in der oralen Stabilisierungsphase erfüllten, wurden in einfach verblindeter Weise der Verabreichung von Abilify Maintena 400 mg/300 mg zugewiesen und begannen eine i.m. Phase für minimal 12 Wochen und maximal 36 Wochen. Patienten, die für die doppelblinde, placebokontrollierte Phase geeignet waren, wurden nach dem Zufallsprinzip in einem Verhältnis von 2:1 einer doppelblinden Behandlung mit Abilify Maintena 400 mg/300 mg bzw. Placebo zugeordnet.
Die endgültige Wirksamkeitsanalyse umfasste 403 randomisierte Patienten und 80 Exazerbationen von psychotischen Symptomen/Ereignissen drohenden Rückfalls. In der Placebogruppe waren 39,6 % der Patienten zu einem drohenden Rückfall fortgeschritten, während in der Abilify Maintena 400 mg/300 mg Gruppe ein drohender Rückfall bei 10 % der Patienten auftrat; somit hatten Patienten in der Placebogruppe ein 5,03-fach höheres Risiko für einen drohenden Rückfall.
Prolaktin
In der doppelblinden, aktiv kontrollierten Phase der 38-wöchigen Studie gab es vom Ausgangswert bis zum letzten Besuch eine mittlere Abnahme der Prolaktin-Spiegel in der Gruppe mit Abilify Maintena 400 mg/300 mg (−0,33 ng/ml), während im Vergleich dazu in der Gruppe mit oralen 10 mg bis 30 mg Aripiprazol-Tabletten ein mittlerer Anstieg (0,79 ng/ml; p <0,01) verzeichnet wurde. Die Inzidenz von mit Abilify Maintena 400 mg/300 mg behandelten Patienten mit Prolaktin-Spiegeln > 1-mal der oberen Grenze des Normbereichs (OGN) bei jeder Beurteilung betrug 5,4 % gegenüber 3,5 % der mit oralen 10 mg bis 30 mg Aripiprazol-Tabletten behandelten Patienten.
Männliche Patienten wiesen in jeder Behandlungsgruppe im Allgemeinen eine höhere Inzidenz auf als weibliche Patienten.
In der doppelblinden, placebokontrollierten Phase der 52-wöchigen Studie gab es vom Ausgangswert bis zum letzten Besuch eine mittlere Abnahme der Prolaktin-Spiegel in der Gruppe mit Abilify Maintena 400 mg/300 mg (−0,38 ng/ml), während im Vergleich dazu in der Placebogruppe ein mittlerer Anstieg (1,67 ng/ml) verzeichnet wurde. Die Inzidenz von mit Abilify Maintena 400 mg/300 mg behandelten Patienten mit Prolaktin-Spiegeln > 1-mal OGN betrug 1,9 % gegenüber 7,1 % der mit Placebo behandelten Patienten.
Akutbehandlung von Schizophrenie bei Erwachsenen
Die Wirksamkeit von Abilify Maintena 400 mg/300 mg bei erwachsenen Patienten mit Schizophrenie, die einen akuten Rückfall erlitten, wurde in einer kurzfristigen (12-wöchigen), randomisierten, doppelblinden, placebokontrollierten Studie (n = 339) untersucht.
Im Hinblick auf den primären Endpunkt (Veränderung des PANSS-Gesamtpunktwerts zwischen Baseline und Woche 10) zeigte sich Abilify Maintena 400 mg/300 mg (n = 167) gegenüber Placebo (n = 172) überlegen.
Ähnlich wie beim PANSS-Gesamtpunktwert wurde im Zeitverlauf auch bei den PANSS-Punktwerten der Positiv- und Negativ-Subskalen eine Verbesserung (Verringerung) gegenüber der Baseline festgestellt.
Tabelle 4: PANSS Gesamtpunktzahl - Veränderung vom Ausgangswert bis Woche 10: Randomisierte Wirksamkeitsstichprobe a
|
|
Abilify Maintena
400 mg/300 mg
|
Placebo
| |
Durchschnittlicher Ausgangswert (SD)
|
102,4 (11,4)
n = 162
|
103,4 (11,1)
n = 167
| |
Durchschnittliche LS-Änderung (SE)
|
−26,8 (1,6)
n = 99
|
−11,7 (1,6)
n = 81
| |
P-Wert
|
< 0,0001
|
| |
Behandlungsdifferenzb (95 %-KI)
|
−15,1 (−19,4; −10,8)
|
|
a Die Daten wurden in einem MMRM-Ansatz (gemischtes Modell mit Messwiederholungen) analysiert. In die Auswertung wurden nur Patienten aufgenommen, die randomisiert einer Behandlung zugeteilt worden waren, mindestens eine Injektion erhalten hatten und bei denen eine Baseline- und mindestens eine Wirksamkeitsbeurteilung nach Baseline durchgeführt worden war.
b Differenz (Abilify Maintena minus Placebo) der durchschnittlichen LS-Veränderung gegenüber den Ausgangswerten.
Darüber hinaus wurde mit Abilify Maintena 400 mg/300 mg anhand der Veränderung des Clinical Global Impressions Severity (CGI-S)-Punktwerts zwischen Baseline und Woche 10 eine statistisch signifikante Verbesserung der Symptome festgestellt.
Das persönliche und soziale Funktionsniveau wurde anhand der PSP-Skala (Personal and Social Performance) beurteilt. Die PSP-Skala ist eine validierte, vom Arzt auszufüllende Skala, mit der die persönliche und soziale Funktionalität in den folgenden vier Bereichen gemessen wird: sozial nützliche Aktivitäten (einschliesslich Arbeit und Studium), persönliche und soziale Beziehungen, Selbstfürsorge und störendes und aggressives Verhalten. Mit Abilify Maintena 400 mg/300 mg wurde in der Woche 10 eine im Vergleich zu Placebo statistisch signifikante Behandlungsdifferenz festgestellt (+7,1; p < 0,0001, 95 %-KI: 4,1; 10,1 in einem ANCOVA-Modell [LOCF]).
Das Sicherheitsprofil entsprach den bekannten Verträglichkeitsmerkmalen von Abilify Maintena 400 mg/300 mg. Allerdings bestanden Unterschiede im Vergleich zu Beobachtungen, die im Rahmen der Erhaltungstherapie bei der Behandlung von Schizophrenie gemacht wurden. In einer kurzfristigen (12-wöchigen), randomisierten, doppelblinden, placebokontrollierten Studie mit Patienten, die Abilify Maintena 400 mg/300 mg erhielten, waren Gewichtszunahme und Akathisie diejenigen Symptome, die mit einer im Vergleich zu Placebo mindestens doppelt so großen Inzidenz auftraten. Die Inzidenz einer Gewichtszunahme von ≥7 % (zwischen Baseline und letzter Visite in Woche 12) lag mit Abilify Maintena 400 mg/300 mg bei 21,5 % (Placebogruppe: 8,5 %). Eine Akathisie war das am häufigsten beobachtete extrapyramidale Symptom (Abilify Maintena 400 mg/300 mg: 11,4 %; Placebogruppe: 3,5 %).
Sicherheit und Wirksamkeit bei pädiatrischen Patienten
Die Europäische Arzneimittel-Agentur hat für Abilify Asimtufii eine Freistellung von der Verpflichtung zur Vorlage von Ergebnissen zu Studien in allen pädiatrischen Altersklassen bei Schizophrenie gewährt.
PharmakokinetikDie nachfolgend aufgeführte Pharmakokinetik von Aripiprazol nach der Anwendung von Abilify Asimtufii basiert auf der Verabreichung in den Glutealmuskel.
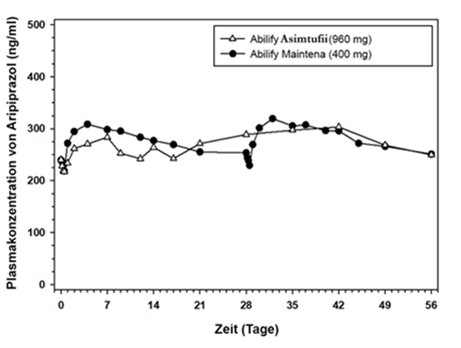
Abilify Asimtufii 960 mg/720 mg setzt im Vergleich mit Abilify Maintena 400 mg/300 mg Aripiprazol über einen Zeitraum von 2 Monaten frei. Abilify Asimtufii -Dosen von 960 mg und 720 mg führen bei Anwendung in den Glutealmuskel insgesamt zu Expositionsbereichen gegenüber Aripiprazol, die innerhalb des Expositionsbereichs liegen, wie sie bei Dosen von 300 mg bzw. 400 mg Abilify Maintena (einmal monatliche Dosisgabe) auftreten. Zusätzlich waren die unter Abilify Asimtufii 960 mg/720 mg beobachteten mittleren maximalen Plasmakonzentrationen (Cmax) sowie Plasmakonzentrationen von Aripiprazol am Ende des Dosierungsintervalls vergleichbar mit denen, die bei entsprechenden Dosen von Abilify Maintena 400 mg/300 mg beobachtet wurden (siehe Abschnitt «Klinische Wirksamkeit», Tabelle 2).
Die mittlere Plasmakonzentration von Aripiprazol im Vergleich zu den Zeitprofilen nach der 4. Anwendung von Abilify Asimtufii 960 mg (n = 102) oder der 7. und 8. Anwendung von Abilify Maintena 400 mg (n = 93) in den Glutealmuskel von Patienten mit Schizophrenie (und Bipolar-I-Störung) ist in Abbildung 2 zu sehen.
Abbildung 2: Mittlere Plasmakonzentration von Aripiprazol vs. Zeitprofil nach der 4. Anwendung von Abilify Asimtufii 960 mg oder der 7. und 8. Anwendung von Abilify Maintena 400 mg
Distribution
Die Resorption von Aripiprazol nach glutealer Injektion in den Blutkreislauf erfolgt langsam und anhaltend aufgrund der niedrigen Löslichkeit der Aripiprazol-Partikel. Das Freisetzungsprofil von Aripiprazol bei Abilify Asimtufii 960 mg/720 mg führt nach glutealen Injektionen 2 Monate lang zu anhaltenden Plasmakonzentrationen. Die Freisetzung des Wirkstoffs nach einer Einzeldosis von 780 mg von einmal alle 2 Monate injiziertem, gebrauchsfertigem und langwirksamem Aripiprazol beginnt an Tag 1 und hält bis zu 34 Wochen an. Für die Standarddosierung von 960 mg ist eine noch über 34 Wochen hinausgehende Nachweisdauer von Aripiprazol im Plasma wahrscheinlich.
Metabolismus
Aripiprazol wird überwiegend in der Leber hauptsächlich über drei Biotransformationswege metabolisiert: Dehydrierung, Hydroxylierung und N-Dealkylierung. Basierend auf in vitro-Studien sind die Enzyme CYP3A4 und CYP2D6 für die Dehydrierung und Hydroxylierung von Aripiprazol verantwortlich, die N-Dealkylierung wird durch CYP3A4 katalysiert. Aripiprazol macht den Hauptanteil des Arzneimittels im systemischen Kreislauf aus. Nach Verabreichung mehrerer Abilify Asimtufii 960 mg/720 mg-Dosen beträgt der Anteil von Dehydro-Aripiprazol, dem aktiven Metaboliten, annähernd 30 % der AUC von Aripiprazol im Plasma.
Elimination
Nach mehrmaliger Verabreichung von 400 mg oder 300 mg Abilify Maintena, beträgt die durchschnittliche terminale Eliminationshalbwertszeit von Aripiprazol 46,5 respektive 29,9 Tage, vermutlich aufgrund der resorptionsratenbegrenzten Kinetik.
Nach einmaliger oraler Gabe von [14C]-markiertem Aripiprazol, wurden etwa 27% der zugeführten Radioaktivität im Urin und etwa 60% in den Fäzes nachgewiesen. Weniger als 1% an unverändertem Aripiprazol wurde im Urin ausgeschieden und etwa 18% wurden unverändert in den Fäzes nachgewiesen.
Kinetik spezieller Patientengruppen
Geschlecht
Nach oraler Gabe von Aripiprazol gibt es keine Unterschiede in der Pharmakokinetik von Aripiprazol zwischen gesunden männlichen und weiblichen Probanden. Ebenso zeigten sich bei der pharmakokinetischen Populationsanalyse von Aripiprazol in klinischen Studien bei schizophrenen Patienten keine geschlechtsabhängigen Wirkungen.
Rauchen
Eine populationsspezifische Auswertung zur Pharmakokinetik von oral angewendetem Aripiprazol ergab keinen Hinweis auf klinisch signifikante Wirkungen hinsichtlich des Rauchens auf die Pharmakokinetik von Aripiprazol.
Ethnische Zugehörigkeit
Eine populationspharmakokinetische Untersuchung von Abilify Asimtufii lieferte keine Hinweise auf ethnisch bedingte Unterschiede in der Pharmakokinetik von Aripiprazol.
Leberfunktionsstörungen
Eine Einzeldosisstudie mit oraler Gabe von Aripiprazol bei Probanden mit verschiedengradiger Leberzirrhose (Child-Pugh-Klassen A, B und C) zeigte keine signifikante Wirkung hinsichtlich der Beeinträchtigung der Leberfunktion auf die Pharmakokinetik von Aripiprazol und Dehydro-Aripiprazol, aber die Studie umfasste nur 3 Patienten mit Leberzirrhose der Klasse C, was nicht ausreicht, um Schlüsse auf deren metabolische Kapazität zu ziehen.
Nierenfunktionsstörungen
In einer Einzeldosisstudie mit oraler Gabe von Aripiprazol wurde bezüglich der pharmakokinetischen Eigenschaften von Aripiprazol und Dehydro-Aripiprazol festgestellt, dass sie bei Patienten mit schweren Nierenerkrankungen im Vergleich zu denen von jungen gesunden Probanden ähnlich sind.
Ältere Patienten
Nach oraler Gabe von Aripiprazol gibt es keine Unterschiede in der Pharmakokinetik von Aripiprazol zwischen gesunden älteren und jüngeren erwachsenen Probanden. Ebenso zeigten sich bei der pharmakokinetischen Populationsanalyse von Aripiprazol bei schizophrenen Patienten keine altersabhängigen Wirkungen.
Genetische Polymorphismen
Langsame Metabolisierer für CYP2D6
Basierend auf einer pharmakokinetischen Populationsanalyse ist die Plasmakonzentration von Aripiprazol bei langsamen CYP2D6-Metabolisierern etwa 2-mal höher als bei normalen CYP2D6-Metabolisierern (für Dosierungsanweisungen siehe Dosierung / Anwendung).
Präklinische DatenDas toxikologische Profil für Aripiprazol, das an Versuchstiere über eine intramuskuläre Injektion verabreicht wurde, ähnelt in der Regel dem nach einer oralen Verabreichung bei vergleichbaren Plasmaspiegeln. Mit einer intramuskulären Injektion war jedoch eine entzündliche Reaktion an der Injektionsstelle zu sehen, die aus einer granulomatösen Entzündung, Herden (deponierter Wirkstoff), zellulären Infiltraten, Ödemen (Schwellungen) und, bei Affen, aus Fibrose bestand. Diese Auswirkungen heilten allmählich mit Einstellung der Verabreichung ab.
Basierend auf den konventionellen Studien zur Sicherheitspharmakologie, Toxizität bei wiederholter Gabe, Reproduktions- und Entwicklungstoxizität, Genotoxizität und zum kanzerogenen Potential mit oral angewendetem Aripiprazol liessen die präklinischen Sicherheitsdaten keine besonderen Gefahren für den Menschen erkennen.
Oral angewendetes Aripiprazol
Für oral angewendetes Aripiprazol wurden toxikologisch signifikante Wirkungen lediglich bei Dosierungen oder Expositionen beobachtet, die die maximale Dosierung oder Exposition beim Menschen deutlich überschritten, womit sie für die klinische Anwendung nur begrenzte oder keine Bedeutung haben. Die Wirkungen umfassten: eine dosisabhängige Nebennierenrinden-Toxizität bei Ratten nach 104 Wochen oraler Gabe mit dem etwa 3- bis 10-fachen der mittleren Steady-State-AUC bei der empfohlenen Maximaldosis beim Menschen, und eine Zunahme von Nebennierenrinden-Karzinomen und kombinierten Nebennierenrinden-Adenomen/Karzinomen bei weiblichen Ratten mit dem etwa 10-fachen der mittleren Steady- State-AUC bei der empfohlenen Maximaldosis beim Menschen. Die höchste Exposition bei weiblichen Ratten, die keinen Tumor induzierte, war etwa 7-mal höher als die Exposition des Menschen bei empfohlener Dosierung.
Zusätzlich wurde eine Cholelithiasis als Folge der Ausfällung von Sulfat-Konjugaten der Hydroxy- Metaboliten von Aripiprazol in der Galle von Affen nach wiederholter oraler Gabe von 25 mg/kg/Tag bis 125 mg/kg/Tag oder dem etwa 16- bis 81-fachen der empfohlenen Maximaldosis beim Menschen, basierend auf mg/m2, festgestellt.
Allerdings betrugen die in der menschlichen Galle bei der höchsten empfohlenen Dosis von 30 mg/Tag gefundenen Konzentrationen der Sulfat-Konjugate von Hydroxy-Aripiprazol nicht mehr als 6 % der Konzentrationen, die in der Studie über 39 Wochen in der Galle von Affen festgestellt wurden, und liegen weit unter den Grenzwerten (6 %) der in vitro-Löslichkeit.
In Studien mit wiederholter Gabe bei jungen Ratten und Hunden war das Toxizitätsprofil von Aripiprazol mit dem von erwachsenen Tieren vergleichbar und es gab keine Hinweise auf Neurotoxizität oder nachteilige Auswirkungen auf die Entwicklung.
Basierend auf den Ergebnissen des kompletten Satzes an Standarduntersuchungen zur Genotoxizität wurde Aripiprazol beim Menschen als nicht genotoxisch eingestuft. Aripiprazol beeinträchtigte die Fertilität in Studien zur Reproduktionstoxizität nicht.
Bei Ratten wurden nach Dosierungen, die zu subtherapeutischen Expositionen (basierend auf der AUC) führten, toxische Effekte auf die Entwicklung, einschliesslich dosisabhängiger fetaler Ossifikationsverzögerungen und möglicher teratogener Wirkungen beobachtet. Bei Kaninchen wurden diese Effekte nach Dosierungen, die zu Expositionen des etwa 3- und 11-fachen der mittleren Steady-State-AUC bei der empfohlenen klinischen Maximaldosis führten, beobachtet. Maternaltoxische Effekte traten in dem Dosisbereich auf, in dem auch toxische Effekte auf die Entwicklung beobachtet worden waren.
Sonstige HinweiseInkompatibilitäten
Das Arzneimittel darf nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Bei 15°- 30°C lagern, nicht einfrieren.
Aus mikrobiologischer Sicht ist das Arzneimittel unmittelbar nach der Vorbereitung der Spritze zur Injektion zu verabreichen. Bereits vorbereitete Injektionsspritzen, welche nicht unmittelbar verabreicht werden können, sollen nicht mehr verwendet werden.
Besondere Massnahmen für die Beseitigung eines gebrauchten Arzneimittels oder dessen Abfallmaterialien
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den gültigen Anforderungen zu beseitigen
Hinweise für die Handhabung
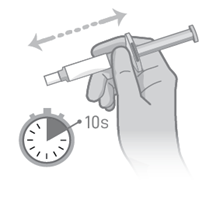
Klopfen Sie die Spritze mindestens 10-mal in Ihre Hand. Schütteln Sie die Spritze nach dem Klopfen für mindestens 10 Sekunden kräftig.
Verabreichung in den Glutealmuskel
Die empfohlene Kanüle für eine Injektion in den Glutealmuskel ist eine 38 mm (1,5 Zoll) 22 Gauge sterile Sicherheitskanüle; bei adipösen Patienten (BMI > 28kg/m2) sollte eine 51 mm (2 Zoll) 21 Gauge sterile Sicherheitskanüle verwendet werden.
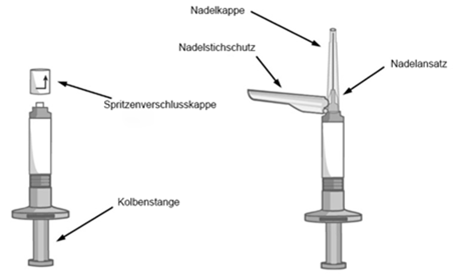
Inhalt des Kits
Stellen Sie sicher, dass die folgenden Komponenten zur Verfügung stehen:
·Eine Fertigspritze, die entweder Abilify Asimtufii 960 mg oder 720 mg Depot-Injektionssuspension enthält, und zwei Sicherheitskanülen.
·Eine sterile 38 mm (1,5 Zoll) 22-Gauge-Kanüle mit schwarzem Nadelansatz.
·Eine sterile 51 mm (2 Zoll) 21-Gauge-Kanüle mit grünem Nadelansatz.
Vorbereitung zur Injektion
·Nehmen Sie die Spritze aus der Verpackung.
·Klopfen Sie die Spritze mindestens 10-mal in Ihre Hand.
·Schütteln Sie die Spritze nach dem Klopfen für mindestens 10 Sekunden kräftig.
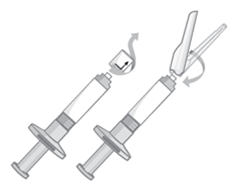
Wählen Sie die passende Kanüle
Darf nur in die Glutealmuskulatur verabreicht werden.
Die Auswahl der Kanüle hängt vom Körpertyp des Patienten ab.
|
Körpertyp
|
Kanülengrösse
|
Farbe des Kanülenstichschutzes
| |
Nicht adipös (BMI < 28 kg/m2)
|
38 mm, 22 Gauge
|
schwarz
| |
Adipös (BMI > 28 kg/m2)
|
51 mm, 21 Gauge
|
grün
|
Anbringen der Kanüle
·Drehen und ziehen Sie die Verschlusskappe der Fertigspritze ab.
·Während Sie das untere Kanülenende halten, stellen Sie durch Drücken sicher, dass die Kanüle fest auf dem Stichschutz sitzt, und drehen Sie sie sanft im Uhrzeigersinn, bis die Kanüle SICHER sitzt.
Luft entfernen
·Wenn Sie bereit sind, die Injektion zu verabreichen, halten Sie die Spritze senkrecht nach oben und entfernen Sie die Nadelkappe, indem Sie diese gerade abziehen. Die Nadelkappe darf nicht gedreht werden, da dadurch die Kanüle von der Spritze gelöst werden kann.
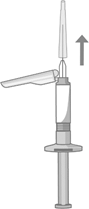
·Drücken Sie langsam die Kolbenstange nach oben, um die Luft zu entfernen und bis die Suspension den Kanülenansatz ausfüllt.
·Nach dem Entfernen der Luft aus der Spritze müssen Sie sofort die Injektion verabreichen.
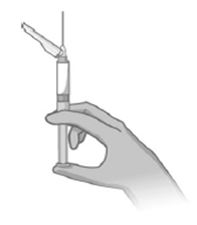
Injektion der Dosis
·Injizieren Sie langsam den gesamten Inhalt intramuskulär in den Glutealmuskel des Patienten. Die Verabreichung darf nicht auf einem anderen Weg stattfinden.
·Sie dürfen die Injektionsstelle nicht massieren.
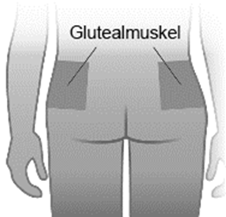
·Denken Sie daran, die Injektionen im Wechsel zwischen den beiden Glutealmuskeln zu verabreichen.
·Erfolgt der Start mit zwei Injektionen, müssen diese in zwei verschiedene Glutealmuskeln verabreicht werden. Beide Injektionen DÜRFEN NICHT gemeinsam in denselben Glutealmuskel injiziert werden.
·Achten Sie auf Anzeichen oder Symptome einer versehentlichen intravenösen Verabreichung.
Entsorgung
·Schliessen Sie nach der Injektion den Kanülenstichschutz, indem Sie diesen auf eine harte Oberfläche drücken, sodass der Stichschutz die Kanüle bedeckt und einrastet.

·Entsorgen Sie die verwendete Spritze und Kanüle umgehend in einem geeigneten durchstichsicheren Behältnis.
·Nicht verwendete Kanülen dürfen nicht für zukünftige Anwendungen aufbewahrt werden.

Zulassungsnummer69793 (Swissmedic)
PackungenAbilify Asimtufii 960 mg Depot-Injektionssuspension in einer Fertigspritze. [B]
Jede 960-mg-Packung enthält eine Fertigspritze und zwei sterile Sicherheitskanülen: eine 38 mm (1,5 Zoll) 22 Gauge und eine 51 mm (2 Zoll) 21 Gauge.
Abilify Asimtufii 720 mg Depot-Injektionssuspension in einer Fertigspritze. [B]
Jede 720-mg-Packung enthält eine Fertigspritze und zwei sterile Sicherheitskanülen: eine 38 mm (1,5 Zoll) 22 Gauge und eine 51 mm (2 Zoll) 21 Gauge.
ZulassungsinhaberinLundbeck (Schweiz) AG, Opfikon
Stand der InformationJanuar 2025
24062025FI
|











