Eigenschaften/WirkungenATC-Code
N05AX12
Wirkungsmechanismus
Es wird vermutet, dass die Wirksamkeit von Aripiprazol bei Schizophrenie über die Kombination einer partiell agonistischen Aktivität auf Dopamin D2- und Serotonin 5-HT1A-Rezeptoren und einer antagonistischen Aktivität auf Serotonin 5-HT2A-Rezeptoren vermittelt wird. Aripiprazol zeigte in Tiermodellen für dopaminerge Hyperaktivität antagonistische Eigenschaften und agonistische Eigenschaften in Modellen für dopaminerge Hypoaktivität. Aripiprazol zeigt eine hohe Bindungsaffinität in vitro zu Dopamin D2 und D3, Serotonin 5-HT1A und 5-HT2A Rezeptoren sowie eine mässige Affinität zu Dopamin D4, Serotonin 5-HT2C und 5-HT7, alpha-1-adrenergen und Histamin-H1-Rezeptoren. Aripiprazol zeigte auch eine mässige Bindungsaffinität zur Stelle der Serotonin-Wiederaufnahme, und keine nennenswerte Affinität zu cholinergen muscarinischen Rezeptoren. Die Interaktion mit anderen Rezeptoren als den Dopamin- und Serotonin-Subtypen könnte einige der anderen klinischen Effekte von Aripiprazol erklären.
Eine Verabreichung von oralem Aripiprazol in Dosierungen von 0,5 bis 30 mg einmal täglich während zwei Wochen an gesunde Versuchspersonen, bewirkte eine dosisabhängige Reduktion der Bindung von 11C-Racloprid, ein D2/D3 Rezeptor Ligand, am Nukleus Caudatus und am Putamen, die mit der Positronen-Emissions-Tomographie ermittelt wurde.
Pharmakodynamik
Klinische Wirksamkeit
Erhaltungstherapie bei Erwachsenen mit Schizophrenie
Die Wirksamkeit von Abilify Asimtufii 960 mg, einmal alle zwei Monate angewendet, wurde teilweise anhand eines pharmakokinetischen Bridgings in einer unverblindeten, randomisierten, multizentrischen Parallelgruppenstudie mit wiederholter Gabe untersucht. Die Studie zeigte, dass Abilify Asimtufii 960 mg über das gesamte Dosierungsintervall zu ähnlichen Aripiprazol-Konzentrationen, und damit einer vergleichbaren Wirksamkeit, führt wie Abilify Maintena 400 mg (siehe Abschnitt «Pharmakokinetik»).
Die Ähnlichkeit der Plasmakonzentrationen von Aripiprazol unter Abilify Asimtufii 960 mg und Abilify Maintena 400 mg ist in Tabelle 2 dargestellt.
Tabelle 2: Geometrisches mittleres Verhältnis und Konfidenzintervall (KI) nach der 4. Anwendung von Abilify Asimtufii 960 mg oder der 7. und 8. Anwendung von Abilify Maintena 400 mg in der unverblindeten Studie
|
Parameter
|
Verhältnis
(Abilify Asimtufii 960 mg/Abilify Maintena 400 mg)
|
90 % KI
| |
AUC0-56a
|
1,006c
|
0,851 - 1,190
| |
C56/C28b
|
1,011d
|
0,893 - 1,145
| |
Cmaxb
|
1,071c
|
0,903 - 1,270
|
a AUC0-56 nach der 4. Anwendung von Abilify Asimtufii 960 mg oder der Summe von AUC0-28 nach der 7. und 8. Anwendung von Abilify Maintena 400 mg.
b Plasmakonzentrationen von Aripiprazol nach der 4. Anwendung von Abilify Asimtufii 960 mg (C56) oder der 8. Anwendung von Abilify Maintena 400 mg (C28).
c Abilify Asimtufii 960 mg (n = 34), Abilify Maintena 400 mg (n = 32).
d Abilify Asimtufii 960 mg (n = 96), Abilify Maintena 400 mg (n = 82).
Die Wirksamkeit von Abilify Asimtufii 960 mg/720 mg bei der Behandlung von Schizophrenie wird des Weiteren gestützt durch die bekannte Wirksamkeit von Abilify Maintena 400 mg/300 mg, die nachfolgend zusammengefasst wird:
Wirksamkeit von Abilify Maintena 400 mg/300 mg
Die Wirksamkeit von Abilify Maintena in der Erhaltungstherapie von Patienten mit Schizophrenie wurde in zwei randomisierten, doppelblinden Langzeitstudien gezeigt.
Die erste Studie war eine 38-Wochen, randomisierte, doppelblinde, aktiv-kontrollierte Studie und diente dem Nachweis der Wirksamkeit, Sicherheit und Verträglichkeit von monatlichen Abilify Maintena Injektionen im Vergleich zur einmal täglichen Anwendung von oralem Aripiprazol 10-30 mg als Erhaltungstherapie bei erwachsenen Patienten mit Schizophrenie. Diese Studie umfasste eine Screening-Phase und 3 Behandlungs-Phasen: Umstellungs-Phase, orale Stabilisierungs-Phase und doppelblinde, aktiv-kontrollierte Phase.
662 Patienten, die für die 38-Wochen doppelblinde, aktiv-kontrollierte Phase in Frage kamen, wurden im Verhältnis 2:2:1 randomisiert einer von drei doppelblinden Behandlungsgruppen zugeteilt: 1) Abilify Maintena, 2) Stabilisierungsdosis von oralem Aripiprazol 10-30 mg oder 3) Aripiprazol langwirksame Injektion 50 mg/25 mg. Die Aripiprazol langwirksame Injektion 50 mg/25 mg wurde als niedrige Aripiprazol-Dosisgruppe aufgenommen, um die Testempfindlichkeit für das Non-Inferiority-Design zu prüfen.
Die Resultate der Auswertung des primären Wirksamkeitsendpunkts, geschätzter Anteil der Patienten mit drohendem Rückfall am Ende von Woche 26 der doppelblinden, aktiv-kontrollierten Phase zeigten, dass Abilify Maintena 400 mg/300 mg dem oralen Aripiprazol 10-30 mg nicht unterlegen ist.
Die geschätzte Rückfallrate am Ende von Woche 26 betrug 7,12% unter Abilify Maintena, und 7,76% unter oralem Aripiprazol 10-30 mg, ein Unterschied von -0,64%. Das 95%-Konfidenzintervall (-5.,6, 3,99) für die Differenz im geschätzten Anteil der Patienten mit drohendem Rückfall am Ende von Woche 26 schloss die vordefinierte Grenze für non-inferiority aus (11,5%). Daher ist Abilify Maintena oralem Aripiprazol 10-30 mg nicht unterlegen.
Der geschätzte Anteil der Patienten mit drohendem Rückfall Ende Woche 26 betrug unter Abilify Asimtufii 7,12% und war damit statistisch signifikant niedriger als in der Gruppe mit Aripiprazol langwirksamer Injektion 50 mg/25 mg (21,80%; p = 0,0006). Somit wurde die Überlegenheit von Abilify Asimtufii gegenüber der Aripiprazol langwirksamen Injektion 50 mg/25 mg nachgewiesen und die Validität des Studiendesigns bestätigt.
Die Kaplan-Meier-Kurven der Zeit von der Randomisierung bis zum drohenden Rückfall während der 38-wöchigen, doppelblinden aktiv kontrollierten Phase für Abilify Maintena 400 mg/300 mg, 10 mg bis 30 mg oral angewendetes Aripiprazol und langwirkender Injektionslösung mit 50 mg/25 mg Aripiprazol sind in Abbildung 1 dargestellt.
Abbildung 1: Kaplan-Meier-Kurve für die Zeit bis zur Exazerbation psychotischer Symptome/drohendem Rückfall
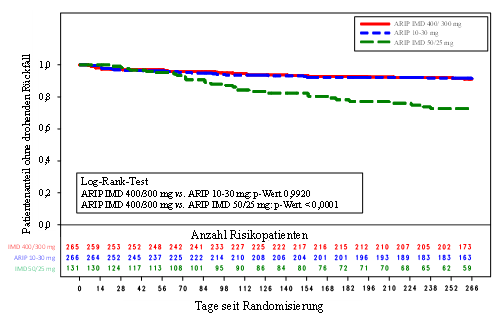
HINWEIS: ARIP IMD 400/300 mg = Abilify Maintena; ARIP 10 mg bis 30 mg = oral angewendetes Aripiprazol; ARIP IMD 50/25 mg = Aripiprazol, langwirkende Injektionslösung
Ferner wird die Nicht-Unterlegenheit von Abilify Asimtufii im Vergleich zu 10 mg bis 30 mg oral angewendetem Aripiprazol durch die Ergebnisse der Analyse der Positive and Negative Syndrome Scale Score (PANSS) gestützt.
Tabelle 3: PANSS Gesamtpunktzahl - Veränderung vom Ausgangswert bis Woche 38-LOCF (Last Observation Carried Forward): Randomisierte Wirksamkeitsstichprobea, b
|
|
Abilify Maintena
400 mg/300 mg
(n = 263)
|
Oral angewendetes Aripiprazol
10 mg bis 30 mg/Tag
(n = 266)
|
Aripiprazol, langwirkende Injektionslösung
50 mg/25 mg
(n = 131)
| |
Durchschnittlicher Ausgangswert (SD)
|
57,9 (12,94)
|
56,6 (12,65)
|
56,1 (12,59)
| |
Durchschnittliche Änderung (SD)
|
−1,8 (10,49)
|
0,7 (11,60)
|
3,2 (14,45)
| |
P-Wert
|
Nicht zutreffend
|
0,0272
|
0,0002
|
a Negative Veränderung des Werts gibt eine Verbesserung an.
b Ausschliesslich Patienten, die sowohl einen Ausgangswert als auch mindestens einen Wert nach dem Ausgangswert hatten, wurden eingeschlossen. P-Werte wurden aus dem Vergleich der Veränderung vom Ausgangswert innerhalb eines Kovarianzanalysemodells mit der Behandlung als Term und dem Ausgangswert als Kovariate abgeleitet.
Die zweite Studie war eine 52-wöchige, randomisierte, doppelblinde Absetzungsstudie bei US-amerikanischen erwachsenen Patienten mit der aktuellen Diagnose einer Schizophrenie. Diese Studie bestand aus einer Screeningphase und 4 Behandlungsphasen: Umstellung, orale Stabilisierung, i.m. Stabilisierung und doppelblinde, placebokontrollierte Phase. Patienten, die die orale Stabilisierungsanforderung in der oralen Stabilisierungsphase erfüllten, wurden in einfach verblindeter Weise der Verabreichung von Abilify Maintena 400 mg/300 mg zugewiesen und begannen eine i.m. Phase für minimal 12 Wochen und maximal 36 Wochen. Patienten, die für die doppelblinde, placebokontrollierte Phase geeignet waren, wurden nach dem Zufallsprinzip in einem Verhältnis von 2:1 einer doppelblinden Behandlung mit Abilify Maintena 400 mg/300 mg bzw. Placebo zugeordnet.
Die endgültige Wirksamkeitsanalyse umfasste 403 randomisierte Patienten und 80 Exazerbationen von psychotischen Symptomen/Ereignissen drohenden Rückfalls. In der Placebogruppe waren 39,6 % der Patienten zu einem drohenden Rückfall fortgeschritten, während in der Abilify Maintena 400 mg/300 mg Gruppe ein drohender Rückfall bei 10 % der Patienten auftrat; somit hatten Patienten in der Placebogruppe ein 5,03-fach höheres Risiko für einen drohenden Rückfall.
Prolaktin
In der doppelblinden, aktiv kontrollierten Phase der 38-wöchigen Studie gab es vom Ausgangswert bis zum letzten Besuch eine mittlere Abnahme der Prolaktin-Spiegel in der Gruppe mit Abilify Maintena 400 mg/300 mg (−0,33 ng/ml), während im Vergleich dazu in der Gruppe mit oralen 10 mg bis 30 mg Aripiprazol-Tabletten ein mittlerer Anstieg (0,79 ng/ml; p <0,01) verzeichnet wurde. Die Inzidenz von mit Abilify Maintena 400 mg/300 mg behandelten Patienten mit Prolaktin-Spiegeln > 1-mal der oberen Grenze des Normbereichs (OGN) bei jeder Beurteilung betrug 5,4 % gegenüber 3,5 % der mit oralen 10 mg bis 30 mg Aripiprazol-Tabletten behandelten Patienten.
Männliche Patienten wiesen in jeder Behandlungsgruppe im Allgemeinen eine höhere Inzidenz auf als weibliche Patienten.
In der doppelblinden, placebokontrollierten Phase der 52-wöchigen Studie gab es vom Ausgangswert bis zum letzten Besuch eine mittlere Abnahme der Prolaktin-Spiegel in der Gruppe mit Abilify Maintena 400 mg/300 mg (−0,38 ng/ml), während im Vergleich dazu in der Placebogruppe ein mittlerer Anstieg (1,67 ng/ml) verzeichnet wurde. Die Inzidenz von mit Abilify Maintena 400 mg/300 mg behandelten Patienten mit Prolaktin-Spiegeln > 1-mal OGN betrug 1,9 % gegenüber 7,1 % der mit Placebo behandelten Patienten.
Akutbehandlung von Schizophrenie bei Erwachsenen
Die Wirksamkeit von Abilify Maintena 400 mg/300 mg bei erwachsenen Patienten mit Schizophrenie, die einen akuten Rückfall erlitten, wurde in einer kurzfristigen (12-wöchigen), randomisierten, doppelblinden, placebokontrollierten Studie (n = 339) untersucht.
Im Hinblick auf den primären Endpunkt (Veränderung des PANSS-Gesamtpunktwerts zwischen Baseline und Woche 10) zeigte sich Abilify Maintena 400 mg/300 mg (n = 167) gegenüber Placebo (n = 172) überlegen.
Ähnlich wie beim PANSS-Gesamtpunktwert wurde im Zeitverlauf auch bei den PANSS-Punktwerten der Positiv- und Negativ-Subskalen eine Verbesserung (Verringerung) gegenüber der Baseline festgestellt.
Tabelle 4: PANSS Gesamtpunktzahl - Veränderung vom Ausgangswert bis Woche 10: Randomisierte Wirksamkeitsstichprobe a
|
|
Abilify Maintena
400 mg/300 mg
|
Placebo
| |
Durchschnittlicher Ausgangswert (SD)
|
102,4 (11,4)
n = 162
|
103,4 (11,1)
n = 167
| |
Durchschnittliche LS-Änderung (SE)
|
−26,8 (1,6)
n = 99
|
−11,7 (1,6)
n = 81
| |
P-Wert
|
< 0,0001
|
| |
Behandlungsdifferenzb (95 %-KI)
|
−15,1 (−19,4; −10,8)
|
|
a Die Daten wurden in einem MMRM-Ansatz (gemischtes Modell mit Messwiederholungen) analysiert. In die Auswertung wurden nur Patienten aufgenommen, die randomisiert einer Behandlung zugeteilt worden waren, mindestens eine Injektion erhalten hatten und bei denen eine Baseline- und mindestens eine Wirksamkeitsbeurteilung nach Baseline durchgeführt worden war.
b Differenz (Abilify Maintena minus Placebo) der durchschnittlichen LS-Veränderung gegenüber den Ausgangswerten.
Darüber hinaus wurde mit Abilify Maintena 400 mg/300 mg anhand der Veränderung des Clinical Global Impressions Severity (CGI-S)-Punktwerts zwischen Baseline und Woche 10 eine statistisch signifikante Verbesserung der Symptome festgestellt.
Das persönliche und soziale Funktionsniveau wurde anhand der PSP-Skala (Personal and Social Performance) beurteilt. Die PSP-Skala ist eine validierte, vom Arzt auszufüllende Skala, mit der die persönliche und soziale Funktionalität in den folgenden vier Bereichen gemessen wird: sozial nützliche Aktivitäten (einschliesslich Arbeit und Studium), persönliche und soziale Beziehungen, Selbstfürsorge und störendes und aggressives Verhalten. Mit Abilify Maintena 400 mg/300 mg wurde in der Woche 10 eine im Vergleich zu Placebo statistisch signifikante Behandlungsdifferenz festgestellt (+7,1; p < 0,0001, 95 %-KI: 4,1; 10,1 in einem ANCOVA-Modell [LOCF]).
Das Sicherheitsprofil entsprach den bekannten Verträglichkeitsmerkmalen von Abilify Maintena 400 mg/300 mg. Allerdings bestanden Unterschiede im Vergleich zu Beobachtungen, die im Rahmen der Erhaltungstherapie bei der Behandlung von Schizophrenie gemacht wurden. In einer kurzfristigen (12-wöchigen), randomisierten, doppelblinden, placebokontrollierten Studie mit Patienten, die Abilify Maintena 400 mg/300 mg erhielten, waren Gewichtszunahme und Akathisie diejenigen Symptome, die mit einer im Vergleich zu Placebo mindestens doppelt so großen Inzidenz auftraten. Die Inzidenz einer Gewichtszunahme von ≥7 % (zwischen Baseline und letzter Visite in Woche 12) lag mit Abilify Maintena 400 mg/300 mg bei 21,5 % (Placebogruppe: 8,5 %). Eine Akathisie war das am häufigsten beobachtete extrapyramidale Symptom (Abilify Maintena 400 mg/300 mg: 11,4 %; Placebogruppe: 3,5 %).
Sicherheit und Wirksamkeit bei pädiatrischen Patienten
Die Europäische Arzneimittel-Agentur hat für Abilify Asimtufii eine Freistellung von der Verpflichtung zur Vorlage von Ergebnissen zu Studien in allen pädiatrischen Altersklassen bei Schizophrenie gewährt.
|

