Zusammensetzung
Wirkstoffe
Alpha-1-Proteinaseinhibitor vom Menschen.
Hilfsstoffe
Pulver: Natriumchlorid, Natriumdihydrogenphosphat (entspricht insgesamt ca. 110 mg Natrium pro Durchstechflasche).
Lösungsmittel: Wasser für Injektionszwecke.
Indikationen/Anwendungsmöglichkeiten
Zur Dauersubstitutionstherapie bei Alpha-1-Proteinaseinhibitormangel mit progredientem Lungenemphysem bei Patienten mit Proteinaseinhibitor-Phänotyp (Z, Z), (Z, Null), (Null, Null) oder (S, Z).
Eine erfolgreiche Verlangsamung der Emphysemprogredienz wird am besten bei einer mittelgradigen Funktionseinschränkung (FEV1-forciertes Expirationsvolumen in der ersten Sekunde) der Lunge erreicht (siehe auch Kapitel «Eigenschaften / Wirkungen»).
Dosierung/Anwendung
Soweit nicht anders verordnet, reicht in den meisten Fällen eine einmal wöchentliche Dosis von 60 mg Alpha-1-Proteinaseinhibitor/kg Körpergewicht (entsprechend 180 ml gebrauchsfertige Infusionslösung mit 25 mg/ml Alpha-1-Proteinaseinhibitor bei einem 75 kg schweren Patienten) als Kurzinfusion aus, um den Alpha-1-Proteinaseinhibitorspiegel im Serum ständig über 80 mg/dl zu halten. Dieser Wert gilt als Mindestwert zum Schutz gegen eine weitere Verschlechterung des Lungenemphysems.
Therapiedauer
Die Dauer der Anwendung bestimmt der behandelnde Arzt. Eine bestimmte Begrenzung der Dauer der Anwendung ist nicht vorgesehen.
Kinder und Jugendliche
Die Anwendung von Prolastin bei Kindern und Jugendlichen ist nicht untersucht worden.
Art der Anwendung
Das Pulver ist, wie im Abschnitt «Hinweise für die Handhabung» beschrieben, mit dem Lösungsmittel (40 ml Wasser für Injektionszwecke) aufzulösen und die gebrauchsfertige Lösung ist langsam intravenös mit einem geeigneten Infusionsbesteck zu infundieren. Die Infusionsgeschwindigkeit sollte 0,08 ml/kg Körpergewicht pro Minute nicht überschreiten (entspricht 6 ml pro Minute bei einem 75 kg schweren Patienten).
Kontraindikationen
Prolastin darf nicht angewendet werden bei Patienten mit:
·IgA-Mangel mit Antikörpern gegen IgA, da es in diesem Fall zu schweren allergischen Reaktionen bis hin zum anaphylaktischen Schock kommen kann.
·Dekompensiertem Cor pulmonale.
·Bekannter Überempfindlichkeit gegen Alpha-1-Proteinaseinhibitoren oder einen der sonstigen Inhaltsstoffe (siehe «Zusammensetzung»).
Warnhinweise und Vorsichtsmassnahmen
Da Prolastin zu einer kurzfristigen Erhöhung des Blutvolumens führen kann, ist bei Patienten mit schwerer Herzinsuffizienz besondere Vorsicht geboten.
Überempfindlichkeit
Im Falle einer schweren Überempfindlichkeitsreaktion (mit Blutdruckabfall <90 mm Hg, Atemnot bis hin zum anaphylaktischen Schock) ist Prolastin sofort abzusetzen und eine entsprechende Behandlung, gegebenenfalls eine Schocktherapie, einzuleiten.
Übertragbare Krankheitserreger
Prolastin wird aus humanem Plasma hergestellt. Standardmassnahmen zur Verhinderung der Übertragung von Infektionen durch den Einsatz von aus Blut oder Blutplasma hergestellten Arzneimitteln schliessen die Auswahl der Spender und das Screening der einzelnen Spender und des Plasmapools auf spezifische Infektionsmarker sowie effektive Schritte zur Inaktivierung/Elimination von Viren im Herstellungsverfahren ein. Dennoch kann bei einer Verabreichung von Arzneimitteln aus humanem Blut oder Blutplasma die Möglichkeit einer Übertragung von Krankheitserregern nicht völlig ausgeschlossen werden. Dasselbe gilt auch für bislang unbekannte oder neu aufgetretene Viren und andere Pathogene. Die ergriffenen Massnahmen werden als wirksam gegen umhüllte Viren wie HIV, HBV und HCV sowie unbehüllte Viren wie HAV und Parvovirus B19 betrachtet.
Für Patienten, welche regelmässig mit Prolastin behandelt werden, sollte eine angemessene Schutzimpfung (Hepatitis A + B) in Betracht gezogen werden.
Rückverfolgbarkeit
Bei jeder Verabreichung von Prolastin an einen Patienten sind Bezeichnung des Arzneimittels und Chargennummer des angewendeten Arzneimittels eindeutig zu dokumentieren, um einen Zusammenhang zwischen Patient und Produktcharge herzustellen.
Rauchen
Rauchen gilt allgemein als wichtigster Risikofaktor für die Entstehung von COPD (inklusive Emphysem) bei Menschen. Auch bei Patienten mit Alpha-1-Proteinaseinhibitormangel ist das Rauchen stark mit der Entwicklung eines Lungenemphysems verknüpft. Im Vergleich zu Patienten, welche das Rauchen aufgegeben oder gar nie geraucht haben, zeigen Raucher mit Alpha-1-Proteinaseinhibitormangel und Lungenemphysem eine schnellere jährliche Abnahme des FEV1 sowie eine erhöhte Mortalitätsrate. Aus diesem Grunde müssen bei Patienten mit Alpha-1-Proteinaseinhibitormangel alle Anstrengungen und geeigneten Massnahmen aufgeboten werden, um das Rauchen einzustellen.
Natriumgehalt
Dieses Arzneimittel enthält ca. 110 mg Natrium pro Durchstechflasche. Bei einem 75 kg schweren Patienten sind gemäss Dosierung 4-5 Flaschen einmal wöchentlich zu verabreichen, was ungefähr 24.8% der von der WHO für einen Erwachsenen empfohlenen maximalen täglichen Natriumaufnahme mit der Nahrung von 2 g entspricht.
Interaktionen
Wechselwirkungen zwischen Prolastin und anderen Arzneimitteln sind nicht bekannt.
Schwangerschaft, Stillzeit
Es liegen keine kontrollierten klinischen Studien zur Anwendung in der Schwangerschaft vor. Es ist nicht bekannt, ob Alpha-1-Proteinaseinhibitor in die Muttermilch übertritt.
Bei der Anwendung während der Schwangerschaft oder der Stillperiode ist Vorsicht geboten.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es wurden keine entsprechenden Studien durchgeführt.
Unerwünschte Wirkungen
Die unerwünschten Wirkungen sind entsprechend der MedDRA-Systemorganklassifikation (SOC und bevorzugte Begriffe) und nach absteigender Häufigkeitskategorien aufgeführt.
Die Häufigkeiten sind wie folgt definiert: gelegentlich (≥1/1000, <1/100); selten (≥1/10'000, <1/1000); sehr selten (<1/10'000).
Erkrankungen des Immunsystems
Gelegentlich: Urtikaria.
Selten: Überempfindlichkeitsreaktionen gegen menschliche Plasmaproteine.
Sehr selten: Anaphylaktischer Schock.
Erkrankungen des Nervensystems
Gelegentlich: Schwindel, Kopfschmerzen.
Herzerkrankungen
Selten: Tachykardie.
Gefässerkrankungen
Selten: vorübergehende Blutdruckerhöhung, Blutdruckabfall.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Selten: akute Atemnot.
Erkrankungen des Gastrointestinaltrakts
Gelegentlich: Übelkeit.
Erkrankungen der Haut und des Unterhautgewebes
Selten: Hautausschläge.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Gelegentlich: Gelenkschmerzen.
Selten: Rückenschmerzen.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Gelegentlich: Schüttelfrost, Fieber, grippeähnliche Symptome, Brustschmerzen.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Konsequenzen einer Überdosierung sind nicht bekannt.
Eigenschaften/Wirkungen
ATC-Code
B02AB02
Wirkungsmechanismus
Alpha-1-Proteinaseinhibitor hemmt eine Reihe von Serin-Proteasen, wie z.B. neutrophile Elastase, pankreatische Elastase, pankreatisches Trypsin, pankreatisches Chymotrypsin, Blutgerinnungsfaktor XI, Blutgerinnungsfaktor XIII, Plasmin und Thrombin. Seine Hauptaktivität liegt jedoch in der Hemmung der neutrophilen Elastase, mit der es einen Komplex im 1:1-Verhältnis bildet.
Pharmakodynamik
Siehe Abschnitt «Wirkungsmechanismus».
Klinische Wirksamkeit
Es liegen keine kontrollierten Langzeitstudien vor zur Wirksamkeit der Substitutionstherapie, was auch mit dem langsamen, aber progredienten Verlauf der Krankheit zusammenhängt. In einem deutsch-dänischen Vergleich profitierte die Gruppe der behandelten deutschen Patienten (n= 112) signifikant (p= 0.04) im Vergleich zu den unbehandelten 58 dänischen Patienten gemessen am jährlichen FEV1-Abfall, welche initial einen Sollwert des FEV1 von 31-65% aufwiesen. Zudem geht aus der amerikanischen Kohortenstudie hervor, dass lediglich Patienten aus der Untergruppe FEV1 35-49% (185 mit und 32 ohne Substitutionstherapie) eine eindeutig verminderte Mortalität aufwiesen.
Pharmakokinetik
Absorption
Nicht zutreffend.
Distribution
Keine Angaben.
Metabolismus
Keine Angaben.
Elimination
In einer an neun Patienten durchgeführten Pharmakokinetik-Studie wurde eine Alpha-1-Proteinaseinhibitor-Halbwertszeit von 4,5 Tagen festgestellt.
Präklinische Daten
Die akute Toxizität von i.v. appliziertem Prolastin wurde an Kaninchen, Mäusen und Ratten geprüft. Ein Teil der letzteren ist gleichzeitig mit einem «Angiotensin Converting Enzyme» behandelt worden, um einen eventuellen kardiovaskulären Effekt zu potenzieren. Eine akute Toxizität wurde in den drei o.g. Tierarten nicht festgestellt. Die LD50 entsprach der Negativkontrolle.
Angaben über die chronische Toxizität, Mutagenität oder Karzinogenität entfallen, da es sich um ein Humanprotein handelt.
Sonstige Hinweise
Inkompatibilitäten
Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Haltbarkeit nach Anbruch
Die rekonstituierte Lösung darf nur innerhalb von 3 Stunden nach der Herstellung verwendet werden. Nicht verwendete Lösung ist zu entsorgen.
Besondere Lagerungshinweise
Pulver nicht über 25 °C lagern. Nicht einfrieren.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Das Pulver ist gemäss der folgenden Anweisung mit dem Inhalt einer Flasche mit 40 ml Wasser für Injektionszwecke (WFI) zu versehen und aufzulösen. Die vollständige Rekonstitution sollte innerhalb von 5 Minuten erfolgt sein.
Herstellen der rekonstituierten Infusionslösung
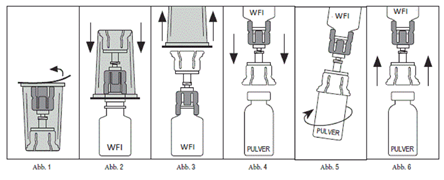
1.Die Rekonstitution muss unter aseptischen Bedingungen (sauber und keimfrei) erfolgen, um die Sterilität aufrechtzuerhalten. Nutzen Sie eine ebene Arbeitsfläche.
2.Stellen Sie sicher, dass beide Flaschen, Prolastin Pulver und Lösungsmittel (steriles Wasser für Injektionszwecke) Raumtemperatur (20-25 ºC) haben.
3.Die Schutzkappe von der Prolastin-Flasche abnehmen und die Oberfläche des Stopfens mit einem Alkoholtupfer säubern. Trocknen lassen.
4.Schritt 3. bei der Lösungsmittelflasche wiederholen.
5.Die Schutzabdeckung von der sterilen Mix2Vial-Verpackung abziehen (Abb. 1), den Mix2Vial-Transferadapter aber in der Packung belassen.
6.Die Wasserflasche auf eine ebene Fläche stellen und sicher festhalten. Den Mix2Vial-Transferadapter mit dem blauen Ende senkrecht nach unten drücken, bis der Dorn den Stopfen durchdrungen hat (Abb. 2).
7.Die durchsichtige Umverpackung vom Mix2Vial entfernen und entsorgen (Abb. 3).
8.Die Prolastin-Flasche auf eine ebene Fläche stellen. Die noch mit dem Mix2Vial-Adapter verbundene Lösungsmittelflasche umdrehen.
9.Die Prolastin-Flasche auf der ebenen Arbeitsfläche sicher festhalten und den Mix2Vial-Adapter mit dem durchsichtigen Ende senkrecht nach unten drücken, bis der Dorn den Stopfen durchdrungen hat (Abb. 4). Das Lösungsmittel wird durch das in der Prolastin-Flasche bestehende Vakuum automatisch angesogen.Achtung: Falls der Mix2Vial-Adapter nicht senkrecht aufgesetzt wird, kann das Vakuum aus der Produktflasche entweichen und das Lösungsmittel fliesst nicht in die Prolastin-Flasche. Bei einem derartigen Vakuumverlust kann eine sterile Spritze und Kanüle benutzt werden, um das sterile Wasser für Injektionszwecke aus der Lösungsmittelflasche zu entnehmen und in die Prolastin-Flasche zu injizieren. Der Flüssigkeitsstrahl ist dabei auf die innere Flaschenwand zu richten.
10.Das Pulver vollständig auflösen durch vorsichtiges Schwenken der noch durch den Mix2Vial verbundenen Flaschen (Abb. 5). Nicht schütteln, um Schaumbildung zu vermeiden. Die rekonstituierte Lösung sollte klar sein. Nicht verwenden, wenn Partikel oder Verfärbungen sichtbar sind.
11.Da für die erforderliche Dosis mehr als eine Flasche des Produkts nötig sein wird, die obigen Anweisungen für jede weitere Packung mit dem darin enthaltenen Mix2Vial-Transferadapter wiederholen. Den Mix2Vial-Transferadapter nicht wiederverwenden.
12.Den Mix2Vial-Transferadapter entfernen (Abb. 6) und das Produkt anschliessend unter aseptischen Bedingungen verabreichen.
Nur klare bis leicht opaleszente, farblose, blassgrüne, blassgelbe oder blassbraune Lösungen verwenden. Die rekonstituierte Lösung muss innerhalb von 3 Stunden nach der Herstellung verwendet werden. Nicht verwendetes Arzneimittel oder Abfallmaterial ist zu beseitigen.
Zulassungsnummer
00697 (Swissmedic).
Packungen
Eine Packung enthält:
·eine Durchstechflasche mit Pulver (1000 mg Alpha-1-Proteinaseinhibitor),
·eine Durchstechflasche mit Lösungsmittel (40 ml Wasser für Injektionszwecke),
·einen Mix2Vial-Transferadapter zur Rekonstitution.
Abgabekategorie: (B)
Zulassungsinhaberin
OM Pharma Suisse AG, 1752 Villars-sur-Glâne
Stand der Information
Oktober 2024