Zusammensetzung
Wirkstoffe
Prothrombinum multiplex humanum (Factor II coagulationis humanus, Factor VII coagulationis humanus, Factor IX coagulationis humanus, Factor X coagulationis humanus).
Hilfsstoffe
Antithrombinum III, Heparinum natricum, Natrii citras, Natrii chloridum, Proteinum C humanum.
Gesamtnatriumgehalt: 68 mg/Durchstechflasche.
Lösungsmittel: Aqua ad iniectabile.
Indikationen/Anwendungsmöglichkeiten
Prothromplex NF ist indiziert zur Therapie und Prophylaxe von Gerinnungsstörungen bedingt durch erworbenen oder angeborenen Mangel der Vitamin-K-abhängigen Faktoren II, VII, IX und X
·Akute Blutungen und perioperative Blutungsprophylaxe bei erworbenen Mangelzuständen bedingt durch:
·orale Antikoagulationstherapie;
·Vitamin K-Mangel (z.B. Resorptionsstörungen, langfristige parenterale Ernährung);
·Leberparenchymschäden (Hepatitis, Leberzirrhose, schwerer toxischer Leberschaden u.a.);
·Verbrauchskoagulopathie (bei schwerem Schock, Polytrauma, massiven Transfusionen) nach Elimination der zugrundeliegenden Verbrauchskoagulopathie.
·Akute Blutungen und perioperative Blutungsprophylaxe bei angeborenem isoliertem oder kombiniertem Mangel der Faktoren II, VII, IX und X. Wegen der potentiell thrombogenen Wirkung von Prothrombinkomplex-Präparaten sollte Prothromplex NF jedoch nur eingesetzt werden, wenn keine geeigneten Einzelfaktoren verfügbar sind.
Dosierung/Anwendung
Die Anwendung von Prothromplex NF sollte durch einen in der Behandlung von Gerinnungskrankheiten erfahrenen Arzt erfolgen.
Die Dosierung und Dauer der Substitutionstherapie richten sich nach dem Schweregrad der Gerinnungsstörung, nach Ort und Ausmass der Blutung und dem klinischen Zustand des Patienten.
Häufigkeit und Menge der Verabreichung sollten individuell für jeden Patienten berechnet werden. Die erforderliche Dosis ist von der in vivo Halbwertszeit des benötigten Faktors (siehe «Pharmakokinetik») und dem Körpergewicht des Patienten abhängig (siehe «Pharmakokinetik»).
Die individuellen Dosierungsanforderungen können nur auf der Basis von regelmässigen Bestimmungen der individuellen Plasmaspiegel der relevanten Gerinnungsfaktoren oder auf der Basis von Globaltests des Prothrombinkomplexes (z.B. Quick-Wert, INR-Thrombinzeit) festgelegt werden. Weiterhin hängt die Dosierung von der kontinuierlichen Überwachung des klinischen Zustandes des Patienten ab.
Angeborener Mangel an Prothrombinkomplex-Faktoren
Die Berechnung der für die Behandlung benötigten Dosis basiert auf der Erfahrung, dass 1 I.E. Faktor IX pro kg Körpergewicht die Faktor IX-Aktivität im Plasma gegenüber der normalen Aktivität um 0,8 % erhöht, 1 I.E. Faktor VII pro kg Körpergewicht die Faktor VII-Aktivität im Plasma gegenüber der normalen Aktivität um 2% erhöht und 1 I.E. Faktor II und X pro kg Körpergewicht die Faktor II- und X-Aktivität im Plasma gegenüber der normalen Aktivität um 1,5% erhöhen.
Die benötigte Dosis wird mit folgender Formel berechnet: Initialdosis (z.B. Faktor IX):
Benötigte Einheiten = Körpergewicht (kg) x erwünschter Faktor IX -Anstieg (%) x 1,2.
Die zu verabreichende Menge und die Frequenz der Verabreichung sollte sich immer nach der klinischen Wirksamkeit im Einzelfall richten. Ein Faktor IX-Mangel sollte mit Prothromplex NF nur dann behandelt werden, wenn kein spezifisches Faktor IX-Präparat zur Verfügung steht.
Patienten, die länger als 4 – 5 Tage mit humanem Plasma-Prothrombinkomplex-Konzentrat behandelt werden müssen, sollten sorgfältig hinsichtlich Anzeichen einer Thrombose oder Verbrauchskoagulopathie (DIC) überwacht werden. Diese Patienten benötigen eine spezielle Behandlung.
Die Erfahrung in der Behandlung von angeborenem Mangel der Faktoren II, VII und X ist begrenzt. Aufgrund der langen Halbwertszeit von Faktor II (40 – 60 Stunden) und Faktor X (30 – 60 Stunden) benötigen Patienten mit angeborenem Faktor II- oder Faktor X-Mangel niedrige Mengen von humanem Plasma-Prothrombinkomplex-Konzentrat.
Die Halbwertszeit von Faktor VII ist sehr kurz (3 – 6 Stunden). Deshalb können Patienten mit angeborenem Faktor VII-Mangel höhere Mengen von humanem Plasma-Prothrombinkomplex-Konzentrat benötigen. Diese Patienten sollten sorgfältig auf Anzeichen einer Thrombose oder Verbrauchskoagulopathie überwacht werden.
Insbesondere bei grossen chirurgischen Eingriffen ist eine sorgfältige Überwachung der Substitutionstherapie mittels Gerinnungstests unerlässlich.
Die Wirksamkeit und Sicherheit der Anwendung von Prothromplex NF wurde bisher bei pädiatrischen Patienten in klinischen Studien von Takeda nicht geprüft.
Erworbener Mangel an Prothrombinkomplex-Faktoren
Bei erworbenem Mangel von Faktoren des Prothrombinkomplexes, z.B. infolge Behandlung mit Vitamin K Antagonisten, sollte das Präparat nur verwendet werden, wenn eine rasche Korrektur notwendig ist (z.B. bei schweren Blutungen oder Operationen). In anderen Fällen kann die Gabe von Vitamin K und/oder Plasma bzw. eine Dosis-Reduktion des Vitamin K-Antagonisten ausreichend sein.
Bei schweren Blutungen und vor Operationen mit einem hohen Blutungsrisiko sollten die Patienten humanes Plasma-Prothrombinkomplex-Konzentrat erhalten, um normale Prothrombinzeit-Werte zu erreichen.
Spezielle Dosierungsempfehlungen
·Dosierung bei erworbenem Mangel an Prothrombinkomplex-FaktorenZur Dosisberechnung kann die folgende Richtformel benutzt werden: Dosis (in I.E.) = erwünschter Quick-Wert-Anstieg (in %) × kg Körpergewicht × 1,2.
·Orale Antikoagulantienbehandlung, Vitamin K-Mangel:Blutungsprophylaxe:Zur Blutungsprophylaxe (z.B. nach Überdosierung oraler Antikoagulantien) reichen im Allgemeinen 1200-2400 I.E.* Prothromplex NF aus.Akute Blutungen:Erfahrungsgemäss können Blutungen mit einer Dosis von 2400 I.E.* Prothromplex NF beherrscht werden. Bei schweren Blutungen ist eine Normalisierung des Quick-Wertes anzustreben. Falls notwendig, können in Abständen von 6-12 Stunden weitere Dosen von 1200-2400 I.E.* Prothromplex NF verabreicht werden.Operationen:Bei der Operationsvorbereitung ist ein Quick-Wert von mindestens 50% (bzw. ein Thrombotest-Wert von mindestens 35%) anzustreben. Im Allgemeinen ist dafür präoperativ eine Dosis von 2400 I.E.* Prothromplex NF ausreichend. Postoperativ sollte der Quick-Wert mindestens 12-24 Stunden lang über 35% gehalten werden.
·Vitamin K-Mangelblutung im Säuglingsalter:Wegen der Gefahr der Aktivierung des Gerinnungssystems muss vorsichtig dosiert werden. Bei schweren Formen der Vitamin K-Mangelblutung im Säuglingsalter (vor allem ZNS-Blutungen), bei denen der Wirkungseintritt von Vitamin K1 nicht abgewartet werden kann, ist grundsätzlich eine Normalisierung des Quick-Wertes anzustreben. In den meisten Fällen kann bis zum sicheren Wirkungseintritt von Vitamin K1 die akute Blutung mit 60 I.E. Prothromplex NF/kg Körpergewicht beherrscht werden. Nur in seltenen Fällen ist eine wiederholte Gabe nach 8-12 Stunden erforderlich, wobei ein Quick-Wert von mindestens 50% anzustreben ist.
* Die Angabe bezieht sich auf normalgewichtige, erwachsene Patienten.
·Schwere Lebererkrankung, schwerer Leberschaden:Im Falle von Blutungen und vor chirurgischen Eingriffen sollte der Quick-Wert auf über 50% angehoben werden. In den meisten Fällen genügt eine Einzeldosis von 25-30 I.E./kg Körpergewicht zur Kontrolle akuter Blutungen und zur perioperativen Blutungsprophylaxe. Genügt eine Einzeldosis nicht, muss individuell aufgrund der Laborresultate und der Klinik weiterdosiert werden.
·Dosierung bei angeborenem Mangel der Faktoren II, VII, IX und/oder XZur Dosisberechnung können folgende Richtformeln benutzt werden:Für Faktor IX (falls kein Faktor IX-Präparat zur Verfügung steht - siehe «Indikationen»):Dosis (in I.E.) = erwünschte Steigerung des Plasmaspiegels (in %) × kg Körpergewicht × 1,2.Für Faktor II und X: Dosis (in I.E.) = erwünschte Steigerung des Plasmaspiegels (in %) × kg Körpergewicht × 0,6.Für Faktor VII (falls kein Faktor-VII-Präparat zur Verfügung steht - siehe «Indikationen»):Dosis (in I.E.) = erwünschte Steigerung des Plasmaspiegels (in %) × kg Körpergewicht × 0,5.
Richtwerte für den erforderlichen Faktor IX-Plasmaspiegel in verschiedenen Blutungssituationen sowie die durchschnittliche Dauer der Substitutionstherapie sind der nachstehenden Tabelle zu entnehmen. Diese Angaben dienen auch als Richtwerte für die Behandlung seltener, angeborener Faktor II-, Faktor VII- oder Faktor X-Mangelzustände.
Die im folgenden angegebenen Dosierungsintervalle haben sich in der Therapie des Faktor IX-Mangels bewährt und werden auch für die Therapie des Faktor II- und X-Mangels empfohlen. Bei Faktor VII-Mangel sind aufgrund der kurzen Halbwertszeit von Faktor VII von höchstens 6 Stunden entweder höhere Initialdosen oder kürzere Substitutionsintervalle zu wählen.
Zur Stillung leichter Blutungen ist im allgemeinen eine Einzelapplikation ausreichend. Gegebenenfalls ist nach 24 Stunden eine zweite Dosis zu verabreichen.
Bei schweren Blutungen ist die Substitutionstherapie bis zur Resorption der Gewebsblutung bzw. bis zur völligen Wundheilung fortzusetzen. Erfahrungsgemäss genügt zur Erhaltungstherapie eine Dosis von zwei Drittel der Initialdosis in 24-stündigen Abständen.
Zur perioperativen Blutungsprophylaxe sollte die präoperative Dosis etwa eine Stunde vor Operationsbeginn gegeben werden. Das durchschnittliche Behandlungsintervall beträgt gewöhnlich 12 Stunden, in der späteren postoperativen Periode sind im allgemeinen 24 Stunden ausreichend.
|
Richtwerte für den erforderlichen Faktor IX (FIX)-Plasmaspiegel und die Dauer der Substitutionstherapie in verschiedenen Blutungssituationen. Richtformel zur Berechnung der Dosis siehe oben. | |||
|
Blutungssituation |
Initial erforderlicher |
FIX-Plasma-Spiegel während der Erhaltungstherapie* |
Durchschnittliche Therapiedauer |
|
Leichte |
20% |
- |
Einmalige Gabe normalerweise ausreichend |
|
Mittelschwere |
40% |
20-40% |
3-4 Tage bzw. bis zum Abschluss der Wundheilung |
|
Lebensbedrohliche |
≥60% |
1. postoperative Woche: 40-60% |
10-14 Tage bzw. bis zum Abschluss der Wundheilung |
* in % der normalen FIX-Plasmaaktivität
Anwendung
Das Auflösen erfolgt wie im Abschnitt «Instruktionen zur Rekonstitution des Pulvers für die Injektionslösung» beschrieben (siehe «Hinweise für die Handhabung»). Prothromplex NF muss langsam intravenös verabreicht werden. Die Verabreichungsgeschwindigkeit sollte nicht mehr als 1 ml/min (25-30 IE/min) betragen.
Kontraindikationen
Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe.
Verbrauchskoagulopathie (disseminierte intravaskuläre Gerinnung, DIC) und/oder Hyperfibrinolyse. Bekannte Allergie gegen Heparin oder Fälle von Heparin-induzierter Thrombozytopenie.
Prothromplex NF darf zur Behandlung von lebensbedrohlichen Blutungen nur nach Unterbrechung dieser Prozesse durch geeignete Mittel verabreicht werden.
Warnhinweise und Vorsichtsmassnahmen
Es sollte ein Spezialist für Gerinnungsstörungen zu Rate gezogen werden (siehe Dosierung).
Patienten mit angeborenem Faktor II, VII, IX oder X-Mangel sollten nur dann mit Prothromplex NF behandelt werden, wenn keine Einzelfaktorkonzentrate zur Verfügung stehen.
Die Substitutionstherapie mit Prothrombinkomplex-Konzentraten vom Menschen, einschliesslich der Therapie mit Prothromplex NF, kann zur Bildung zirkulierender Antikörper, die einen oder mehrere Faktoren des Prothrombinkomplexes vom Menschen hemmen, führen. Bei Auftreten dieser Inhibitoren manifestiert sich der Zustand als unzureichende klinische Antwort. Wie bei jeder Therapie mit intravenös zu verabreichenden Plasmaderivaten können Überempfindlichkeitsreaktionen (wie Fieber, Urtikaria, Übelkeit, Erbrechen, Atemnot, Blutdruckabfall, Schock) auftreten.
Bei Auftreten von Überempfindlichkeitsreaktionen muss die Verabreichung sofort gestoppt werden. Leichtere Reaktionen können mit Antihistaminika beherrscht werden. Die Therapie schwerer hypotoner Reaktionen muss den Regeln der modernen Schocktherapie folgen.
Humane Plasma-Prothrombinkomplex-Konzentrate wurden, besonders bei wiederholter Verabreichung, mit einem erhöhten Risiko für disseminierte intravaskuläre Gerinnung (DIC), thromboembolischen Komplikationen und Myokardinfarkt, Schlaganfall und Lungenembolie in Verbindung gebracht.
Patienten, die mit humanem Plasma-Prothrombinkomplex-Konzentrat behandelt werden, sollten sorgfältig hinsichtlich Anzeichen einer Thrombose oder disseminierten intravaskulären Gerinnung überwacht werden.
Wegen des potentiellen Risikos thromboembolischer Komplikationen ist bei der Anwendung von humanem Plasma-Prothrombinkomplex-Konzentrat bei Patienten mit koronarer Herzkrankheit oder Myokardinfarkt, bei Patienten mit Lebererkrankungen, postoperativen Patienten, Neugeborenen oder bei Patienten, bei denen ein Risiko für Thrombose oder Verbrauchskoagulopathie besteht, Vorsicht geboten. In all diesen Fällen sollte der potentielle Nutzen einer Behandlung mit humanem Plasma-Prothrombinkomplex-Konzentrat gegenüber dem Risiko dieser Komplikationen abgewogen werden.
Bei Patienten, welche mit Vitamin K-Antagonisten behandelt werden, muss in Betracht gezogen werden, dass eine Neigung zur Hyperkoagulation bestehen kann, welche durch die Anwendung von Prothrombinkomplex verstärkt werden könnte.
Das Risiko kann bei der Behandlung eines isolierten Faktor VII-Mangels weiter erhöht sein, da dabei die anderen Vitamin K-abhängigen Gerinnungsfaktoren mit längeren Halbwertszeiten akkumulieren können, was zu beträchtlich erhöhten Normalwerten führen kann.
Da bei Verabreichung der maximalen Tagesdosis die Natriummenge von 200 mg überschritten werden kann, können Personen mit einer niedrigen Natriumdiät ungünstig beeinflusst werden.
Prothromplex NF wird aus humanem Plasma hergestellt. Standardmassnahmen zur Verhinderung von Infektionen, die sich durch den Einsatz von Arzneimitteln ergeben, die aus Blut oder Blutplasma hergestellt werden, schliessen die Auswahl der Spender und das Screening der einzelnen Spenden und Plasmapools auf spezifische Infektionsmarker sowie den Einsatz effektiver Schritte zur Inaktivierung/Entfernung von Viren im Herstellungsverfahren ein. Dennoch kann bei der Verabreichung von Arzneimitteln aus menschlichem Blut oder Blutplasma die Möglichkeit der Übertragung von Krankheitserregern nicht völlig ausgeschlossen werden. Dies gilt auch für bislang unbekannte oder neu aufgetretene Viren und andere Pathogene.
Die ergriffenen Sicherheitsmassnahmen werden als wirksam gegen umhüllte Viren wie z.B. HIV, HBV und HCV sowie gegen unbehüllte Viren wie Hepatitis A Virus (HAV) betrachtet.
Für Parvovirus B19 können die getroffenen Massnahmen von eingeschränktem Wert sein. Parvovirus B19 Infektionen können schwerwiegende Folgen für schwangere Frauen (fötale Infektion) und für Personen mit Immunmangelkrankheiten oder gesteigerter Erythropoese (z.B. hämolytische Anämie) haben.
Für Patienten, die regelmässig Präparate aus menschlichem Blut oder Plasma erhalten, wird grundsätzlich eine Impfung gegen Hepatitis A und Hepatitis B empfohlen.
Dieses Arzneimittel enthält 68 mg Natrium pro Durchstechflasche, entsprechend 3.4% der von der WHO für einen Erwachsenen empfohlenen maximalen täglichen Natriumaufnahme mit der Nahrung von 2 g.
Dieses Arzneimittel enthält Heparin. Heparin kann allergische Reaktionen hervorrufen und die Blutzellenzahl vermindern mit der Folge einer Blutgerinnungsstörung. Wenn bei Ihnen früher durch Heparin bedingte allergische Reaktionen aufgetreten sind, sollten Sie heparinhaltige Arzneimittel nicht anwenden.
Es wird empfohlen, bei jeder Verabreichung von Prothromplex NF an einen Patienten den Namen und die Chargennummer des Präparates zu dokumentieren, um einen Zusammenhang zwischen Patient und Produktcharge herzustellen.
Interaktionen
Die Wirkung von Vitamin K-Antagonisten wird reduziert.
Wechselwirkungen mit anderen Arzneimitteln:
Es wurden keine Interaktionsstudien durchgeführt.
Schwangerschaft, Stillzeit
Es liegen keine klinischen Daten zur Anwendung bei Schwangeren vor.
Daher darf das Medikament während der Schwangerschaft und in der Stillzeit nicht verabreicht werden, es sei denn, dies ist eindeutig erforderlich und der potentielle Nutzen übersteigt das Risiko.
Siehe «Warnhinweise und Vorsichtsmassnahmen» für Informationen zu Parvovirus B19 Infektionen.
In kontrollierten klinischen Studien wurden die Effekte von Prothromplex NF auf die Fertilität nicht ermittelt.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es gibt keinen Hinweis darauf, dass Prothromplex NF einen Einfluss auf die Fahrtüchtigkeit oder die Fähigkeit, Maschinen zu bedienen haben könnte.
Unerwünschte Wirkungen
Die im Folgenden aufgelisteten unerwünschten Wirkungen wurden aus der Post-Marketing-Erfahrung oder in einer klinischen Studie mit Prothromplex NF bei Patienten mit erworbenem Prothrombinkomplex Koagulationsfaktorenmangel (II, VII, IX, X) zur oralen Umkehrung der Antikoagulation ermittelt.
Die Häufigkeiten werden wie folgt definiert: «Sehr häufig» (≥1/10), «häufig» (<1/10, ≥1/100), «gelegentlich» (<1/100, ≥1/1000), «selten» (<1/1000, ≥1/10'000), «sehr selten» (<1/10'000), unbekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Erkrankungen des Blutes und des Lymphsystems
Häufig: Disseminierte intravaskuläre Gerinnung, Inhibitoren gegen einen oder mehrere Faktoren des Prothrombinkomplexes (Faktor II, VII, IX, X) *
* Entwicklung bei Patienten mit angeborenem Mangel an Faktoren
Erkrankungen des Immunsystems
Häufig: Anaphylaktischer Schock, anaphylaktische Reaktion, Überempfindlichkeitsreaktionen
Unbekannt: Angioödem
Erkrankungen des Nervensystems
Häufig: Schlaganfall, Kopfschmerz
Unbekannt: Lethargie, Paresthesie, Unruhe
Herzerkrankungen
Häufig: Akuter Myokardinfarkt, Tachykardie, Herzversagen
Gefässerkrankungen
Häufig: Venöse Thrombose, Arterielle thromboembolische Ereignisse, Hypotension, Hitzegefühl, Schock, Thrombophlebitis
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Häufig: Lungenembolie, Dyspnoe, Bronchospasmus
Erkrankungen des Gastrointestinaltrakts
Häufig: Übelkeit, Erbrechen
Erkrankungen der Haut und des Unterhautgewebes
Häufig: Urtikaria, erythematöser Hautausschlag, Pruritus
Erkrankungen der Nieren und Harnwege
Häufig: Nephrotische Syndrome
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Fieber, Reaktionen an der Infusionsstelle
Überempfindlichkeitsreaktionen können auftreten (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Die Substitutionstherapie mit Prothromplex NF kann zur Bildung zirkulierender Antikörper führen (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Bei der Behandlung mit Prothrombinkomplex-Konzentraten können thromboembolische Ereignisse auftreten, insbesondere nach Verabreichung von hohen Dosen und/oder bei thrombosegefährdeten Patienten.
Für Informationen zur Virussicherheit siehe «Warnhinweise und Vorsichtsmassnahmen».
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Fälle von Myokardinfarkt, Verbrauchskoagulopathie, venöser Thrombose und pulmonaler Embolie wurden mit der Gabe von hohen Dosen von humanem Plasma-Prothrombinkomplex-Konzentrat in Verbindung gebracht. Deshalb ist im Falle einer Überdosierung bei Patienten mit Risikofaktoren für diese Komplikationen die Entwicklung von thromboembolischen Ereignissen oder einer Verbrauchskoagulopathie erhöht.
Eigenschaften/Wirkungen
ATC-Code
B02BD01
Wirkungsmechanismus/Pharmakodynamik
Faktor II, IX und X sind Komponenten des intrinsischen Gerinnungssystems und Faktor VII ist eine Komponente des extrinsischen Systems. Sie werden in der Leber auf einem Vitamin-K-abhängigen Weg synthetisiert. Zusammen bilden sie den Prothrombinkomplex. Bei einem Mangel an einem oder mehreren dieser Faktoren ist die Blutgerinnung gestört und eine geeignete Substitutionstherapie erforderlich.
Klinische Wirksamkeit
Keine Angaben.
Pharmakokinetik
Die Plasmahalbwertszeit von Faktor II beträgt 40 – 60 Stunden, von Faktor VII höchstens 6 Stunden, von Faktor IX 16 – 30 Stunden und von Faktor X 30 – 60 Stunden.
Präklinische Daten
Die humanen Plasma-Prothrombinkomplex-Faktoren (die im Konzentrat enthalten sind) sind normale Bestandteile des menschlichen Plasmas und verhalten sich wie die endogenen Faktoren. Aussagekräftige Tierstudien zur akuten und chronischen Toxizität sind nicht durchführbar. Toxizitätsstudien mit einmaliger Verabreichung belegen nur die bei der Anwendung am Menschen zu erwartenden Effekte einer Überdosierung und sind deshalb von beschränkter Relevanz.
Toxizitätsstudien bei Tieren mit mehrmaliger Verabreichung sind wegen der Interferenz mit sich entwickelnden Antikörpern gegen heterologes Protein nicht durchführbar. Da die klinische Erfahrung keinen Hinweis auf tumorigene und mutagene Wirkungen der humanen Plasma-Prothrombinkomplex-Faktoren gibt, wurden experimentelle Untersuchungen, insbesondere bei heterologen Spezies, nicht als notwendig angesehen.
Sonstige Hinweise
Inkompatibilitäten
Um die Wirksamkeit und Verträglichkeit des Präparates nicht zu beeinträchtigen, darf Prothromplex NF, wie alle anderen Faktorenkonzentrate, vor der Verabreichung nicht mit anderen Arzneimitteln gemischt und nicht in Infusionslösungen verdünnt werden. Gegebenenfalls empfiehlt es sich, einen gemeinsamen venösen Zugang vor und nach der Anwendung von Prothromplex NF mit physiologischer Kochsalzlösung zu spülen.
Beeinflussung diagnostischer Methoden
Nach Anwendung hoher Dosen Prothromplex NF ist bei der Durchführung heparinempfindlicher Gerinnungsanalysen das mit dem Präparat zugeführte Heparin zu berücksichtigen. Ein Heparineffekt auf Gerinnungstests kann gegebenenfalls mit Hilfe von Protaminsulfat oder anderen erhältlichen Reagenzien in vitro neutralisiert werden.
Haltbarkeit
Das Medikament darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Im Kühlschrank (2 – 8 °C) lagern. Nicht einfrieren.
In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
Arzneimittel für Kinder unerreichbar aufbewahren.
Innerhalb der Haltbarkeitsdauer (2 – 8 °C) darf das Produkt vor Gebrauch einmalig bis zu 6 Monate bei Raumtemperatur (15 – 25 °C) gelagert werden. In diesem Falle sollte das Ende dieser 6-Monatsfrist als neues Verfalldatum auf der Verpackung vermerkt werden. Nach der Lagerung bei 15 – 25 °C darf das Präparat nicht erneut bei 2 – 8 °C gelagert werden und ist entweder zu verbrauchen oder zu entsorgen.
Hinweise für die Handhabung
Das Präparat darf nach der Rekonstitution nicht wieder im Kühlschrank gelagert werden. Die chemische und physikalische Stabilität der gebrauchsfertigen Lösung wurde für 3 Stunden bei 20 - 25 °C belegt. Aus mikrobiologischer Sicht, ausser wenn die Rekonstitution unter kontrollierten und validierten aseptischen Bedingungen erfolgte, soll Prothromplex NF nach der Rekonstitution unmittelbar verwendet werden, da die Zubereitung kein Konservierungsmittel enthält. Falls dies nicht möglich ist, liegen Aufbrauchfristen und Lagerbedingungen in der Verantwortung des Anwenders. Das rekonstituierte Produkt soll vor der Verabreichung visuell auf Partikel und Trübungen untersucht werden. Lösungen, die trübe sind oder einen Niederschlag aufweisen, dürfen nicht verwendet werden. Nicht verwendete Lösung sowie Abfallmaterial sind sachgemäss zu entsorgen.
Generelle Instruktionen
·Nur das beigelegte Rekonstitutions-Set für die Rekonstitution verwenden.
·Das Haltbarkeitsdatum prüfen und sicherstellen, dass Prothromplex NF Pulver und das Wasser für Injektionszwecke (Lösungsmittel) vor der Zubereitung Raumtemperatur haben. Nicht nach Ablauf des auf der Etikette und der Faltschachtel angegebenen Haltbarkeitsdatums verwenden.
·Antiseptische Technik anwenden (saubere und keimarme Bedingungen) und eine flache Arbeitsoberfläche bei der Rekonstitution wählen. Hände waschen und saubere Untersuchungshandschuhe anziehen (die Verwendung von Handschuhen ist optional).
·Das ungeöffnete Fläschchen mit dem Lösungsmittel (Wasser für Injektionszwecke) auf Raum- oder Körpertemperatur (maximal 37 °C) erwärmen.
·Prothromplex NF ist unmittelbar vor Verabreichung zu rekonstituieren. Die Lösung ist klar oder leicht opaleszent. Trübe Lösungen oder solche, die Partikel enthalten nicht verwenden.
Instruktionen zur Rekonstitution des Pulvers für die Injektionslösung
|
|
Schritte |
Beispielbild | |
|
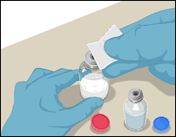
1 |
·Die Schutzkappen von den Durchstechflaschen entfernen. |
|
|
|
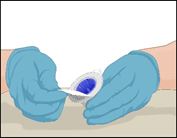
2 |
·Jeden Stopfen mit einem separaten, sterilen Alkoholtupfer (oder einer anderen geeigneten sterilen Lösung) desinfizieren. Dazu den Stopfen mehrere Sekunden lang abwischen. |
|
|
|
3 |
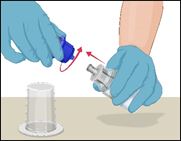
·Die Verpackung des Mix2Vial-Sets öffnen durch vollständiges Abziehen der Abdeckung. Dabei nicht das Innere der Packung berühren. |
|
|
|
4 |
·Die Packung mit dem Mix2Vial-Set umdrehen und kopfüber auf die Lösungsmittelflasche setzen. |
|
|
|
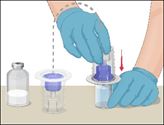
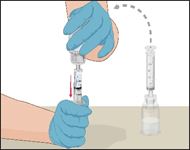
5 |
·Um die beiden Durchstechflaschen miteinander zu verbinden, die Lösungsmittelflasche umdrehen und oben auf die Durchstechflasche mit dem Prothromplex NF-Pulver aufsetzen. |
|
|
|
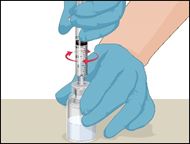
6 |
·Die miteinander verbundenen Durchstechflaschen vorsichtig und stetig schwenken oder das rekonstituierte Arzneimittel 5 Minuten stehen lassen und dann vorsichtig schwenken, damit sich das Pulver vollständig auflöst. |
|
|
|
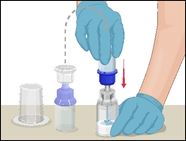
7 |
·Die beiden Seiten des Mix2Vial voneinander trennen. Dazu mit der einen Hand die durchsichtige Kunststoffseite des Mix2Vial-Sets, die mit der Durchstechflasche mit Prothromplex NF verbunden ist, und mit der anderen Hand die blaue Kunststoffseite des Mix2Vial-Sets mit der nun leeren Lösungsmittelflasche greifen. |
|
|
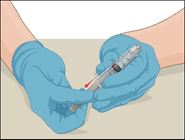
|
8 |
·Den Kolben einer leeren, sterilen Kunststoff-Einwegspritze zurückziehen und so Luft aufziehen. |
|
|
|
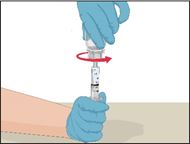
9 |
·Die Spritze auf den durchsichtigen Kunststoffteil an der weiterhin aufrecht stehenden Durchstechflasche mit dem rekonstituierten Prothromplex NF aufsetzen und im Uhrzeigersinn drehen. |
|
|
|
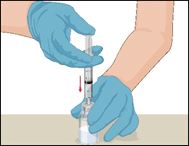
10 |
·Die Durchstechflasche mit einer Hand halten und mit der anderen Hand die gesamte Luft aus der Spritze in die Durchstechflasche drücken. |
|
|
|
11 |
·Die Spritze mit der aufgesetzten Prothromplex NF-Durchstechflasche umdrehen, sodass die Durchstechflasche nun oben ist. Darauf achten, dass dabei der Kolben der Spritze eingedrückt bleibt. Nun die Prothromplex NF-Lösung durch langsames Zurückziehen des Kolbens in die Spritze aufziehen. |
|
|
|
12 |
·Wenn Sie zur Infusion bereit sind, die Spritze durch Drehen entgegen dem Uhrzeigersinn abnehmen. Den Inhalt der Spritze visuell auf Schwebeteilchen überprüfen; die Lösung sollte klar und leicht opaleszent sein. |
|
|
Instruktionen für die Verabreichung
Überprüfen Sie die zubereitete Lösung in der Spritze vor der Anwendung auf Partikel und Verfärbungen (die Lösung sollte klar, farblos und partikelfrei sein). Es ist nicht unüblich, dass einige wenige Flocken nach der Rekonstitution in der Durchstechflasche mit dem Produkt verbleiben. Der Filter im Mix2Vial-Transferset entfernt diese Partikel vollständig. Die Filtrierung beeinflusst die Dosisberechnung nicht. Die Lösung in der Spritze sollte nicht verwendet werden, wenn sie trüb ist oder Flocken oder Partikel enthält nach der Filtration.
1.An einer Spritze mit der Prothromplex NF-Lösung eine Kanüle befestigen, vorzugsweise ein Infusionsset mit Flügeln (Butterfly). Die Kanüle nach oben richten und etwaige Luftbläschen entfernen, indem Sie mit dem Finger sanft an die Spritze klopfen und dann die Luft langsam und vorsichtig aus der Spritze und der Kanüle drücken.
2.Einen Venenstauschlauch am Arm anbringen und die Infusionsstelle durch sorgfältiges Reinigen mit einem sterilen Alkoholtupfer (oder einer anderen geeigneten sterilen Lösung) vorbereiten.
3.Die Kanüle in die Vene einführen und den Venenstauschlauch abnehmen. Prothromplex NF langsam, mit einer Geschwindigkeit bis höchstens 1 ml pro Minute, infundieren. Die leere Spritze abnehmen.Hinweis: Die Butterfly-Nadel erst entfernen, wenn alle Spritzen injiziert wurden. Den Anschluss zwischen Kanüle und Spritze nicht berühren.
4.Die Kanüle aus der Vene ziehen und mithilfe eines sterilen Tupfers mehrere Minuten lang Druck auf die Infusionsstelle ausüben.
Die Kappe nicht wieder auf die Nadel aufsetzen. Nadel, Spritze und alle leeren Durchstechflaschen zur korrekten Entsorgung in einen durchschlagsicheren Behälter geben. Diese Gegenstände nicht im normalen Hausmüll entsorgen.
Zulassungsnummer
41330 (Swissmedic)
Packungen
Jede Packung Prothromplex NF 500 enthält: 1 Durchstechflasche mit Pulver zur Herstellung einer Injektionslösung (i.v.), 1 Durchstechflasche Lösungsmittel (Wasser für Injektionszwecke Ph. Eur.) zum Auflösen und 1 Mix2Vial.
Prothromplex NF 500:
Pulver mit 375 – 708 I.E. Faktor II, 417 I.E. Faktor VII, 500 I.E. Faktor IX und 500 I.E. Faktor X und 17 ml Wasser für Injektionszwecke
Abgabekategorie: B
Zulassungsinhaberin
Takeda Pharma AG, 8152 Opfikon
Stand der Information
September 2023