Zusammensetzung
Wirkstoffe
Octreotidum* ut Octreotidi acetas.
Hilfsstoffe
Copoly (DL-lactidum-glycolidum), Mannitolum.
Lösungsmittel: Carboxymethylcellulosum natricum (entspricht 1,512 mg Natrium/ml); Mannitolum, Poloxamer 188, Aqua ad iniectabilia.
*INN rec.
Indikationen/Anwendungsmöglichkeiten
Akromegalie
Behandlung von Patienten mit Akromegalie, bei denen eine chirurgische Behandlung oder Radiotherapie ungeeignet oder nicht wirksam ist, oder zur Überbrückung, bis die Radiotherapie ihre volle Wirkung zeigt.
Tumoren des gastroenteropankreatischen endokrinen (GEP)-Systems
Behandlung von Patienten mit Symptomen von funktionellen, gastroenteropankreatischen endokrinen Tumoren
·Karzinoide mit den Merkmalen des Karzinoidsyndroms,
·VIPome,
·Glukagonome,
·Gastrinome/Zollinger-Ellison-Syndrom,
·Insulinome, zur präoperativen Beherrschung der Hypoglykämie und zur Erhaltungstherapie,
·GRFome.
Behandlung von Patienten mit fortgeschrittenen, gut differenzierten (G1, G2) neuroendokrinen Tumoren des Mitteldarms (Dünndarm, Zökum oder Appendix).
Dosierung/Anwendung
Sandostatin LAR darf nur über eine tiefe intragluteale Injektion verabreicht werden. Die Injektionsstelle für die wiederholten intraglutealen Injektionen ist zwischen dem linken und rechten Gesässmuskel abzuwechseln (siehe «Hinweise für die Handhabung - Anleitung zur i.m. Injektion von Sandostatin LAR»).
Um eine korrekte Dosierung sicherzustellen, muss das Sandostatin LAR-Injektionskit vor der Rekonstitution auf Raumtemperatur erwärmt werden (siehe «Sonstige Hinweise», Abschnitt «Hinweise für die Handhabung»).
Akromegalie
Die Behandlung sollte mit einer Dosis von 20 mg Sandostatin LAR in vierwöchigen Intervallen während 3 Monaten eingeleitet werden. Allfällige nachfolgende Dosisanpassungen sollten entsprechend der Serumspiegel des Wachstumshormons (GH) und des Somatomedin C (IGF-1) sowie der klinischen Symptome gemäss der untenstehenden Empfehlungen erfolgen.
Patienten unter einer Behandlung mit subkutan appliziertem Octreotid können mit der Behandlung mit Sandostatin LAR am Tag nach der letzten Sandostatin s.c.-Verabreichung beginnen.
·Bei Patienten, bei denen die klinischen Symptome und Laborwerte (GH; IGF-1) innerhalb dieser 3 Monate nicht vollständig unter Kontrolle gebracht werden (GH-Werte noch immer über 2.5 µg/l), kann die Dosis auf 30 mg in vierwöchigen Intervallen gesteigert werden.
·Bei Patienten, deren GH-Spiegel konstant unter 1 µg/l liegen, deren IGF-1-Serumspiegel sich normalisierten und bei denen die meisten reversiblen Zeichen einer Akromegalie nach dreimonatiger Behandlung mit 20 mg verschwunden sind, kann die Dosis auf 10 mg Sandostatin LAR reduziert werden. Unter dieser niedrigen Sandostatin LAR-Dosierung empfiehlt es sich indessen, die GH- und IGF-1-Serumspiegel sowie die klinischen Symptome sorgfältig zu überwachen.
·Bei Patienten, die mit einer stets gleichen Dosis von Sandostatin LAR behandelt werden, sollte alle 6 Monate eine Kontrolle des GH und IGF-1 vorgenommen werden.
Tumoren des gastroenteropankreatischen endokrinen Systems
Funktionelle Tumore des gastroenteropankreatischen neuroendokrinen Systems oder des Mitteldarms (Karzinoide, VIPome)
Die Behandlung sollte mit 20 mg Sandostatin LAR in vierwöchigen Abständen eingeleitet werden. Bei Patienten, welche bereits mit subkutan appliziertem Octreotid behandelt werden, sollte bis 2 Wochen nach der ersten Injektion von Sandostatin LAR zusätzlich die zuvor wirksame Dosierung von Octreotid s.c. fortgesetzt werden.
·Bei Patienten, bei denen Symptome und biologische Marker nach dreimonatiger Behandlung ausreichend unter Kontrolle gebracht werden konnten, kann die Dosis anschliessend auf 10 mg Sandostatin LAR in vierwöchigen Abständen reduziert werden.
·Bei Patienten, bei denen die Symptome nach dreimonatiger Behandlung nur teilweise unter Kontrolle gebracht werden konnten, kann die Dosis anschliessend auf 30 mg Sandostatin LAR in vierwöchigen Abständen erhöht werden.
An einigen Tagen können unter der Behandlung mit Sandostatin LAR die mit Tumoren des gastroenteropankreatischen Systems einhergehenden Symptome verstärkt auftreten. An diesen Tagen wird die zusätzliche Verabreichung von Octreotid s.c. in jener Dosis, die vor der Behandlung mit Sandostatin LAR gebraucht wurde, empfohlen. Dies kann vor allem in den ersten 2 Monaten der Behandlung notwendig werden, bis therapeutische Octreotid-Spiegel erreicht werden.
Neuroendokrine Tumore des Mitteldarms
Die empfohlene Dosis von Sandostatin LAR beträgt 30 mg in vierwöchigen Abständen. Bei fehlender Tumorprogression sollte die Behandlung mit Sandostatin LAR zur Kontrolle des Tumors fortgesetzt werden.
Spezielle Dosierungsanweisungen
Ältere Patienten
Eine spezielle Dosierung bei älteren Patienten zu Beginn einer Therapie mit Sandostatin oder Sandostatin LAR ist nicht erforderlich.
Kinder und Jugendliche
Über die Anwendung von Sandostatin LAR bei Patienten unter 18 Jahren liegen keine Erfahrungen vor.
Patienten mit Nierenfunktionsstörungen
Eine Dosisanpassung ist nicht erforderlich (siehe «Pharmakokinetik»).
Patienten mit Leberfunktionsstörungen
Die Elimination von Octreotid kann bei Patienten mit Leberzirrhose herabgesetzt sein. Infolge der grossen therapeutischen Breite von Octreotid ist bei Patienten mit Leberzirrhose keine Dosisanpassung erforderlich.
Kontraindikationen
Bekannte Überempfindlichkeit gegenüber Octreotid oder einem der Hilfsstoffe.
Warnhinweise und Vorsichtsmassnahmen
Allgemein
Da GH-sezernierende Hypophysentumoren manchmal expandieren und dadurch schwerwiegende Komplikationen verursachen können (z.B. Einengung des Gesichtsfeldes), ist eine sorgfältige Überwachung der Patienten nötig. Sobald Anzeichen einer Tumorexpansion auftreten, sind alternative Behandlungsmethoden zu erwägen.
Glukosemetabolismus
Bei Patienten mit insulinpflichtigen Diabetes mellitus Typ I kann Sandostatin LAR die Glukoseregulierung beeinflussen, und der Insulinbedarf kann vermindert sein. Über Hypoglykämien wurde berichtet.
Bei Nicht-Diabetikern und Typ-II-Diabetikern mit partiell intakten Insulinreserven kann die Verabreichung von Sandostatin s.c. zu einem postprandialen Blutzuckeranstieg führen. Es wird daher empfohlen, den Blutzuckerspiegel zu überwachen und ggf. die antidiabetische Therapie anzupassen.
Patienten mit Insulinomen: Da Octreotid die Sekretion von Wachstumshormon und Glukagon stärker hemmt als jene von Insulin und die Insulinsekretion kurzfristiger hemmt, können bei solchen Patienten Intensität und Dauer einer Hypoglykämie verstärkt sein. Diese Patienten sollten daher engmaschig überwacht werden.
Erkrankungen der Gallenwege
Somatostatin-Analoga hemmen die Kontraktilität der Gallenblase und verringern die Gallensekretion, was zu Anomalien der Gallenblase, zur Gallengriessbildung (Sludge) oder zur Bildung von Gallensteinen führen kann. Die Inzidenz einer Cholelithiasis wird unter Behandlung mit Sandostatin s.c. auf 15-30% geschätzt, im Vergleich zu einer Inzidenz von 5-20% in der Allgemeinbevölkerung. Langzeitdaten für Sandostatin LAR bei Patienten mit Akromegalie oder Tumoren des gastroenteropankreatischen endokrinen Systems deuten darauf hin, dass die Behandlung mit Sandostatin LAR im Vergleich zu Sandostatin s.c. nicht häufiger zu einer Gallensteinbildung führt. Wenn Gallensteine auftreten, sind sie meist asymptomatisch.
Darüber hinaus wurde unter Anwendung von Sandostatin auch über eine Dilatation der Gallenwege sowie über Fälle einer Cholezystitis oder Cholangitis (als Komplikation der Cholelithiasis) berichtet. Daher wird vor Therapiebeginn sowie während der Behandlung mit Sandostatin LAR in 6-12monatigen Intervallen eine sonographische Untersuchung der Gallenblase empfohlen.
Pankreatitis
In sehr seltenen Fällen wurde über eine akute Pankreatitis berichtet. Im Allgemeinen tritt diese innerhalb der ersten Stunden oder Tage einer Sandostatin-Behandlung auf und bildet sich nach Absetzen des Arzneimittels zurück. Ausserdem wurde bei Patienten unter einer Langzeitbehandlung mit Sandostatin über eine «cholelithiasis-induzierte» Pankreatitis berichtet.
Kardiovaskuläre unerwünschte Wirkungen
Eine Bradykardie ist eine häufige unerwünschte Wirkung bei der Behandlung mit Somatostatin-Analoga. Eine Dosisanpassung von Arzneimitteln wie Betablockern, Calciumkanalblockern oder Arzneimitteln zur Kontrolle des Elektrolyt- und Flüssigkeitshaushaltes kann erforderlich sein.
Ausserdem wurden EKG-Veränderungen wie QT-Verlängerung, Achsenverschiebung, frühe Repolarisation, niedrige elektrische Spannung, R/S-Übertragung, frühe R-Wellenfortbewegung und nicht-spezifische ST-T-Wellenveränderungen beobachtet. Der Zusammenhang dieser Ereignisse mit Octreotid wurde nicht eindeutig nachgewiesen, da viele dieser Patienten an einer zugrundeliegenden Herzerkrankung litten.
Nach Markteinführung wurde über Überempfindlichkeit und allergische Reaktionen berichtet. Diese gingen hauptsächlich mit Hautreaktionen einher, selten waren Mund und/oder Atemwege betroffen. Über isolierte Fälle von anaphylaktischem Schock wurde berichtet.
Sonstige Vorsichtsmassnahmen
Tiefere Vitamin B12-Blutspiegel und abnorme Werte beim Schilling-Test wurden bei einigen Patienten unter Behandlung mit Octreotrid beobachtet. Bei Patienten mit einem Vitamin B12-Mangel in der Anamnese wird empfohlen, während der Behandlung mit Sandostatin LAR den Vitamin B12-Spiegel zu überwachen.
Bei Patienten unter Langzeitbehandlung mit Octreotid sollte die Schilddrüsenfunktion überwacht werden.
Octreotid kann bei einigen Patienten die Aufnahme der Nahrungsfette verändern. Insbesondere kann die Fettausscheidung im Stuhl erhöht sein. Es gibt jedoch selbst bei Langzeitbehandlung mit Octreotid keine Hinweise auf ein durch Malabsorption verursachtes Ernährungsdefizit.
Durch den therapeutischen Nutzen einer Senkung der GH («Growth hormone»)-Spiegel und die Normalisierung der IGF-1 («Insulin-like growth factor»)-Konzentration bei akromegalen Patientinnen kann möglicherweise die Fertilität wiedererlangt werden. Falls angezeigt sollten Patientinnen im gebährfähigen Alter angewiesen werden, während einer Octreotid-Behandlung geeignete kontrazeptive Massnahmen anzuwenden (s. «Schwangerschaft, Stillzeit»).
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Dosiervolumen, d.h. es ist nahezu «natriumfrei».
Interaktionen
Pharmakokinetische Interaktionen
Octreotid vermindert die intestinale Resorption von Ciclosporin und verzögert jene von Cimetidin.
Die gleichzeitige Verabreichung von Octreotid und Bromocriptin erhöht die Bioverfügbarkeit von Bromocriptin.
Eine begrenzte Zahl publizierter Daten deutet darauf hin, dass Somatostatin-Analoga die metabolische Clearance von Substanzen verringern könnten, die durch Cytochrom P450-Enzyme metabolisiert werden. Dies wird der Suppression von Wachstumshormonen zugeschrieben. Da nicht ausgeschlossen werden kann, dass Octreotid diesen Effekt ebenfalls hat, sollten andere Präparate, die hauptsächlich durch CYP3A4 metabolisiert werden und die eine geringe therapeutische Breite haben (z.B. Chinidin, Terfenadin), mit Vorsicht angewendet werden.
Pharmakodynamische Interaktionen
Eine Dosisanpassung von Arzneimitteln wie Betablockern, Calciumkanalblockern oder Arzneimitteln zur Kontrolle des Flüssigkeits- und Elektrolytgleichgewichts kann bei gleichzeitiger Anwendung mit Sandostatin LAR notwendig sein (s. «Warnhinweise und Vorsichtsmassnahmen»).
Dosisanpassungen von Insulin und Antidiabetika können erforderlich sein, wenn gleichzeitig Sandostatin LAR verabreicht wird (s. «Warnhinweise und Vorsichtsmassnahmen»).
Gleichzeitige Anwendung von an Somatostatin-Analoga gekoppelten Radiotherapeutika (sogenannten Peptid-Radio-Rezeptor-Therapeutika, PRRT)
Somatostatin und seine Analoga, wie z.B. Octreotid, binden kompetitiv an Somatostatin-Rezeptoren und können die Wirksamkeit entsprechender Radiotherapeutika (wie z.B. 177Lu)-Oxodotreotid) beeinträchtigen. Die Verabreichung von Sandostatin LAR als langwirksamem Somatostatin-Analogon muss daher 4-6 Wochen vor Beginn der Behandlung mit einem PRRT unterbrochen werden. Falls erforderlich, können Patienten bis spätestens 24 Stunden vor der Verabreichung des PRRT mit kurzwirksamen Somatostatin-Analoga behandelt werden.
Innerhalb von 4 bis 24 Stunden nach Verabreichung des PRRT kann die Behandlung mit Sandostatin LAR fortgeführt werden, muss aber 4-6 Wochen vor der nächsten Verabreichung des Radiotherapeutikums wieder unterbrochen werden.
Schwangerschaft, Stillzeit
Schwangerschaft
Tierexperimentelle Untersuchungen mit Octreotid zeigten keine toxikologischen Auswirkungen von Octreotid auf die Reproduktion, abgesehen von einer vorübergehenden Wachstumsverzögerung der Nachkommen (s. «Präklinische Daten»).
Es gibt keine adäquaten und gut kontrollierten Studien bei schwangeren Frauen. Nach Markteinführung wurde über eine begrenzte Anzahl von akromegalen Patientinnen berichtet, die schwanger waren und Octreotid erhielten; bei der Hälfte dieser Fälle ist jedoch der Ausgang der Schwangerschaft nicht bekannt. Die meisten Patientinnen erhielten Octreotid während des ersten Trimenons der Schwangerschaft in einem Dosisbereich von 100 bis 300 µg/Tag Sandostatin s.c oder von 20 bis 30 mg/Monat Sandostatin LAR. Bei ungefähr zwei Dritteln der Fälle mit bekanntem Schwangerschaftsausgang wählten die Frauen eine Weiterführung der Octreotid-Behandlung während ihrer Schwangerschaft. In den meisten Fällen mit bekanntem Ausgang wurde über unauffällige Neugeborene berichtet, jedoch auch über einige Spontanaborte während des ersten Trimenons. Kongenitale Anomalien oder Malformationen wurden nicht beobachtet.
Sandostatin LAR soll nicht bei schwangeren Frauen angewendet werden, es sei denn, dies ist absolut notwendig.
Stillzeit
Es ist nicht bekannt, ob Octreotid in die menschliche Muttermilch ausgeschieden wird. Untersuchungen am Tier haben eine Ausscheidung von Octreotid in die Muttermilch gezeigt. Patientinnen sollten während einer Behandlung mit Sandostatin LAR nicht stillen.
Fertilität
Es ist nicht bekannt, ob Octreotid Auswirkungen auf die menschliche Fertilität hat. Octreotid in Dosen bis zu 1 mg/kg/Tag beeinträchtigte die Fertilität bei männlichen und weiblichen Ratten nicht (s. «Präklinische Daten»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Über den Einfluss von Sandostatin LAR auf die Fahrtüchtigkeit und auf die Fähigkeit, Maschinen zu bedienen, liegen keine Erfahrungen vor.
Unerwünschte Wirkungen
Die in klinischen Studien nach Gabe von Octreotid am häufigsten berichteten unerwünschten Wirkungen waren Diarrhoe, Bauchschmerzen, Übelkeit, Blähungen, Kopfschmerzen, Cholelithiasis, Hyperglykämie und Obstipation.
Andere häufig berichtete unerwünschte Wirkungen waren Schwindel, lokalisierter Schmerz, Gallengriess, Funktionsstörung der Schilddrüse (z.B. vermindertes TSH, vermindertes Gesamt-T4 und vermindertes Freies-T4), Stuhlabgänge, eingeschränkte Glukosetoleranz, Erbrechen, Asthenie und Hypoglykämie.
Erkrankungen des Gastrointestinaltrakts und Ernährung
In seltenen Fällen können die gastrointestinalen Nebenwirkungen dem Bild eines akuten Darmverschlusses mit zunehmender abdominaler Blähung, schweren epigastrischen Schmerzen und schmerzhafter Bauchdeckenabwehrspannung ähneln.
Reaktionen an der Injektionsstelle:
Reaktionen an der Injektionsstelle sind Schmerzen, Rötung, Blutung, Juckreiz, Schwellung oder Verhärtung, die bei Patienten berichtet wurden, die Sandostatin LAR erhielten. Diese Ereignisse erforderten jedoch in den meisten Fällen keine klinische Intervention.
Thrombozytopenie
Nach der Markteinführung wurde über Fälle einer Thrombozytopenie berichtet, speziell während der Behandlung mit Sandostatin (i.v.) bei Patienten mit Leberzirrhose und während der Behandlung mit Sandostatin LAR. Die Thrombozytopenie war nach Absetzen der Behandlung reversibel.
Nachfolgend sind die unerwünschten Wirkungen, welche in den klinischen Studien oder während der Marktüberwachung unter der Anwendung von Octreotid beobachtet wurden, nach MedDRA- Organklassensystem und Häufigkeit aufgelistet. Für die Häufigkeiten gilt dabei folgende Konvention: sehr häufig (≥1/10); häufig (≥1/100, <1/10); gelegentlich (≥1/1'000, <1/100); selten (≥1/10'000, <1/1'000); sehr selten (<1/10'000); nicht bekannt (basierend überwiegend auf Spontanmeldungen aus der Marktüberwachung, genaue Häufigkeit kann nicht abgeschätzt werden).
Erkrankungen des Blutes und des Lymphsystems
Nicht bekannt: Thrombozytopenie.
Erkrankungen des Immunsystems
Nicht bekannt: Überempfindlichkeitsreaktionen einschliesslich anaphylaktischer Reaktionen.
Endokrine Erkrankungen
Häufig: Hypothyreose, Funktionsstörung der Schilddrüse (z.B. vermindertes TSH, vermindertes Gesamt-T4 und vermindertes Freies-T4).
Stoffwechsel und Ernährungsstörungen
Sehr häufig: Hyperglykämie (10.8%).
Häufig: Hypoglykämie, eingeschränkte Glukosetoleranz, Anorexie.
Gelegentlich: Dehydration.
Erkrankungen des Nervensystem
Sehr häufig: Kopfschmerzen (12.4%).
Häufig: Schwindel.
Herzerkrankungen
Häufig: Bradykardie.
Gelegentlich: Tachykardie.
Nicht bekannt: Arrhythmien.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Häufig: Dyspnoe.
Erkrankungen des Gastrointestinaltrakts
Sehr häufig: Diarrhoe (26.1%), Bauchschmerzen (24.2%), Übelkeit (14.3%), Flatulenz (14.2%), Obstipation (12.7%).
Häufig: Dyspepsie, Erbrechen, abdominelle Distension, Steatorrhoe, Verfärbung der Fäzes.
Nicht bekannt: akute Pankreatitis.
Affektionen der Leber und Gallenblase
Sehr häufig: Cholelithiasis (12.0%).
Häufig: erhöhte Transaminasen, Hyperbilirubinämie, Cholezystitis.
Nicht bekannt: Alkalische Phosphatase im Blut erhöht, Gammaglutamyltransferase erhöht, Ikterus, Cholestase, cholestatischer Ikterus, cholestatische Hepatitis, akute Hepatitis ohne Cholestase.
Erkrankungen der Haut und des Unterhautzellgewebes
Häufig: Pruritus, Hautausschlag, Alopezie.
Nicht bekannt: Urtikaria.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Sehr häufig: Reaktionen an der Injektionsstelle (10-30%, je nach Dosis und Injektionsintervall, z.B. Schmerzen, Parästhesien, Erythem).
Häufig: Asthenie.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Symptomatik
Über eine begrenzte Anzahl versehentlicher Überdosierungen von Sandostatin LAR wurde berichtet. Die Dosen reichten von 100 mg bis 163 mg/Monat Sandostatin LAR. Die einzige gemeldete unerwünschte Wirkung war Hitzewallungen.
Über Krebspatienten, die Sandostatin LAR-Dosen von bis zu 60 mg pro Monat und bis zu 90 mg pro 2 Wochen erhielten, wurde berichtet. Diese Dosen wurden im Allgemeinen gut vertragen, wobei über die folgenden unerwünschten Wirkungen berichtet wurde: häufiges Wasserlassen, Ermüdung, Depression, Ängstlichkeit, Konzentrationsmangel.
Behandlung
Die Behandlung einer Überdosierung mit Sandostatin LAR ist symptomatisch.
Eigenschaften/Wirkungen
ATC-Code
H01CB02
Wirkungsmechanismus
Octreotid ist ein synthetisches Octapeptid-Derivat des natürlichen Somatostatins mit qualitativ gleichartigen pharmakologischen Wirkungen, jedoch mit einer wesentlich längeren Wirkungsdauer. Es hemmt die pathologisch erhöhte Sekretion von Wachstumshormon (GH) und von Peptiden und Serotonin, die im gastroenteropankreatischen (GEP) endokrinen System gebildet werden.
Beim Tier hemmt Octreotid die Freisetzung von Wachstumshormon, Glukagon und Insulin stärker als Somatostatin. Es besitzt zudem eine grössere Selektivität für die Unterdrückung von Wachstumshormon und von Glukagon.
An gesunden Versuchspersonen wurden mit Octreotid, wie mit Somatostatin, die folgenden Wirkungen nachgewiesen:
·Hemmung der auf verschiedene Weise (Arginin, Anstrengung, Insulin-induzierte Hypoglykämie) stimulierten Wachstumshormon-Freisetzung.
·Hemmung der postprandialen Freisetzung von Insulin, Glukagon, Gastrin und anderen Peptiden des GEP-Systems sowie Hemmung der durch Arginin stimulierten Insulin- und Glukagon-Sekretion.
·Hemmung der durch Protirelin (TRH thyrotropin releasing hormone) induzierten Freisetzung von TSH (thyroid stimulating hormone).
Im Gegensatz zu Somatostatin hemmt Octreotid das Wachstumshormon vorzugsweise über Insulin, und nach seiner Verabreichung kommt es zu keiner Rebound-Hypersekretion von Hormonen (z.B. GH bei akromegalen Patienten).
Pharmakodynamik
Klinische Wirksamkeit
Akromegalie
Sandostatin LAR liefert konstante und therapeutisch wirksame Octreotid-Serumspiegel, was zu einer konstanten GH-Senkung und Normalisierung der IGF-1-Serumspiegel führt. Bei den meisten Patienten bessert Sandostatin LAR die klinischen Krankheitssymptome wie Kopfschmerzen, Schwitzen, Parästhesien, Müdigkeit, Osteoarthralgien und Karpaltunnelsyndrom markant.
Auch wenn unter Therapie mit Somatostatin-Analoga bei einem Teil der Patienten mit einer Abnahme der Tumorgrösse gerechnet werden kann, müssen alle Patienten unter dieser Therapie regelmässig überwacht werden (s. «Warnhinweise und Vorsichtsmassnahmen»).
Bei zuvor unbehandelten Akromegalie-Patienten mit GH-sezernierendem Hypophysenadenom führte eine Behandlung mit Sandostatin LAR in der Hälfte der Fälle zu einer Tumorvolumenabnahme von >20%.
Die Wirksamkeit und Sicherheit von Sandostatin LAR zur Therapie der Akromegalie nach einer Einzeldosis von 10, 20 oder 30 mg wurde in zwei randomisierten, doppelblinden, unkontrollierten Studien an insgesamt 93 Patienten untersucht. Primärer Wirksamkeitsendpunkt war der mittlere STH-Serumspiegel nach 12 Stunden. Die Dosen von 20 und 30 mg Sandostatin LAR waren dabei in der Lage, den STH-Spiegel von Tag 14 bis Tag 42 auf <5 µg/l zu supprimieren.
In einer anschliessenden offenen Verlängerung konnten die Patienten über bis zu 28 Injektionen (jeweils im Abstand von 28 Tagen) weiterbehandelt werden, wobei von 87 Patienten Daten über diesen Behandlungszeitraum vorliegen. Dabei war eine Dosisanpassung zwischen 10 und 30 mg (in Ausnahmefällen bis 40 mg) anhand des individuellen Ansprechens möglich. Sandostatin LAR führte über das gesamte Dosierungsintervall zu einer anhaltenden Suppression des STH-Spiegels. Dies ging mit einer deutlichen Senkung auch des IGF-I-Spiegels sowie mit einem nachhaltigen Rückgang der klinischen Symptomatik der Akromegalie einher.
Die Verträglichkeit von Sandostatin LAR war in diesen Studien jener von subkutan appliziertem Sandostatin vergleichbar.
Funktionelle Tumoren des gastropankreatischen endokrinen Systems
Die Behandlung mit Sandostatin LAR ermöglicht eine kontinuierliche Beherrschung der durch die Grunderkrankung hervorgerufenen Symptome. Dabei beeinflusst Octreotid die verschiedenen Formen gastroenteropankreatischer Tumoren wie folgt:
Karzinoide
Die Anwendung von Octreotid kann zu einer Besserung der Symptome, insbesondere von Flush und Diarrhoe, führen. In gewissen Fällen kommt es darüberhinaus zu einer Senkung des Serotoninspiegels im Plasma und zu einer verminderten Ausscheidung von 5-Hydroxyindolessigsäure im Urin.
Die Wirksamkeit und Sicherheit von Sandostatin LAR in Dosen von 10, 20 und 30 mg in 4wöchigen Intervallen zur Therapie eines malignen Karzinoid-Syndroms wurde in einer randomisierten, doppelblinden Studie im Vergleich zu Sandostatin s.c. an n=93 Patienten untersucht. Als Wirksamkeitsendpunkt war eine Erfolgsrate definiert, die Stärke und Dauer der Suppression der Karzinoidsymptome berücksichtigte. Ein Therapieerfolg setzte dabei voraus, dass innerhalb der letzten 4 Wochen in den Sandostatin LAR-Gruppen maximal zwei Mal über insgesamt höchstens 5 Tage eine Notfallbehandlung mit subkutan appliziertem Octreotid erforderlich war. In der Sandostatin s.c.-Gruppe galt ein Therapieerfolg dann als gegeben, wenn innerhalb desselben Zeitraums maximal zwei Mal eine Dosiserhöhung über insgesamt höchstens 5 Tage erforderlich war.
Die Wirksamkeit von Sandostatin LAR war dabei jener von Sandostatin s.c. vergleichbar. Einen Behandlungserfolg erreichten am Studienende unter Sandostatin s.c. 58% der Patienten, unter Sandostatin LAR 10, 20 und 30 mg 55%, 50% bzw. 56%.
VIPome
Biochemisches Merkmal dieser Tumoren ist die Überproduktion von VIP (vasoactive intestinal peptide). Die Behandlung mit Octreotid führt in den meisten Fällen zu einer Besserung der für diese Erkrankung typischen schweren sekretorischen Diarrhoe und damit zu einer Verbesserung der Lebensqualität. Damit verbunden ist eine Besserung der durch die Diarrhoe hervorgerufenen Störungen des Elektrolythaushalts, z.B. der Hypokaliämie, so dass enterale und parenterale Flüssigkeits- und Elektrolytsubstitution abgesetzt werden können. Untersuchungen mittels Computer-Tomographie lassen in einzelnen Fällen - besonders bei Lebermetastasen - eine Verlangsamung oder einen Stillstand des Tumorwachstums, unter Umständen sogar eine Abnahme der Tumorgrösse erkennen. Die klinische Besserung geht in der Regel mit einer Senkung des VIP-Plasmaspiegels einher, wobei Normalwerte erreicht werden können.
Glukagonome
Die Anwendung von Octreotid führt in den meisten Fällen zu einer wesentlichen Besserung der für diese Krankheit typischen Hautveränderungen (nekrolytisch-migrierendes Erythem). Ein leichter Diabetes mellitus - eine bei Glukagonom-Patienten häufige Erscheinung - wird durch Octreotid wenig beeinflusst. Der Bedarf an Insulin oder oralen Antidiabetika wird in der Regel nicht vermindert. Eine eventuell bestehende Diarrhoe wird gebessert mit der Folge einer Gewichtszunahme. Octreotid bewirkt oft eine sofortige Senkung des Glukagon-Plasmaspiegels. Dieser Effekt hält jedoch bei fortgesetzter Behandlung nicht an, obschon die Besserung der Symptome bestehen bleibt.
Gastrinome/Zollinger-Ellison-Syndrom
Die Behandlung mit Protonenpumpenblockern oder H2-Rezeptorenblockern vermag rezidivierende Magenulzerationen - eine Folge der chronischen gastrinstimulierten Hypersekretion von Magensäure - nicht immer zu verhindern und bewirkt nicht in allen Fällen eine Besserung der manchmal stark ausgeprägten Diarrhoe. In solchen Fällen kann Octreotid, allein oder in Kombination mit Protonenpumpenblockern oder H2-Rezeptorenblockern, die erhöhte Magensäure-Produktion verringern und die klinischen Symptome der Krankheit einschliesslich der Diarrhoe, bei 50% der Fälle, bessern. Auch andere, vermutlich durch Tumorpeptide verursachte Symptome wie z.B. Flush können gebessert werden. Bei einem Teil der Patienten bewirkt Octreotid eine Senkung des Plasma-Gastrinspiegels.
Insulinome
Octreotid führt zu einer Verminderung des zirkulierenden immunoreaktiven Insulins. Bei Patienten mit operablen Tumoren kann Octreotid dazu beitragen, präoperativ einen normoglykämischen Zustand zu erreichen und beizubehalten. Bei inoperablen gutartigen oder bösartigen Tumoren führt Octreotid in einigen Fällen auch ohne anhaltende Senkung des Insulinspiegels, zu einer Verbesserung der Blutzucker-Regulation.
GRFome
Diese seltenen Tumoren produzieren GRF (growth hormone releasing factor) allein oder zusammen mit anderen biologisch aktiven Peptiden. Octreotid führte in 1 von 2 untersuchten Fällen zu einer Besserung der Symptome der hieraus resultierenden Akromegalie. Diese Wirkung beruht wahrscheinlich auf einer Hemmung der GRF- und Wachstumshormonsekretion. Eine Verkleinerung der vergrösserten Hypophyse kann damit einhergehen.
Fortgeschrittene gut differenzierte neuroendokrine Tumoren des Mitteldarms
In einer placebokontrollierten Phase-III-Studie (PROMID) wurden Patienten mit Metastasen von gut differenzierten funktionalen oder nicht funktionalen neuroendokrinen Tumoren des Mitteldarms eingeschlossen.
85 Patienten wurden randomisiert für eine Behandlung mit Sandostatin LAR 30 mg in vierwöchigen Abständen (n=42) oder Placebo (n=43).
Die Haupteinschlusskriterien waren: nicht vorbehandelt; histologisch bestätigt; lokal inoperabel oder metastasierend; gut differenziert; funktionelle oder nicht funktionelle neuroendokrine Tumoren/Karzinome; Primärtumor im Mitteldarm lokalisiert oder mit unbekanntem Ursprung (jedoch vermutetem Ursprung im Mitteldarm nach Ausschluss eines Primärtumors in Pankreas, Brustkorb oder anderen Lokalisationen).
Der primäre Endpunkt war die Zeit bis zur Tumorprogression (TTP), basierend auf einer zentral durchgeführten Bewertung radiologischer Befunde gemäss WHO-Kriterien.
Die mittlere Zeit bis zur Tumorprogression in der Gruppe unter Sandostatin LAR betrug 14.3 Monate und unter Placebo 5.9 Monate (HR = 0.36; 95% CI, 0.21 – 0.61; p=0.0001)
Der Behandlungseffekt war bei Patienten mit funktionellen (HR = 0.41; 95% CI, 0.18 bis 0.92) und nicht funktionellen Tumoren (HR = 0.32; 95% CI, 0.15 bis 0.66) ähnlich.
Da sich in der vorab geplanten Interimsanalyse zum Zeitpunkt von 18 Monaten ein signifikanter klinischer Vorteil für Sandostatin LAR zeigte, wurde die Patientenrekrutierung gestoppt. Im Sandostatin LAR-Arm konnte die Behandlung fortgeführt werden, bis eine Progression auftrat, im Placebo-Arm konnte auf eine aktive Behandlung umgestellt werden.
Das Gesamtüberleben wurde nach einem zusätzlichen Follow-up von 4.5 Jahren ausgewertet. Hier fand sich kein Unterschied zwischen beiden Studienarmen.
Pharmakokinetik
Absorption
Das pharmakokinetische Profil von Octreotid nach Injektion von Sandostatin LAR spiegelt die Freisetzung aus der polymeren Matrix und den biologischen Abbau der Substanz wider. Nach Freisetzung in den systemischen Kreislauf erfolgt die Verteilung von Octreotid entsprechend seiner bekannten und bei der subkutanen Anwendung beschriebenen pharmakokinetischen Eigenschaften. Nach einmaliger i.m.-Injektion von Sandostatin LAR erreicht der Serum-Octreotid-Spiegel innerhalb einer Stunde nach Verabreichung ein initiales vorübergehendes Maximum, gefolgt von einer allmählichen Senkung auf einen niedrigen, unter der Nachweisgrenze liegenden Octreotidspiegel innerhalb von 24 h.
Am ersten Tag werden weniger als 0.5% der insgesamt freigesetzten Substanzmenge gemessen. Während der folgenden 7 Tage nach Injektion von Sandostatin LAR bleibt der Octreotidspiegel bei den meisten Patienten im Bereich subtherapeutischer Werte.
Die Octreotidspiegel erreichen etwa am 14. Tag ein Plateau, auf dem sie während der folgenden 3 bis 4 Wochen relativ konstant verbleiben.
Nach ca. 42 Tagen beginnt der Octreotidspiegel aufgrund des terminalen Abbaus der polymeren Matrix allmählich wieder abzusinken.
Distribution
Das Verteilungsvolumen beträgt 0.27 l/kg, die Gesamtkörper-Clearance 160 ml/min. Die Plasmaproteinbindung beträgt 65%. Octreotid wird nur in geringem Ausmass an Blutzellen gebunden.
Metabolismus
Keine Angaben.
Elimination
Nach subkutaner Anwendung beträgt die Eliminationshalbwertszeit 100 min. Der grösste Teil des Peptides wird mit den Fäzes ausgeschieden, ca. 32% in unverändertem Zustand über den Urin.
Kinetik spezieller Patientengruppen
Nierenfunktionsstörungen
Eine Nierenfunktionsbeeinträchtigung hatte keinen Einfluss auf die totale Exposition (AUC) von subkutan verabreichtem Octreotid.
Leberfunktionsstörungen
Eine Leberzirrhose, nicht aber eine Fettleber, führen zu einer verminderten Elimination (30%) von Octreotid.
Präklinische Daten
Mutagenität
Subkutan verabreichtes Octreotid und/oder seine Metaboliten zeigten in in vitro-Untersuchungen an validierten Bakterien- oder Säugetierzell-Stämmen kein mutagenes Potential. In einer Studie wurde in V79-Zellen des Chinesischen Hamsters vermehrt Chromosomenveränderungen gefunden, jedoch nur bei hohen und zytotoxischen Konzentrationen. In menschlichen Lymphozyten, die mit Octreotidacetat inkubiert worden waren, fand sich jedoch keine erhöhte Häufigkeit von Chromosomenaberrationen. In vivo wurde im Octreotid-behandelten Knochenmark der Maus keine klastogene Aktivität beobachtet (Mikronucleus-Test); auch bei männlichen Mäusen fand sich in einem DNA-Reparatur-Assay der Spermienköpfe kein Hinweis auf Genotoxizität. Die Überprüfung der Mikrosphären in Standardassays für Genotoxizität ergab ebenfalls kein mutagenes Potential.
Karzinogenität/Chronische Toxizität
Aus Langzeitstudien in Ratten, Mäusen und Hund konnte kein Potential für eine chronische Toxizität gezeigt werden.
In einer Karzinogenizitätsstudie wurde Octreotid während 116 Wochen bei Ratten s.c. verabreicht. Es wurden Adenokarzinome des Endometriums beobachtet, deren Inzidenz bei der höchsten s.c. verabreichten Dosis von 1.25 mg/kg/d statistisch signifikant war. Offenbar waren diese Beobachtungen mit einer Störung des hormonellen Gleichgewichts verbunden. Die verfügbaren Daten deuten darauf hin, dass die über diesen endokrinen Weg ausgelösten Tumoren spezies-spezifisch bei Ratten auftreten und somit für den Menschen nicht relevant sind.
Reproduktionstoxizität
Untersuchungen zur Reproduktions- und Entwicklungstoxizität wurden an Ratten und Kaninchen in Dosen bis zu 1 mg/kg Körpergewicht pro Tag durchgeführt. Octreotid beeinträchtigte die Fertilität bei männlichen und weiblichen Ratten nicht. Es gab keine Hinweise auf teratogene, embryonale/fetale Effekte oder andere Auswirkungen auf die Reproduktion aufgrund von Octreotid. Bei Jungen von Ratten wurde eine gewisse Verzögerung des physiologischen Wachstums festgestellt, welche vorübergehend und höchstwahrscheinlich auf die Hemmung des Wachstumshormons aufgrund der starken pharmakodynamischen Wirkung zurückzuführen war. In Studien zur prä- und postnatalen Entwicklung wurde ein verspäteter Deszensus der Hoden bei männlichen Nachkommen von Muttertieren, die während der Trächtigkeit und Säugezeit behandelt wurden, beobachtet. Die Fertilität der betroffenen F1 Jungtiere war jedoch normal. Es wird angenommen, dass diese Beobachtungen auf die Wachstumshemmung durch Octreotid zurückzuführen sind.
Die Mikrosphären waren ohne reproduktionstoxikologische Auswirkungen nach Prüfung in Standarduntersuchungen für Reproduktionstoxizität bei Ratten und Kaninchen.
Sonstige Hinweise
Inkompatibilitäten
Sandostatin LAR Mikrosphären zur Injektion dürfen ausschliesslich für die Zubereitung einer Einzeldosis verwendet und nicht mit anderen Substanzen verdünnt oder gemischt werden. Aus diesem Grund wurden keine Daten zur Kompatibilität mit anderen Lösungen oder Substanzen gesammelt.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Verpackung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Sandostatin LAR Durchstechflaschen sollen für längere Lagerung im Kühlschrank bei 2-8°C und unter Frost- und Lichtschutz aufbewahrt werden.
Sandostatin LAR darf während ca. 24 h vor der Injektion nicht über 25°C aufbewahrt werden. Allerdings darf die Suspension erst unmittelbar vor der Injektion zubereitet werden.
Arzneimittel sollen für Kinder unerreichbar aufbewahrt werden.
Hinweise für die Handhabung
Anleitung zur i.m. Injektion von Sandostatin LAR
Sandostatin LAR sollte nur von geschultem Fachpersonal verabreicht werden.
Sandostatin LAR darf nur über tiefe intragluteale Injektion, NIEMALS intravenös verabreicht werden.
Zur vollständigen Benetzung des Pulvers und dessen homogenen Suspension vor der Injektion sollte die untenstehende Anleitung sorgfältig befolgt werden.
Die Suspension darf erst unmittelbar vor der Injektion zubereitet werden.
Bei wiederholten Injektionen ist zwischen dem linken und rechten Gesässmuskel abzuwechseln.
Inhalt der Packung:
|
|
| |
|
a |
Durchstechflasche mit Sandostatin LAR Trockensubstanz | |
|
b |
Spritze mit Lösungsmittel | |
|
c |
Adapter für die Durchstechflasche | |
|
d |
Sicherheitsnadel | |
Die Rekonstitution muss unter aseptischen Bedingungen erfolgen.
|
Schritt 1 | |||
|
|
|
Sandostatin LAR-Injektionskit aus dem Kühlschrank nehmen und auf Raumtemperatur bringen. Hierzu Kit mindestens 30 bis 60min bei Raumtemperatur stehen lassen, nicht aber länger als 24h. | |
|
Schritt 2 | |||
|
|
|
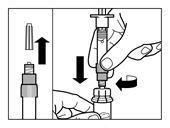
Verschlusskappe der Durchstechflasche, die Sandostatin LAR enthält, entfernen. | |
|
Schritt 3 | |||
|
|
|
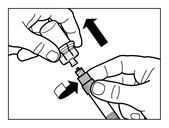
|
Die Verschlusskappe der Fertigspritze, die das Lösungsmittel enthält, entfernen und die Spritze auf den Adapter der Durchstechflasche schrauben. |
|
Schritt 4 | |||
|
|
|
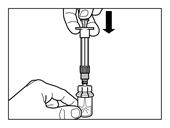
Die Durchstechflasche während 5 min nicht bewegen, bis das Lösungsmittel die Sandostatin-LAR-Trockensubstanz vollständig benetzt hat. Während dieser Zeit soll der Patient vorbereitet werden. | |
|
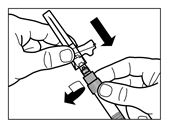
Schritt 5 | |||
|
|
|
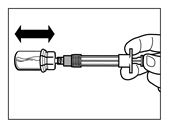
Wenn die Trockensubstanz vollständig benetzt ist, den Kolben vollständig zurück in die Fertigspritze pressen. | |
|
Schritt 6 | |||
|
|
Die Injektionsstelle mit einem Alkoholtupfer desinfizieren. | ||
|
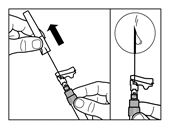
|
|
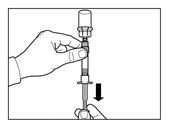
Die Fertigspritze mit der Ampulle auf den Kopf stellen und den Kolben langsam herausziehen, so dass der gesamte Inhalt aus der Ampulle in die Fertigspritze gezogen wird. | |
|
|
|
Danach die Fertigspritze sofort vom Adapter abschrauben. | |
|
Schritt 7 | |||
|
|
|
Die Sicherheitsnadel auf die Spritze schrauben. | |
|
|
|
Die Schutzhülle der Nadel entfernen. | |
|
Schritt 8 | |||
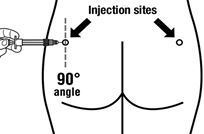
|
|
|
|
Die Nadel in einem 90° Winkel zur Haut in den rechten oder linken Gesässmuskel stechen und aspirieren, um sicherzustellen, dass kein Blutgefäss angestochen wurde, sonst muss die Nadelposition geändert werden. |
|
Schritt 9 | |||
|
|
|
Die Nadel-Schutzvorrichtung wird mit einer Ein-Hand-Technik aktiviert: | |
|
|
|
Ein hörbarer «Klick» bestätigt, dass die Schutzvorrichtung richtig angewendet wurde. | |
Zulassungsnummer
53161 (Swissmedic).
Packungen
Sandostatin LAR 10 mg Durchstechflasche: 1 [A]
Sandostatin LAR 20 mg Durchstechflasche: 1 [A]
Sandostatin LAR 30 mg Durchstechflasche: 1 [A]
Zulassungsinhaberin
Novartis Pharma Schweiz AG, Risch; Domizil: 6343 Rotkreuz.
Stand der Information
Januar 2021.