Zusammensetzung
Wirkstoffe
Natriumchlorid, Calciumchlorid-Dihydrat, Magnesiumchlorid-Hexahydrat, (S)-Milchsäure, Natriumhydrogencarbonat.
Hilfsstoffe
Wasser für Injektionszwecke, Kohlendioxid.
Indikationen/Anwendungsmöglichkeiten
Als Substitutionslösung für die kontinuierliche Hämofiltration und Hämodiafiltration und als Dialyselösung für die kontinuierliche Hämodialyse bei akutem Nierenversagen.
Dosierung/Anwendung
Übliche Dosierung
Die Rate mit der Hemosol B0 verabreicht wird, hängt von der Blutelektrolytkonzentration, dem Säure-Basen-Gleichgewicht, dem Flüssigkeitshaushalt und dem allgemeinen klinischen Zustand des Patienten ab. Das zu verabreichende Volumen der Ersatzlösung und/oder des Dialysates hängt von der gewünschten Intensität (Dosis) der Behandlung ab.
Dosis, Infusionsrate und kumuliertes Volumen sollten von einem in der Intensivmedizin und in der CRRT (kontinuierliche Nierenersatztherapie) erfahrenen Arzt festgelegt werden.
Erwachsene
Folgende Flussraten sind für Substitutionslösungen bei Hämofiltration und Hämodiafiltration üblich:
|
Erwachsene: |
500 - 3000 ml/h |
Folgende Flussraten sind für Dialyselösungen (Dialysat) bei kontinuierlicher Hämodialyse üblich:
|
Erwachsene: |
500 - 2500 ml/h |
Häufig verwendete Flussraten bei Erwachsenen sind zwischen 2000 und 2500 ml/h, welche einem täglichen Flüssigkeitsvolumen von ungefähr 48 bis 60 l entsprechen.
Kinder und Jugendliche
Die üblichen verwendeten Flussraten für die Substitutionslösung in Hämoflitration und Hämodiafiltration und für die Dialyselösung (Dialysat) in der kontinuerlichen Hämodialyse sind:
|
Kinder (Neugeborene bis Jugendliche bis 18 Jahre): |
1000 bis 2000 ml/h/1,73 m2 |
Flussraten bis 4000 ml/h/1,73 m2 werden möglicherweise notwendig sein, vor allem bei jüngeren Kindern (≤ 10 kg). Die maximal verwendete Flussrate (in ml/h) sollte im Allgemeinen die bei Erwachsenen verwendete maximale Flussrate nicht überschreiten.
Art der Anwendung
Zur intravenösen Anwendung und zur Hämodialyse.
Bei Verwendung von Hemosol B0 als Substitutionslösung wird Hemosol B0 vor (Prädilution) oder nach dem Hämofilter bzw. Hämodiafilter (Postdilution) in den extrakorporalen Blutkreislauf gegeben.
Kontraindikationen
Überempfindlichkeit gegen die Wirkstoffe oder einen der sonstigen Inhaltssstoffe.
Metabolische Alkalose.
Warnhinweise und Vorsichtsmassnahmen
Da Hemosol B0 kein Kalium enthält, ist bei Patienten mit Hypokaliämie besondere Vorsicht geboten. Die Serum-Kalium-Konzentration muss vor und während der Hämofiltration und/oder Hämodialyse überwacht werden.
Während der gesamten Behandlung sind der hämodynamische Status, das Flüssigkeits- und Elektrolytgleichgewicht sowie das Säure-Basen-Gleichgewicht engmaschig zu überwachen.
Der Kalium-, Harnstoff-, Glucose- und der Kreatininspiegel sind besonders genau zu überwachen.
Eine regelmässige Überwachung des anorganischen Phosphates sollte erfolgen.
Bis zu 1,2 mmol/l Phosphat können zu der Lösung zugegeben werden. Wenn Kaliumphosphat hinzugefügt wird, sollte die Gesamtkaliumkonzentration 4 mEq/l (4 mmol/l) nicht übersteigen.
Eine Substitution von Kalium kann notwendig sein.
Der hämodynamische Status und der Flüssigkeitshaushalt des Patienten sollten während des gesamten Verfahrens überwacht werden.
·Bei Hypervolämie kann die vorgeschriebene Netto-Ultrafiltrationsrate für die CRRT-Einrichtung erhöht werden und/oder die Verabreichungsrate von anderen Lösungen als Ersatzflüssigkeit und/oder Dialysat kann reduziert werden.
·Bei Hypovolämie kann die vorgeschriebene Netto-Ultrafiltationsrate für die CRRT-Einrichtung reduziert werden und/oder die Verabreichungsrate von anderen Lösungen als Ersatzflüssigkeit und/oder Dialysat kann erhöht werden.
Da Hemosol B0 keine Glucose enthält, kann die Verabreichung zu einer Hypoglykämie führen. Der Blutglucosespiegel sollte regelmässig überwacht werden. Wenn eine Hypoglykämie auftritt, sollte die Verwendung einer glucosehaltigen Lösung in Betracht gezogen werden. Andere Korrekturmassnahmen können erforderlich sein, um die gewünschte Blutzuckerkontrolle aufrechtzuerhalten.
Hemosol B0 enthält Hydrogencarbonat (Bicarbonat) und Lactat (einen Hydrogencarbonatvorläufer), die das Säure-Basen-Gleichgewicht des Patienten beeinflussen können. Wenn sich während der Therapie mit Hemosol B0 eine metabolische Alkalose entwickelt oder verschlechtert, sollte die Verabreichungsrate verringert oder die Verabreichung gestoppt werden.
Die Verwendung einer kontaminierten Hämofiltrationslösung kann zu Sepsis, Schock und lebensbedrohlichen Zuständen führen.
Interaktionen
Die Plasmaspiegel filtrierbarer/dialysierbarer Arzneimittel können während der Behandlung durch Entfernung im extrakorporalen Filter reduziert werden. Gegebenenfalls sind Korrekturmassnahmen einzuleiten, um die gewünschten Blutkonzentrationen der Arzneimittel zu gewährleisten.
Interaktionen mit anderen Arzneimitteln, die auf Elektrolyt- oder Säure-Basen-Ungleichgewichte zurückzuführen sind, können durch korrekte Dosierung der Hämofiltrations- und Hämodialyselösung sowie enge Überwachung vermieden werden.
Folgende Interaktionen können jedoch auftreten:
·Das Risiko einer Digitalis-induzierten kardialen Arrhythmie ist bei einer Hypokaliämie erhöht.
·Vitamin D und andere Vitamin D Analoga sowie calciumhaltige Arzneimittel (z.B. Calciumchlorid oder Calciumgluconat), die für die Aufrechterhaltung der Calcium-Homöostase verwendet werden, können das Risiko einer Hypercalcämie erhöhen.
·Die zusätzliche Gabe von Natriumhydrogencarbonat z.B. via CRRT-Flüssigkeiten oder anderen Flüssigkeiten oder von Pufferlösungen, kann das Risiko einer metabolischen Alkalose erhöhen.
·Wenn Citrat als Antikoagulans verwendet wird, trägt es zu der Gesamtpufferlast bei und kann den Plasmacalciumspiegel senken.
Schwangerschaft, Stillzeit
Zur Anwendung von Hemosol B0 während der Schwangerschaft oder Stillzeit liegen keine ausreichenden Daten vor. Hemosol B0 soll in der Schwangerschaft und Stillzeit nur eingesetzt werden, wenn dies unbedingt erforderlich ist.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Nach einer ambulant durchgeführten Dialyse/Hämofiltration/Hämodiafiltration sind der Allgemeinzustand des Patienten und die allfälligen unerwünschten Wirkungen zu beachten.
Unerwünschte Wirkungen
Die Häufigkeit ist wie folgt definiert:
„Sehr häufig“ (≥1/10), „häufig“ (≥1/100, <1/10), „gelegentlich“ (≥1/1‘000, <1/100), „selten“ (≥1/10‘000, <1/1‘000), „sehr selten“ (<1/10‘000),
„nicht bekannt“ (kann aus den verfügbaren Daten nicht abgeschätzt werden).
Unerwünschte Wirkungen können durch die Lösung oder die Behandlung selbst bedingt sein. Die folgenden unerwünschten Wirkungen sind nach der Markteinführung aufgetreten:
Stoffwechsel- und Ernährungsstörungen
Nicht bekannt: Elektrolytungleichgewicht, z.B. Hypophosphatämie, Hypokaliämie, Störungen
des Säure-Basen-Gleichgewichts z.B. metabolische Alkalose, Flüssigkeitsretention,
Dehydratation
Gefässerkrankungen
Nicht bekannt: Hypotonie*.
Erkrankungen des Gastrointestinaltrakts
Nicht bekannt: Übelkeit*, Erbrechen*.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Nicht bekannt: Muskelkrämpfe*.
* durch die Dialysebehandlung (Hämofiltration und Hämodialyse) hervorgerufene unerwünschte Wirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Wenn das Verfahren korrekt durchgeführt wird und das Flüssigkeits-, Elektrolyt- und Säure-Basen-Gleichgewicht des Patienten sorgfältig überwacht werden, ist eine Überdosierung nicht zu erwarten.
Eine Überdosierung kann schwerwiegende Folgen wie Stauungsherzinsuffizienz, Elektrolyt- oder Säure-Basen-Störungen haben.
Bezüglich Handhabung von Hypervolämie bzw. Hypovolämie siehe Abschnitt Warnhinweise und Vorsichtsmassnahmen (diese sind in diesem Kapitel beschrieben und genau zu befolgen).
Wenn ein Elektrolytungleichgewicht und ein Säure-Base-Ungleichgewicht (z.B. metabolische Alkalose, Hypophosphatämie, Hypokaliämie, usw.) auftreten, ist die Anwendung sofort zu stoppen. Es gibt kein spezifisches Antidot für eine Überdosierung.
Dieses Risiko kann durch genaue Überwachung während der Behandlung minimiert werden (siehe Warnhinweise und Vorsichtsmassnahmen).
Eigenschaften/Wirkungen
ATC-Code
B05ZB
Wirkungsmechanismus
Hemosol B0 ist pharmakologisch inaktiv. Die darin enthaltenen Natrium-, Calcium-, Magnesium- und Chlorid-Ionen liegen in für Plasma typischen physiologischen Konzentrationen vor.
Die Lösung dient zur Substitution von Flüssigkeit und Elektrolyten, die während der Hämofiltration entfernt wurden, oder als Austauschmedium für die Hämodiafiltration oder kontinuierliche Hämodialyse.
Hydrogencarbonat wird als alkalisierender Puffer verwendet.
Pharmakodynamik
Nicht zutreffend. Die Wirkstoffe sind pharmakologisch inaktiv und liegen in für Plasma typischen Konzentrationen vor.
Klinische Wirksamkeit
Keine Angaben.
Pharmakokinetik
Nicht zutreffend. Die Wirkstoffe sind pharmakologisch inaktiv und liegen in für Plasma typischen Konzentrationen vor.
Absorption
Keine Angaben.
Distribution
Keine Angaben.
Metabolismus
Keine Angaben.
Elimination
Keine Angaben.
Präklinische Daten
Es sind keine für die Anwendung relevante, präparatespezifische Daten bekannt.
Sonstige Hinweise
Inkompatibilitäten
Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden, es sei denn, das Verfahren bzw. die Behandlung des Patienten erfordern dies unbedingt.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit „EXP“ bezeichneten Datum verwendet werden.
Die chemische und physikalische Stabilität der gebrauchsfertigen Lösung wurde über 24 Stunden bei 22 °C nachgewiesen. Aus mikrobiologischer Sicht und wegen des Gehaltes an Natriumhydrogencarbonat muss das Präparat nach dem Öffnen (d.h. nach Anschluss an das Schlauchsystem) sofort verwendet werden. Andere Lagerbedingungen und/oder Lagerzeiten nach Herstellung der gebrauchsfertigen Lösung liegen in der Verantwortung des Anwenders und sollten auf keinen Fall länger als 24 Stunden sein, die Behandlung mit eingeschlossen.
Haltbarkeit nach Anbruch
Haltbarkeit nach dem Mischen: 24 Stunden.
Besondere Lagerungshinweise
Arzneimittel für Kinder unzugänglich aufbewahren.
Nicht über 30 °C lagern.
Nicht unter +4 °C lagern.
Hinweise für die Handhabung
Die Hinweise für die Handhabung müssen genau befolgt werden.
Bei Konnektion und Diskonnektion aller Schlauchanschlüsse ist auf streng aseptisches Vorgehen zu achten.
Nur mit geeigneten Überwachungsgeräten für die kontinuierliche extrakorporale Nierenersatztherapie verwenden.
Die Elektrolytlösung muss vor der Anwendung mit der Pufferlösung vermischt werden, um die endgültige, gebrauchsfertige Lösung für die Hämofiltration, Hämodiafiltration oder kontinuierliche Hämodialyse zu erhalten.
Hemosol B0 kann auf 37 °C erwärmt werden, um den Komfort des Patienten zu verbessern. Vor der Verwendung der Lösung sollte eine Erwärmung nur mit trockener Wärme und vor der Rekonstitution durchgeführt werden. Die Lösungen sollten nicht im Wasser oder in einer Mikrowelle erhitzt werden.
Bei der Anwendung des Arzneimittels am Patienten ist auf streng aseptisches Vorgehen zu achten.
Die Lösung sollte vor der Verabreichung visuell auf Partikel und Verfärbungen untersucht werden, wenn immer Lösung und Behälter es zulassen.
Nur verwenden, wenn die Schutzhülle, alle Trennnähte und Verschlüsse intakt sind und die Lösung klar ist. Den Beutel fest zusammenpressen, um auf Dichtigkeit zu prüfen. Wenn ein Leck entdeckt wird, die Lösung sofort entsorgen, da die Sterilität nicht mehr gewährleistet werden kann.
Prüfen Sie vor dem Mischen, dass die Lösungen klar und der Beutel unversehrt sind. Nur verwenden, wenn die Lösung klar ist.
Die grosse Kammer ist mit einem Injektionsport für den möglichen Zusatz von anderen notwendigen Medikamenten nach der Rekonstitution der Lösung ausgestattet.
Es liegt in der Verantwortung des behandelnden Arztes, die Kompatibilität von zugesetzten Arzneimitteln mit Hemosol B0 zu beurteilen.
Zusätze können inkompatibel sein. Die Instruktionen für die zugefügte Medikation sowie die entsprechende Literatur und Fachinformation muss vorgängig konsultiert werden. Wenn nach der Zugabe eine Farbänderung und/oder Präzipitate, unlösliche Komplexe oder Kristalle auftreten, darf die Lösung nicht verwendet werden.
Vor der Zugabe eines Wirkstoffes oder einer Medikation sollte dessen Löslichkeit und Stabilität in Hemosol B0 überprüft werden, und in einem für Hemosol B0 geeignetem pH Bereich liegen (pH der gebrauchsfertigen Lösungen beträgt 7,0 - 8,5).
Die Lösung sorgfältig mischen, wenn Zusätze zugesetzt wurden.
Das Hinzufügen und Mischen von Zusätzen muss immer vor dem Anschluss des Lösungsbeutels an den extrakorporalen Kreislauf erfolgen.
Kompatible Arzneimittel dürfen ausschliesslich in die gebrauchsfertige Lösung gegeben und die so erhaltene Lösung muss sofort angewendet werden.
Die Elektrolytlösung (kleine Kammer A) wird direkt vor der Anwendung am Patienten durch Öffnen der Trennnaht zur Pufferlösung (grosse Kammer B) hinzugefügt, um die rekonstruierte Lösung zu erhalten:
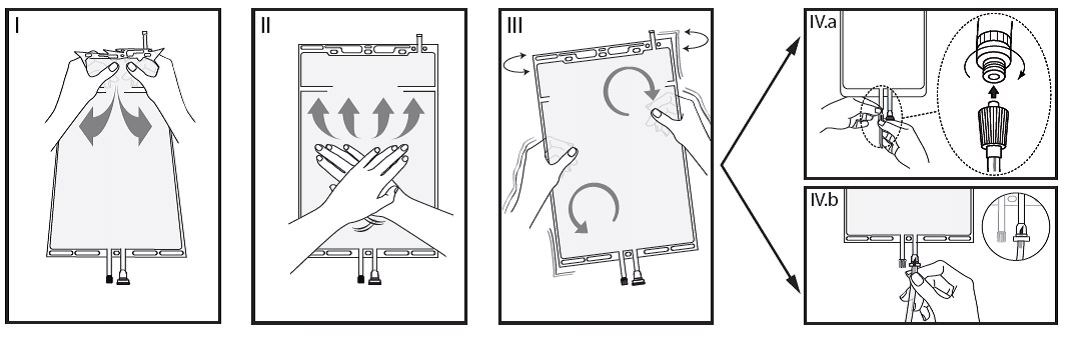
I Entfernen Sie die Schutzhülle des Beutels erst direkt vor der Anwendung und mischen Sie die Lösungen in den zwei Kammern. Halten Sie die kleine Kammer A mit beiden Händen und drücken Sie diese zusammen, bis sich eine Öffnung in der Trennnaht zwischen beiden Kammern bildet.
II Drücken Sie mit beiden Händen auf die grosse Kammer B, bis die Trennnaht zwischen beiden Kammern vollständig geöffnet ist.
III Stellen Sie die komplette Durchmischung der Lösung durch vorsichtiges Schütteln des Beutels sicher. Die Lösung ist nun gebrauchsfertig und kann am Gerät aufgehängt werden.
IV Der Dialyse-, oder Substitutionsschlauch kann mit jedem der beiden Anschlüsse verbunden werden.
IV.a Bei Verwendung des Luer-Anschlusses entfernen Sie erst die Kappe. Schliessen Sie den männlichen Luer-Lock des Dialyse- oder Substitutionsschlauches an den weiblichen Anschluss des Beutels an und drehen Sie ihn fest. Stellen Sie sicher, dass die Verbindung festsitzt und dicht ist.
Die Verbindung ist nun offen. Stellen Sie sicher, dass die Flüssigkeit frei fliessen kann. Sobald der Dialyse- oder Substitutionsschlauch vom Luer-Anschluss abgetrennt wird, ist der Anschluss geschlossen und der freie Fluss der Lösung ist gestoppt. Dieser Anschluss ist nadelfrei und desinfizierbar.
IV.b Entfernen Sie bei Verwendung des Injektionsanschlusses zuerst die Schutzkappe. Der Injektionsanschluss ist ein desinfizierbarer Anschluss. Stechen Sie dann mit dem Anstechdorn durch das Gummi-Septum. Stellen Sie einen freien Fluss der Lösung sicher.
Die gebrauchsfertige Lösung muss sofort verwendet werden nach dem Entfernen der Schutzhülle. Wird sie nicht sofort eingesetzt, ist die rekonstituierte Lösung innerhalb von 24 Stunden, die Behandlung miteingeschlossen, nach dem Zumischen der Elektrolytlösung in die Pufferlösung zu verbrauchen.
Nur zum einmaligen Gebrauch.
Nicht verwenden, wenn der Behälter beschädigt oder die Lösung nicht klar ist.
Restlösungen verwerfen.
Zulassungsnummer
56202 (Swissmedic)
Packungen
Zwei-Kammer-Beutel aus Polyolefin. Der 5000 ml Beutel besteht aus einer kleinen Kammer A (250 ml) und einer grossen Kammer B (4750 ml). Die beiden Kammern sind durch eine Trennnaht getrennt.
Die grosse Kammer (B) ist mit einem Injektionsanschluss (bzw. Anstechdorn) aus Polycarbonat ausgestattet, der mit einer Gummischeibe unter einer Schutzkappe geschlossen wird, und einem Luer-Anschluss mit einem Ventil aus Silikongummi für den Anschluss des Beutels an eine geeignete Substitutionslösung- oder Dialysatleitung.
Der Beutel ist in einer transparenten Hülle aus mehrschichtiger Polymerfolie verpackt.
Polyolefin-Beutel mit Ventil: 2 x 5000 ml (B).
Zulassungsinhaberin
Vantive GmbH, 8152 Opfikon
Stand der Information
November 2024