Zusammensetzung
Wirkstoffe
Mutter- und Tochternuklid:
Mutterradionuklid: 99Mo (Spaltmolybdän)
Tochterradionuklid: 99mTc
Aktivität:
|
Tc-99m-Aktivität (T 12 h MEZ) |
2 |
4 |
6 |
8 |
10 |
12 |
16 |
20 |
25 |
50 |
GBq |
|
Mo-99-Aktivität (T 12 h MEZ) |
2,5 |
5 |
7 |
9,5 |
12 |
14,5 |
19 |
24 |
30 |
60 |
GBq |
Ohne Träger
Hilfsstoffe
Material der Chromatographiesäule:
Chromatographiesäule aus Glas, die Aluminiumoxid enthält
Beutel mit Elutionslösung:
Natrii chloridum, Natrii nitras, Aqua ad iniectabilia
Elutionsdurchstechflaschen:
Nitrogenium unter vermindertem Druck
Die (99mTc)-Natriumpertechnetat-Injektionslösung enthält 3,6 mg/ml Natrium.
Spezifikationen
Spezifikation des Eluats:
Dieser Generator ermöglicht die Elution einer klaren und farblosen (99mTc)-Natriumpertechnetat-Injektionslösung (Ph. Eur.), deren pH-Wert bei 4,5 bis 7,5 liegt und die eine radiochemische Reinheit von mindestens 95 % aufweist.
Reinheit des Radionuklids (Monographie 0124 „Natriumpertechnetat (99mTc) Injektion (Spaltung)“ der Europäischen Pharmakopöe, aktuelle Ausgabe):
·Jod-131: maximal 5 × 10− 3 Prozent der Gesamtradioaktivität.
·Molybdän-99: maximal 0,1 Prozent der Gesamtradioaktivität.
·Ruthenium-103: maximal 5 × 10− 3 Prozent der Gesamtradioaktivität.
·Strontium-89: maximal 6 × 10− 5 Prozent der Gesamtradioaktivität.
·Strontium-90: maximal 6 × 10− 6 Prozent der Gesamtradioaktivität.
·Andere Gammastrahlen emittierende Radionuklide: maximal 0,01 Prozent der Gesamtradioaktivität.
·Alphastrahlen emittierende Radionuklide: maximal 1 × 10− 7 Prozent der Gesamtradioaktivität.
Radiochemische Reinheit (Monographie 0124 „Natriumpertechnetat (99mTc) Injektion (Spaltung)“ der Europäischen Pharmakopöe, aktuelle Ausgabe)
(99mTc)-Pertechnetat-Ion: mindestens 95 Prozent der Gesamtradioaktivität durch Technetium-99m.
Indikationen/Anwendungsmöglichkeiten
Dieses Arzneimittel ist ein Diagnostikum.
Die erhaltene (99mTc)-Natriumpertechnetat-Injektionslösung kann für die Markierung verschiedener Verbindungen in Form von Kits verwendet werden, aber auch für die folgenden Indikationen direkt verabreicht werden:
a. Intravenöse Verabreichung:
·Schilddrüsen-Szintigraphie: Bildgebung und Messung der Schilddrüsenaufnahme zum Erhalt von Informationen zur Funktion der Schilddrüse (Nodularität, Position)
·Speicheldrüsen-Szintigraphie: Untersuchung der Funktion
·Nachweis ektopischer Magenschleimhaut (Meckel-Divertikel, intestinale Duplikation mit Heterotopie der Magenschleimhaut)
b. In-vivo-Markierung von Erythrozyten mit Technetium (99mTc) nach Verabreichung eines Reduktionsmittels
·Angio-Szintigraphie zur:
-Beurteilung der ventrikulären Ejektionsfraktion
-Globalen oder regionalen Beurteilung der Motilität der Herzwand
-Bildgebung der ventrikulären Phasen
-Bildgebung der Organperfusion oder von Gefässanomalien
c. Instillation in das Auge:
·Szintigraphie der Tränengänge
Die (99mTc)-Natriumpertechnetat-Injektionslösung kann bei Erwachsenen und Kindern (Neugeborene bis Jugendliche) angewendet werden.
Dosierung/Anwendung
Dieses Arzneimittel darf nur in nuklearmedizinischen Einrichtungen durch befugtes Personal angewendet werden.
Zur Vorbereitung des Patienten beachten Sie bitte den Abschnitt «Warnhinweise und Vorsichtsmassnahmen».
Übliche Dosierung
Die (99mTc)-Natriumpertechnetat-Injektionslösung wird üblicherweise intravenös verabreicht oder in die Augen instilliert. Die verabreichte Aktivität ist stark unterschiedlich und hängt von der gewünschten klinischen Information und der angewendeten Instrumentation ab. Die folgenden Aktivitäten werden empfohlen:
Erwachsene (70 kg) und ältere Patienten:
Schilddrüsen-Szintigraphie: 20 bis 80 MBq
Beginn der Bildgebung 20 Minuten nach der intravenösen Injektion.
Speicheldrüsen-Szintigraphie: 50 bis 150 MBq
Beginn der Bildgebung unmittelbar nach der intravenösen Injektion und in regelmässigen Abständen von bis zu 15 Minuten.
Nachweis ektopischer Magenschleimhaut: 400 MBq
Beginn der Bildgebung unmittelbar nach der intravenösen Injektion und in regelmässigen Abständen von bis zu 30-60 Minuten.
Angio-Szintigraphie: 750 bis 1’000 MBq
Erythrozyten werden nach vorheriger Verabreichung eines Reduktionsmittels in vivo markiert. Bildgebung der ersten Herzpassage unmittelbar nach der Injektion; für Untersuchungen im „Gated“-Modus (= kardiale Synchronisation) Bildgebungen im Gleichgewicht bis zu 30 Minuten nach der Injektion.
Szintigraphie der Tränengänge: 2 bis 4 MBq in jedes Auge
Nach Instillation von Tropfen in jedes Auge Aufnahme einer Bildserie in 2 Minuten; in den folgenden 20 Minuten Aufnahme statischer Bilder in regelmässigen Abständen.
Kinder und Jugendliche
Die Anwendung in der pädiatrischen Population muss auf Grundlage der klinischen Erfordernisse und des Nutzen-Risiko-Verhältnisses in dieser Population sorgfältig abgewogen werden.
Bei Kindern und Jugendlichen müssen die zu verabreichenden Aktivitäten angepasst und können gemäss den Empfehlungen auf der pädiatrischen Dosiskarte (Dosage Card) der Europäischen Gesellschaft für Nuklearmedizin (EANM - Februar 2014) berechnet werden. Hierzu werden die Formel für die jeweilige Indikation und der entsprechende Korrekturfaktor für die Körpermasse des jungen Patienten verwendet (siehe Tabelle 1).
A[MBq] Verabreicht = Grundaktivität x Korrekturfaktor
Schilddrüsen-Szintigraphie:
Verabreichte Aktivität [MBq] = 5,6 MBq x Korrekturfaktor (Tabelle 1)
Mindestaktivität von 10 MBq, um eine ausreichende Bildqualität zu erzielen.
Nachweis ektopischer Magenschleimhaut:
Verabreichte Aktivität [MBq] = 10,5 MBq x Korrekturfaktor (Tabelle 1)
Mindestaktivität von 20 MBq, um eine ausreichende Bildqualität zu erzielen.
Kardiale Szintigraphie (Erstpassage):
Verabreichte Aktivität [MBq] = 35,0 MBq x Korrekturfaktor (Tabelle 1)
Mindestaktivität von 80 MBq, um eine ausreichende Bildqualität zu erzielen.
Angio-Szintigraphie (Gleichgewicht) / Markierung von Erythrozyten in vivo:
Verabreichte Aktivität [MBq] = 56,0 MBq x Korrekturfaktor (Tabelle 1)
Mindestaktivität von 80 MBq, um eine ausreichende Bildqualität zu erzielen.
Tabelle 1: Gewichtsabhängige Korrekturfaktoren für Kinder und Jugendliche (für die
Schilddrüsen-Szintigraphie und den Nachweis bzw. die Lokalisierung ektopischer
Magenschleimhaut) gemäss EANM-Leitlinie vom Mai 2008.
|
Gewicht |
|
Faktor |
Gewicht |
|
Faktor |
Gewicht |
|
Faktor |
|
3 kg |
= |
1 |
22 kg |
= |
5,29 |
42 kg |
= |
9,14 |
|
4 kg |
= |
1,14 |
24 kg |
= |
5,71 |
44 kg |
= |
9,57 |
|
6 kg |
= |
1,71 |
26 kg |
= |
6,14 |
46 kg |
= |
10,00 |
|
8 kg |
= |
2,14 |
28 kg |
= |
6,43 |
48 kg |
= |
10,29 |
|
10 kg |
= |
2,71 |
30 kg |
= |
6,86 |
50 kg |
= |
10,71 |
|
12 kg |
= |
3,14 |
32 kg |
= |
7,29 |
52-54 kg |
= |
11,29 |
|
14 kg |
= |
3,57 |
34 kg |
= |
7,72 |
56-58 kg |
= |
12,00 |
|
16 kg |
= |
4,00 |
36 kg |
= |
8,00 |
60-62 kg |
= |
12,71 |
|
18 kg |
= |
4,43 |
38 kg |
= |
8,43 |
64-66 kg |
= |
13,43 |
|
20 kg |
= |
4,86 |
40 kg |
= |
8,86 |
68 kg |
= |
14,00 |
Speicheldrüsen-Szintigraphie:
Nach Empfehlungen der Arbeitsgruppe Pädiatrie der EANM (1990) ist die bei Kindern zu verabreichende Aktivität anhand des Körpergewichts gemäss der nachstehenden Tabelle zu berechnen, wobei die Mindestdosis für eine ausreichende Bildqualität 10 MBq beträgt (siehe Tabelle 2).
Tabelle 2: Gewichtsabhängige Korrekturfaktoren für Kinder und Jugendliche (für die Speicheldrüsen-Szintigraphie) gemäss EANM-Empfehlungen von 1990.
|
Gewicht |
|
Faktor |
Gewicht |
|
Faktor |
Gewicht |
|
Faktor |
|
3 kg |
= |
0,1 |
22 kg |
= |
0,50 |
42 kg |
= |
0,78 |
|
4 kg |
= |
0,14 |
24 kg |
= |
0,53 |
44 kg |
= |
0,80 |
|
6 kg |
= |
0,19 |
26 kg |
= |
0,56 |
46 kg |
= |
0,82 |
|
8 kg |
= |
0,23 |
28 kg |
= |
0,58 |
48 kg |
= |
0,85 |
|
10 kg |
= |
0,27 |
30 kg |
= |
0,62 |
50 kg |
= |
0,88 |
|
12 kg |
= |
0,32 |
32 kg |
= |
0,65 |
52-54 kg |
= |
0,90 |
|
14 kg |
= |
0,36 |
34 kg |
= |
0,68 |
56-58 kg |
= |
0,92 |
|
16 kg |
= |
0,40 |
36 kg |
= |
0,71 |
60-62 kg |
= |
0,96 |
|
18 kg |
= |
0,44 |
38 kg |
= |
0,73 |
64-66 kg |
= |
0,98 |
|
20 kg |
= |
0,46 |
40 kg |
= |
0,76 |
68 kg |
= |
0,99 |
Szintigraphie der Tränengänge:
Die empfohlenen Aktivitäten gelten sowohl für Erwachsenen als auch für Kinder. Hinweise für die Vorbereitung von Radiopharmazeutika sowie besondere Vorsichtsmassnahmen für die Handhabung finden sich im Abschnitt «Warnhinweise und Vorsichtsmassnahmen» und unter «Hinweise für die Handhabung». Besondere Vorsichtsmassnahmen für die Beseitigung siehe Abschnitt «Gesetzliche Bestimmungen».
Spezielle Dosierungsempfehlungen
Patienten mit Niereninsuffizienz:
Mit diesem Präparat wurden keine Studien mit ansteigen Dosen bzw. zur Dosisanpassung in normalen und speziellen Populationen durchgeführt. Die Pharmakokinetik von (99mTc)-Natriumpertechnetat bei Patienten mit Nierenfunktionsstörungen wurde nicht beurteilt.
Eingeschränkte Nierenfunktion:
Bei diesen Patienten ist eine sorgfältige Abwägung der zu verabreichenden Aktivität erforderlich, da bei diesen Patienten ein erhöhtes Strahlenexpositionsrisiko besteht.
Art der Anwendung
Zur intravenösen Anwendung oder Anwendung am Auge.
Zur Mehrfachdosierung.
Hinweise zur Zubereitung des Arzneimittels vor der Anwendung, siehe «Hinweise für die Handhabung».
Zur Vorbereitung der Patienten, siehe Abschnitt «Warnhinweise und Vorsichtsmassnahmen».
Bei der Schilddrüsen-Szintigraphie, Speicheldrüsen-Szintigraphie und zum Nachweis/zur Lokalisierung ektopischer Magenschleimhaut wird (99mTc)-Natriumpertechnetat-Lösung als intravenöse Injektion verabreicht.
Bei der Tränengang-Szintigraphie wird in jedes Auge eingetropft (Anwendung am Auge).
Bildakquisition
Schilddrüsen-Szintigraphie: 20 Minuten nach intravenöser Injektion.
Speicheldrüsen-Szintigraphie: unmittelbar nach der intravenösen Injektion und 15 Minuten lang in regelmässigen Abständen.
Nachweis/Lokalisierung ektopischer Magenschleimhaut (Meckel-Divertikel): unmittelbar nach der intravenösen Injektion und in regelmässigen Abständen bis zu 30 Minuten.
Tränengang-Szintigraphie: dynamische Aufnahmen innerhalb von 2 Minuten nach dem Eintropfen, anschliessend statische Aufnahmen in regelmässigen Abständen innerhalb von 20 Minuten.
Strahlenexposition
Die in der folgenden Tabelle angegebenen Daten stammen aus der ICRP 128 und wurden unter folgenden Annahmen berechnet:
Gemäss ICRP 128 (Internationale Strahlenschutzkommission) haben alle publizierten Studien eine rasche aktive Fixierung in der Schilddrüse, den Speicheldrüsen und im Magen sowie eine verzögerte Fixierung im Dickdarm gezeigt. Die verweilende Fraktion der verabreichten Aktivität dürfte sich gleichmässig in den Geweben aller anderen Organe verteilen (mit Ausnahme des Gehirns). Die Elimination erfolgt auf renalem und intestinalem Weg.
(1) Vom Patienten aufgenommene Strahlendosen nach intravenöser Injektion von (99mTc)-Natriumpertechnetat ohne Vorbehandlung mit einer blockierenden Substanz
|
Organ |
Aufgenommene Dosen je verabreichte Aktivitätseinheit | ||||||
|
Erwachsener |
15 Jahre |
10 Jahre |
5 Jahre |
1 Jahr | |||
|
Nebennieren |
3,7 |
4,6 |
7,1 |
11,0 |
19,0 | ||
|
Harnblasenwand |
18,0 |
23,0 |
34,0 |
45,0 |
66,0 | ||
|
Knochenoberfläche |
5,4 |
6,5 |
9,6 |
14,0 |
25,0 | ||
|
Gehirn |
2,0 |
2,5 |
4,1 |
6,5 |
11,0 | ||
|
Mamma |
1,8 |
2,3 |
3,4 |
5,6 |
11,0 | ||
|
Gallenblasenwand |
7,4 |
9,8 |
16,0 |
23,0 |
35,0 | ||
|
Gastro-Intestinaltrakt |
|
|
|
|
| ||
|
Magenwand |
26,0 |
34,0 |
48,0 |
78,0 |
160,0 | ||
|
Dünndarmwand |
16,0 |
20,0 |
31,0 |
47,0 |
82,0 | ||
|
Dickdarmwand |
41,0 |
53,0 |
89,0 |
140,0 |
270,0 | ||
|
Colon ascendens |
56,0 |
73,0 |
120,0 |
200,0 |
370,0 | ||
|
Colon descendens |
21,0 |
27,0 |
45,0 |
71,0 |
130,0 | ||
|
Herzwand |
3,1 |
4,0 |
6,0 |
9,1 |
16,0 | ||
|
Nieren |
5,0 |
6,0 |
8,6 |
13,0 |
21,0 | ||
|
Leber |
3,8 |
4,8 |
8,0 |
12,0 |
22,0 | ||
|
Lunge |
2,6 |
3,4 |
5,1 |
7,9 |
14,0 | ||
|
Muskeln |
3,2 |
4,0 |
6,0 |
9,1 |
16,0 | ||
|
Ösophagus |
2,5 |
3,2 |
4,8 |
7,5 |
14,0 | ||
|
Ovarien |
9,9 |
13,0 |
18,0 |
27,0 |
44,0 | ||
|
Pankreas |
5,6 |
7,2 |
11,0 |
16,0 |
27,0 | ||
|
Rotes Knochenmark |
3,7 |
4,4 |
6,5 |
9,0 |
15,0 | ||
|
Speicheldrüsen |
8,5 |
10,0 |
14,0 |
18,0 |
26,0 | ||
|
Haut |
1,8 |
2,2 |
3,5 |
5,6 |
10,0 | ||
|
Milz |
4,3 |
5,3 |
8,0 |
12,0 |
20,0 | ||
|
Testikel |
2,8 |
3,7 |
5,9 |
9,1 |
16,0 | ||
|
Thymus |
2,5 |
3,2 |
4,8 |
7,5 |
14,0 | ||
|
Schilddrüse |
22,0 |
36,0 |
54,0 |
120,0 |
220,0 | ||
|
Uterus |
8,1 |
10,0 |
16,0 |
23,0 |
37,0 | ||
|
Übrige Gewebe |
3,7 |
4,7 |
7,1 |
11,0 |
19,0 | ||
|
Effektive Dosis (µSv/MBq) |
13,0 |
17,0 |
26,0 |
42,0 |
79,0 | ||
(2) Vom Patienten aufgenommene Strahlendosen nach intravenöser Injektion von (99mTc)-Natriumpertechnetat nach Vorbehandlung mit einer blockierenden Substanz
|
Organ |
Aufgenommene Dosen je verabreichte Aktivitätseinheit | ||||||
|
Erwachsener |
15 Jahre |
10 Jahre |
5 Jahre |
1 Jahr | |||
|
Nebennieren |
3,3 |
4,1 |
6,2 |
9,3 |
17,0 | ||
|
Harnblasenwand |
30,0 |
38,0 |
55,0 |
71,0 |
91,0 | ||
|
Knochenoberfläche |
5,1 |
6,1 |
9,0 |
13,0 |
23,0 | ||
|
Gehirn |
2,3 |
2,9 |
4,7 |
7,6 |
13,0 | ||
|
Mamma |
1,9 |
2,5 |
3,5 |
5,6 |
11,0 | ||
|
Gallenblasenwand |
3,5 |
4,7 |
7,8 |
11,0 |
14,0 | ||
|
Gastro-Intestinaltrakt |
|
|
|
|
| ||
|
Magenwand |
3,1 |
4,1 |
6,6 |
9,3 |
16,0 | ||
|
Dünndarmwand |
3,9 |
4,9 |
7,5 |
11,0 |
19,0 | ||
|
Dickdarmwand |
4,1 |
5,3 |
8,0 |
12,0 |
19,0 | ||
|
Colon ascendens |
3,7 |
4,8 |
7,1 |
11,0 |
18,0 | ||
|
Colon descendens |
4,7 |
5,9 |
9,1 |
12,0 |
21,0 | ||
|
Herzwand |
3,1 |
3,9 |
5,8 |
8,6 |
15,0 | ||
|
Nieren |
4,6 |
5,6 |
8,3 |
13,0 |
22,0 | ||
|
Leber |
3,0 |
3,8 |
5,9 |
8,8 |
16,0 | ||
|
Lunge |
2,7 |
3,5 |
5,2 |
7,9 |
14,0 | ||
|
Muskeln |
2,8 |
3,5 |
5,3 |
7,9 |
14,0 | ||
|
Ösophagus |
2,7 |
3,5 |
5,2 |
8,0 |
15,0 | ||
|
Ovarien |
4,8 |
5,9 |
8,7 |
13,0 |
20,0 | ||
|
Pankreas |
3,5 |
4,4 |
6,6 |
10,0 |
18,0 | ||
|
Rotes Knochenmark |
2,9 |
3,6 |
5,4 |
7,9 |
14,0 | ||
|
Haut |
1,9 |
2,2 |
3,6 |
5,6 |
10,0 | ||
|
Milz |
3,1 |
3,9 |
6,0 |
8,9 |
16,0 | ||
|
Testikel |
3,4 |
4,3 |
6,8 |
10,0 |
16,0 | ||
|
Thymus |
2,7 |
3,5 |
5,2 |
8,0 |
15,0 | ||
|
Schilddrüse |
2,8 |
3,5 |
5,6 |
9,0 |
16,0 | ||
|
Uterus |
6,4 |
7,8 |
12,0 |
16,0 |
24,0 | ||
|
Übrige Gewebe |
2,9 |
3,6 |
5,4 |
8,2 |
14,0 | ||
|
Effektive Dosis (µSv/MBq) |
4,6 |
5,8 |
8,7 |
12,0 |
20,0 | ||
Die effektive Dosis nach intravenöser Verabreichung der empfohlenen maximalen Aktivität von 400 MBq (99mTc)-Natriumpertechnetat beträgt 5'200 µSv bei einem Menschen mit 70 kg Körpergewicht. Bei dieser injizierten Aktivität erreichen folgende Strahlendosen die Zielorgane: Magen: 10’400 µGy; Schilddrüse: 8’800 µGy; Speicheldrüsen: 3'400 µGy. Die folgenden Strahlendosen erreichen kritische Organe: Wand des Colon ascendens: 22’400 µGy.
Nach Vorbehandlung von Patienten mit blockierenden Substanzen und Verabreichung von 400 MBq (99mTc)-Natriumpertechnetat an Erwachsenen mit einem Gewicht von 70 kg beträgt die effektive Dosis 1,7 mSv.
Die von der Augenlinse aufgenommene Strahlendosis nach Verabreichung von (99mTc)-Natriumpertechnetat bei der Tränengang-Szintigraphie wird auf 0,038 mGy/Mq geschätzt.
Dies führt bei einer verabreichten Aktivität von 4 MBq zu einer effektiven Dosis von weniger als 0,01 mSV.
Die Angaben für die Strahlenexposition sind nur dann gültig, wenn alle Organe, in denen sich (99mTc)-Natriumpertechnetat anreichert, normal funktionieren. Bei Über-/Unterfunktion (z.B. der Schilddrüse, der Magenschleimhaut oder der Nieren) und ausgedehnten Krankheitsprozessen mit Beeinträchtigung der Blut-Hirn-Schranke oder gestörter Ausscheidung über die Niere, kommt es zu Veränderungen der Strahlenexposition und lokal auch zu einer starken Erhöhung.
(3) Vom Patienten aufgenommene Strahlendosen nach In-vivo-Markierung der Erythrozyten mit Technetium (99mTc)
|
Organ |
Aufgenommene Dosen je verabreichte Aktivitätseinheit | |||||
|
Erwachsener |
15 Jahre |
10 Jahre |
5 Jahre |
1 Jahr | ||
|
Nebenniere |
9,9 |
12,0 |
20,0 |
30,0 |
56,0 | |
|
Harnblasenwand |
8,5 |
11,0 |
14,0 |
17,0 |
31,0 | |
|
Knochenoberfläche |
7,4 |
12,0 |
19,0 |
36,0 |
74,0 | |
|
Gehirn |
3,6 |
4,6 |
7,5 |
12,0 |
22,0 | |
|
Mamma |
3,5 |
4,1 |
7,0 |
11,0 |
19,0 | |
|
Gallenblasewand |
6,5 |
8,1 |
13,0 |
20,0 |
30,0 | |
|
Gastro-Intestinaltrakt |
|
|
|
|
| |
|
Magenwand |
4,6 |
5,9 |
9,7 |
14,0 |
25,0 | |
|
Dünndarmwand |
3,9 |
4,9 |
7,8 |
12,0 |
21,0 | |
|
Dickdarmwand |
3,7 |
4,8 |
7,5 |
12,0 |
20,0 | |
|
Colon ascendens |
4,0 |
5,1 |
8,0 |
13,0 |
22,0 | |
|
Colon descendens |
3,4 |
4,4 |
6,9 |
10,0 |
18,0 | |
|
Herzwand |
23,0 |
29,0 |
43,0 |
66,0 |
110,0 | |
|
Nieren |
18,0 |
22,0 |
36,0 |
57,0 |
110,0 | |
|
Leber |
13,0 |
17,0 |
26,0 |
40,0 |
72,0 | |
|
Lunge |
18,0 |
22,0 |
35,0 |
56,0 |
110,0 | |
|
Muskeln |
3,3 |
4,0 |
6,1 |
9,4 |
17,0 | |
|
Ösophagus |
6,1 |
7,0 |
9,8 |
15,0 |
23,0 | |
|
Ovarien |
3,7 |
4,8 |
7,0 |
11,0 |
19,0 | |
|
Pankreas |
6,6 |
8,1 |
13,0 |
19,0 |
33,0 | |
|
Rotes Knochenmark |
6,1 |
7,6 |
12,0 |
20,0 |
37,0 | |
|
Haut |
2,0 |
2,4 |
3,8 |
6,2 |
12,0 | |
|
Milz |
14,0 |
17,0 |
27,0 |
43,0 |
81,0 | |
|
Testikel |
2,3 |
3,0 |
4,4 |
6,9 |
13,0 | |
|
Thymus |
6,1 |
7,0 |
9,8 |
15,0 |
23,0 | |
|
Schilddrüse |
5,7 |
7,1 |
12,0 |
19,0 |
36,0 | |
|
Uterus |
3,9 |
4,9 |
7,4 |
11,0 |
19,0 | |
|
Übrige Gewebe |
3,5 |
4,5 |
7,3 |
13,0 |
23,0 | |
|
Effektive Dosis (µSv/MBq) |
7,0 |
8,9 |
14,0 |
21,0 |
39,0 | |
Die wirksame Dosis nach Verabreichung von 1‘000 MBq (99mTc)-Natriumpertechnetat im Anschluss an die In-vivo-Markierung von Erythrozyten (empfohlene maximale Aktivität für einen Menschen mit 70 kg Körpergewicht) beträgt 7‘000 µSv.
Bei einer injizierten Aktivität von 1'000 MBq erreichen folgende Strahlendosen die Zielorgane: Herz: 23'000 µGy. Die folgenden Strahlendosen erreichen kritische Organe: Lungen: 18'000 µGy; Nieren: 18'000 µGy; Milz: 14'000 µGy; Leber: 13'000 µGy.
Die von der Augenlinse aufgenommene Strahlendosis nach Verabreichung von (99mTc)-Natriumpertechnetat bei der Tränengang-Szintigraphie wird auf 38 µGy/MBq geschätzt. Dies führt bei einer verabreichten Aktivität von 4 MBq zu einer effektiven Dosis von weniger als 10 µSv.
Kontraindikationen
Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe.
Warnhinweise und Vorsichtsmassnahmen
Radiopharmazeutische Produkte dürfen nur von befugtem Personal in spezialisierten Abteilungen in Empfang genommen, gehandhabt und angewendet werden. Empfang, Lagerung, Verwendung, Transfer und Entsorgung dieser Produkte unterliegen den Vorschriften und entsprechenden Genehmigungen der zuständigen Behörden.
Bei der Vorbereitung radiopharmazeutischer Arzneimittel sind sowohl die Strahlenschutzvorschriften als auch die üblichen aseptischen Vorsichtsmassnahmen zu beachten.
Potenzial für Überempfindlichkeitsreaktionen oder anaphylaktische Reaktionen
Bei Auftreten von Überempfindlichkeitsreaktionen oder anaphylaktischen Reaktionen muss die Verabreichung des Arzneimittels sofort abgebrochen werden. Falls erforderlich, ist eine intravenöse Behandlung einzuleiten.
Um im Notfall eine rasche Behandlung zu ermöglichen, sollten die erforderlichen Arzneimittel und die nötige Ausrüstung, insbesondere Endotrachealtubus und Beatmungsgerät, unmittelbar griffbereit sein.
Individuelles Nutzen-Risiko-Verhältnis
Die Exposition gegenüber ionisierender Strahlung muss bei jedem Patienten durch den erwarteten Nutzen gerechtfertigt sein. Die verabreichte Aktivität darf in keinem Fall zu einer Strahlendosis führen, die höher liegt als für die Erhebung der gewünschten diagnostischen Information erforderlich.
Nierenfunktionsstörung
Bei diesen Patienten ist eine sorgfältige Abwägung des Nutzen-Risiko-Verhältnisses erforderlich, da ein erhöhtes Strahlenexpositionsrisiko vorliegen kann.
Kinder und Jugendliche
Die Anwendung bei Kindern und Jugendlichen bedarf einer besonders sorgfältigen Abwägung und setzt eine Beurteilung der klinischen Erfordernisse und des Nutzen/Risiko-Verhältnisses in dieser Population voraus.
Eine sorgfältige Indikationsstellung ist erforderlich, weil die effektive Dosis per MBq bei Kindern und Jugendlichen höher ist als bei Erwachsenen (siehe Abschnitt „Strahlenexposition“).
Bei Kindern und Jugendlichen ist die Schilddrüse-Blockade besonders wichtig (mit Ausnahme: der Schilddrüsen-Szintigraphie).
Patientenvorbereitung
Den Patienten sollte geraten werden, vor Beginn der Untersuchung ausreichend zu trinken und in den ersten Stunden nach der Untersuchung so oft wie möglich die Blase zu entleeren, um die aufgenommene Strahlendosis zu vermindern.
Bei bestimmten Indikationen ist unter Umständen eine Vorbehandlung der Patienten mit Schilddrüsenblockern bzw. Thyreostatika erforderlich.
Zur Vermeidung falsch positiver Werte oder zur Minimerung der Strahlung durch Reduktion der Kumulation von Pertechnetat in Schilddrüse und Speicheldrüsen sollte vor einer Tränengang-Szintigraphie oder Meckel-Szintigraphie ein Schilddrüsenblocker verabreicht werden.
Vor einer Schilddrüsen-, Nebenschilddrüsen- oder Speicheldrüsen-Szintigrapie darf dagegen KEIN Schilddrüsenblocker verwendet werden.
Vor der Verabreichung der (99mTc)-Natriumpertechnetat-Injektionslösung für eine Meckel-Divertikel-Szintigraphie muss der Patient 3 bis 4 Stunden lang einen leeren Magen haben, um die Darmperistaltik zu reduzieren.
Nach einer In vivo-Markierung der Erythrozyten, bei der Zinn-Ionen zur Reduktion von (99mTc)-Natriumpertechnetat verwendet werden, wird der 99mTc-Komplex hauptsächlich in Erythrozyten eingebaut. Daher sollte eine Meckel-Szintigraphie nur vor oder mehrere Tage nach einer In vivo-Erythrozytenmarkierung erfolgen.
Nach der Untersuchung
Enger Kontakt mit Säuglingen/Kleinkindern sowie mit schwangeren Frauen ist während 12 Stunden einzuschränken.
Besondere Warnhinweise
Die (99mTc)-Natriumpertechnetat-Injektionslösung enthält 3,6 mg/ml Natrium. Abhängig vom Zeitpunkt der Vorbereitung der Injektion und vom injizierten Volumen kann der Natriumgehalt in manchen Fällen 1 mmol (23 mg) übersteigen. Dies ist bei Personen unter natriumarmer Diät zu berücksichtigen.
Bei der Kit-Markierung ist in Hinblick auf den Natriumgehalt der verabreichten Dosis das aus dem Eluat und dem Kit stammende Natrium zu berücksichtigen. Bitte entnehmen Sie diese Angaben aus der Fachinformation des betreffenden Kits.
Bei der Speicheldrüsen-Szintigraphie ist im Vergleich zur MR-Sialographie eine niedrigere Spezifität der Methode zu erwarten.
Hinweise zur Vermeidung von Gefahren für die Umwelt, siehe Abschnitt «Vorsichtsmassnahmen für die Handhabung».
Interaktionen
Atropin, Isoprenalin und Analgetika können die Magenentleerung verzögern und dadurch in der Abdomendarstellung eine Umverteilung des Pertechnetats (99mTc) bewirken.
Laxantien sind abzusetzen, da diese den Gastrointestinaltrakt reizen. Kontrastverstärkte Untersuchungen (z. B. mit bariumhaltigen Kontrastmitteln) und Untersuchungen des oberen Gastrointestinaltrakts sind innerhalb von 48 Stunden vor der Verabreichung von Pertechnetat (99mTc) für eine Szintigraphie des Meckel-Divertikels zu vermeiden.
Viele pharmakologische Substanzen beeinflussen die Aufnahme in die Schilddrüse.
·Thyreostatika (z. B. Carbimazol oder andere Imidazolderivate wie Propylthiouracil), Salicylate, Kortikoide, Natrium-Nitroprussid, Natrium-Sulfobromophthalein und Perchlorat: Diese Substanzen müssen eine Woche vor einer Schilddrüsen-Szintigraphie abgesetzt werden.
·Phenylbutazon und Expektoranzien: Die Behandlung muss zwei Wochen zuvor abgesetzt werden.
·Natürliche oder synthetische Schilddrüsenhormone (z. B. Natriumthyroxin, Liothyronin-Natrium, Schilddrüsenextrakt): Die Behandlung muss zwei bis drei Wochen zuvor abgesetzt werden.
·Amiodaron, Benzodiazepine und Lithium müssen vier Wochen zuvor abgesetzt werden.
·Innerhalb von 30 bis 60 Tagen vor der Untersuchung dürfen keine jodhaltigen Kontrastmittel verabreicht worden sein.
·Zinn(II)-Ionen und Sulfonamide können zu einer erhöhten Natriumpertechnetat-(99mTc)Konzentration in den Erythrozyten und damit zu einer verminderten Anreicherung im Plasma führen. Entsprechende Arzneimittel müssen mindestens 8 Tage vor der Anwendung abgesetzt werden.
Informationen über mögliche Interaktionen bei Verwendung zur Markierung eines Kits für ein radioaktives Arzneimittel sind der Produktinformation des Herstellers des jeweiligen Kits zu entnehmen.
Schwangerschaft, Stillzeit
Frauen im gebärfähigen Alter
Es wurde nachgewiesen, dass (99mTc)-Technetium in Form von Pertechnetat plazentagängig ist. Sollte die Verabreichung eines Radiopharmazeutikums bei einer Frau im gebärfähigen Alter erforderlich sein, muss eine Schwangerschaft ausgeschlossen werden.
Schwangerschaft
Bei Radionukliduntersuchungen an schwangeren Frauen kommt es auch zu einer Strahlenexposition des Föten. Daher dürfen während der Schwangerschaft nur zwingend erforderliche Untersuchungen durchgeführt werden, deren wahrscheinlicher Nutzen das Risiko für die Mutter und den Föten übersteigt. Alternativ sollten strahlungsfreie diagnostische Verfahren Berücksichtigung finden.
99mTc (als freies Pertechnetat) ist plazentagängig.
Bei der direkten Verabreichung von 400 MBq (99mTc)-Natriumpertechnetat beträgt die Strahlendosis im Uterus 3,2 mGy. Die Verabreichung von 1‘000 MBq mit (99mTc)-Technetium markierten Erythrozyten bringt eine Strahlendosis im Uterus von 3,9 mGy mit sich. Es ist nicht bekannt, welcher Strahlendosis der Fetus ausgesetzt ist.
Stillzeit
In Anbetracht der Tatsache, dass Radioaktivität in die Muttermilch übertritt, ist vor der Verabreichung von Radiopharmaka an eine stillende Mutter zu erwägen, ob diese Untersuchung bis zum Abstillen hinausgeschoben werden kann. Andernfalls ist auf Grundlage der in die Muttermilch gelangenden Aktivität das am besten geeignete Radiopharmazeutikum auszuwählen.
Sollte sich die Verabreichung des Radiopharmazeutikums nicht vermeiden lassen, muss das Stillen über einen Zeitraum von mindestens 12 Stunden nach der Injektion unterbrochen werden, die in dieser Zeit gebildete Milch muss abgepumpt und verworfen werden.
In den ersten 12 Stunden nach der Injektion muss enger Kontakt zwischen Mutter und Säugling eingeschränkt werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es wurden keine entsprechenden Studien durchgeführt.
Unerwünschte Wirkungen
Zusammenfassung des Sicherheitsprofils
Es liegen Angaben zu unerwünschten Wirkungen aus Spontanmeldungen vor. Bei den berichteten Wirkungen handelte es sich um anaphylaktoide Reaktionen, vegetative Reaktionen sowie verschiedene Arten von Reaktionen am Verabreichungsort der Injektion. (99mTc)-Natriumpertechnetat aus dem Tekcis-Radionuklidgenerator wird zur radioaktiven Markierung verschiedener Substanzen verwendet. Diese Arzneimittel haben im Allgemeinen ein höheres Potenzial für unerwünschte Reaktionen als 99mTc. Daher sind die berichteten unerwünschten Reaktionen eher den markierten Substanzen als 99mTc zuzuschreiben.
Welche Arten von unerwünschten Reaktionen nach intravenöser Verabreichung des 99mTc- markierten Präparates auftreten können, hängt von der jeweiligen Substanz ab. Die entsprechenden Angaben sind in der Fachinformation des zur Zubereitung des radioaktiven Arzneimittels verwendeten Kits enthalten.
Liste der unerwünschten Wirkungen
Die unerwünschten Wirkungen sind nach MedDRA-Systemorganklassen und Häufigkeit gemäss folgender Konvention geordnet: „sehr häufig“ (≥1/10), „häufig“ (≥1/100, <1/10), „gelegentlich“ (≥1/1‘000, <1/100), „selten“ (≥1/10‘000, <1/1‘000), „sehr selten“ (<1/10‘000), „nicht bekannt“ (Häufigkeit kann aus den verfügbaren Daten nicht abgeschätzt werden).
|
Systemorganklassen gemäss MedDRA |
Nebenwirkungen |
Häufigkeit |
|
Erkrankungen des Immunsystems |
Anaphylaktoide Reaktionen (z.B. Dyspnoe, Koma, Urtikaria, Erythem, Hautausschlag, Pruritus, Ödembildung an verschiedenen Stellen z.B. im Gesicht) |
Nicht bekannt * |
|
Erkrankung des Nervensystems |
Vasovagale Reaktionen (z.B. Synkope, Tachykardie, Bradykardie, Schwindelgefühl, Kopfschmerzen, verschwommenes Sehen, Gesichtsrötung/Hitzegefühl (Flushing)) |
Nicht bekannt * |
|
Erkrankungen des Gastrointestinaltraktes |
Erbrechen, Übelkeit, Diarrhoe |
Nicht bekannt * |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Reaktionen am Verabreichungsort der Injektion durch Paravasation (z.B. Cellulitis, Schmerzen, Erythem, Schwellung) |
Nicht bekannt * |
* Unerwünschte Wirkungen aus Spontanmeldungen.
Da nur Meldungen aus Spontanberichten analysiert werden konnten, sind keine Angaben zur Häufigkeit möglich.
Die Exposition gegenüber ionisierender Strahlung kann potentiell Krebserkrankungen hervorrufen oder zu genetischen Defekten führen. Da die wirksame Dosis für eine empfohlene Aktivität von 1‘000 MBq bei 7 mSv liegt, ist die Wahrscheinlichkeit des Auftretens solcher Wirkungen gering.
Beschreibung spezifischer unerwünschter Wirkungen und Zusatzinformationen
Anaphylaktische Reaktionen (z. B. Dyspnoe, Koma, Urtikaria, Erythem, Hautausschlag, Pruritus, Ödembildung an verschiedenen Stellen [z. B. im Gesicht]).
Anaphylaktische Reaktionen wurden nach intravenöser Injektion von (99mTc)-Natriumpertechnetat berichtet und beinhalten verschiedene Haut- oder Atemwegsymptome wie Hautreizungen, Ödeme oder Dyspnoe.
Vegetative Reaktionen (Erkrankungen des Nervensystems und des Gastrointestinaltrakts)
Einzelfälle schwerer vegetativer Reaktionen wurden berichtet, jedoch handelte es sich bei den meisten berichteten vegetativen Reaktionen um gastrointestinale Reaktionen wie Übelkeit oder Erbrechen. Andere Berichte beinhalten vasovagale Reaktionen wie Kopfschmerzen oder Schwindelgefühl. Vegetative Reaktionen werden eher auf die Untersuchungssituation als auf (99mTc)-Technetium zurückgeführt, vor allem bei ängstlichen Patienten.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Andere Berichte beschreiben lokale Reaktionen am Verabreichungsort der Injektion. Solche Reaktionen werden durch Paravasation des radioaktiven Materials während der Injektion verursacht. Die beobachteten Reaktionen reichen von lokaler Schwellung bis hin zur Cellulitis. Abhängig von der verabreichten Radioaktivität und der markierten Substanz kann eine grössere Paravasation eine chirurgische Behandlung erfordern.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Bei Verabreichung einer überhöhten Aktivität von (99mTc)-Natriumpertechnetat sollte so schnell wie möglich eine Blockierung der Schilddrüse durch Einnahme von Kaliumperchlorat oder Jodüberladung erfolgen. Die vom Patienten aufgenommene Strahlendosis kann verringert werden, indem die Diurese und fäkale Ausscheidung des nicht abgebauten Radionuklids möglichst stark gesteigert werden. Bei einer Überdosis (99mTc)-Technetium-markierter Erythrozyten lassen sich wenig unterstützende Massnahmen ergreifen, da die Ausscheidung vom normalen Hämolyseprozess abhängig ist.
Eigenschaften/Wirkungen
ATC-Code
V09FX01
Wirkungsmechanismus
TEKCIS ist ein komplett vormontierter (99mTc)-Technetium-Generator, mit dessen Hilfe man eine sterile, pyrogenfreie (99mTc)-Natriumpertechnetat-Lösung gewinnen kann. Diese Lösung erhält man durch Elution einer mit Aluminiumoxid gefüllten Chromatographiesäule, an der Spaltmolybdän (99Mo; HWZ=66 Stunden) als Mutternuklid für Technetium (99mTc; HWZ=6,0 Stunden) gebunden ist. Das System arbeitet automatisch und ist bestmöglich abgeschirmt.
Physikalische Eigenschaften
Technetium (99mTc) entsteht durch radioaktiven Abbau von Molybdän (99Mo). Beim Abbau wird Gammastrahlung mit einer mittleren Energie von 140 keV und einer HWZ von 6,02 Stunden abgegeben und es entsteht Technetium (99Tc), das aufgrund seiner sehr langen HWZ (2,13 x 105 Jahre) als stabil betrachtet werden kann.
Pharmakodynamik
In den für diagnostische Untersuchungen verwendeten Konzentrationen scheint (99mTc)-Natriumpertechnetat keine pharmakodynamische Aktivität zu besitzen.
Klinische Wirksamkeit
Nicht zutreffend.
Pharmakokinetik
Absorption
Siehe unter «Distribution».
Distribution
Das Pertechnetat-Ion weist eine ähnliche biologische Verteilung auf wie Iodid- und Perchlorat-Ionen und reichert sich vorübergehend in den Speicheldrüsen, im Plexus chorioideus, im Magen (in der Magenschleimhaut) und der Schilddrüse an, aus der es unverändert wieder ausgeschieden wird.
Das Pertechnetat-Ion reichert sich auch in Regionen mit erhöhter Vaskularisierung oder mit abnormer Gefässpermeabilität an, vor allem wenn es durch Vorbehandlung mit Schilddrüsenblockern zur Hemmung der Aufnahme in Drüsenstrukturen kommt. Bei intakter Blut-Hirn-Schranke tritt (99mTc)-Natriumpertechnetat nicht in Hirngewebe über.
Organaufnahme
Im Blut sind 70–80 % des intravenös injizierten (99mTc)-Natriumpertechnetat an Proteine gebunden, vorwiegend unspezifisch an Albumin. Die ungebundene Fraktion (20–30 %) reichert sich vorübergehend in der Schilddrüse und den Speicheldrüsen, in der Magen- und Nasenschleimhaut sowie im Plexus chorioideus an.
Im Gegensatz zu Iod wird (99mTc)-Natriumpertechnetat jedoch weder in Schilddrüsenhormon eingebaut (Organifizierung) noch im Dünndarm resorbiert. In der Schilddrüse wird die maximale Kumulation abhängig vom Funktionszustand und der Iodsättigung (bei Euthyreose etwa 0,3 - 3 %, bei Hyperthyreose und Iodmangel bis zu 25 %) ca. 20 Minuten nach Injektion erreicht; anschliessend nimmt die Aktivität rasch ab. Dies gilt auch für die Parietalzellen der Magenschleimhaut und die Azinarzellen der Speicheldrüsen.
Im Gegensatz zur Schilddrüse, die (99mTc)-Natriumpertechnetat in die Blutzirkulation abgibt, erfolgt in Speicheldrüsen und Magen eine (99mTc)-Natriumpertechnetat-Sekretion in den Speichel bzw. Magensaft. Die Anreicherung in den Speicheldrüsen liegt in der Grössenordnung von 0,5 % der applizierten Aktivität, wobei das Maximum nach etwa 20 Minuten erreicht wird. Eine Stunde nach Injektion beträgt die Konzentration im Speichel etwa das 10 bis 30fache der Plasmakonzentration. Die Ausscheidung kann durch Zitronensaft oder Stimulierung des parasympathischen Nervensystems beschleunigt werden, die Resorption wird durch Perchlorat reduziert.
Metabolismus
Nicht zutreffend.
Elimination
Technetium (99mTc) wird rasch aus dem Liquor ausgeschieden. Nach intravenöser Verabreichung verteilt sich (99mTc)-Natriumpertechnetat über das Gefässsystem, aus dem es durch drei Hauptmechanismen ausgeschieden wird:
·Diffusion in die Interstitialflüssigkeit mit nachfolgender rascher Ausscheidung
·Anreicherung des Pertechnetats in den Drüsengeweben, v.a. in der Schilddrüse, in den Speicheldrüsen und in der Magenfundusdrüse
·Glomeruläre renale Filtration mit nachfolgender langsamer Ausscheidung
Halbwertszeit
Die Plasmahalbwertszeit liegt bei rund 3 Stunden.
Die Ausscheidung während der ersten 24 Stunden nach der Verabreichung erfolgt hauptsächlich über den Urin (ca. 25 %), während sich die fäkale Ausscheidung über die folgenden 48 Stunden verteilt. Etwa 50 % der verabreichten Aktivität werden innerhalb der ersten 50 Stunden ausgeschieden.
Wenn (99mTc)-Natriumpertechnetat in Verbindung mit einer Prämedikation mit Reduktionsmitteln wie Zinnmedronat oder Zinnpyrophosphat, die eine „Zinnbeladung“ der Erythrozyten verursachen, verabreicht wird, werden bis zu ca. 95 % der verabreichten Aktivität von den Erythrozyten aufgenommen und innerhalb der Zellen gebunden. Das nicht gebundene (99mTc)-Natriumpertechnetat wird renal ausgeschieden; die Radioaktivität im Plasma beträgt normalerweise weniger als 5 % der intravaskulären Aktivität.
Der Verbleib von Technetium (99mTC) entspricht dem der markierten Erythrozyten, und die Radioaktivität wird sehr langsam ausgeschieden. Man nimmt an, dass ein kleiner Teil der Radioaktivität aus den zirkulierenden Erythrozyten ausgeschieden wird.
Präklinische Daten
Es liegen keine Daten aus Studien zur Toxizität nach Einmalgabe oder wiederholter Verabreichung und keine Langzeitstudien zur Kanzerogenität und Reproduktionsfunktion vor.
Reproduktionstoxizität: Die Plazentagängigkeit von Technetium (99mTC) nach intravenöser Gabe von (99mTc)-Natriumpertechnetat wurde bei Mäusen untersucht. Im trächtigen Uterus wurden mehr als 60 % der injizierten Aktivität nachgewiesen. In Studien, die an Mäusen während der Gestation, während der Gestation und Laktation und nur während der Laktation durchgeführt wurden, zeigten sich Veränderungen bei den Nachkommen wie vermindertes Geburtsgewicht, Haarlosigkeit und Sterilität.
Sonstige Hinweise
Inkompatibilitäten
Dieses Arzneimittel darf, ausser mit den im Abschnitt «Indikationen» genannten, nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Radionuklidgenerator: 21 Tage ab Fabrikationsdatum.
Natriumpertechnetat-(99mTc-)Eluat: Nach der Elution innerhalb von 10 Stunden verwenden, maximal 10 Entnahmen.
Für dieses Produkt sind keine besonderen Aufbewahrungsbedingungen erforderlich.
Elutionsdurchstechflaschen: 24 Monate.
Besondere Lagerungshinweise
Radionuklidenerator: Es sind keine besonderen Aufbewahrungsbedingungen in Bezug auf die Temperatur erforderlich.
Natriumpertechnetat-(99mTc-)Eluat: Für dieses Produkt sind keine besonderen Aufbewahrungsbedingungen erforderlich
Vakuumdurchstechflaschen: Nicht über 25°C lagern.
Die Lagerung muss in Übereinstimmung mit den nationalen Vorschriften für radioaktive Produkte erfolgen.
Hinweise für die Handhabung
Der TEKCIS-Generator beinhaltet:
·einen elastischen Polypropylen-Beutel zu 250 ml, der die Elutionslösung enthält (1). Der Beutel ist durch eine Nadel aus Edelstahl (2) mit dem oberen Ende der Chromatographiesäule verbunden.
·eine Chromatographiesäule aus Glas (3), die an beiden Enden durch Silikonstopfen verschlossen ist, die mit gesintertem Edelstahlgranulat gefüllt sind (4). Diese Säule enthält Aluminiumoxid, an welches Molybdän-99 adsorbiert wird.
·eine Auslassnadel (5), die an einem Ende mit der Unterseite der Säule verbunden ist, während das andere Ende der Nadel (6) zur Elution der Säule an eine Elutionsdurchstechflasche oder zur Gewährleistung der Sterilität zwischen zwei Elutionen an eine Schutzdurchstechflasche (STE-ELU) angeschlossen werden kann.
Die Aluminiumoxidsäule und die Nadeln sind durch eine zylinderförmige Abschirmung (7) aus Blei oder Wolfram geschützt. Generatoren bis zu 25 GBq sind durch eine Bleiabschirmung geschützt, während Generatoren mit 50 GBq eine Wolframabschirmung aufweisen. Das ganze System wird in eine quaderförmige Verkleidung (23 x 21 x 14 cm) aus geformtem Kunststoff eingesetzt (8-9). Die Elutionsnadel ragt aus dem Oberteil des Kunststoffgehäuses heraus und ist durch eine Transportkappe oder eine Schutzdurchstechflasche (STE-ELU) geschützt. Neben der Elutionsnadel befindet sich ein Sicherheitsventil (10), das beim Transport geschlossen bleibt.
Im Lieferumfang des Generators enthaltenes Zubehör:
·1 Beutel mit 7 sterilen, pyrogenfreien, teilevakuierten Elutionsdurchstechflaschen (TC-ELU-5) (11) zur Elution von 5 ml bis 6 ml.
·1 sterile Durchstechflasche zum Schutz der Elutionsnadel (STE-ELU).
Jede Elutionsdurchstechflasche oder Durchstechflasche zum Schutz der Elutionsnadel zu 15 ml besteht aus farblosem Typ-I-Glas (Ph. Eur.) und ist mit einem Gummistopfen verschlossen und mit einer Aluminiumkappe versiegelt.
·1 Elutionsbehälter (12) ist in der Erstlieferung inbegriffen.
Der TEKCIS-Generator wird in einem Transportbehälter des Typs A geliefert.
Schematische Darstellung des TEKCIS-Generators im Elutionsmodus
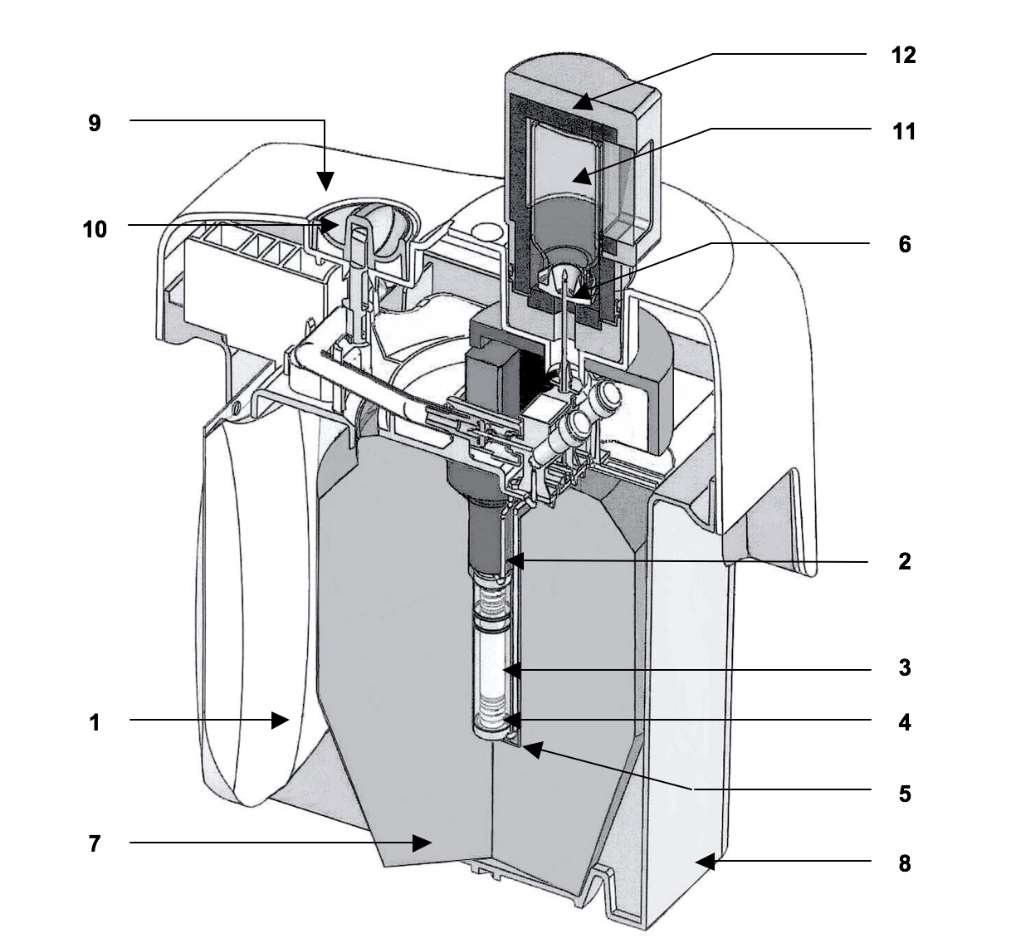
|
1 |
Beutel mit der Elutionslösung |
Zylinderförmige Abschirmung aus Blei oder Wolfram |
7 |
|
2 |
Verbindungsnadel |
Untere Verkleidung aus Kunststoff |
8 |
|
3 |
Chromatographiesäule aus Glas |
Obere Verkleidung aus Kunststoff |
9 |
|
4 |
Silikonstopfen + gesintertes Edelstahlgranulat |
Sicherheitsventil |
10 |
|
5 |
Auslassnadel aus Edelstahl |
Elutionsdurchstechflasche |
11 |
|
6 |
Elutionsnadel |
Elutionsbehälter |
12 |
Hinweise für die Zubereitung von Radiopharmazeutika
Die Elution durch den Generator muss in Einrichtungen stattfinden, die hinsichtlich der Sicherheit der Anwendung von radioaktiven Produkten die nationalen Bestimmungen erfüllen.
Es wird empfohlen, die Elution des Generators und alle weiteren Arbeitsschritte mit der Natriumlösung hinter einer zusätzlichen geeigneten Abschirmung (z. B. 50 mm dicke Bleiwand) durchzuführen. Die Dosisrate an der Oberfläche sowie 1 m von der Oberfläche entfernt darf 1 mSv/h bzw. 10 µSv/h nicht übersteigen. Auch die für die Herstellung des Radiopharmakons verwendeten Spritzen müssen mit einem Bleischutz versehen sein (Code OS-2, OS-5, OS-10 und OS-P-10).
Bei der Zubereitung radiopharmazeutischer Arzneimittel müssen sowohl die Strahlenschutzvorschriften als auch die pharmazeutischen Qualitätsnormen eingehalten werden. Die üblichen aseptischen Vorsichtsmassnahmen sind zu beachten, sodass die Anforderungen der guten pharmazeutischen Herstellungspraxis eingehalten werden.
Wie bei allen radiopharmazeutischen Produkten ist die Durchstechflasche zu verwerfen, wenn sie im Lauf der Zubereitung des Präparats beschädigt wird.
Zubereitungsmethode:
Vor jeder Elution den Stopfen und die Elutionsnadel desinfizieren.
Wichtig:
Weder auf die Nadel noch auf den Stopfen der Durchstechflasche sollte Ethanol oder Ethyläther gespritzt werden, dies kann den Elutionsvorgang beeinträchtigen.
Während des Transports wird die Sterilität der Elutionsnadel durch eine Transportkappe gewährleistet.
Um die Elutionsnadel vor einer bakteriellen Kontamination zu schützen, muss die Durchstechflasche zum Schutz der Elutionsnadel zwischen zwei Elutionen wieder auf die Nadel gesetzt werden.
Für zufriedenstellende Ergebnisse die nachstehende Abfolge beachten:
Erste Elution:
Im Rahmen der Inbetriebnahme VOR dem Aufbringen der Elutionsdurchstechflasche das Sicherheitsventil (10) ÖFFNEN (Position ON). Das Sicherheitsventil zwischen zwei Elutionen nicht wieder schliessen. Das Sicherheitsventil darf erst nach der endgültigen Ausserbetriebnahme des Generators wieder geschlossen werden.
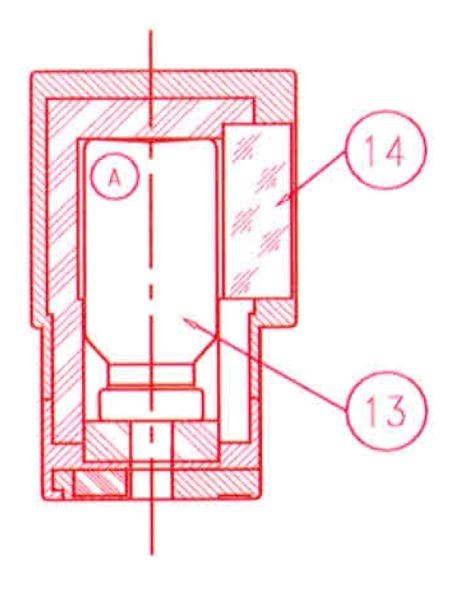
Um den Generator zu eluieren, den Verschluss oder die Durchstechflasche zum Schutz der Elutionsnadel durch einen Elutionsbehälter (A) ersetzen, in den eine Vakuum-Elutionsdurchstechflasche mit dem gewählten Elutionsvolumen eingesetzt wurde (13).
Die Elution kann durch das Bleiglasfenster (14) des Behälters (A) beobachtet werden.
Die Elution ist nach zwei Minuten abgeschlossen.
Vor der Anwendung prüfen, ob das Eluat klar ist. Wenn es nicht klar erscheint, ist es zu verwerfen. Nach der Elution sofort die Durchstechflasche zum Schutz der Elutionsnadel wieder aufsetzen, um die Nadel steril zu halten.
Elutionsvolumina
Der TEKCIS-Generator ist für die Elution der gesamten verfügbaren Technetium-99m-Aktivität in einem Volumen von 5 ml ausgelegt. Fraktionierte Elutionen sind daher nicht erforderlich. Eine Elution auf grössere Volumina kann jedoch durchgeführt werden: 10 ml oder 15 ml.
Anwendungsmöglichkeiten
Die auf dem Etikett des Generators angegebene Aktivität bezieht sich auf Technetium-99m zum Kalibrierungszeitpunkt (12 Uhr MEZ).
Die verfügbare Technetium-99m-Aktivität hängt ab von:
·der Molybdän-99-Aktivität zum Zeitpunkt der Elution
·der Zeit seit der letzten Elution
Qualitätskontrollen
Die Klarheit der Lösung und die Radioaktivität müssen vor jeder Anwendung überprüft werden.
Jedes Eluat ist durch das Bleiglasfenster des Elutionsbehälters einer Sichtprüfung zu unterziehen. Wenn das Eluat eine Trübung oder Färbung aufweist, darf es nicht verwendet werden. Die Zulassungsinhaberin ist umgehend zu informieren.
Die Prüfung auf Molybdän-99-Durchbruch durch den Anwender ist in Übereinstimmung mit der Verordnung über den Umgang mit offenen radioaktiven Strahlenquellen bzw. mit der in Monographie 0124 Ph. Eur. beschriebenen Methode vorzunehmen (Vorprüfung).
Weitere Informationen siehe Abschnitte „Physikalische Eigenschaften“ und „Chemische Eigenschaften“ unter „Eigenschaften/Wirkungen“.
Masse an Technetium ([99mTc] + [99Tc]) im Eluat:
Molybdän-99 zerfällt zu Technetium-99m (87,6 % des Molybdän-99-Zerfalls) und Technetium-99 (12,4 % des Molybdän-99-Zerfalls). Die Gesamtmasse an Technetium ([99mTc]+ [99Tc]) wird in μg des im Eluat vorhandenen Technetiums angegeben und kann mit der folgenden vereinfachten Formel berechnet werden:
|
M (µg) |
= |
Technetium-99m-Aktivität des Eluats x k |
|
F |
k = 5,161.10-3 (Aktivität in GBq)
F = Verhältnis zwischen der Anzahl der Technetium-99m-Atome (N99m) und der Gesamtzahl der Technetiumatome (Nt):
|
F |
= |
N99m |
|
Nt |
Die Werte für dieses Verhältnis (F) als Funktion des Intervalls zwischen zwei Elutionen sind in der Tabelle unten angeführt:
|
Stunden |
Tage | ||||||
|
|
0 |
1 |
2 |
3 |
4 |
5 |
6 |
|
0 |
- |
0,277 |
0,131 |
0,076 |
0,0498 |
0,0344 |
0,0246 |
|
3 |
0,727 |
0,248 |
0,121 |
0,072 |
0,0474 |
0,0329 |
0,0236 |
|
6 |
0,619 |
0,223 |
0,113 |
0,068 |
0,0452 |
0,0315 |
0,0227 |
|
9 |
0,531 |
0,202 |
0,105 |
0,064 |
0,0431 |
0,0302 |
0,0218 |
|
12 |
0,459 |
0,184 |
0,098 |
0,061 |
0,0411 |
0,0290 |
0,0210 |
|
15 |
0,400 |
0,168 |
0,092 |
0,058 |
0,0393 |
0,0278 |
0,0202 |
|
18 |
0,352 |
0,154 |
0,086 |
0,055 |
0,0375 |
0,0266 |
0,0194 |
|
21 |
0,311 |
0,141 |
0,081 |
0,052 |
0,0359 |
0,0256 |
0,0187 |
Beispiele:
Technetium-99m wird von einem Generator in 5 ml eluiert; die gemessene Aktivität beträgt 10 GBq; die letzte Elution wurde 27 Stunden zuvor durchgeführt.
Die Masse an Technetium beträgt:
|
M (µg) |
= |
10 x 5,161 x 10-3 |
= |
0,208 µg |
|
0,248 |
Dies ergibt 0,042 µg/ml.
Technetium-99m wird von einem Generator 4 Tage nach der Herstellung eluiert (dies entspricht der ersten Elution). Bei einer in 5 ml eluierten Aktivität von 10 GBq beträgt die Masse an Technetium:
|
M (µg) |
= |
10 x 5,161 x 10-3 |
= |
1,036 µg |
|
0,0498 |
Dies ergibt 0,207 μg/ml, d. h. fünfmal mehr Technetium als im vorherigen Beispiel.
Wenngleich diese Technetiummenge gering ist, kann sie bei bestimmten Verbindungen die Markierungsausbeute beeinflussen.
Vorsichtsmassnahmen für die Handhabung
Ohne zusätzliche Abschirmung beläuft sich die in Kontakt mit dem Generator gemessene Dosisrate maximal auf:
|
Nominale Aktivität des Generators, ausgedrückt in Technetium-99m, eluierbar zum Referenzzeitpunkt (GBq) |
2 |
4 |
6 |
8 |
10 |
12 |
16 |
20 |
25 |
50 ** |
|
Maximale Dosisrate* |
0,2 |
0,5 |
0,75 |
1,0 |
1,2 |
1,4 |
1,9 |
2,4 |
3 |
2,8 |
* gemessen am Fabrikationstag für einen auf 8 Tage kalibrierten Generator
** Generatoren bis zu 25 GBq sind durch eine Bleiabschirmung geschützt, Generatoren mit 50 GBq weisen eine Wolframabschirmung auf.
Gesetzliche Bestimmungen
Strahlenschutzhinweis
Verabreichung radioaktiver Produkte beim Menschen wird durch die „Strahlenschutzverordnung“ bzw. die Verordnung über den Umgang mit offenen radioaktiven Strahlenquellen (jeweils in der aktuellen Fassung) geregelt. Radiopharmazeutische Produkte dürfen nur von befugtem Personal in Abteilungen mit entsprechender Genehmigung in Empfang genommen, verwendet und verabreicht werden. Empfang, Lagerung, Verwendung, Transfer und Entsorgung dieser Produkte unterliegen einer vorherigen Genehmigung durch das Bundesamt für Gesundheit.
Abfallbeseitigung
Während der Anwendung radioaktiver Produkte und der Entsorgung der von ihrer Verwendung stammenden radioaktiven Abfallmaterialien sind sämtliche in der genannten Verordnung beschriebenen Vorsichtsmassnahmen einzuhalten, um die Strahlenbelastung des Patienten und des Pflegepersonals auf ein absolutes Mindestmass zu beschränken. Nicht verwendete Lösung sowie während ihrer Anwendung kontaminiertes Material müssen an einem dafür vorgesehen Ort gelagert werden, bis die Radioaktivität den Schwellenwert für die verträgliche Radioaktivität des betreffenden Isotops erreicht hat. Die Anwendung von Radiopharmazeutika setzt andere Personen im Umfeld des Patienten einem Risiko durch externe Strahlung oder Kontamination durch Urin, Erbrochenes und Schleim aus. Daher müssen Strahlenschutzmassnahmen gemäss den nationalen Vorschriften eingehalten werden.
Zulassungsnummer
62442
Packungen
(99mTc)-Technetium-Generator
|
Tc-99m-Aktivität (T 12 h MEZ) |
2 |
4 |
6 |
8 |
10 |
12 |
16 |
20 |
25 |
50 |
GBq |
Der TEKCIS-Generator wird in einem Transportbehälter des Typs A geliefert.
Im Lieferumfang des Generators enthaltenes Zubehör:
·1 Beutel mit 7 sterilen, pyrogenfreien, teilevakuierten Elutionsdurchstechflaschen (TC-ELU-5) zur Elution von 5 ml bis 6 ml.
·1 sterile Durchstechflasche zum Schutz der Elutionsnadel (STE-ELU).
·Jede Elutionsdurchstechflasche oder Durchstechflasche zum Schutz der Elutionsnadel zu 15 ml besteht aus farblosem Typ-I-Glas (Ph. Eur.) und ist mit einem Gummistopfen verschlossen und mit einer Aluminiumkappe versiegelt.
·1 Elutionsbehälter (12) ist in der Erstlieferung inbegriffen.
Weiteres lieferbares Zubehör:
·Elutionsdurchstechflaschen zu 15 ml:teilevakuierte Durchstechflaschen zur Elution von 5 bis 6 ml (TC-ELU-5)teilevakuierte Durchstechflaschen zur Elution von 9 bis 11 ml (TC-ELU-10)- Vakuum-Durchstechflaschen zur Elution von 14 bis 16 ml (TC-ELU-15)
·Zusätzliche Bleiabschirmung für den TEKCIS-Generator: PROTECT ELU
Abgabekategorie A
Zulassungsinhaberin
b.e.imaging AG
6430 Schwyz
Stand der Information
August 2023