Zusammensetzung
Wirkstoffe
Glucagon
Hilfsstoffe
Beta-Cyclodextrin, Dodecylphosphocholin
Indikationen/Anwendungsmöglichkeiten
Baqsimi ist indiziert zur Behandlung schwerer Hypoglykämie bei Erwachsenen, Jugendlichen und Kindern ab 4 Jahren mit Diabetes mellitus.
Dosierung/Anwendung
Übliche Dosierung
Erwachsene, Jugendliche und Kinder ab 4 Jahren
Die Anwendung von Baqsimi bei Erwachsenen, Jugendlichen und Kindern erfolgt intranasal als 3 mg Einzeldosis.
Spezielle Dosierungsanweisungen
Patienten mit Leberfunktionsstörungen
Eine Dosisanpassung in Abhängigkeit der Leberfunktion ist nicht erforderlich. Formale Studien zur Beurteilung bei eingeschränkter Leberfunktion wurden nicht durchgeführt.
Patienten mit Nierenfunktionsstörungen
Eine Dosisanpassung in Abhängigkeit der Nierenfunktion ist nicht erforderlich. Formale Studien zur Beurteilung bei eingeschränkter Nierenfunktion wurden nicht durchgeführt.
Ältere Patienten
Eine Dosisanpassung in Abhängigkeit des Alters ist nicht erforderlich.
Kinder und Jugendliche
Baqsimi ist nicht empfohlen bei Kindern unter 4 Jahren, da es in dieser Altersgruppe nicht untersucht wurde.
Art der Anwendung
Nasale Anwendung. Baqsimi wird in eines der Nasenlöcher appliziert. Glucagon wird passiv über die Nasenschleimhaut absorbiert. Es ist nicht erforderlich, nach der Anwendung zu inhalieren oder tief einzuatmen.
Kontraindikationen
Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe.
Glucagon Pulver zur nasalen Anwendung ist ebenfalls kontraindiziert bei Patienten mit Phäochromozytom.
Warnhinweise und Vorsichtsmassnahmen
Phäochromozytom
Bei Phäochromozytom kann Glucagon die Freisetzung von Catecholaminen aus dem Tumor stimulieren. Sollte der Patient einen dramatischen Blutdruckanstieg entwickeln, hat der Gebrauch nichtselektiver α-adrenerger Blockade eine wirksame Senkung des Blutdrucks gezeigt.
Insulinom
Bei Patienten mit Insulinom kann die Gabe von Glucagon einen initialen Anstieg des Blutzuckers hervorrufen; jedoch kann die Gabe von Glucagon eine direkte oder indirekte (vermittelt durch einen initialen Anstieg des Blutzuckers) übersteigerte Insulinfreisetzung aus dem Insulinom hervorrufen und eine Hypoglykämie verursachen. Ein Patient, der nach Gabe von Glucagon Symptome einer Hypoglykämie zeigt, sollte Glucose oral oder intravenös erhalten.
Überempfindlichkeit und allergische Reaktionen
Allergische Reaktionen, die unter Glucagon berichtet wurden, können auftreten und beinhalten generalisierten Ausschlag und in manchen Fällen anaphylaktischer Schock mit Atemschwierigkeiten und Hypotonie.
Glykogenspeicher und Hypoglykämie
Glucagon ist zur Behandlung der Hypoglykämie nur wirksam, wenn in der Leber ausreichend Glykogen vorhanden ist. Da Glucagon in Hungerphasen, bei Nebenniereninsuffizienz oder chronischer Hypoglykämie von geringem oder ohne Nutzen ist, sollten diese Zustände mit Glucose behandelt werden.
Zur Vorbeugung eines Rückfalls in die Hypoglykämie sollten orale Kohlenhydrate gegeben werden, um das Leberglycogen wiederherzustellen, sobald der Patient auf die Therapie angesprochen hat.
Interaktionen
Spezielle Arzneimittel-Interaktionsstudien mit Baqsimi wurden nicht durchgeführt.
Betablocker
Bei Patienten, die Betablocker nehmen, könnte vorübergehend ein Anstieg von Puls und Blutdruck auftreten, der aber auf Grund der kurzen Halbwertszeit von Glukagon zeitlich begrenzt ist.
Indometacin
Bei Anwendung mit Indometacin kann Glucagon seine Fähigkeit, den Blutzuckerspiegel zu erhöhen, verlieren oder sogar Hypoglykämie hervorrufen.
Warfarin
Glucagon kann die gerinnungshemmende Wirkung von Warfarin erhöhen.
Schwangerschaft, Stillzeit
Schwangerschaft
Glucagon passiert die Plazentaschranke nicht, daher wurden mit Glucagon Pulver zur nasalen Anwendung keine tierexperimentellen Studien zur Reproduktion oder Fertilität durchgeführt.
Glucagon Pulver zur nasalen Anwendung darf in der Schwangerschaft nur angewendet werden, wenn der mögliche Nutzen das unbekannte Risiko für Mutter oder Fetus rechtfertigt.
Stillzeit
Die sichere Anwendung von Glucagon Pulver zur nasalen Anwendung während der Stillzeit wurde nicht gezeigt und es ist nicht bekannt, ob Glucagon über die Muttermilch ausgeschieden wird. Klinische Studien bei stillenden Müttern wurden nicht durchgeführt. Glucagon ist ein Peptid und intaktes Glucagon wird nicht aus dem Gastrointestinaltrakt resorbiert. Daher ist eine Wirkung auf das Kind unwahrscheinlich, auch wenn das Kind Glucagon über die Muttermilch aufgenommen hat.
Fertilität
Mit Glucagon Pulver zur nasalen Anwendung wurden keine Studien zur Fertilität durchgeführt.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Studien zu den Wirkungen auf die Fahrtüchtigkeit oder die Fähigkeit zum Bedienen von Maschinen wurden nicht durchgeführt. Die Fähigkeit des Patienten sich zu konzentrieren und zu reagieren kann infolge der Hypoglykämie eingeschränkt sein. Dies kann ein Risiko darstellen in Situationen, in denen diese Fähigkeiten besonders wichtig sind, wie beim Fahren oder Bedienen von Maschinen.
Unerwünschte Wirkungen
Die am häufigsten berichteten unerwünschten Wirkungen sind Übelkeit, Erbrechen, Kopfschmerzen und Irritation der oberen Atemwege.
Insgesamt erhielten 499 Patienten, darunter 70 Patienten <18 Jahre, Studienmedikation (entweder Glucagon zur nasalen Anwendung (NG) oder Glucagon zur subkuntanen Anwendung (CG)) in 11 beendeten klinischen Studien. Von diesen Patienten erhielten 461 NG, wobei 421 Patienten die zur Zulassung vorgeschlagene 3 mg Dosis erhalten haben. In der Gruppe der 461 NG Patienten hatten 365 Patienten Diabetes Mellitus Typ 1 (T1D), 44 waren Patienten mit Diabetes Mellitus Typ 2 (T2D) und 52 waren Erwachsene ohne Diabetes. Insgesamt 234 Patienten erhielten CG in der zugelassenen Dosis von 0,5 mg oder 1 mg. Da in den meisten Studien ein Cross-over-Design verwendet wurde, haben viele Patienten NG und CG erhalten, und somit ist die Gesamtanzahl der Patienten niedriger als die Summe der NG-Patienten und der CG-Patienten.
Liste der unerwünschten Wirkungen in klinischen Studien
Die Häufigkeiten der unerwünschten Wirkungen werden wie folgt angegeben: «sehr häufig» (≥1/10), «häufig» (<1/10, ≥1/100), «gelegentlich» (<1/100, ≥1/1000), «selten» (<1/1000, ≥1/10'000), «sehr selten» (<1/10'000).
Zulassungsstudien Typ 1 und Typ 2 Diabetes (n = 83).
Erkrankungen des Nervensystems
Sehr häufig: Kopfschmerzen.
Augenerkrankungen
Häufig: Vermehrte Tränenbildung, Okulare Hyperämie, Augenjucken.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Sehr häufig: Irritation der oberen Atemwegea.
Erkrankungen des Gastrointestinaltrakts
Sehr häufig: Erbrechen, Übelkeit.
Erkrankungen der Haut und des Unterhautzellgewebes
Häufig: Juckreiz.
Untersuchungend
Häufig: Erhöhter systolischer Blutdruck, Erhöhter diastolischer Blutdruck.
Konfirmatorische Studie Typ 1 Diabetes (n = 70)e.
Erkrankungen des Nervensystems
Sehr häufig: Kopfschmerzen.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Häufig: Irritation der oberen Atemwegeb.
Erkrankungen des Gastrointestinaltrakts
Sehr häufig: Erbrechen, Übelkeit.
Untersuchungend
Sehr häufig: Erhöhter diastolischer Blutdruck.
Häufig: Erhöhter systolischer Blutdruck.
Zulassungsstudie bei Kindern mit Typ 1 Diabetes (n = 36)e.
Erkrankungen des Nervensystems
Sehr häufig: Kopfschmerzen.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Sehr häufig: Irritation der oberen Atemwegec.
Erkrankungen des Gastrointestinaltrakts
Sehr häufig: Erbrechen, Übelkeit.
Untersuchungend
Häufig: Erhöhter diastolischer Blutdruck.
a Irritation der oberen Atemwege: Rhinorrhoe, nasale Beschwerden und verstopfte Nase
b Irritation der oberen Atemwege: Husten und Epistaxis
c Irritation der oberen Atemwege: nasale Beschwerden, verstopfte Nase und Niesen
d Anstieg des Blutdrucks: Beurteilt anhand von Messungen der Vitalzeichen. Die Häufigkeiten basierten auf den Verschiebungen der Werte, die vor und nach der Therapie gemessen wurden
e Nicht alle unerwünschten Wirkungen aus der Zulassungsstudie bei Erwachsenen (n = 83) wurden in der konfirmatorischen Studie bei Erwachsenen (n = 70) und in der Zulassungsstudie bei Kindern (n = 36) berichtet; daher sind die geschätzten Häufigkeiten im konfirmatorischen Abschnitt bei Erwachsenen oder im Abschnitt zu Kindern nicht widergegeben
Andere klinisch relevante Ergebnisse, die über die klinischen Studien mit Glucagon Pulver zur nasalen Anwendung hinweg beobachtet wurden, waren Dysgeusie und erhöhte Herzfrequenz (häufig), sowie weitere Ereignisse zu Irritation der oberen Atemwege (sehr häufig), bestehend aus nasaler Juckreiz, Irritation des Rachens und Parosmie.
Beschreibung ausgewählter Nebenwirkungen
Übelkeit/Erbrechen
Diese Ereignisse wurden sehr häufig und mit ähnlicher Inzidenz in den klinischen Studien für Erwachsene und Kinder, die 3 mg NG oder IMG (intramuskuläres Glucagon) erhalten hatten, berichtet. Diese Ereignisse waren meistens leicht oder mittelschwer, keines war schwerwiegend.
Die Daten weisen nicht auf ein vermehrtes Auftreten von Übelkeit oder Erbrachen unter NG Therapie hin, gegenüber der derzeit vermarkteten Glucagon-Injektionszubereitungen.
Immunogenität und Überempfindlichkeits-Reaktionen
Insgesamt war bei Patienten unter Glucagon die Inzidenz von Antikörpern gegen das Arzneimittel, die während der Therapie aufgetretenen sind, niedrig, und es wurden keine gegen das Arzneimittel gerichteten neutralisierenden Antikörper gefunden.
Die berichteten Überempfindlichkeits-Ereignisse waren üblicherweise leicht oder mittelschwer und keines war schwerwiegend. Kein Patient brach die Therapie aufgrund eines Überempfindlichkeits-Ereignisses ab.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Bei einer Überdosierung kann es bei Patienten zu Übelkeit, Erbrechen, Hemmung der gastrointestinalen Motilität, sowie Anstieg von Blutdruck und Herzfrequenz kommen. Bei vermuteter Überdosierung kann das Serumkalium absinken und sollte überwacht und bei Bedarf korrigiert werden. Wenn der Patient einen dramatischen Blutdruckanstieg entwickelt, hat die Anwendung einer nichtselektiven α-adrenergen Blockade eine wirksame Senkung des Blutdrucks gezeigt, für die kurze Zeit, in der eine Kontrolle nötig gewesen wäre.
Eigenschaften/Wirkungen
ATC-Code
H04AA01
Wirkungsmechanismus
Glucagon steigert die Blutzucker-Konzentration durch Aktivierung hepatischer Glucagonrezeptoren, wodurch der Abbau von Glykogen und die Freisetzung von Glucose aus der Leber stimuliert wird. Hepatische Glykogen-Speicher sind erforderlich, damit Glucagon eine anti-hypoglykämische Wirkung hervorrufen kann.
Pharmakodynamik
Geschlecht und Körpergewicht hatten keinen klinisch bedeutsamen Einfluss auf die Pharmakodynamik von Glucagon Pulver zur nasalen Anwendung.
Nach Gabe von Glucagon Pulver zur nasalen Anwendung bei erwachsenen Patienten mit Typ 1 Diabetes begannen die Glucosewert bereits nach 5 Minuten anzusteigen (Abbildung 1). Innerhalb von 10 Minuten lag der mediane Glucosewert über 3.9 mmol/l (70 mg/dl). Der durchschnittliche maximale Glucoseanstieg betrug 7.8 mmol/l (140 mg/dl).
Bei pädiatrischen Patienten mit Typ 1 Diabetes (4 bis <17 Jahre) begannen die Glucosewerte nach Gabe von Glucagon Pulver zur nasalen Anwendung bereits nach 5 Minuten anzusteigen (Abbildung 2) mit einem durchschnittlichen maximalen Glucoseanstieg von 5.7 mmol/l (102 mg/dl) bis 7.7 mmol/l (138 mg/dl).
Eine gewöhnliche Erkältung mit verstopfter Nase mit oder ohne begleitende Anwendung von Medikamenten zum Abschwellen der Nasenschleimhaut hatte keinen Einfluss auf die Pharmakodynamik von Glucagon Pulver zur nasalen Anwendung.
Abbildung 1. Mittlere Glucose-Konzentration im Zeitverlauf bei erwachsenen Patienten mit Typ 1 Diabetes.
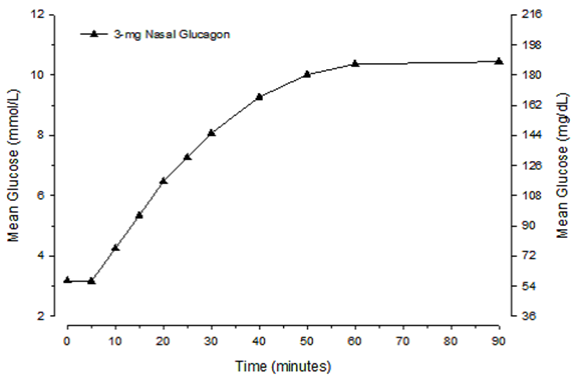
Abbildung 2. Mittlere Glucose-Konzentration im Zeitverlauf bei pädiatrischen Patienten mit Typ 1 Diabetes.
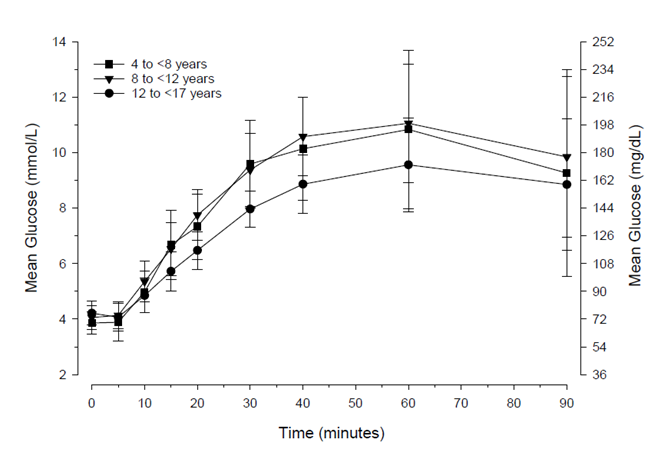
Klinische Wirksamkeit
Die Zulassungsstudie bei Erwachsenen war eine randomisierte, multizentrische, offene Studie über 2 Phasen im Cross-over Design bei erwachsenen Patienten mit Typ 1 Diabetes oder Typ 2 Diabetes. Primärer Endpunkt war der Vergleich der Wirksamkeit einer Baqsimi 3 mg Einzeldosis mit einer Dosis von 1 mg Glucagon intramuskulär (i.m) bei erwachsenen Patienten mit Typ 1 Diabetes. Die Blutzuckerwerte wurden mit Insulin in den hypoglykämischen Bereich gesenkt, mit einem Ziel-Nadir des Blutzuckers von <2.8 mmol/l (<50 mg/dl).
Die Zulassungsstudie schloss insgesamt 83 Patienten im Alter von 18 bis <65 Jahre ein. Bei 77 Patienten bestand ein Typ 1 Diabetes, bei einem mittleren Alter von 32.9 Jahren und einer mittleren Diabetesdauer von 18.1 Jahren, wobei 45 (58%) der Patienten Frauen waren. Das mittlere Alter der Patienten mit Typ 2 Diabetes (n = 6) betrug 47.8 Jahre, mit einer mittleren Diabetesdauer von 18.8 Jahren, wobei 4 (67%) der Patienten Frauen waren.
Das primäre Wirksamkeitsergebnis war der Anteil der Patienten mit erreichtem Therapieerfolg, definiert als entweder ein Anstieg des Blutzuckers auf ≥3.9 mmol/l (≥70 mg/dl) oder ein Anstieg um ≥1.1 mmol/l (≥20 mg/dl) gegenüber des Glucose-Nadir innerhalb von 30 Minuten nach Gabe des Studienglucagons, ohne weitere Massnahmen zur Steigerung der Blutzuckerwerte. Der Glucose-Nadir war definiert als die niedrigste Glucosemessung zum Zeitpunkt oder innerhalb von 10 Minuten nach Gabe von Glucagon.
Bei Patienten mit Typ 1 Diabetes betrug der mittlere Glucose-Nadir 2.5 mmol/l (44.2 mg/dl) für Baqsimi und 2.7 mmol/l (48.9 mg/dl) für i.m. Glucagon. Baqsimi zeigte seine Nichtunterlegenheit gegenüber i.m. Glucagon zur Erhöhung des Blutzuckerspiegels bei der Insulin-induzierten Hypoglykämie, wobei 98.7% der Patienten unter Baqsimi und 100% der Patienten unter Glucagon i.m. innerhalb von 30 Minuten einen Therapieerfolg erzielten (Tabelle 1). Alle Patienten erreichten die Glucose-Kriterien für einen Therapieerfolg innerhalb von 40 Minuten. Alle Patienten mit Typ 2 Diabetes (100%) erreichten einen Therapieerfolg innerhalb von 30 Minuten.
Die durchschnittliche Zeit bis zum Therapieerfolg betrug 16.2 und 12.2 Minuten unter Baqsimi und Glucagon 1 mg i.m. respetive. Die Zeit bis zum Therapieerfolg entspricht der Zeit von der Glucagon-Gabe bis zum Zeitpunkt, an dem der Patient den Therapieerfolg erreicht. Die Zeit, die in der Kontrollgruppe für die Rekonstitution und Vorbereitung der intramuskulären Injektion benötigt wurde, ist nicht beinhaltet.
Innerhalb von 30 Minuten nach Gabe von Glucagon zeigten Patienten unter Baqsimi und Glucagon i.m. ähnliche Verbesserungen der Hypoglykämie-Symptome, beurteilt anhand des Edinburgh Hypoglycaemia Symptom Questionnaire.
Tabelle 1. Patienten mit erreichtem Therapieerfolg und weiteren Glucose-Kriterien in der Zulassungsstudie
|
|
Typ 1 Diabetes |
Typ 1 und Typ 2 Diabetes | ||
|
Baqsimi |
Glucagon i.m. |
Baqsimi |
Glucagon i.m. | |
|
Therapieerfolg – n (%) |
74 (98.7%) |
75 (100%) |
79 (98.8%) |
80 (100%) |
|
Therapieunterschied (1-seitiges Konfidenzintervall, oberes Limit 97.5%) b, c |
1.3% (4.0%) |
1.3% (3.7%) | ||
|
Glucose-Kriterien erreicht – n (%)d | ||||
|
(i) ≥3.9 mmol/l (≥70 mg/dl) |
72 (97%) |
74 (99%) |
77 (97%) |
79 (99%) |
|
(ii) Anstieg um ≥1.1 mmol/l |
74 (100%) |
75 (100%) |
79 (100%) |
80 (100%) |
|
Beides, (i) und (ii) |
72 (97%) |
74 (99%) |
77 (97%) |
79 (99%) |
a Die ausgewertete Wirksamkeitspopulation enthielt alle Patienten, die beide Studiendosierungen erhalten haben, mit auswertbarem primärem Ergebnis.
b Differenz berechnet als (prozentualer Anteil mit Erfolg unter Glucagon i.m.) – (prozentualer Anteil mit Erfolg unter Baqsimi).
c 1-seitiges Konfidenzintervall (confidence interval, CI) aus einem 1-Muster Mittelwert der gepaarten Differenzen bei Erreichen des Therapieerfolges; Nicht-unterlegenheitsgrenze = 10%.
d Prozentualer Anteil auf Basis der Anzahl Patienten mit erreichtem Thrapieerfolg.
In eine konfirmatorische Studie mit ähnlichem Design wurden 70 Patienten mit Typ 1 Diabetes eingeschlossen, mit einem mittleren Alter von 41.7 Jahren und einer mittleren Diabetesdauer von 19.8 Jahren; 27 (39%) waren Frauen. Mit Insulin wurden die Blutzucker-Werte auf <3.3 mmol/l (<60 mg/dl) gesenkt.
Der mittlere Nadir des Blutzuckers betrug 3.0 mmol/l (54.2 mg/dl) für Baqsimi und 3.1 mmol/l (55.7 mg/dl) für Glucagon i.m. Baqsimi zeigte Nichtunterlegenheit im Vergleich zu Glucagon i.m. bei der bei Erhöhung des Blutzuckers der Insulin-induzierten Hypoglykämie, wobei 100% der Patienten unter Baqsimi und 100% der Patienten unter Glucagon i.m. einen Therapieerfolg erreichten (Tabelle 2). Die durchschnittliche Zeit bis zum Therapieerfolg betrug 11.4 und 9.9 Minuten unter Baqsimi und Glucagon 1 mg i.m respektive.
Tabelle 2. Patienten mit erreichtem Therapieerfolg und anderen Glucose-Kriterien in der konfirmatorischen Studie
|
|
Type 1 Diabetes | |
|
Baqsimi |
Glucagon i.m. | |
|
Therapieerfolg – n (%) |
66 (100%) |
66 (100%) |
|
Therapieunterschied (1-seitiges Konfidenzintervall, oberes Limit 97.5%) b, c |
0% (-1.5%, 1.5%)c | |
|
Glucose criterion met – n (%)d | ||
|
(i) ≥3.9 mmol/l (≥70 mg/dl) |
66 (100%) |
66 (100%) |
|
(ii) Anstieg um ≥1.1 mmol/l (≥20 mg/dl) ab Nadir |
66 (100%) |
66 (100%) |
|
Beides, (i) und (ii) |
66 (100%) |
66 (100%) |
a Die ausgewertete Wirksamkeitspopulation enthielt alle Patienten, die beide Studiendosierungen erhalten haben, mit auswertbarem primärem Ergebnis.
b Differenz berechnet als (prozentualer Anteil mit Erfolg unter Glucagon i.m.) – (prozentualer Anteil mit Erfolg unter Baqsimi); Nichtunterlegenheitsgrenze = 10%
c 2-seitiges 95% Konfidenzintervall (confidence interval, CI) gemäss Wald-Methode mit Korrektur auf Kontinuität.
In einer Studie bei Erwachsenen zur eigentlichen Anwendung erhielten Patienten mit Typ 1 Diabetes und deren Pflegepersonal Baqsimi zur Therapie mittelschwerer oder schwerer hypoglykämischer Ereignisse zu Hause oder auf der Arbeit. In der Wirksamkeitsauswertung wurden insgesamt 157 mittelschwere oder schwere hypoglykämische Ereignisse berücksichtigt, die von 69 Patienten berichtet worden waren; bei 151 (96.2%) der Ereignisse wachten die Patienten innerhalb von 30 Minuten nach Gabe von Baqsimi auf oder erlangten einen normalen Status wieder. Bei allen (100%) 12 schweren hypoglykämischen Ereignissen wachten die Patienten innerhalb von 5 bis 15 Minuten nach Gabe von Baqsimi auf, die Konvulsionen stoppten oder ein normaler Status wurde wiedererlangt.
Sicherheit und Wirksamkeit bei pädiatrischen Patienten
Die pädiatrische Zulassungsstudie war eine randomisierte, multizentrische, klinische Studie und untersuchte Baqsimi im Vergleich zu Glucagon intramuskulär (i.m.) bei Kindern und Jugendlichen mit Typ 1 Diabetes. Glucagon wurde verabreicht, nachdem die Glucose am Tag der Dosisgabe <4.4 mmol/l (<80 mg/dl) gefallen war. Die Wirksamkeit wurde beurteilt anhand des Anteils der Patienten mit einem Anstieg der Glucose um ≥1.1 mmol/l (≥20 mg/dl) gegenüber dem Glucose-Nadir innerhalb von 30 Minuten nach Glucagon-Gabe.
48 Patienten wurden in die Studie eingeschlossen und erhielten mindestens eine Studiendosis. Das mittlere Alter der Kohorte junger Kinder (4 bis <8 Jahre) betrug 6.5 Jahre. In der Kohorte der Kinder (8 bis <12 Jahre) betrug das mittlere Alter 11.1 Jahre und in der Kohorte der Jugendlichen (12 bis <17 Jahre) lag das mittlere Alter bei 14.6 Jahren. In allen Alters-Kohorten waren die Populationen überwiegend männlich und weiss.
In allen Altersgruppen zeigten 3 mg Baqsimi und 0.5 mg oder 1 mg Glucagon i.m. (auf Basis des Körpergewichts) ein ähnliches glykämisches Ansprechen. Alle (100%) Patienten in beiden Therapiearmen über alle Altersgruppen hinweg erreichten einen Anstieg der Glucose um ≥1.1 mmol/l (≥20 mg/dl) ab dem Glucose-Nadir, innerhalb von 20 Minuten nach Glucagon-Gabe (Tabelle 3).
Die durchschnittliche Zeit bis zum Erreichen des Glucoseanstiegs um ≥1.1 mmol/l (≥20 mg/dl) war in allen Altersgruppen ähnlich zwischen Baqsimi und Glucagon i.m.
Tabelle 3. Mittlere Zeit bis zum Glucose-Anstieg ≥1.1 mmol/l (≥20 mg/dl) gegenüber dem Nadir in der pädiatrischen Zulassungsstudie
|
|
Mittlere Zeit nach Glucagon-Gabe (Minuten) | |||||
|
Anstieg gegenüber Nadir |
Junge Kinder |
Kinder |
Jugendliche | |||
|
|
Glucagon i.m.a |
Baqsimi |
Glucagon i.m.a |
Baqsimi |
Glucagon i.m.a |
Baqsimi |
|
≥1.1 mmol/l |
10.0 |
10.8 |
12.5 |
11.3 |
12.5 |
14.2 |
a 0.5 mg oder 1 mg Glucagon i.m. (auf Grundlage des Körpergewichts)
In einer pädiatrischen Studie zur eigentlichen Anwendung erhielten Patienten im Alter von 4 bis <18 Jahre mit Typ 1 Diabetes und deren Pflegepersonal Baqsimi 3 mg zur Therapie mittelschwerer oder schwerer hypoglykämischer Ereignisse zu Hause oder in der Schule. In der Wirksamkeitsauswertung wurden insgesamt 33 mittelschwere hypoglykämische Ereignisse berücksichtigt, die von 14 Patienten berichtet worden waren. Bei allen Ereignissen, auch bei klinisch signifikanter Hypoglykämie mit einem Glucose-Wert <3.0 mmol/l (<54 mg/dl) erlangten die Patienten innerhalb von 5 bis 30 Minuten nach Gabe von Baqsimi einen normalen Status wieder.
Pharmakokinetik
Absorption
Die nasale Absorption von Glucagon erreicht durchschnittlich maximale Plasmakonzentrationen von 6.130 pg/ml nach 15 Minuten.
Distribution
Das scheinbare Verteilungsvolumen von Glucagon betrug etwa 885 l bei nasaler Anwendung.
Metabolismus
Von Glucagon ist bekannt, dass es in der Leber, den Nieren und im Plasma abgebaut wird.
Elimination
Die mediane Halbwertszeit von Glucagon betrug etwa 35 Minuten bei nasaler Anwendung.
Kinetik spezieller Patientengruppen
Formale Studien zur Beurteilung bei Einschränkung der Nieren- oder Leberfunktion wurden nicht durchgeführt.
Bei pädiatrischen Patienten (4 bis <17Jahre) wurden die durchschnittlichen maximalen Plasmakonzentrationen bei nasaler Anwendung nach 15 bis 20 Minuten erreicht. Die mediane Halbwertszeit von Glucagon betrug 21 bis 31 Minuten bei nasaler Anwendung.
Gewöhnliche Erkältung und Verwendung von Medikamenten zum Abschwellen der Nasenschleimhaut
Eine gewöhnliche Erkältung mit verstopfter Nase mit oder ohne begleitende Anwendung von Medikamenten zum Abschwellen der Nasenschleimhaut hatte keinen Einfluss auf die Pharmakokinetik bei nasaler Anwendung.
Präklinische Daten
Nicht-klinische Daten aus Studien mit Glucagon Pulver zur nasalen Anwendung zeigten keine speziellen Gefahren für den Menschen, beurteilt anhand konventioneller Studien zur Sicherheitspharmakologie, Toxizität bei wiederholter Gabe und lokalen Verträglichkeit.
Studien mit Glucagon Pulver zur nasalen Anwendung zur Untersuchung des Potentials für Karzinogenität, Gentoxizität, Reproduktionstoxizität oder Einschränkung der Fertilität wurden nicht durchgeführt.
Sonstige Hinweise
Inkompatibilitäten
Nicht zutreffend (Applikator zur einmaligen nasalen Anwendung).
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Glucagon Pulver zur nasalen Anwendung muss in seinem in Kunststofffolie verschweissten Röhrchen verbleiben, bis es bereit zur Anwendung ist.
Wenn das Röhrchen geöffnet wurde, kann möglicherweise Feuchtigkeit in den Applikator gelangt sein. Dies kann dazu führen, dass Baqsimi nicht wie erwartet wirkt.
Das eingeschweisste Röhrchen soll von Zeit zu Zeit geprüft werden. Wenn das Röhrchen geöffnet wurde, soll das Arzneimittel ersetzt werden
Nicht über 30 °C lagern.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Baqsimi ist ein für die Einmalanwendung vorgesehener Applikator zur nasalen Anwendung. Die direkte Verpackung (Applikator) besteht aus Polyethylen und Polypropylen. Die sekundäre Verpackung (Röhrchen) besteht aus Polyethylen und Polypropylen und enthält ein Trockenmittel.
Dieses Produkt ist gebrauchsfertig.
Der Applikator enthält nur eine Dosis und darf vor der Anwendung daher nicht entlüftet oder getestet werden.
Die Bedienungsanleitung für den Gebrauch des Applikator, die in der Packungsbeilage enthalten ist, muss sorgfältig befolgt werden.
Nach der Verwendung sind der Applikator für die nasale Anwendung von Glucagon und das Röhrchen zu entsorgen.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend der lokalen Anforderungen zu entsorgen.
Zulassungsnummer
67465 (Swissmedic).
Packungen
Glucagon 3 mg Pulver zur nasalen Anwendung: 1 vorgefüllter Applikator (B)
Zulassungsinhaberin
Future Health Pharma GmbH, 8620 Wetzikon
Stand der Information
Juni 2020