Zusammensetzung
Wirkstoffe
Botulinumtoxin Typ A (150 kD) aus Clostridium botulinum (Stamm I01).
Hilfsstoffe
Dinatriumhydrogenphosphat-Dihydrat, Natriumdihydrogenphosphat-Dihydrat, Kaliumchlorid, Natriumchlorid, Polysorbat 80, L-Tryptophan, Wasser für Injektionszwecke.
Eine Durchstechflasche enthält 5.4 mg Natrium, 0.18 mg Kalium und 1.6 mg Polysorbate 80.
Indikationen/Anwendungsmöglichkeiten
Relfydess wird angewendet zur vorübergehenden Verbesserung des Erscheinungsbildes von:
·mittelstarken bis starken Glabellafalten bei maximalem Stirnrunzeln
·mittelstarken bis starken seitlichen Canthallinien bei maximalem Lächeln,
allein oder in Kombination, bei erwachsenen Patienten unter 65 Jahren, wenn das Ausmass dieser Falten eine erhebliche psychische Belastung für den Patienten darstellt.
Dosierung/Anwendung
Relfydess darf nur von Ärzten mit geeigneter Qualifikation angewendet werden, die die entsprechende Erfahrung mit dieser Behandlung haben und über die erforderliche Ausstattung verfügen.
Botulinumtoxin-Einheiten sind je nach Arzneimittel verschieden. Die Einheiten von Relfydess sind für das Arzneimittel spezifisch und nicht auf andere Botulinumtoxin-Präparate übertragbar.
Jede Durchstechflasche von Relfydess darf nur für einen einzigen Patienten während einer einzigen Behandlungssitzung verwendet werden. Nach der Behandlung verbleibende Produktreste sollten verworfen werden.
Die Dosierung und das Therapieintervall ist von dem festgestellten individuellen Ansprechen des jeweiligen Patienten abhängig. Das Therapieintervall mit Relfydess sollte nicht häufiger als alle 12 Wochen sein.
Bei der Behandlung erwachsener Patienten mit Relfydess gegen Glabellafalten und seitliche Canthalfalten, allein oder in Kombination, ist die kumulative Dosis zu berücksichtigen, wenn andere Botulinumtoxin-Produkte zur Behandlung anderer für diese Produkte zugelassener Indikationen verwendet werden oder wurden.
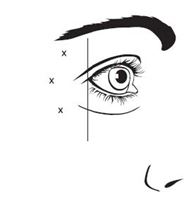
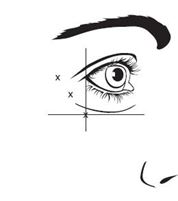
Die empfohlenen Injektionspunkte für Glabellafalten sind in Abbildung 1 beschrieben, die empfohlenen Injektionspunkte für die seitlichen Canthallinien in Abbildung 2.
Übliche Dosierung
Relfydess ist gebrauchsfertig mit einer Konzentration von 10 Einheiten pro 0,1 ml und muss nicht rekonstruiert werden.
Tabelle 1: Dosierungsanleitung für Relfydess
|
Behandlung(en) |
Empfohlene Gesamtdosis |
Dosis pro Injektion |
|
Glabellafalten (GL) |
50 Einheiten/0,5 mL |
5 Injektionen à 10 Einheiten/0,1 ml: |
|
Seitliche Canthallinien (LCL) |
60 Einheiten/0,6 mL |
6 Injektionen von 10 Einheiten/0,1 ml: |
|
Kombinierte Behandlung von Glabellafalten und seitlichen Canthallinien |
110 Einheiten/1,1 mL |
11 Injektionen von insgesamt 10 Einheiten/0,1 ml für kombinierte GL und LCL |
Glabellafalten
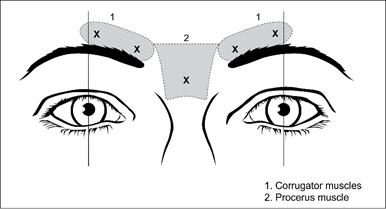
Die empfohlene Dosis für die Behandlung von Glabellafalten bei Erwachsenen beträgt insgesamt 50 Einheiten/0,5 ml, die durch intramuskuläre Injektion zu gleichen Teilen (10 Einheiten/0,1 ml pro Injektion) in jede der 5 intramuskulären Injektionsstellen verabreicht werden (siehe Abbildung 1): 2 Injektionen auf jeder Seite in den Corrugator-Muskel und 1 Injektion in den Procerus-Muskel in der Nähe des nasofrontalen Winkels.
Um das Risiko einer Ptosis der Augenlider zu mindern, sollten die folgenden Massnahmen ergriffen werden:
·Vermeiden Sie Injektionen in der Nähe des Musculus levator palpebrae superioris, insbesondere bei Patienten mit grösseren Brauen-Depressor-Komplexen.
·Die Injektionen in den seitlichen Corrugator sollten mindestens 1 Zentimeter über dem knöchernen Supraorbitalkamm platziert werden.
·Stellen Sie sicher, dass die injizierte Dosis (Volumen) genau ist.
·Die Injektion sollte nicht näher als 1 Zentimeter über der mittleren Augenbraue erfolgen.
Abbildung 1: Lage der Injektionsstellen für Glabellarlinien
Seitliche Canthallinien
Die empfohlene Dosis für die Behandlung der lateralen Canthallinien bei Erwachsenen beträgt insgesamt 60 Einheiten/0,6 ml, die durch intramuskuläre Injektion verabreicht werden, die zu gleichen Teilen in 10 Einheiten/0,1 ml in jede der 6 intramuskulären Injektionsstellen aufgeteilt wird (siehe Abbildung 2: Option 1 und Option 2): 3 Injektionen (30 Einheiten/0,3 mL) auf jeder Seite in den Musculus orbicularis oculi. Die Injektionen sollten mit der Nadel schräg nach oben und vom Auge weg gerichtet in den Musculus orbicularis oculi lateralis gegeben werden. Wenn Linien im Bereich des lateralen Canthus sowohl oberhalb als auch unterhalb des lateralen Canthus auftreten, injizieren Sie gemäss Option 1. Wenn die Linien in der lateralen Canthalregion hauptsächlich unterhalb des lateralen Canthus auftreten, injizieren Sie gemäss Option 2.
Abbildung 2: Lage der Injektionsstellen für die lateralen Canthallinien
|
Option 1: Oberhalb und unterhalb des lateralen Canthus |
Option 2: Unterhalb des lateralen Canthus | ||
|
|
|
|
|
Die anatomischen Orientierungspunkte der lateralen Canthallinie lassen sich leichter identifizieren, wenn sie beim maximalen Lächeln beobachtet und ertastet werden. Es muss darauf geachtet werden, dass die Musculi zygomatici major/minor nicht injiziert werden, um ein seitliches Absinken des Mundes und ein asymmetrisches Lächeln zu vermeiden.
Kombinierte Behandlung von Glabellafalten / lateralen Canthalfalten
Für die Kombinationsbehandlung von Glabellafalten und seitlichen Canthalfalten sollte die jeweilige Einzeldosierung und -verabreichung für eine Gesamtdosis von 110 Einheiten/1,1 ml von Relfydess befolgt werden.
Die empfohlene Dosis für die Behandlung von Glabellafalten beträgt 50 Einheiten/0,5 ml (10 Einheiten/0,1 ml pro Injektion in jede von 5 intramuskulären Injektionsstellen) und für die Behandlung der lateralen Canthalfalten 60 Einheiten/0,6 ml (10 Einheiten/0,1 ml in jede von 6 intramuskulären Injektionsstellen).
Allgemeine Informationen
Um die Rückverfolgbarkeit von biotechnologisch hergestellten Arzneimitteln sicherzustellen, wird empfohlen Handelsname und Chargennummer bei jeder Behandlung zu dokumentieren.
Wenn die Behandlung fehlschlägt oder die Wirkung bei Wiederholungsinjektionen nachlässt, sollten alternative Behandlungsmethoden angewendet werden. Bei Fehlschlagen der Behandlung nach der ersten Anwendung können folgende Massnahmen in Erwägung gezogen werden:
·Analyse der Gründe für das Therapieversagen, z.B. falsche Muskeln, in die injiziert wurde, oder ungeeignete Injektionstechnik, Bildung Toxin-neutralisierender Antikörper
·Erneute Überprüfung der Relevanz der Behandlung mit Botulinumtoxinum A
Therapiedauer
Sicherheit und Wirksamkeit von Wiederholungsinjektionen mit Relfydess wurden bis zu 12 Monaten und bis zu 7 wiederholten Behandlungszyklen überprüft.
Ältere Patienten
Es liegen begrenzte klinische Daten zur Anwendung von Relfydess bei Patienten über 65 Jahren vor. Die Anwendung von Relfydess bei Personen über 65 Jahren wird nicht empfohlen.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Relfydess bei Personen unter 18 Jahren wurde nicht nachgewiesen. Die Anwendung von Relfydess bei Personen unter 18 Jahren wird nicht empfohlen.
Kontraindikationen
Relfydess darf nicht angewendet werden bei:
·Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe gemäss Zusammensetzung.
·Infektionen an den vorgesehenen Injektionsstellen.
·Vorliegen von Myasthenia gravis, Eaton-Lambert-Syndrom oder amyotropher Lateralsklerose.
Warnhinweise und Vorsichtsmassnahmen
Allgemein
Es sollte darauf geachtet werden, dass Relfydess nicht in ein Blutgefäss injiziert wird.
Die Anwendung von Relfydess wird nicht empfohlen bei Personen, die unter 18 Jahren bzw. über 65 Jahre sind.
Wie bei allen intramuskulären Injektionen wird die Anwendung von Relfydess bei Patienten mit verlängerter Blutungszeit nicht empfohlen.
Überempfindlichkeitsreaktionen
Für Botulinumtoxin-Produkte wurden schwerwiegende und/oder sofortige Überempfindlichkeitsreaktionen gemeldet. Zu diesen Reaktionen gehören Anaphylaxie, Serumkrankheit, Urtikaria, Weichteilödeme und Dyspnoe. Tritt eine solche Reaktion auf, sollte die weitere Injektion von Relfydess abgebrochen und unverzüglich eine angemessene medizinische Therapie eingeleitet werden, sofern die erforderlichen Geräte und Arzneimittel zur Verfügung stehen.
Lokale und entfernte Ausbreitung der Toxin-Wirkung
Daten zur Sicherheit nach dem Inverkehrbringen von anderen zugelassenen Botulinumtoxin-Produkten deuten darauf hin, dass die Wirkungen von Botulinumtoxin über den Ort der lokalen Injektion hinaus beobachtet werden können. Die Symptome stimmen mit dem Wirkmechanismus von Botulinumtoxinen überein und können Asthenie, generalisierte Muskelschwäche, Diplopie, verschwommenes Sehen, Ptosis, Dysphagie, Dysphonie, Dysarthrie, Harninkontinenz und Atembeschwerden umfassen. Diese Symptome sind Stunden bis Wochen nach der Injektion aufgetreten.
Schluck- und Atembeschwerden können lebensbedrohlich sein, und es gibt Berichte über Todesfälle im Zusammenhang mit der Ausbreitung der Toxinwirkung. Patienten mit vorbestehenden Schluck- oder Atembeschwerden können anfälliger für diese Komplikationen sein. Insbesondere wurden nach der Behandlung mit Botulinumtoxin sehr seltene Fälle von Todesfällen bei Patienten mit Schluckstörungen, Pneumopathie oder erheblicher Asthenie berichtet. Daher muss die Behandlung bei solchen Patienten unter der Kontrolle eines Facharztes und nur dann durchgeführt werden, wenn der Nutzen der Behandlung das Risiko überwiegt.
Patienten oder Betreuer sollten darauf hingewiesen werden, bei Schluck-, Sprach- oder Atembeschwerden sofort einen Arzt aufzusuchen.
Im Rahmen des klinischen Entwicklungsprogramms von Relfydess kam es bei keinem Probanden zu einer Fernausbreitung der Toxinwirkung.
Bestehende neuromuskuläre Störungen
Relfydess sollte bei Patienten mit einem Risiko für eine ausgeprägte neuromuskuläre Defekttransmission mit Vorsicht angewendet werden. Diese Patienten können eine erhöhte Empfindlichkeit gegenüber Wirkstoffen wie Botulinumtoxin aufweisen und nach der Behandlung kann es zu einer übermässigen Muskelschwäche (einschliesslich systemischer Auswirkungen einer schweren Dysphagie und einer Beeinträchtigung der Atmung) kommen. In einigen dieser Fälle hielt die Dysphagie mehrere Monate an und erforderte die Platzierung einer Magensonde.
Vorbestehende Erkrankungen an der Injektionsstelle
Vorsicht ist geboten, wenn Relfydess bei Vorliegen einer Entzündung an der/den vorgeschlagenen Injektionsstelle(n) oder bei übermässiger Schwäche oder Atrophie des/der betroffenen Muskels/Muskeln angewendet wird.
Vorsicht ist geboten, wenn die Relfydess-Behandlung bei Patienten mit ausgeprägter Gesichtsasymmetrie, Ptosis, übermässiger Dermatochalasis, tiefer dermaler Narbenbildung oder dicker talghaltiger Haut angewendet wird.
Unerwünschte ophthalmische Reaktionen
Bei der Anwendung von Botulinumtoxinen kann es zu trockenen Augen, verminderter Tränenproduktion, vermindertem Blinzeln und Hornhautstörungen kommen. Wenn die Symptome des trockenen Auges (z.B. Augenreizung, Photophobie oder Sehveränderungen) fortbestehen, sollte der Patient an einen Augenarzt überwiesen werden.
Muskelatrophie
Nach wiederholter Botulinumtoxin-Behandlung ist aufgrund der schlaffen Lähmung der behandelten Muskeln mit Muskelatrophie zu rechnen.
Antikörperbildung
Injektionen in kürzeren Abständen oder in höheren Dosen können das Risiko der Bildung neutralisierender Antikörper gegen Botulinumtoxin erhöhen. Klinisch gesehen kann die Bildung neutralisierender Antikörper die Wirksamkeit nachfolgender Behandlungen beeinträchtigen.
Hilfsstoffe
Dieses Arzneimittel enthält Kalium, jedoch weniger als 1 mmol (39 mg) pro Durchstechflasche, d.h. es ist nahezu «kaliumfrei». Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Durchstechflasche, d.h. es ist nahezu «natriumfrei».
Dieses Arzneimittel enthält 1.6 mg Polysorbat 80 pro Durchstechflasche entsprechend 1.1 mg/ml. Polysorbate können allergische Reaktionen hervorrufen.
Interaktionen
Es wurden keine Wechselwirkungsstudien durchgeführt.
Die gleichzeitige Behandlung mit Relfydess und anderen Botulinumtoxin-Produkten, Aminoglykosiden oder anderen Arzneimitteln, die auf die neuromuskuläre Reizleitung wirken (z.B. Curare-ähnliche Wirkstoffe), Anticholinergen Medikamenten und Muskelrelaxantien sollte nur mit Vorsicht erfolgen, da die Wirkung von Relfydess potenziert werden kann.
Schwangerschaft, Stillzeit
Schwangerschaft
Es liegen keine angemessenen Daten über die Anwendung von Botulinumtoxin Typ A bei schwangeren Frauen vor. Es liegen keine ausreichenden tierexperimentellen Studien in Bezug auf eine Reproduktionstoxizität vor (siehe «Präklinische Daten»). Das potentielle Risiko für den Patienten ist unbekannt. Relfydess soll während der Schwangerschaft und bei Frauen im gebärfähigen Alter, die nicht verhüten, nicht angewendet werden.
Stillzeit
Es ist nicht bekannt, ob Relfydess in die menschliche Milch ausgeschieden wird. Die Ausscheidung von Relfydess in der Milch wurde bei Tieren nicht untersucht. Relfydess soll während der Stillzeit nicht angewendet werden.
Fertilität
Es liegen keine klinischen Daten über die Auswirkung von Relfydess auf die Fruchtbarkeit vor. Es wurden keine Tierstudien zur Fertilität durchgeführt. Tierexperimentelle Studien mit anderen Botulinumtoxin Typ A-enthaltenden Präparaten haben eine Verringerung der Fertilität gezeigt (siehe «Präklinische Daten»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Von anderen Botulinumtoxin-Produkten wurde berichtet, dass sie die Fähigkeit zum Führen eines Fahrzeugs und/oder zum Bedienen von Maschinen geringfügig oder mässig beeinflussen. Es besteht ein potenzielles Risiko für eine örtlich begrenzte Muskelschwäche oder Sehstörungen im Zusammenhang mit der Anwendung von Relfydess, die vorübergehend die Fähigkeit zum Führen eines Fahrzeugs oder zum Bedienen von Maschinen beeinträchtigen können.
Unerwünschte Wirkungen
Zusammenfassung des Sicherheitsprofils
Die Mehrzahl der unerwünschten Wirkungen, die in den zulassungsrelevanten placebokontrollierten Phase-III-Studien mit Relfydess nach einer Behandlung gemeldet wurden, waren von leichter bis mittlerer Intensität. Die am häufigsten gemeldeten unerwünschten Wirkungen waren Blutergüsse an der Injektionsstelle und Kopfschmerzen, die bei etwa 2 % der Probanden auftraten.
Im Allgemeinen traten behandlungs-/injektionstechnikbedingte Reaktionen innerhalb des ersten Monats nach der Injektion auf und waren vorübergehend.
Die unerwünschten Wirkungen stammen aus zulassungsrelevanten placebokontrollierten klinischen Phase-III-Studien mit Relfydess und sind nach primären Systemorganklassen (SOC) für jeden bevorzugten Begriff in MedDRA geordnet.
Bei der kombinierten Behandlung von Glabellafalten und lateralen Canthalfalten waren Art und Häufigkeit der unerwünschten Wirkungen vergleichbar mit denen, die bei der Behandlung der einzelnen Indikationen beobachtet wurden.
Liste der unerwünschten Wirkungen
Die Häufigkeit der unerwünschten Reaktionen wird wie folgt klassifiziert:
Sehr häufig (≥1/10); häufig (≥1/100 bis < 1/10); gelegentlich (≥1/1.000 bis < 1/100); selten (≥1/10.000 bis < 1/1.000); sehr selten (< 1/10.000); nicht bekannt (kann aus den verfügbaren Daten nicht abgeschätzt werden).
Tabelle 2: Mittelstarke bis starke Glabellafalten
Die folgenden unerwünschten Wirkungen wurden bei Patienten beobachtet, die Relfydess zur vorübergehenden Verbesserung des Erscheinungsbildes von mittelstarken bis starken Glabellafalten erhielten.
|
System Organ Klasse |
Frequenz |
Unerwünschte Reaktionen |
|
Störungen des Nervensystems |
häufig |
Kopfschmerzen |
|
|
gelegentlich |
Schwindel |
|
Augenkrankheiten |
häufig |
Ptose der Augenlider |
|
Erkrankungen der Haut und des Unterhautzellgewebes |
gelegentlich |
Augenbrauen-Ptose |
|
Erkrankungen des Muskel-Skelett-Systems und des Bindegewebes |
gelegentlich |
Muskelschwäche |
|
Allgemeine Erkrankungen und Bedingungen am Verabreichungsort |
häufig |
Blutergüsse an der Injektionsstelle |
Tabelle 3: Mittelstarke bis starke seitliche Canthallinien
Die folgenden unerwünschten Wirkungen wurden bei Patienten beobachtet, die Relfydess zur vorübergehenden Verbesserung des Aussehens von mittelstarken bis starken seitlichen Canthalfalten erhielten.
|
System Organ Klasse |
Frequenz |
Unerwünschte Reaktionen |
|
Störungen des Nervensystems |
häufig |
Kopfschmerzen |
|
Erkrankungen des Muskel-Skelett-Systems und des Bindegewebes |
gelegentlich |
Muskelschwäche |
|
Allgemeine Erkrankungen und Bedingungen am Verabreichungsort |
häufig |
Blutergüsse an der Injektionsstelle |
|
gelegentlich |
Schmerzen an der Injektionsstelle |
Verwandte TEAEs* (Reaktionen an der Injektionsstelle)
Darüber hinaus wurden folgende während der Behandlung auftretende unerwüschte Wirkungen (TEAEs) im Zusammenhang mit Reaktionen an der Injektionsstelle bei Relfydess behandelten Probanden (die ≥50 U erhielten) im «Pool aller placebokontrollierten Studien» genannt: Juckreiz an der Injektionsstelle, Schwellung, Erythem, Unbehagen, Hämatom, Überempfindlichkeit und Wärme.
Verwandte TEAEs* (Spock-Stirn)
Die Spock-Stirn (Mephisto-Zeichen) wurde in der offenen Langzeitstudie bei einem Probanden als verwandte TEAE von leichter Intensität gemeldet. Dieses Ereignis klang nach drei Wochen ab. Daraus ergibt sich eine Gesamtinzidenz von 0,06% (1/1708 Probanden) für die Spock-Stirn im Sicherheitspool der Phase-III-Studien, in denen die Probanden ≥50U erhielten.
*vom Prüfer auf der Ebene der einzelnen unerwünschten Ereignisse als zusammenhängend betrachtet
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Anzeichen und Symptome
Überhöhte Dosen können zu weitreichenden und tiefgreifenden neuromuskulären Lähmungen führen. Eine Überdosierung kann zu einem erhöhten Risiko führen, dass das Botulinumtoxin in den Blutkreislauf gelangt, und kann Komplikationen verursachen, die mit den Auswirkungen einer oralen Botulinumvergiftung verbunden sind. (z.B. Dysphagie und Dysphonie).
Die Symptome einer Überdosierung treten möglicherweise nicht unmittelbar nach der Injektion auf. Sollte es zu einer versehentlichen Injektion oder Einnahme kommen, sollte der Patient mehrere Wochen lang medizinisch auf Anzeichen und/oder Symptome einer übermässigen Muskelschwäche oder Muskellähmung überwacht werden.
Behandlung
Bei Patienten mit offensichtlichen Symptomen einer Botulinumtoxin-Überdosierung sollte eine Krankenhauseinweisung in Betracht gezogen werden.
Im Falle einer Überdosierung sollte der Patient medizinisch auf Anzeichen und/oder Symptome einer übermässigen Muskelschwäche oder Muskellähmung überwacht werden. Es wird eine allgemeine unterstützende Pflege empfohlen, und wenn nötig sollte eine symptomatische Behandlung eingeleitet werden. Bei einer Überdosierung, die zu einer Lähmung der Atemmuskulatur führt, kann eine Beatmung erforderlich sein.
Eigenschaften/Wirkungen
ATC-Code
M03AX01
Wirkungsmechanismus
Der bekannte Wirkmechanismus von Botulinumtoxin Typ A-Produkten besteht in der Blockierung der Freisetzung von Acetylcholin aus der präsynaptischen neuronalen Synapse. Die schwere Kette von Botulinumtoxin Typ A vermittelt die Bindung und Internalisierung des Toxinproteins, während die leichte Kette ein Enzym ist, das das synaptosom-assoziierte Protein von 25 kDa (SNAP-25) spaltet.
Bei intramuskulärer Injektion führt das Toxin zu einer teilweisen Lähmung des betroffenen Muskels, wodurch die Muskelaktivität vorübergehend reduziert wird, was zu einer vorübergehenden Verringerung der Glabellafalten oder der seitlichen Canthalfalten führt. Botulinumtoxin-Typ-A-Produkte haben bei Tieren und Menschen eine lange Wirkungsdauer, die in Wochen bis Monaten gemessen wird. Die Muskelfunktion kehrt allmählich zurück, wenn die Nervenfasern mit neuen Nervenendigungen nachwachsen, um die Muskeln zu innervieren und die Denervierung durch die Verabreichung des Toxins rückgängig zu machen.
Pharmakodynamik
Zu den bekannten Wirkungen von Botulinumtoxin-Typ-A-Produkten gehört die Blockierung der Freisetzung von Acetylcholin aus der präsynaptischen neuronalen Synapse.
Klinische Wirksamkeit
Die im Folgenden beschriebenen Daten spiegeln die Ergebnisse der placebokontrollierten Phase-III-Studien READY- 1, READY- 2 und READY- 3 wider. Insgesamt wurden 1.012 Patienten in drei Zulassungsstudien behandelt, darunter 806 Patienten, die mit Relfydess behandelt wurden, und 206 Patienten, die mit Placebo behandelt wurden. Weitere 902 Patienten, die mit Relfydess behandelt wurden, nahmen an einer offenen Langzeitsicherheitsstudie teil (READY- 4). Insgesamt wurden in allen Phase-III-Studien 1708 Patienten mit Relfydess behandelt.
Die psychologischen Funktionen der Probanden wurde anhand der FACE-Q™-Skala zum psychischen Wohlbefinden beobachtet (die die Bewertungen der Probanden zu den Themen Selbstliebe, positives Gefühl, gutes Gefühl, Glücksgefühl, Zufriedenheit mit sich selbst, Selbstakzeptanz, Selbstvertrauen, Attraktivität und des Gefühls der eigenen Grossartigkeit umfasst).
Die FLTSQ-Skala (Facial Line Treatment Satisfaction Questionnaire - Fragebogen zur Zufriedenheit mit der Gesichtslinienbehandlung) wurde verwendet, um die Zufriedenheit der Probanden mit dem Aussehen der GL und/oder der LCL zu ermitteln (die Probanden bewerteten, ob sie sich mit bestimmten Gesichtsausdrücken oder -positionen wohlfühlen, ob die Gesichtslinien sichtbar sind, ob die Haut glatt ist, ob sie jugendlich aussieht, ob sie für ihr Alter gut aussieht, ob sie entspannt aussieht, ob sie attraktiv aussieht, ob sie ausgeruht aussieht und ob sie erneuert aussieht), aber auch, um die Zufriedenheit der Probanden mit der Behandlung zu ermitteln (die Probanden bewerteten, ob sie mit einer erneuten Behandlung, einer Behandlungsempfehlung, den erwarteten Ergebnissen, der Natürlichkeit, der richtigen Behandlungswahl, der Zufriedenheit mit den Behandlungsergebnissen, aber auch mit dem Behandlungsergebnis selbst und der Zufriedenheit mit der Behandlungsverbesserung zufrieden sind).
Die Antworten auf die FACE-Q™-Skala für psychologische Funktionen und die FLTSQ-Skala zeigten, dass die mit Relfydess behandelten Probanden zu allen Nachbehandlungszeitpunkten eine Verbesserung der psychologischen Funktionen zeigten und mit ihrer Behandlung und ihrem Aussehen zufriedener waren als die Probanden unter Placebo. Wie anhand der FACE-Q™- und FLTSQ-Skala festgestellt wurde, blieben die positive psychologische Funktion und die Zufriedenheit der Probanden auch noch 6 Monate nach der Behandlung erhalten.
Patienten, die Relfydess erhielten (insgesamt 1699), wurden zu Beginn und nach jeder Behandlung auf die Bildung von Antikörpern gegen das Arzneimittel getestet. Kein Patient wurde positiv auf Toxin-neutralisierende Antikörper getestet.
Glabellafalten (READY-1 und READY-3)
In zwei zulassungsrelevanten, multizentrischen, doppelblinden, placebokontrollierten Phase-III-Studien wurden 451 Patienten in den Glabellafalten (GL) mit der empfohlenen Dosis von 50 Einheiten behandelt. READY- 1 untersuchte Relfydess nur für die Behandlung von Glabellafalten; READY- 3 untersuchte die Kombinationsbehandlung von Glabellafalten und latheralen Canthallinien (LCL). Die Ergebnisse von READY-3 werden für die Patienten beschrieben, die Relfydess sowohl in der GL als auch in der LCL in Kombination erhielten.
Primärer Wirksamkeitsendpunkt war der Anteil der Probanden, die auf die Behandlung ansprachen, definiert als Erreichen einer Punktzahl von 0 oder 1 beim Schweregrad der Glabellafalten auf der GL-ILA 4-Punkteskala (Investigator Live Assessment) für den Schweregrad der Glabellafalten bei maximalem Stirnrunzeln bei der Visite in Monat 1. Die Mehrheit der Probanden sowohl in der Relfydess- als auch in der Placebogruppe hatte zu Studienbeginn schwere Glabellafalten, wie vom Prüfarzt festgestellt (74,5% bzw. 75,8%).
Der vom Prüfarzt gemessene Behandlungserfolg für GL (GL-ILA, unter Verwendung einer 4-Punkte-Skala- [0 = keine, 1 = leicht, 2 = mittelschwer, 3 = schwer], bei maximalem Stirnrunzeln) war in der Relfydess-Gruppe im Vergleich zur Placebo-Gruppe nach einem Monat statistisch signifikant grösser (p < 0,001) (Tabelle 4).
Tabelle 4: Bewertung des Prüfarztes zum Behandlungserfolg der Glabellarliniena (% und Anzahl der Probanden) im Monat 1b in doppelblinden, placebokontrollierten klinischen Studien
|
Studie |
Relfydess 50 Einheiten GL |
Relfydess 50 Einheiten GL und 60 Einheiten LCL |
Placebo |
|
READY- 1, nur GL |
96.3% |
- |
4.5% |
|
READY- 3 LCL & GL Behandlung |
94.3% |
96.3% |
1.8% |
a auf der GL-ILA einen Wert von 0 oder 1 für den Schweregrad der GL erreicht haben
b Primärer Wirksamkeitsendpunkt an Tag 30; p < 0,001
Subgruppenanalysen des primären Wirksamkeitsendpunkts der Ansprechraten auf der Grundlage der GL-ILA 4-Punkteskala bei maximalem Stirnrunzeln im Monat 1 zeigten die Wirksamkeit von Relfydess unabhängig von Alter, Rasse, früherer Botulinumtoxin-Anwendung oder dem Ausgangsschweregrad auf der GL-ILA bei maximalem Stirnrunzeln.
Bei den Probanden, die sowohl auf der fotografischen GL-ILA 4-Punkteskala als auch auf der statischen GL-SLA 4-Punkteskala bei maximalem Stirnrunzeln einen Wert von 0 oder 1 erreichten, betrug die mittlere Anzahl von Tagen bis zum Verlust eines Wertes von 0 oder 1 168 Tage (24 Wochen) bei READY-1 und 140 Tage (20 Wochen) bei READY-3.
Einen Monat nach der Injektion zeigten 98 % der mit Relfydess behandelten Patienten in READY-1 und READY-3 eine Verbesserung der Glabellafalten um mindestens einen Grad bei maximaler Stirnrunzelung, basierend auf der Bewertung des Schweregrads der Glabellafalten durch die Prüfärzte. Sechs Monate nach der Injektion wiesen 58 % der mit Relfydess behandelten Patienten in der Studie READY-1 und 46 % der Patienten in der Studie READY-3 immer noch eine Verbesserung auf, verglichen mit den mit Placebo behandelten Patienten (10 % in der Studie READY-1 und 4 % in der Studie READY-3, p < 0,001).
Für diese READY-1 Probanden konnte der Median der Tage bis zur Rückkehr zum Ausgangswert für den Schweregrad der GL nicht berechnet werden, da mehr als die Hälfte der Probanden bis zum Ende der Studie (≥ 24 Wochen) nicht zum Ausgangswert zurückgekehrt war. 75 % der Probanden in der Relfydess-Gruppe erreichten nach 169 Tagen (> 24 Wochen) wieder den Ausgangswert. Bei den Probanden von READY-3 betrug die mediane Anzahl der Tage bis zur Rückkehr zum Ausgangswert in der Relfydess -Gruppe 179 Tage (26 Wochen) im Glabellar Lines Treatment Pool und 172 Tage (25 Wochen) in der GL-Relfydess/LCL-Placebogruppe und 189 Tage (27 Wochen) in der GL-Relfydess-/LCL Relfydess-Gruppe.
In der Relfydess-Gruppe wurde im Vergleich zur Placebogruppe über einen Zeitraum von 6 Monaten eine vom Prüfarzt bewertete Verbesserung des Schweregrads der GL festgestellt (Abbildung 3).
Abbildung 3: Relfydess Prüfarzt- und Probandenbeurteilung der Glabellarlinien-Ansprechrate (Erreichen einer Punktzahl von keinea oder leichterb im Schweregrad der GL) im Vergleich zu Placebo im Laufe der Zeit (READY- 1)c, d
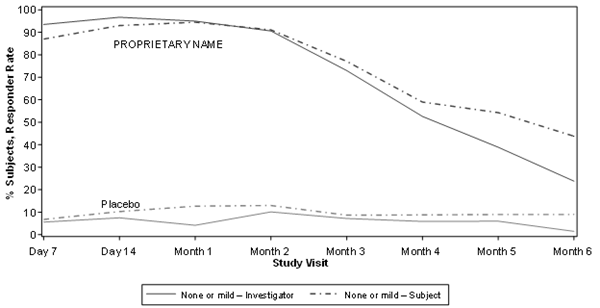
a keine Punkte = 0
b Wertung von mild = 1
c Statistisch signifikant höhere Responder-Rate (basierend auf GL-ILA 4-Punkteskala bei maximalem Stirnrunzeln in der Relfydess-Gruppe) im Vergleich zu Placebo (p- Wert < 0,001) zu allen Zeitpunkten bis Monat 6.
d Statistisch signifikant höhere Responder-Rate (basierend auf der GL- SLA 4- Punkteskala bei maximalem Stirnrunzeln in der Relfydess-Gruppe) im Vergleich zu Placebo (p- Wert < 0,001) zu allen Zeitpunkten bis Monat 6
Bei kombinierter Behandlung mit LCL war das Ansprechen (Erreichen von 0 oder 1 auf dem GL-ILA bei maximalem Stirnrunzeln) in der Relfydess-GL/Relfydess LCL-Gruppe im Vergleich zur Placebo-GL/Placebo-LCL-Gruppe während der gesamten 6 Monate nach der Behandlung statistisch signifikant höher.
Seitliche Canthallinien (READY-2 und READY-3)
In zwei zulassungsrelevanten multizentrischen, doppelblinden, placebokontrollierten Phase-III-Studien wurden 471 Patienten in den lateralen Canthallinien (LCL) mit der empfohlenen Dosis von 60 Einheiten behandelt. READY-2 untersuchte Relfydess nur für die Behandlung von LCL; READY-3 untersuchte die Kombinationsbehandlung von GL und LCL. Die Ergebnisse für READY-3 werden für die Patienten beschrieben, die Relfydess sowohl in der GL als auch in den LCL in Kombination erhielten.
Primärer Wirksamkeitsnachweis war der Anteil der Probanden, die bei der Visite im Monat 1 auf der LCL-ILA 4-Punkteskala (LCL-Investigator Live Assessment) für den Schweregrad der lateralen Canthallinien bei maximalem Lächeln einen Wert von 0 oder 1 erreichten. Etwa 40 % der Probanden sowohl in der Relfydess- als auch in der Placebogruppe hatten zu Studienbeginn schwere beidseitig symmetrische seitliche Canthallinien, wie vom Prüfarzt festgestellt (42,3 % bzw. 42,7 %).
Der vom Prüfarzt gemessene Behandlungserfolg bei LCL (LCL-Investigator Live Assessment, unter Verwendung einer 4-Punkte-Skala- [0 = keine, 1 = leicht, 2 = mittelschwer, 3 = schwer], bei maximalem Lächeln) war in der Relfydess-Gruppe im Vergleich zur Placebo-Gruppe nach einem Monat statistisch signifikant grösser (p < 0,001) (Tabelle 5).
Tabelle 5: Bewertung des Prüfarztes zum Behandlungserfolg der lateralen Canthalliniena (% und Anzahl der Probanden) im Monat 1b in doppelblinden, placebokontrollierten klinischen Studien
|
Studie |
Relfydess 60 Einheiten LCL |
Relfydess 60 Einheiten LCL & 50 Einheiten GL |
Placebo |
|
READY-2, nur LCL |
87.2% |
- |
11.9% |
|
READY- 3, LCL & GL Behandlung |
78.1% |
83.3% |
19.3% |
a einen LCL-Schweregrad von 0 oder 1 auf der LCL-ILA erreicht haben
b Primärer Wirksamkeitsendpunkt an Tag 30; p < 0,001
Untergruppenanalysen des primären Wirksamkeitsendpunkts der Responder-Raten auf der Grundlage der LCL--ILA 4-Punkte-Fotoskala bei maximalem Lächeln im Monat 1 zeigten die Wirksamkeit von Relfydess unabhängig von Alter, Rasse, vorheriger Botulinumtoxin-Anwendung oder dem Ausgangsschweregrad auf der LCL-ILA bei maximalem Lächeln.
Bei Probanden, die sowohl auf der LCL-ILA 4-Punkteskala als auch auf der LCL-SLA Static 4-Punkteskala bei maximalem Lächeln einen Wert von 0 oder 1 erreichten, betrug die mediane Anzahl der Tage bis zum Verlust eines Wertes von 0 oder 1 in der Relfydess-Gruppe 144 Tage (21 Wochen) im Lateral Canthal Lines Treatment Pool und 162 Tage (23 Wochen) in READY-2, 140 Tage (20 Wochen) in der GL Placebo/LCL Relfydess-Gruppe und 142 Tage (20 Wochen) in der GL Relfydess/LCL Relfydess-Gruppe in READY-3.
Einen Monat nach der Injektion wiesen 93 % der mit Relfydess behandelten Patienten in READY-2 und 3 eine Verbesserung der LCL um mindestens einen Grad bei maximalem Lächeln auf, basierend auf der Bewertung der Schwere der lateralen Canthallinie durch den Prüfarzt. Sechs Monate nach der Injektion zeigten 36 % der mit Relfydess behandelten Patienten in der Studie READY-2 und 33 % der Patienten in der Studie READY-3 immer noch eine Verbesserung, verglichen mit den mit Placebo behandelten Patienten (15 % in der Studie READY-2 und 13 % in der Studie READY-3, p < 0,003).
Bei diesen Probanden betrug die mediane Anzahl der Tage bis zur Rückkehr zum Ausgangswert des LCL-Schweregrads in der Relfydess-Gruppe 173 Tage (25 Wochen) im Behandlungspool für laterale Canthal-Linien und in der READY-2-Studie, 168 Tage (24 Wochen) in der GL-Placebo/LCL Relfydess-Gruppe und 174 Tage (25 Wochen) in der GL Relfydess/LCLRelfydess-Gruppe in READY-3. In der Studie READY-2 kehrten 75 % der Probanden in der Relfydess-Gruppe nach 147 Tagen (21 Wochen) zum Ausgangswert zurück, in der LCL-Gruppe nach 141 Tagen (20 Wochen). In der Studie READY-3 kehrten 75 % der Probanden in der Gruppe GL Placebo/LCL Relfydess nach 139 Tagen (20 Wochen) zum Ausgangswert zurück, und nach 147 Tagen (21 Wochen) für die Probanden in der Gruppe GL Relfydess/LCLRelfydess.
Die von Prüfärzten und Probanden bewertete Verbesserung des Schweregrads der LCL wurde in der Relfydess-Gruppe im Vergleich zur Placebogruppe über 6 Monate hinaus gezeigt (Abbildung 4).
Abbildung 4: Relfydess - Von Prüfern und Probanden bewertete Ansprechrate der lateralen Canthallinie (Erreichen einer Punktzahl von keinera oder leichterb im Schweregrad der LCL) im Vergleich zu Placebo im Zeitverlauf (READY-2)c, d
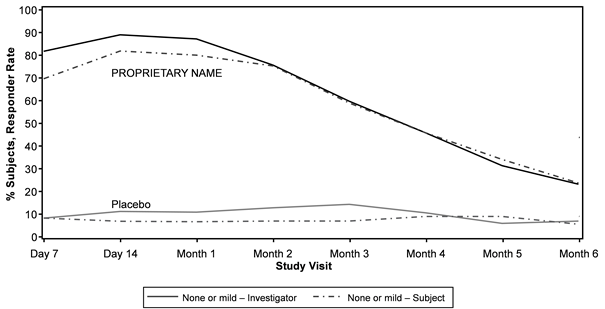
a keine Punkte = 0
b Wertung von mild = 1
c Statistisch signifikant höhere Responder-Rate (basierend auf LCL- ILA 4- Punkteskala bei maximalem Lächeln in der Relfydess-Gruppe) im Vergleich zu Placebo (p < 0,001) zu allen Zeitpunkten bis Monat 5; Monat 6, p- Wert = 0,002
d Statistisch signifikant höhere Responderrate (basierend auf der LCL- SLA 4- Punkteskala bei maximalem Lächeln in der Relfydess-Gruppe) im Vergleich zu Placebo (p < 0,001) zu allen Zeitpunkten bis Monat 6.
Bei kombinierter Behandlung mit GL war das Ansprechen (Erreichen von 0 oder 1 auf dem LCL-ILA bei maximalem Lächeln) in der Gruppe Relfydess-GL/Relfydess -LCL im Vergleich zu Placebo-GL/Placebo-LCL zu allen Nachbehandlungszeitpunkten ausser Monat 6 statistisch signifikant höher (p = 0,052).
Offene Studie (READY-4)
READY-4 war eine multizentrische, offene Phase-III-Studie zur Untersuchung der Sicherheit wiederholter Injektionen von Relfydess für die Langzeitbehandlung von mittelschweren bis schweren Glabellafalten und seitlichen Canthalfalten (mit einem Abstand von mindestens 12 Wochen zwischen den Behandlungszyklen).
In der Studie READY-4 zeigte die Verabreichung von Relfydess bis zu 110 IU und bis zu 7 GL- und/oder LCL-Behandlungen über einen Studienzeitraum von 52- Wochen günstige Wirksamkeitsergebnisse sowohl bei Glabellafalten als auch bei seitlichen Canthalfalten, unabhängig davon, ob sie gleichzeitig oder unabhängig voneinander behandelt wurden.
Pharmakokinetik
Absorption
Es ist nicht zu erwarten, dass Relfydess nach intramuskulärer Injektion in der empfohlenen Dosis in messbaren Mengen im peripheren Blut vorhanden ist. Pharmakokinetische Studien wurden daher nicht durchgeführt.
Distribution
Nicht zutreffend.
Metabolismus
Nicht zutreffend.
Elimination
Nicht zutreffend.
Kinetik spezieller Patientengruppen
Keine Angaben.
Präklinische Daten
Basierend auf den konventionellen Studien zur akuten Toxizität und zur Toxizität bei wiederholter Gabe lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
Mutagenität und Karzinogenität
Es wurden keine Studien zum genotoxischen oder kanzerogenen Potenzial von Relfydess durchgeführt.
Reproduktionstoxizität
Es wurden keine Studien zur Fertilität und Embryotoxizität mit Relfydess durchgeführt. Jedoch wurden bei Ratten nach hoher Dosierung anderer Botulinumtoxin Typ A enthaltender Produkte Beeinträchtigungen der männlichen und weiblichen Fertilität beobachtet. In Reproduktionstudien mit anderer Botulinumtoxin Typ A wurden embryfetale Effekte beobachtet. Die Auswirkungen auf die peri-/postnatale Entwicklung wurden nicht untersucht.
Sonstige Hinweise
Inkompatibilitäten
Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Im Kühlschrank (2°C - 8°C) lagern. Nicht einfrieren.
In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
Ausser Reichweite von Kindern aufbewahren.
Die ungeöffnete Durchstechflasche kann vor Licht geschützt bei maximal 25°C während 24 Stunden gelagert werden.
Hinweise für die Handhabung
Unmittelbar nach der Behandlung des Patienten sollten etwaige Rückstände von Relfydess in der Ampulle oder Spritze mit verdünnter Hypochlorit- oder Natriumhydroxidlösung inaktiviert werden.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den örtlichen Vorschriften zu entsorgen.
Empfehlungen für den Fall, dass bei der Handhabung von Botulinumtoxin ein Zwischenfall eintritt:
·Verschüttetes Produkt muss mit trockenem, saugfähigem Material aufgewischt werden.
·Die kontaminierten Oberflächen sollten mit verdünnter Hypochlorit- oder Natriumhydroxidlösung gereinigt und anschliessend getrocknet werden.
·Wenn eine Durchstechflasche zerbrochen ist, gehen Sie wie oben beschrieben vor, indem Sie die Glasscherben vorsichtig aufsammeln und das Produkt aufwischen, ohne die Haut zu verletzen.
·Wenn das Produkt mit der Haut in Berührung kommt, waschen Sie die betroffene Stelle mit Wasser und Seife.
·Bei Kontakt mit den Augen gründlich mit viel Wasser oder einer Augenspüllösung ausspülen.
·Wenn das Produkt mit einer Wunde, einem Schnitt oder einer Hautverletzung in Berührung kommt, gründlich mit viel Wasser abspülen und einen Arzt aufsuchen.
Diese Gebrauchs-, Handhabungs- und Entsorgungsanweisungen sind strikt zu befolgen.
Zulassungsnummer
69620 (Swissmedic)
Packungen
Packung à 1 Durchstechflasche 100 Einheiten/ml Injektionslösung. [A]
Packung à 10 Durchstechflaschen 100 Einheiten/ml Injektionslösung. [A]
Zulassungsinhaberin
Ipsen Pharma Schweiz GmbH, 6300 Zug
Stand der Information
Oktober 2025