CompositionPrincipes actifs
Antigène de surface du virus de l'hépatite B (AgHBs).
Produit dans des cellules de levures (Saccharomyces cerevisiae) par la technologie de l'ADN recombinant.
Excipients
Hydroxyde d'aluminium (hydraté pour adsorption), chlorure de sodium, phosphate disodique dihydraté, dihydrogénophosphate de sodium dihydraté, eau pour préparation injectable
Teneur totale en sodium:
Engerix-B 10: 1,75 mg
Engerix-B 20: 3,52 mg
Indications/Possibilités d’emploiEngerix-B est utilisé pour l'immunisation active contre les infections causées par tous les sous-types connus du virus de l'hépatite B (VHB) chez les personnes non immunes, selon les recommandations de l'Office fédéral de la santé publique.
Comme l'hépatite D est toujours associée à une infection par l'hépatite B, Engerix-B protège aussi contre l'hépatite D.
La vaccination est indiquée pour toutes les personnes non immunes, surtout celles qui sont exposées à un risque accru d'infection. La vaccination est possible à tout âge, dès la naissance.
Une primo-vaccination commencée avec des vaccins classiques d'origine plasmatique ou fabriqués par des méthodes biotechnologiques peut être poursuivie par Engerix-B. On peut également utiliser Engerix-B pour le rappel après une primo-vaccination effectuée avec des vaccins d'origine plasmatique ou fabriqués par des méthodes biotechnologiques.
Posologie/Mode d’emploiPrimo-vaccination
Selon l'âge du sujet à vacciner, l'un des schémas posologiques suivants peut être utilisé:
|
Âge
|
Schéma de vaccination
|
Schéma de vaccination rapide / remarques
| |
Dès la naissance jusqu'au 16e anniversaire
|
3 doses d'Engerix-B 10:
1ère dose: au début de la série d'injections
2e dose: un mois plus tard
3e dose: 6 mois après la 1ère dose
|
Dans les cas où un effet protecteur le plus rapide possible est souhaité, vaccination par 4 doses d'Engerix-B 10:
1ère dose: au début de la série d'injections
2e dose: un mois plus tard
3e dose: 2 mois après la 1ère dose
4e dose: 12 mois après la 1ère dose
| |
11e anniversaire jusqu'au 16e anniversaire
|
2 doses d'Engerix-B 20:
1ère dose: au début de la série d'injections
2e dose: 6 mois plus tard
|
Dans les études cliniques, un intervalle de 6 à 12 mois entre les deux doses de vaccin a été examiné.
| |
À partir du 16e anniversaire
|
3 doses d'Engerix-B 20:
1ère dose: au début de la série d'injections
2e dose: un mois plus tard
3e dose: 6 mois après la 1ère dose
|
Dans les cas où un effet protecteur le plus rapide possible est souhaité, vaccination par 4 doses d'Engerix-B 20:
1ère dose: au début de la série d'injections
2e dose: un mois plus tard
3e dose: 2 mois après la 1ère dose
4e dose: 12 mois après la 1ère dose
| |
À partir du 18e anniversaire
|
|
Schéma alternatif de vaccination rapide à partir du 18e anniversaire:
1ère dose: au début de la série d'injections
2e dose: 7 jours plus tard
3e dose: 21 jours après la 1ère dose
4e dose: 12 mois après la 1ère dose
|
Engerix-B 20 peut être administré aux adolescents à partir du 11e anniversaire jusqu'au 16e anniversaire selon un schéma à 2 doses, et ceci dans les cas où le risque d'une infection par l'hépatite B au cours du cycle vaccinal est relativement faible et si l'observance peut être assurée tout au long du cycle vaccinal.
Rappel
Selon l'état actuel des données, la nécessité d'un rappel chez les personnes immunocompétentes ayant répondu à un schéma complet de primo-vaccination n'a pas été établie (recommandation de l'OFSP, Lancet 2000, 333: 561). Cependant, une dose de rappel devrait être administrée aux sujets immunodéficients (p.ex. patients atteints de défaillance rénale chronique, patients hémodialysés et personnes infectées par le VIH) afin d'obtenir un titre d'anticorps anti-HBs supérieur au titre de 10 UI/l garantissant un effet protecteur. On recommande de procéder à des contrôles du statut immunitaire chez les sujets immunodéficients tous les 6 à 12 mois après la vaccination.
|
Réponse immunitaire
|
Rappel
|
Détermination(s) ultérieure(s) des anticorps anti-HBs
| |
Non-/faibles répondeurs:
anti-HBs < 100 mUI/ml après trois doses1.
|
1. Vaccination de rappel immédiate.
2. Si le titre d'anti-HBs est encore < 100 mUI/ml après le rappel: rappels tous les 6 à 12 mois selon le risque d'exposition2.
|
1 mois après chaque rappel
|
1 Les non- et faibles répondeurs faisant partie du personnel de santé doivent être informés de leur risque augmenté d'hépatite B après exposition. Ils doivent être encouragés à rapporter immédiatement tout accident au médecin du personnel et à bénéficier de l'immunisation passive.
2 Si les anticorps anti-HBs sont toujours indétectables après le premier rappel (c'est-à-dire après 4 doses), il est nécessaire de vérifier s'il n'existe pas une infection préexistante par le VHB (détermination de AgHBs et anti-HBc).
Après 3 rappels, si le titre des anticorps anti-HBs reste inférieur à 10 mUl/ml, l'indication pour des injections supplémentaires de vaccin devrait être établie sur une base individuelle.
Chez les personnes ayant une immunodépression connue, la réponse immunitaire est souvent insuffisante. Dans ces situations, il est possible d'administrer une série de rappels sur une courte durée (2 à 3 à un intervalle de 1 à 2 mois), avant de vérifier la concentration des anti-HBs.
Instructions posologiques particulières
Patients dans leur 16e année de vie et plus âgés avec insuffisance rénale et patients hémodialysés
Le schéma d'une primo-vaccination chez les patients atteints d'insuffisance rénale et les patients hémodialysés consiste en l'injection de quatre doubles doses (2 x 20 µg) administrées aux temps prédéterminés de 1 mois, 2 mois et 6 mois après l'injection de la 1re dose. Il est nécessaire d'adapter le schéma de vaccination pour garantir un effet protecteur correspondant à un titre d'anticorps anti-HBs d'au moins 10 UI/l ou plus.
1ère dose: au début de la série d'injections
2e dose: 1 mois plus tard
3e dose: 2 mois après la première dose
4e dose: 6 mois après la première dose
Le titre d'anticorps de ces personnes doit être régulièrement contrôlé et une dose de rappel est recommandée si le titre a chuté à 10 mUI/ml.
Posologie recommandée pour les nouveau-nés de mères porteuses de l'antigène HBs
Chez ces nouveau-nés, il faut entreprendre l'immunisation par Engerix-B 10 (10 µg) dès la naissance. Deux schémas de vaccination ont déjà été utilisés. On peut utiliser aussi bien le schéma 0/1/2/12 mois que le schéma 0/1/6 mois; le premier schéma permet d'obtenir une réponse immunitaire plus rapide. Pour garantir une protection optimale, il est recommandé d'administrer (du côté opposé) des immunoglobulines dirigées contre l'hépatite B en même temps que la première vaccination, pour autant que l'on dispose de telles immunoglobulines.
Posologie recommandée en cas d'exposition certaine ou suspectée au virus de l'hépatite B
En cas d'exposition récente au virus de l'hépatite B (par exemple blessure avec une aiguille contaminée), la première dose d'Engerix-B peut être administrée en même temps que des immunoglobulines dirigées contre l'hépatite B; les injections doivent cependant être réalisées à des endroits différents. Il est recommandé d'utiliser le schéma de vaccination plus rapide (0/1/2/12).
Mode d'administration
Engerix-B est injecté par voie intramusculaire. Chez les adultes et les enfants plus âgés, l'injection est pratiquée dans le muscle deltoïde, chez les enfants plus jeunes et les nouveau-nés dans la cuisse, au niveau antérolatéral.
Dans des cas exceptionnels (p.ex. patients ayant une prédisposition marquée à des hémorragies, telle que l'hémophilie ou la thrombocytopénie), le vaccin peut être injecté par voie sous-cutanée.
Une administration intradermique ou une injection pratiquée dans la musculature glutéale doivent être évitées, ces voies d'application pouvant éventuellement entraîner une réponse immunitaire non optimale.
Contre-indicationsHypersensibilité (allergie) à l'une des substances contenues dans le vaccin et apparition d'une hypersensibilité après une première vaccination par Engerix-B.
En cas de maladie infectieuse aiguë fébrile, il faut différer la vaccination par Engerix-B. En revanche, les infections légères de même qu'une infection par le VIH ne constituent pas une contre-indication à la vaccination.
Mises en garde et précautionsEngerix-B ne doit en aucun cas être injecté par voie intraveineuse!
Une syncope (évanouissement) peut survenir après toute vaccination, voire avant, en particulier chez les adolescents, comme réaction psychogène à l'injection. Ceci peut s'accompagner de plusieurs signes neurologiques comme un trouble transitoire de la vision, des paresthésies et des mouvements tonico-cloniques des membres durant la phase de récupération. Il est important que des mesures soient mises en place afin d'éviter des blessures en cas d'évanouissement.
Etant donné la longue période d'incubation du virus de l'hépatite B, il se peut qu'une infection méconnue soit déjà présente au moment de la vaccination. Dans de tels cas, il est possible qu'Engerix-B ne prévienne pas l'hépatite B. Le vaccin ne protège pas contre l'infection provoquée par le virus de l'hépatite A, C ou E ou contre d'autres agents pathogènes susceptibles d'infecter le foie.
Comme pour tous les vaccins, il est possible que la vaccination n'entraîne pas une réaction immunitaire protectrice chez tous les sujets.
La réponse immunitaire aux vaccins contre l'hépatite B dépend d'un certain nombre de facteurs, comme l'âge, le sexe masculin, l'obésité, les habitudes tabagiques, le site d'administration et quelques maladies chroniques de base. Chez les sujets répondant moins bien aux vaccins contre l'hépatite B (âgés de plus de 40 ans, etc.), des doses supplémentaires peuvent être envisagées.
La seringue préremplie ne contient pas d'agent conservateur.
Comme pour tous les vaccins injectables, il faut avoir sous la main une solution d'adrénaline au 1:1000 de façon à pouvoir l'utiliser immédiatement en cas de réaction anaphylactique.
S'il apparaît des réactions allergiques, le médecin doit prendre les mesures thérapeutiques habituelles.
Les patients souffrant de maladies hépatiques chroniques ou infectés par le VIH ou porteurs du virus de l'hépatite C ne doivent pas être exclus de la vaccination contre l'hépatite B. Chez ces patients, la vaccination doit être recommandée en fonction de la gravité d'une infection par le virus de l'hépatite B. Le médecin doit évaluer la nécessité d'une vaccination contre l'hépatite B au cas par cas. Il est possible que les patients porteurs du VIH, les patients souffrant d'insuffisance rénale et les patients dont le système immunitaire est perturbé n'atteignent pas un titre d'anticorps anti-HBs suffisant après avoir suivi et complété le premier schéma posologique de vaccination. De tels patients pourraient en conséquence avoir besoin de doses supplémentaires de vaccin.
Le risque d'apnée et la nécessité d'une surveillance respiratoire pendant 48 - 72 h doivent être soigneusement pris en compte lors de la primo-vaccination des très grands prématurés (nés avant la fin de la 28e semaine de grossesse) et particulièrement chez ceux qui ont des antécédents d'immaturité pulmonaire.
En raison du bénéfice élevé de la vaccination chez ces nourrissons, l'administration ne doit pas être suspendue ou reportée.
Engerix-B contient moins de 1 mmol (23 mg) de sodium par dose, c'est-à-dire qu'il est essentiellement «sans sodium».
InteractionsL'administration simultanée d'Engerix-B et d'une dose standard d'immunoglobulines anti-hépatite B ne provoque pas de diminution du titre d'anticorps anti-HBs, à condition que les injections ne soient pas réalisées du même côté.
Engerix-B peut être administré en même temps que les vaccins suivants, mais toujours à des sites d'injection différents (injections controlatérales): vaccins contre la poliomyélite; vaccins diphtérie-tétanos-coqueluche et diphtérie-tétanos; vaccins contenant des composantes contre la rougeole, les oreillons et la rubéole; vaccins anti-Haemophilus influenzae de type b, vaccins contre l'hépatite A et vaccins antituberculeux (BCG).
Engerix-B peut être administré en même temps qu'un vaccin contre les virus du papillome humain (HPV) (Cervarix).
Lors de l'administration concomitante d'Engerix-B et de Cervarix, aucune perturbation cliniquement significative de la réponse en anticorps aux antigènes HPV n'a été observée. Les concentrations géométriques moyennes des anticorps anti-HBs étaient plus basses en cas d'administration concomitante; il y avait de légères différences dans les taux de séroprotection. La signification clinique de cette observation n'est pas connue. Le tableau suivant montre l'influence de Cervarix sur les taux de réponse et les titres en anticorps anti-HBs après administration concomitante avec Engerix-B.
|
|
Cervarix avec
Engerix-B
(N=194)
|
Engerix-B seul
(N=181)
| |
Proportion de personnes avec une concentration en anticorps anti-HBs ≥10 mU.I./ml
|
97,9%
(n=190)
|
100%
(n=181)
| |
Proportion de personnes avec une concentration en anticorps anti-HBs ≥100 mU.I./ml
|
88,7%
(n=172)
|
97,2%
(n=176)
| |
Concentration absolue en anticorps anti-HBs en mU.I./ml
|
1280,9
(973,3 - 1685,7)*
|
3107,7
(2473,1 - 3905,1)*
|
* intervalle de confiance à 95%
Si Engerix-B est administré en même temps qu'un autre vaccin injectable, les vaccins doivent être toujours administrés à des sites d'injection différents.
Engerix-B peut être utilisé pour compléter un schéma de primo-vaccination commencé avec un vaccin contre l'hépatite B dérivé du plasma ou produit par génie génétique. Si une dose de rappel est souhaitée, elle peut être administrée à des sujets ayant été primo-vaccinés avec un vaccin contre l'hépatite B dérivé du plasma ou produit par génie génétique.
Grossesse, allaitementGrossesse
L'effet de l'AgHBs sur le développement fœtal chez l'homme n'a pas été évalué. Cependant, comme pour tous les vaccins viraux inactivés, des dommages sur le fœtus ne sont pas à attendre. Engerix-B ne doit être utilisé chez la femme enceinte que si la vaccination est vraiment nécessaire et si les avantages escomptés l'emportent sur les risques éventuels pour le fœtus.
Allaitement
L'effet sur les enfants allaités suite à l'administration d'Engerix-B à leurs mères n'a pas été étudié dans des études cliniques puisque l'information concernant la présence du vaccin et de ses composants dans le lait maternel n'est pas disponible.
L'allaitement ne constitue pas une contre-indication.
Effet sur l’aptitude à la conduite et l’utilisation de machinesQuelques-uns des effets indésirables peuvent entraîner une répercussion sur l'aptitude à la conduite ou l'utilisation de machines.
Effets indésirablesÉtudes cliniques
Les effets indésirables suivants proviennent de données de plus de 5300 volontaires.
Les fréquences sont indiquées comme suit:
«Très fréquents» (≥1/10), «fréquents» (≥1/100 à < 1/10), «occasionnels» (≥1/1000 à < 1/100), «rares» (≥1/10 000 à < 1/1000), «très rares» (< 1/10 000).
Affections hématologiques et du système lymphatique
Rares: lymphadénopathie.
Troubles du métabolisme et de la nutrition
Occasionnels: perte d'appétit.
Affections psychiatriques
Très fréquents: irritabilité (Engerix-B 10: 10,0%).
Affections du système nerveux
Fréquents: céphalées (très fréquent sous Engerix-B 10: 13,1%), somnolence.
Occasionnels: vertige.
Rares: paresthésies.
Affections gastro-intestinales
Occasionnels: troubles gastro-intestinaux (comme nausées, vomissements, diarrhées, douleurs abdominales).
Affections de la peau et du tissu sous-cutané
Rares: éruption cutanée, prurit, urticaire.
Affections musculosquelettiques et du tissu conjonctif
Occasionnels: myalgie.
Rares: arthralgie.
Troubles généraux et anomalies au site d'administration
Très fréquents: douleurs (Engerix-B 20: 36,4%; Engerix-B 10: 15,2%) et rougeurs au site d'injection (Engerix-B 20: 13,0%, Engerix-B 10: 17,2%), fatigue (Engerix-B 20: 12,3%; Engerix-B 10: 12,6%).
Fréquents: tuméfaction au site d'injection, malaise, réactions au site d'injection (telles que des indurations), fièvre (> 37,5°C).
Occasionnels: symptômes de type grippal.
La dose de rappel est aussi bien tolérée que les doses de la primo-vaccination.
Dans une étude comparative chez des sujets âgés de 11 à 15 ans, l'incidence des symptômes locaux et généraux signalés après le schéma posologique comportant 2 doses de 20 μg d'Engerix-B était comparable à celle rapportée après le schéma standard à 3 doses de 10 μg d'Engerix-B.
Effets indésirables identifiés après la mise sur le marché
Infections et infestations
Méningite.
Affections hématologiques et du système lymphatique
Thrombocytopénie.
Affections du système immunitaire
Anaphylaxie, réactions allergiques, y compris réactions anaphylactoïdes et symptômes de type maladie sérique.
Affections du système nerveux
Paralysie, convulsions, hypoesthésie, encéphalite, encéphalopathie, neuropathie, névrite (y compris syndrome de Guillain-Barré, névrite optique et sclérose en plaques), méningite.
Affections vasculaires
Hypotension, vascularite.
Affections respiratoires, thoraciques et médiastinales
Apnée chez les très grands prématurés (nés avant la fin de la 28e semaine de grossesse) (cf. «Mises en garde et précautions»).
Affections de la peau et du tissu sous-cutané
Angioœdème, lichen plan, érythème polymorphe.
Affections musculosquelettiques et du tissu conjonctif
Arthrite, faiblesse musculaire.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageDes cas de surdosage ont été rapportés après la mise sur le marché du produit. Les effets indésirables survenus lors de surdosages sont comparables à ceux observés dans le cadre d'une administration correcte du vaccin.
Propriétés/EffetsCode ATC
J07BC01
Mécanisme d'action
Voir «Pharmacodynamique».
Pharmacodynamique
Engerix-B contient l'antigène de surface du virus de l'hépatite B (AgHBs) sous forme hautement purifiée. L'antigène HBs est obtenu à partir de cultures de levures (Saccharomyces cerevisiae) qui expriment l'information génétique pour la synthèse de cette protéine. L'antigène de surface est purifié au cours de diverses étapes physico-chimiques, puis adsorbé sur de l'hydroxyde d'aluminium. Il se trouve alors sous la forme d'un vaccin utilisable pour l'immunisation active. La pureté du vaccin est conforme aux exigences de l'OMS.
Ce procédé de fabrication par génie génétique permet de ne pas utiliser de constituants d'origine humaine lors de la production d'Engerix-B. Il est donc exclu qu'une vaccination par Engerix-B transmette des agents pathogènes et une qualité constante des différents lots est garantie.
Efficacité clinique
Effet protecteur
Les concentrations en anticorps (anti-HBs) ≥10 mUI/ml sont considérées comme protectrices.
Des études menées sur le terrain chez des nouveau-nés, des enfants et des adultes ont montré un effet protecteur de 95% à 100%.
Le tableau ci-dessous montre les taux de séroprotection (pourcentage des personnes vaccinées ayant un titre d'anticorps protecteur), tels qu'ils ont été observés dans les études cliniques utilisant les schémas posologiques indiqués:
|
Population
|
Schéma
|
N
|
Taux de séroprotection
(anti-HBs ≥10 mUI/ml)
|
Taux de séroprotection
(anti-HBs ≥100 mUI/ml)
|
GMC
(mUI/ml)
| |
Sujets sains
(âgés de 16 ans ou plus)
|
0, 1, 6 mois
|
|
Mois 7: ≥ 96,0%
|
|
| |
|
0, 1, 2 – 12 mois
|
|
Mois 1: 15,0%
Mois 3: 89,0%
Mois 13: 95,8%
|
|
| |
Sujets sains
(âgés de 18 ans ou plus)
|
0, 7, 21 jours – 12 mois
|
|
Jour 28: 65,2%
Mois 2: 76,0%
Mois 13: 98,6%
|
|
| |
Sujets sains
(11-15 ans)*
|
20 μg:
0, 6 mois
|
240
239
241
140
166
147
132
|
Mois 2: 11,3%
Mois 6: 26,4%
Mois 7: 96,7%
Mois 30: 87,1%
Mois 42: 83,7%
Mois 54: 84,4%
Mois 66: 79,5%
|
2,1%
2,1%
88,8%
59,3%
56,6%
55,1%
43,9%
|
17,6
18,8
2738,5
229,0
159,7
123,6
82,1
| |
|
10 μg:
0, 1, 6 mois
|
113
113
113
64
80
76
70
|
Mois 2: 55,8%
Mois 6: 87,6%
Mois 7: 98,2%
Mois 30: 96,9%
Mois 42: 92,5%
Mois 54: 94,7%
Mois 66: 91,4%
|
11,5%
46,0%
97,3%
78,1%
71,3%
67,1%
68,6%
|
29,4
90,0
7238,3
708,3
417,9
277,6
225,2
| |
Patients avec une fonction rénale réduite, y compris les patients sous hémodialyse
(âgés de 16 ans ou plus)
|
0, 1, 2, 6 mois
(2 x 20 µg à chaque fois)
|
|
Mois 3: 55,4%
Mois 7: 87,1%
|
|
|
L'ensemble des données de ce tableau provient d'études réalisées avec des vaccins contenant du thiomersal. Deux études cliniques supplémentaires chez des enfants et des adultes sains avec la composition actuelle d'Engerix-B ne contenant pas de thiomersal montrent des taux de séroprotection comparables à ceux obtenus avec les compositions antérieures d'Engerix-B contenant du thiomersal.
* La réponse immunitaire à long terme a été évaluée dans le cadre d'une étude clinique menée auprès de sujets âgés de 11 à 15 ans révolus au moment de la primo-vaccination. Les taux de séroprotection obtenus avec les deux différents dosages et schémas de vaccination ont été évalués sur une période allant jusqu'à 66 mois après la première dose de la primo-vaccination.
Tous les sujets des deux groupes de vaccination ont reçu une dose de rappel 72 à 78 mois après la primo-vaccination. Un mois plus tard, une réponse anamnestique s'était formée chez tous les sujets (augmentation de la GMC de 108 et 95 fois un mois après la dose de rappel en comparaison aux valeurs d'avant la vaccination, dans les groupes avec le schéma de primo-vaccination à 2 doses et à 3 doses) et une séroprotection a été montrée. Ces données indiquent qu'une mémoire immunitaire a été induite chez tous les sujets qui avaient répondu à la primo-vaccination, aussi chez ceux qui n'avaient plus de séroprotection au mois 66.
|
Groupe
|
Temps
|
N
|
Taux de réponse
≥10 mUI/ml
|
Taux de réponse
≥100 mUI/ml
|
GMC (mUI/ml)
| |
Groupe 1
(20 μg: 0, 6 mois)
|
Avant le rappel
|
53
|
77,4%
|
28,3%
|
57,7
| |
|
Un mois après le rappel
|
53
|
100%
|
94,3%
|
6214,1
| |
Groupe 2
(10 μg: 0, 1, 6 mois)
|
Avant le rappel
|
21
|
95,2%
|
52,4%
|
175,2
| |
|
Un mois après le rappel
|
21
|
100%
|
95,2%
|
16 564,3
| |
Groupe 1 & Groupe 2 combinés
|
Avant le rappel
|
74
|
82,4%
|
35,1%
|
80,4
| |
|
Un mois après le rappel
|
74
|
100%
|
94,6%
|
8207,6
|
La persistance à long terme a été évaluée dans le cadre de l'étude clinique de phase IV HBV-319, ouverte et non contrôlée, menée auprès de sujets (N = 292) âgés de 15 à 16 ans qui avaient été immunisés avec 3 doses d'Engerix-B 10 au cours des deux premières années de leur vie. Le critère d'évaluation principal était la réponse anti-HBs 31 jours après une vaccination de rappel avec Engerix-B 10 dans le groupe de personnes ayant atteint un taux de séroprotection anti-HBs ≥100 mUI/ml. La séroprotection anti-HBs ≥100 mUI/ml était de 23,3% 14 ans (fourchette: de 13,5 à 15,5 ans) après la primo-vaccination. À cette date, tous les sujets ont reçu une dose de provocation d'Engerix-B 10. Un mois après l'administration de cette dose de provocation, 90,8% des sujets présentaient une séroprotection ≥100 mUI/ml. Le tableau ci-après présente les données ainsi que les seuils de séroprotection ≥10 mUI/ml et ≥100 mUI/ml respectivement avant et après la vaccination de rappel.
|
|
|
≥10 mUI/ml
|
≥100 mUI/ml
| |
|
|
|
IC à 95%
|
|
IC à 95%
| |
Anticorps
|
Moment
|
N
|
n
|
%
|
LL
|
UL
|
n
|
%
|
LL
|
UL
| |
Anticorps anti-HBs
|
Pré-DP
|
292
|
191
|
65,4
|
59,6
|
70,9
|
68
|
23,3
|
18,6
|
28,6
| |
|
Post-DP
|
292
|
286
|
97,9
|
95,6
|
99,2
|
265
|
90,8
|
86,8
|
93,8
|
Pré-DP = avant administration de la dose de provocation
Post-DP = après administration de la dose de provocation
n = nombre de sujets présentant une concentration de 10 mUI/ml resp. de 100 mUI/ml ou plus
% = pourcentage de sujets présentant une concentration de 10 mUI/ml resp. de 100 mUI/ml ou plus
IC à 95% = intervalle de confiance à 95%; LL = limite inférieure, UL = limite supérieure
Chez des nouveau-nés de mères AgHBe-positives, une efficacité protectrice de 95% a été observée après immunisation selon le schéma 0/1/2 mois, suivi de l'injection d'une dose de rappel 12 mois après la première dose, ainsi qu'après un schéma 0/1/6 mois (sans administration concomitante d'immunoglobulines anti-hépatite B à la naissance). Quand la première vaccination était associée à des immunoglobulines anti-hépatite B, le taux de protection augmentait à 98%.
À long terme, l'immunisation contre l'hépatite B diminue l'incidence non seulement de la maladie elle-même, mais aussi de ses complications telles que l'hépatite B chronique active et la cirrhose post-hépatitique. Après une campagne nationale de vaccination contre l'hépatite B à Taiwan, un recul significatif de l'incidence du cancer hépatocellulaire chez les enfants âgés de 6-14 ans a été constaté. Ce recul était dû à la diminution marquée de la prévalence des antigènes de l'hépatite B comme facteur décisif pour le développement du cancer hépatocellulaire.
PharmacocinétiqueLes études d'absorption, de distribution et d'élimination ne sont généralement pas effectuées pour les vaccins.
Absorption
Non pertinent.
Distribution
Non pertinent.
Métabolisme
Non pertinent.
Élimination
Non pertinent.
Données précliniquesLes données précliniques de sécurité satisfont les exigences de l'OMS.
Remarques particulièresIncompatibilités
Engerix-B ne doit pas être mélangé avec d'autres vaccins dans la même seringue.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Conservé à une température comprise entre +2°C et +8°C, Engerix-B conserve sa pleine efficacité pendant 3 ans à partir de la date de fabrication.
Remarques particulières concernant le stockage
Conserver au réfrigérateur (2-8°C). Ne pas congeler. Conserver le récipient dans son carton pour le protéger de la lumière. Conserver hors de portée des enfants.
Les données de stabilité indiquent qu'Engerix-B est stable pendant trois jours à des températures allant jusqu'à 37°C et pendant sept jours à des températures allant jusqu'à 25°C. Ces données servent de valeurs indicatives pour les professionnels de la santé lors de brèves variations de température.
Remarques concernant la manipulation
Lors du stockage, un fin dépôt blanc avec un surnageant limpide incolore peut se former. Le vaccin doit être bien agité avant l'emploi, jusqu'à la formation d'une suspension homogène blanchâtre et trouble. Le vaccin doit en outre être contrôlé à l'œil nu avant administration pour déceler d'éventuelles particules étrangères et/ou modifications de son aspect. Le vaccin ne doit pas être administré en cas d'anomalies.
Mode d'emploi de la seringue préremplie
|
|
|
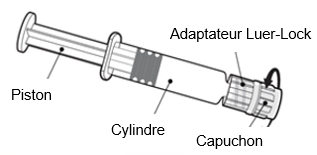
Tenez la seringue par le cylindre et non par le piston. Dévissez le capuchon en le tournant dans le sens inverse des aiguilles d’une montre.
| |
|
|
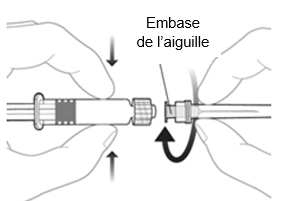
Pour fixer l’aiguille sur la seringue, connectez l’embase de l’aiguille sur l’adaptateur Luer-Lock et tournez l’aiguille d’un quart de tour dans le sens des aiguilles d’une montre jusqu’à sentir son enclenchement. Ne retirez pas le piston de la seringue du cylindre. Si cela devait se produire, n’administrez pas le vaccin.
|
Élimination
Les résidus de vaccin non utilisé et les déchets doivent être éliminés conformément à la réglementation locale.
Numéro d’autorisationEngerix-B 20: 00534 (Swissmedic)
Engerix-B 10: 00551 (Swissmedic)
PrésentationEngerix-B 20
1 emballage avec 1 seringue préremplie (aiguille séparée) avec suspension de vaccin (20 µg/1 ml). (B)
1 emballage avec 10 seringues préremplies (aiguilles séparées) avec suspension de vaccin (20 µg/1 ml). (B)
Engerix-B 10
1 emballage avec 1 seringue préremplie (aiguille séparée) avec suspension de vaccin (10 µg/0,5 ml). (B)
Titulaire de l’autorisationGlaxoSmithKline AG, 6340 Baar
Mise à jour de l’informationOctobre 2024
|


