CompositionPrincipes actifs
Virus de la rougeole (souche Schwarz) (vivant, atténué), virus des oreillons (souche RIT 4385) (vivant, atténué), virus de la rubéole (souche Wistar RA 27/3) (vivant, atténué).
Excipients
Poudre: lactose, sorbitol (E 420) 9 mg, mannitol (E 421), acides aminés (contient de la phénylalanine 334 µg).
Solvant: eau pour préparations injectables.
Résidus provenant du procédé de fabrication
Sulfate de néomycine.
Indications/Possibilités d’emploiPriorix est indiqué pour l'immunisation active contre la rougeole, les oreillons et la rubéole chez les enfants à partir de 12 mois et les adultes.
Priorix peut être administré à partir de l'âge de 9 mois dans des circonstances particulières (par ex. conformément aux recommandations nationales en matière de vaccination, dans des situations épidémiques ou lors de voyages dans une région où la prévalence de la rougeole est élevée). Il faut cependant tenir compte du fait que les nourrissons durant la première année de vie peuvent ne pas répondre suffisamment aux composants du vaccin (rougeole, oreillons) en raison d'éventuelles interférences avec les anticorps maternels.
Lorsqu'une situation épidémiologique requiert la vaccination durant la première année de vie, une deuxième dose de Priorix est recommandée de préférence 3 mois après la première dose.
La vaccination par Priorix est également recommandée chez les personnes exposées professionnellement qui peuvent transmettre ces infections à des femmes enceintes ou à d'autres patients à risques (par exemple dans des maternités, hôpitaux pour enfants, etc.).
Priorix doit être administré selon les recommandations officielles de vaccination.
Posologie/Mode d’emploiPosologie usuelle
La dose recommandée pour les adultes et les enfants est de 0,5 ml de vaccin reconstitué.
Personnes à partir de l'âge de 12 mois
Pour garantir une protection optimale, l'administration d'une deuxième dose est recommandée. La deuxième dose peut être administrée à partir d'un mois après la première dose.
Enfants âgés de 9 à 12 mois
Il faut tenir compte du fait que les nourrissons durant la première année de vie peuvent ne pas répondre suffisamment aux composants du vaccin (rougeole, oreillons) en raison de possibles interférences avec les anticorps maternels. Une deuxième dose de Priorix est recommandée chez ces enfants de préférence 3 mois après la première dose.
Une vaccination de rattrapage peut généralement être effectuée à tout âge.
Mode d'administration
Priorix est à injecter par voie sous-cutanée, mais peut aussi être injecté par voie intramusculaire, dans la région deltoïde de la partie supérieure du bras ou dans la région antérolatérale de la cuisse (voir «Mises en garde et précautions»).
Le vaccin doit être administré par voie sous-cutanée chez les personnes présentant des troubles hémorragiques (par ex. une thrombocytopénie ou un trouble de la coagulation).
Pour les instructions concernant la reconstitution du vaccin avant administration, voir «Remarques particulières».
Contre-indicationsPriorix est contre-indiqué en cas d'hypersensibilité connue à l'un des composants du vaccin ou à la néomycine. Un antécédent de dermatite de contact provoquée par la néomycine ne constitue pas une contre-indication à la vaccination. Pour l'allergie aux protéines de l'œuf de poule, voir «Mises en garde et précautions».
Priorix est contre-indiqué chez les personnes qui ont développé une réaction d'hypersensibilité lors d'une administration antérieure de vaccins contre la rougeole, les oreillons et/ou la rubéole.
Comme lors de l'utilisation de tous les autres vaccins, il faudra différer la vaccination par Priorix en cas de maladie aiguë s'accompagnant d'une fièvre élevée. En revanche, les infections légères ne constituent pas une contre-indication à la vaccination.
Priorix est contre-indiqué chez la femme enceinte. De plus, toute grossesse doit être évitée dans les trois mois qui suivent la vaccination (voir «Grossesse, allaitement»).
Priorix ne doit pas être administré aux sujets présentant une faiblesse du système immunitaire, y compris les patients présentant une immunodéficience primaire ou secondaire. Chez les enfants VIH-positifs, il incombera au médecin traitant de décider ou non de réaliser la vaccination ROR.
Mises en garde et précautionsPriorix ne doit en aucun cas être injecté par voie intravasculaire!
Une syncope (évanouissement) peut survenir après toute vaccination, voire même avant, en particulier chez les adolescents, comme réaction psychogène à l'injection. Ceci peut s'accompagner de plusieurs signes neurologiques comme un trouble transitoire de la vision, des paresthésies et des mouvements tonico-cloniques des membres durant la phase de récupération. Il est important que des mesures soient mises en place afin d'éviter des blessures en cas d'évanouissement.
Comme pour tous les vaccins injectables, il est nécessaire de toujours disposer d'un traitement médical adapté pour le cas où surviendrait une réaction anaphylactique après la vaccination (p.ex. solution d'adrénaline 1/1000).
Attendre l'évaporation complète de l'alcool ou d'autres agents désinfectants appliqués sur la peau avant l'injection, afin d'éviter une inactivation des virus atténués du vaccin.
La réponse immunitaire des enfants peut être insuffisante durant la première année de vie en raison d'une éventuelle interférence avec les anticorps maternels. Lorsqu'une situation épidémiologique requiert la vaccination durant la première année de vie, une deuxième dose de Priorix est recommandée de préférence 3 mois après la première dose. L'intervalle entre les doses ne doit en aucun cas être inférieur à 4 semaines.
Les composants rougeole et oreillons du vaccin sont produits sur cultures cellulaires d'embryon de poulet et peuvent donc contenir des traces de protéines de l'œuf de poule. Chez les personnes présentant des réactions anaphylactiques, anaphylactoïdes ou autres de type immédiat (p.ex. urticaire généralisée, œdème bucco-pharyngé, difficultés respiratoires, hypotension ou choc) après l'ingestion d'œufs, le risque d'une réaction d'hypersensibilité de type immédiat est augmenté après la vaccination, bien que ces réactions n'aient été observées que très rarement. Les personnes qui ont déjà présenté une réaction anaphylactique après l'ingestion d'œufs, doivent être vaccinées avec une prudence extrême. Il est nécessaire de disposer de mesures thérapeutiques appropriées pour le cas où surviendrait une réaction anaphylactique.
Priorix doit être administré avec prudence chez les sujets ayant des antécédents d'allergies ou de convulsions ou chez les sujets ayant des antécédents familiaux positifs.
Un traitement antipyrétique prophylactique doit être administré chez les personnes présentant des affections cérébrales, une prédisposition aux convulsions fébriles ou des antécédents familiaux de convulsions.
Si la vaccination est effectuée dans les 72 heures après une exposition naturelle à la rougeole, il est vraisemblable que la protection obtenue sera diminuée.
Aucune transmission de la rougeole et des oreillons de sujets vaccinés à des personnes prédisposées n'a été rapportée. On sait que le virus de la rubéole est excrété par voie pharyngée environ 7 - 28 jours après la vaccination, avec un pic d'excrétion aux alentours du 11ème jour. Une transmission des virus excrétés à des personnes prédisposées n'a toutefois pas été prouvée.
Des cas d'aggravation de thrombocytopénie et des cas de récidives de thrombocytopénie chez des sujets ayant souffert d'une thrombocytopénie après la première dose ont été rapportés après une vaccination par des vaccins vivants contre la rougeole, les oreillons et la rubéole. Dans de telles situations, une nouvelle vaccination par Priorix n'est pas recommandée.
Les données issues des études cliniques sur l'injection intramusculaire de Priorix montrent que les taux de séroconversion pour les trois antigènes (rougeole, oreillons, rubéole) ont été identiques à ceux observés après injection sous-cutanée. Les titres d'anticorps contre les oreillons et la rubéole peuvent être comparativement plus faibles.
Comme pour tout vaccin, il est possible qu'une réponse immunitaire protectrice ne soit pas atteinte chez tous les sujets vaccinés.
Le médicament contient 9 mg de sorbitol par dose de vaccin.
Ce médicament contient 334 µg de phénylalanine par dose. La phénylalanine peut être nocive pour les patients atteints de phénylcétonurie.
InteractionsSi un test tuberculinique doit être effectué, celui-ci doit être fait avant ou en même temps que la vaccination. Le vaccin vivant contre la rougeole (vraisemblablement aussi celui contre les oreillons) provoque probablement une inhibition transitoire de la réaction cutanée à la tuberculine. C'est pourquoi il faudra attendre 4 à 6 semaines après la vaccination pour effectuer un test tuberculinique, afin de ne pas obtenir de résultats faux négatifs.
Des études ont montré que Priorix peut être administré en même temps que le vaccin vivant Varilrix contre la varicelle, si des sites d'injection différents sont utilisés.
Priorix peut être administré en même temps que le vaccin oral contre la polio (VOP), le vaccin inactivé contre la polio (IPV), le vaccin combiné contre la diphtérie, le tétanos et la coqueluche (DTPw/DTPa), le vaccin contre le Td, l'hépatite B et l'Haemophilus influenzae de type b (Hib) si des sites d'injection différents sont utilisés.
Priorix peut également être administré en même temps que d'autres vaccins vivants atténués comme le BCG, le vaccin contre la fièvre jaune, le vaccin oral contre le typhus.
Lorsque Priorix ne peut pas être administré en même temps que d'autres vaccins vivants atténués, un écart d'au moins un mois entre les vaccinations devra être respecté.
Chez les sujets ayant reçu des gammaglobulines humaines ou une transfusion sanguine, la vaccination par Priorix ne devra être effectuée que trois mois plus tard, en raison de la possibilité d'un échec vaccinal provoqué par l'acquisition passive d'anticorps contre la rougeole, les oreillons et la rubéole.
Priorix peut être administré comme rappel si la primo-vaccination a été faite avec un autre vaccin contre la rougeole, les oreillons et la rubéole.
Grossesse, allaitementGrossesse
L'administration de Priorix est contre-indiquée pendant la grossesse. De plus, toute grossesse doit être exclue dans les 3 mois suivant la vaccination.
Des études sur la toxicité de reproduction n'ont pas été effectuées en expérimentation animale.
Allaitement
Il n'existe que peu de données sur l'administration de Priorix pendant l'allaitement. Toutefois, si le bénéfice l'emporte sur le risque, la vaccination peut être pratiquée .
Effet sur l’aptitude à la conduite et l’utilisation de machinesNon pertinent.
Effets indésirablesDonnées d'études cliniques
Les effets indésirables susceptibles de survenir après l'administration d'un vaccin ROR correspondent à ceux observés après l'administration des vaccins monovalents isolés ou associés.
Dans le cadre d'études cliniques contrôlées, les signes et les symptômes ont été surveillés de manière active pendant une période de suivi de 42 jours. De plus, on a demandé aux sujets vaccinés de signaler tous les événements cliniques pendant la durée de l'étude.
Le profil de tolérance suivant repose sur les données d'environ 12'000 personnes au total ayant reçu Priorix dans des études cliniques.
Les effets indésirables sont rangés par classe de système d'organes de la classification MedDRA et par fréquence selon la convention suivante: «très fréquent» (≥1/10), «fréquent» (≥1/100, <1/10), «occasionnel» (≥1/1000, <1/100), «rare» (≥1/10'000, <1/1000), «très rare» (<1/10'000).
Infections et infestations
Fréquents: Infections des voies respiratoires supérieures.
Occasionnels: Otite moyenne.
Affections hématologiques et du système lymphatique
Occasionnels: Lymphadénopathie.
Affections du système immunitaire
Rares: Réactions allergiques.
Troubles du métabolisme et de la nutrition
Occasionnels: Anorexie.
Affections psychiatriques
Fréquents: Nervosité.
Occasionnels: Cris anormaux, insomnie.
Affections du système nerveux
Rares: Convulsions fébriles.
Affections oculaires
Occasionnels: Conjonctivite.
Affections respiratoires, thoraciques et médiastinales
Occasionnels: Bronchite, toux.
Affections gastro-intestinales
Occasionnels: Gonflement des parotides, diarrhée, vomissements.
Affections de la peau et du tissu sous-cutané
Fréquents: Eruption cutanée.
Troubles généraux et anomalies au site d'administration
Très fréquents: Rougeur au site d'injection (12,2%), fièvre ≥38°C (rectale) ou ≥37,5°C (axillaire/orale) (22,7%).
Fréquents: Douleurs et gonflement au site d'injection, fièvre > 39,5°C (rectale) ou ≥39,0°C (axillaire/orale).
Les fréquences des effets indésirables ont habituellement été semblables pour la première et la deuxième dose de vaccin. Les douleurs au site d'injection ont fait exception, elles ont été «fréquentes» après la première dose et «très fréquentes» après la deuxième dose.
Effets indésirables identifiés après la mise sur le marché
Depuis la mise sur le marché, les réactions supplémentaires suivantes ont été rapportées suite à une vaccination par Priorix:
Infections et infestations
Rares: Méningite, syndrome semblable à la rougeole, syndrome semblable aux oreillons (y compris orchite, épididymite et parotidite).
Affections hématologiques et du système lymphatique
Rares: Thrombocytopénie, purpura thrombocytopénique.
Affections du système immunitaire
Rares: Réactions allergiques, y compris réactions anaphylactiques.
Affections du système nerveux
Rares: Encéphalite*, cérébellite, symptômes de type cérébellite (y compris des troubles transitoires de la locomotion et une ataxie transitoire), syndrome de Guillain-Barré, myélite transverse, névrite périphérique.
Affections vasculaires
Rares: Vascularite (y compris purpura de Henoch-Schönlein et syndrome de Kawasaki).
Affections de la peau et du tissu sous-cutané
Rares: Erythème polymorphe.
Affections musculosquelettiques et du tissu conjonctif
Rares: Arthralgie, arthrite.
* Une encéphalite a été rapportée avec une fréquence inférieure à 1 dose sur 10 millions. Le risque d'encéphalite après l'administration de la vaccination est beaucoup plus faible que le risque d'encéphalite après une maladie naturelle (rougeole: 1 cas sur 1000 à 2000; rubéole: environ 1 cas sur 6000).
L'administration intravasculaire accidentelle peut provoquer des réactions sévères, pouvant aller jusqu'à un choc. Des mesures immédiates adaptées au degré de sévérité devront être prises (voir «Mises en garde et précautions»).
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageDes cas de surdosage (jusqu'à 2 fois la posologie recommandée) ont été rapportés depuis la mise sur le marché. Aucun effet indésirable n'a été mis en rapport avec le surdosage.
Propriétés/EffetsCode ATC
J07BD52
Priorix est un vaccin combiné composé d'un lyophilisat de virus atténués de la rougeole Schwarz, de virus des oreillons RIT 4385 et de virus de la rubéole de souche Wistar RA 27/3.
Priorix satisfait aux exigences de l'OMS pour la fabrication de substances biologiques ainsi qu'aux exigences relatives aux vaccins combinés produits à partir de virus vivants contre la rougeole, les oreillons et la rubéole.
Les virus de la rougeole et des oreillons sont cultivés, extraits et purifiés séparément sur des cultures cellulaires d'embryons de poulet et les virus de la rubéole dans des cultures de cellules diploïdes MRC-5 humaines.
Mécanisme d'action
Non pertinent.
Pharmacodynamique
Priorix confère une immunisation active contre la rougeole, les oreillons et la rubéole.
Des études cliniques ont montré une efficacité élevée de Priorix. Des anticorps contre la rougeole, les oreillons et la rubéole ont été décelés respectivement chez 98,0%, 96,1% et 99,3% des sujets vaccinés séronégatifs antérieurement.
Dans une étude comparative, 98,7% des sujets vaccinés séronégatifs antérieurement présentaient des anticorps contre la rougeole, 95,5% des anticorps contre les oreillons et 99,5% des anticorps contre la rubéole après vaccination par Priorix, comparativement à 96,9% contre la rougeole, 96,9% contre les oreillons et 99,5% contre la rubéole après vaccination par un autre vaccin combiné ROR commercialisé.
12 mois après la vaccination, tous les sujets vaccinés étaient séropositifs pour les anticorps contre la rougeole et la rubéole. Les anticorps contre les oreillons étaient encore décelables dans 88,4% des cas. Ces résultats ont également été observés avec un autre vaccin combiné disponible sur le marché (87%).
Efficacité clinique
Voir sous «Pharmacodynamique».
PharmacocinétiqueL'évaluation des propriétés pharmacocinétiques n'est pas requise pour les vaccins.
Absorption
Non pertinent.
Distribution
Non pertinent.
Métabolisme
Non pertinent.
Élimination
Non pertinent.
Données précliniquesNon pertinent.
Remarques particulièresIncompatibilités
Priorix ne doit pas être mélangé avec d'autres vaccins dans la même seringue.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques particulières concernant le stockage
Conserver au réfrigérateur (2-8°C), à l'abri de la lumière dans l'emballage d'origine et hors de portée des enfants. Respecter la chaîne du froid. Ne pas congeler!
En cas de transport, tenir compte des conditions de stockage, en particulier dans les zones climatiques chaudes.
Remarques concernant la manipulation
Priorix se présente sous la forme de pellets blanchâtres à légèrement rosés dans un flacon-ampoule. Le solvant stérile est limpide et incolore et se trouve dans une seringue prête à l'emploi. En raison de légers écarts de pH, la couleur du vaccin reconstitué peut varier de pêche à rose fuchsia, sans que cela n'ait d'influence sur son efficacité.
Le solvant et le vaccin reconstitué doivent être soumis avant la reconstitution ou l'administration à un contrôle visuel pour s'assurer de l'absence de particules étrangères et/ou de modifications de l'aspect physique. Si l'on observe de quelconques modifications, le solvant ou le vaccin reconstitué ne doivent pas être utilisés.
Instructions pour la reconstitution du vaccin avec le solvant contenu dans la seringue préremplie
Priorix est reconstitué en ajoutant la totalité du contenu de la seringue préremplie de solvant dans le flacon-ampoule contenant la poudre.
Pour fixer l'aiguille à la seringue, suivez les instructions ci-dessous. La seringue fournie avec Priorix peut toutefois légèrement différer de la seringue illustrée (c.-à-d. sans filetage). Dans ce cas, l'aiguille ne doit pas être vissée pour être connectée à la seringue.
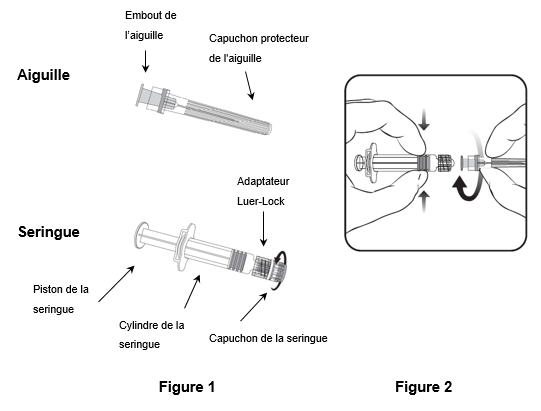
Tenez toujours la seringue par le cylindre. Ne tenez pas la seringue par le piston ou l'adaptateur Luer-Lock (ALL).
1.Tenez la seringue par le cylindre et retirez le capuchon de la seringue en le tournant dans le sens inverse des aiguilles d'une montre (comme illustré dans la figure 1).
2.Pour fixer l'aiguille à la seringue, introduisez prudemment l'embout de l'aiguille dans l'ALL et tournez l'aiguille dans le sens des aiguilles d'une montre jusqu'à ce qu'elle soit solidement fixée (comme illustré dans la figure 2). Veillez pendant cette opération à ce que l'aiguille soit dans l'axe de la seringue (comme illustré dans la figure 2). L'ALL risquerait sinon de se tordre et de ne plus être étanche. Si l'ALL se détache pendant la fixation de l'aiguille, il faut utiliser une nouvelle dose de vaccin (nouvelle seringue et nouveau flacon-ampoule).
3.Retirez le capuchon protecteur de l'aiguille, qui peut parfois résister.
4.Ajoutez le solvant à la poudre. Puis agitez soigneusement le mélange jusqu'à ce que la poudre soit entièrement dissoute dans le solvant.Le vaccin doit être administré immédiatement après la reconstitution.
5.Prélevez la totalité du contenu du flacon-ampoule dans la seringue.
6.Une nouvelle aiguille doit être utilisée pour l'administration du vaccin. Retirez l'aiguille de la seringue en la dévissant et fixez une aiguille d'injection en répétant l'étape 2.
Le vaccin doit être injecté dès que possible après reconstitution, et pas plus de 8 heures après sa reconstitution.
Les résidus de vaccin non utilisés et les déchets doivent être éliminés conformément à la règlementation nationale.
Numéro d’autorisation00615 (Swissmedic)
PrésentationFlacon-ampoule avec vaccin lyophilisé et seringue prête à l'emploi avec solvant (aiguilles séparées): 1 et 10 [B].
Titulaire de l’autorisationGlaxoSmithKline AG, 6340 Baar
Mise à jour de l’informationNovembre 2023
|

