CompositionPrincipes actifs
Toxoïde diphtérique; toxoïde tétanique; toxoïde de la coqueluche (PT); hémagglutinine filamenteuse (HAF) de Bordetella pertussis; pertactine (PRN) de Bordetella pertussis; antigène de surface du virus de l'hépatite B (HBsAg); poliovirus inactivé de type 1 (souche Mahoney); poliovirus inactivé de type 2 (souche MEF-1); poliovirus inactivé de type 3 (souche Saukett); polysaccharide capsulaire purifié de Haemophilus influenzae de type b (conjugué).
Excipients
Dans le composant DTPa-HBV-IPV: hydroxyde d'aluminium, phosphate d'aluminium, chlorure de sodium corresp. 1,8 mg de sodium, milieu 199, eau pour préparations injectables q.s. ad 0,5 mL.
Dans le composant Hib: lactose, phosphate d'aluminium.
Résidus
Sulfate de néomycine, sulfate de polymyxine B, polysorbate 20 et 80, formaldéhyde.
Indications/Possibilités d’emploiInfanrix hexa (DTPa-HBV-IPV+Hib) est indiqué pour la primovaccination et la vaccination de rappel contre la diphtérie, le tétanos, la coqueluche, l'hépatite B, la poliomyélite et l'Haemophilus influenzae de type b chez les nourrissons et les jeunes enfants à partir de l'âge de 6 semaines.
Infanrix hexa n'est pas destiné à être utilisé chez l'enfant de plus de 36 mois.
Infanrix hexa doit être administré selon les recommandations officielles de vaccination.
Posologie/Mode d’emploiPosologie usuelle
Primovaccination régulière
Elle se compose de trois vaccinations à des intervalles de 2 mois.
1ère dose à l'âge de 2 mois.
2ème dose à l'âge de 4 mois.
3ème dose à l'âge de 6 mois.
La primovaccination avec 3 doses peut alternativement être aussi faite à un intervalle d'au moins un mois entre les doses, conformément aux recommandations officielles.
En outre, des données relatives à un schéma de primovaccination avec deux doses à un intervalle d'au moins 2 mois sont disponibles à partir de l'âge de 8 semaines (voir «Propriétés/Effets» pour les schémas vaccinaux qui ont fait l'objet d'études cliniques).
La vaccination par Infanrix hexa (DTPa-HBV-IPV+Hib) selon le schéma EPI (Expanded Program on Immunisation; vaccination à l'âge de 6, 10 et 14 semaines) ne doit être effectuée que si l'enfant a été vacciné à la naissance contre l'hépatite B.
Si une dose de vaccin contre l'hépatite B a déjà été administrée à la naissance, Infanrix hexa (DTPa-HBV-IPV+Hib) peut être administré en remplacement de doses supplémentaires du vaccin contre l'hépatite B à partir de l'âge de 6 semaines. Si une deuxième vaccination contre l'hépatite B est nécessaire avant cette date, il convient d'utiliser un vaccin monovalent contre l'hépatite B. Infanrix hexa (DTPa-HBV-IPV+Hib) peut aussi être utilisé pour un schéma mixte d'immunisation avec le vaccin pentavalent combiné de GSK contre la diphtérie, le tétanos, la coqueluche (acellulaire), la poliomyélite (inactivé) et l'Haemophilus influenzae de type b (DTPa-IPV+Hib), selon les recommandations officielles.
Interchangeabilité
Infanrix hexa (DTPa-HBV-IPV+Hib) peut être remplacé par l'administration simultanée du vaccin pentavalent DTPa-IPV+Hib de GSK et du vaccin contre l'hépatite B de GSK.
Vaccination de rappel
Après une série de primovaccination avec Infanrix hexa, une vaccination de rappel doit être réalisée selon les recommandations officielles.
Infanrix hexa (DTPa-HBV-IPV+Hib) peut être administré en rappel si l'enfant a reçu une primovaccination complète avec chacun des antigènes contenus dans le vaccin, qu'elle ait été réalisée avec des vaccins monovalents ou combinés.
Infanrix hexa peut être utilisé en rappel chez des enfants qui ont été vaccinés auparavant avec un autre vaccin hexavalent non disponible localement au moment de la vaccination de rappel, ou chez ceux qui ont été vaccinés avec un vaccin pentavalent DTPa-IPV+Hib en association avec un vaccin monovalent contre l'hépatite B.
D'autres associations d'antigènes ont été examinées au cours d'études cliniques après la primovaccination par Infanrix hexa (DTPa-HBV-IPV+Hib) et peuvent être employées pour la vaccination de rappel: DTPa, DTPa-IPV+Hib, DTPa-HBV-IPV.
Mode d'administration
Infanrix hexa (DTPa-HBV-IPV+Hib) est à injecter par voie intramusculaire profonde. Les sites d'injection recommandés sont la face antérolatérale de la cuisse (site d'injection privilégié chez les nourrissons de moins d'un an) ou le muscle deltoïde dans la partie supérieure du bras.
Contre-indicationsInfanrix hexa (DTPa-HBV-IPV+Hib) ne doit pas être utilisé chez les enfants présentant une hypersensibilité connue à l'un des composants du vaccin (y compris la néomycine et la polymyxine) ni chez ceux ayant présenté des signes d'hypersensibilité suite à une administration précédente d'un vaccin contre la diphtérie, le tétanos, la coqueluche, l'hépatite B, la poliomyélite ou le Hib.
Infanrix hexa (DTPa-HBV-IPV+Hib) est contre-indiqué si l'enfant a souffert d'une encéphalopathie d'étiologie inconnue au cours des 7 jours qui ont suivi une vaccination anticoquelucheuse antérieure. Dans ce cas, il convient de suspendre la vaccination anticoquelucheuse et de poursuivre l'immunisation au moyen de vaccins contre la diphtérie, le tétanos, l'hépatite B, la poliomyélite (vaccin inactivé) et le Hib.
Comme pour les autres vaccins, l'administration d'Infanrix hexa doit être différée chez les sujets atteints d'infections fébriles sévères aiguës. Une infection légère ne représente pas une contre-indication.
Mises en garde et précautionsInfanrix hexa (DTPa-HBV-IPV+Hib) ne doit en aucun cas être administré par voie intravasculaire ou intradermique!
Conformément aux «bonnes pratiques de vaccination» habituelles, la vaccination doit être précédée d'une vérification des antécédents médicaux (en particulier en ce qui concerne des vaccinations antérieures et les effets secondaires possibles) et éventuellement d'un examen clinique.
Comme pour tous les vaccins injectables, un traitement médical approprié doit toujours être disponible et une surveillance de l'enfant vacciné doit être assurée pour les rares cas de réaction anaphylactique secondaire à la vaccination.
Infanrix hexa (DTPa-HBV-IPV+Hib) doit être administré avec prudence chez les enfants présentant une thrombocytopénie ou un trouble de la coagulation sanguine, car une hémorragie peut survenir à la suite d'une injection intramusculaire chez ces enfants.
En présence des symptômes suivants, dont la survenue est chronologiquement liée à l'administration d'un vaccin avec des composants coquelucheux, la décision d'administrer des doses supplémentaires contenant des composants coquelucheux doit être soigneusement pesée:
·hausse de la température à ≥40,0°C dans les 48 heures après la vaccination sans autre cause connue;
·collapsus ou pseudo-état de choc (épisodes d'hypotonie-hyporéactivité) dans les 48 heures après la vaccination;
·pleurs inconsolables persistant pendant plus de 3 heures et survenant dans les 48 heures après la vaccination;
·convulsions avec ou sans fièvre, survenant dans les 3 jours après la vaccination.
Dans certaines circonstances, par ex. en cas d'incidence élevée de coqueluche, les avantages potentiels de la vaccination peuvent l'emporter sur les risques possibles.
Comme pour toute vaccination, le rapport bénéfice/risque de réaliser une vaccination par Infanrix hexa ou de la reporter doit être évalué avec attention chez un nourrisson ou un enfant souffrant d'une maladie neurologique sévère, qu'elle soit nouvelle ou évolutive.
Une réponse immunitaire protectrice peut ne pas être obtenue chez tous les sujets vaccinés.
Infanrix hexa ne prévient pas les maladies provoquées par d'autres agents pathogènes que Corynebacterium diphtheriae, Clostridium tetani, Bordetella pertussis, le virus de l'hépatite B, les poliovirus ou l'Haemophilus influenzae de type b. Toutefois, on peut supposer qu'une immunisation peut permettre de prévenir une hépatite D car cette dernière ne survient pas sans une hépatite B.
Des antécédents de convulsions fébriles chez l'enfant à vacciner ainsi que des antécédents familiaux de convulsions et de syndrome de mort subite du nourrisson (SIDS) ne sont pas des contre-indications à la vaccination par Infanrix hexa. Des antécédents de convulsions fébriles chez l'enfant à vacciner exigent une attention particulière, car de tels effets indésirables peuvent survenir dans les 2-3 jours suivant la vaccination.
Une incidence élevée de fièvre (> 39,5°C) a été rapportée chez des enfants en bas âge vaccinés par Infanrix hexa et Prevenar en comparaison avec des enfants en bas âge ayant reçu le vaccin hexavalent seul.
Lors de l'administration concomitante d'Infanrix hexa et de Prevenar 13, une augmentation des taux de déclarations de convulsions (avec ou sans fièvre) et d'épisodes d'hypotonie-hyporéactivité (EHH) a été observée (voir «Effets indésirables»).
Un traitement antipyrétique peut être instauré conformément aux directives thérapeutiques locales, mais il faut tenir compte du fait que le traitement antipyrétique peut affaiblir la réaction immunitaire à certains composants immunogènes des deux vaccins. Il est préférable de dissocier dans le temps l'administration d'Infanrix hexa et celle de Prevenar 13.
Une syncope (évanouissement) peut survenir après toute vaccination, voire même avant, comme réaction psychogène à l'injection. Il est important que des mesures soient mises en place afin d'éviter des blessures en cas d'évanouissement.
Populations particulières
Une infection par le VIH ne constitue pas une contre-indication à la vaccination par Infanrix hexa (DTPa-HBV-IPV+Hib). La réaction immunitaire souhaitée peut faire défaut chez les patients immunodéprimés après la vaccination.
Des données cliniques montrent qu'Infanrix hexa peut être utilisé chez les prématurés, mais comme attendu dans cette population, une réponse immunitaire plus faible à certains antigènes a été observée. Une diminution de l'effet protecteur clinique, par ex. contre l'hépatite B, ne peut pas être exclue (voir «Effets indésirables» et «Propriétés/Effets»). Le schéma vaccinal accéléré indiqué pour les prématurés (nés avant la 33ème semaine de grossesse avec un poids <1500 g à la naissance) dans le plan de vaccination suisse n'a pas été étudié chez cette population dans les études sur Infanrix hexa.
Le risque potentiel d'apnées et la nécessité d'une surveillance respiratoire pendant 48-72 heures doivent être pris en considération dans le cadre de la primovaccination des grands prématurés (nés avant la fin de la 28ème semaine de grossesse) et en particulier de ceux ayant des antécédents de signes d'immaturité pulmonaire. Les bénéfices de la vaccination étant élevés chez ce groupe de nourrissons, celle-ci ne doit pas leur être refusée ni être reportée.
Chez les prématurés, seule la primovaccination régulière avec 3 doses d'Infanrix hexa a fait l'objet d'études.
Influence sur les résultats d'analyse de laboratoire
Le polysaccharide capsulaire de Hib étant éliminé dans les urines, un test urinaire positif peut être obtenu 1 à 2 semaines après la vaccination. Il convient d'effectuer d'autres examens pour être en mesure de confirmer une infection à Hib pendant cette période.
Ce médicament contient moins de 1 mmol de sodium (23 mg) par dose de vaccin, c.-à-d. qu'il est pratiquement «sans sodium».
InteractionsLes données sur la sécurité et l'efficacité de l'administration concomitante d'Infanrix hexa (DTPa-HBV-IPV+Hib) et d'un vaccin Rougeole-Oreillons-Rubéole sont insuffisantes pour permettre d'émettre une recommandation.
Les données portant sur l'administration concomitante d'Infanrix hexa (DTPa-HBV-IPV+Hib) et d'un vaccin pneumococcique conjugué (Prevenar) lors d'une primovaccination avec 3 doses de vaccin ne fournissent aucun indice évoquant une interférence cliniquement significative au niveau de la réponse en anticorps aux antigènes individuels. Une incidence élevée de fièvre (> 39,5°C) a cependant été rapportée après l'administration concomitante d'Infanrix hexa et de Prevenar en comparaison à l'administration du vaccin hexavalent seul chez des enfants en bas âge (voir «Mises en garde et précautions» pour les instructions sur Prevenar et Prevenar 13). Il est préférable de dissocier dans le temps l'administration d'Infanrix hexa et celle de Prevenar 13.
Dans l'étude DTPa-HBV-IPV-111, 68 sujets ont reçu Infanrix hexa en tant que dose de rappel (4e dose après la primovaccination selon le schéma de 3-4-5 mois) en même temps que le vaccin conjugué pneumococcique (Prevenar). On a constaté un effet légèrement réducteur de Prevenar sur le pourcentage de répondeurs atteignant un titre d'anticorps anti-HBs ≥100 mUI/mL (88,2% versus 94,2%) et sur le niveau absolu des concentrations moyennes géométriques d'anticorps (GMC, 4709,0 mUI/mL versus 11255,7 mUI/mL).
Comme avec d'autres vaccins, une réponse immunitaire adéquate peut faire défaut chez les patients sous traitement immunosuppresseur.
Un traitement par des antipyrétiques tels que le paracétamol peut affaiblir la réaction immunitaire à certains composants d'Infanrix hexa et d'autres vaccins administrés en même temps, par ex. les vaccins pneumococciques.
Grossesse, allaitementInfanrix hexa (DTPa-HBV-IPV+Hib) n'étant pas destiné à l'adulte, on ne dispose pas de données suffisantes concernant une utilisation pendant la grossesse et l'allaitement chez l'être humain, ni d'études de reproduction adéquates chez l'animal.
Effet sur l’aptitude à la conduite et l’utilisation de machinesNon pertinent.
Effets indésirablesEtudes cliniques
Le profil d'effets secondaires suivant provient des données de plus de 16'000 enfants.
Comme cela a été observé avec d'autres vaccins DTPa et des combinaisons de vaccins contenant DTPa, une augmentation de la réactogénicité locale et des cas de fièvre ont été rapportés après la vaccination de rappel par Infanrix hexa par rapport à la primovaccination. Au cours d'études cliniques, un gonflement œdémateux ayant entraîné occasionnellement une augmentation du volume de l'extrémité dans laquelle le vaccin avait été injecté a été observé avec une fréquence de 2,3% après l'administration d'une dose de rappel d'Infanrix hexa. Toutes ces réactions ont disparu sans séquelles.
Etudes cliniques sur la co-administration
Au cours des études cliniques dans lesquelles des sujets vaccinés ont reçu Infanrix hexa en même temps que Prevenar comme dose de rappel (4ème dose), une fièvre ≥38,0°C a été rapportée chez 43,4% des enfants ayant reçu les deux vaccins simultanément. Dans le groupe vacciné par Infanrix hexa seul, une telle fièvre a été rapportée dans 30,5% des vaccinations. Une fièvre > 39,5°C a été observée chez 2,6% des enfants vaccinés à la fois par Prevenar et Infanrix hexa et chez 1,5% des enfants ayant reçu Infanrix hexa seul.
L'incidence de fièvre suite à la co-administration de ces deux vaccins était plus faible suite à la primovaccination que suite à la vaccination de rappel.
Liste récapitulative des effets indésirables observés dans les études cliniques
Les fréquences par dose sont définies comme suit: très fréquents: ≥1/10; fréquents: ≥1/100 à < 1/10; occasionnels: ≥1/1000 à < 1/100; rares: ≥1/10 000 à < 1/1000; très rares: < 1/10 000.
Infections et infestations
Occasionnels: infections des voies respiratoires supérieures.
Affections du système immunitaire
Fréquents: infections virales, candidoses, otite moyenne.
Occasionnels: infections.
Troubles du métabolisme et de la nutrition
Très fréquents: perte d'appétit (17,8%).
Affections psychiatriques
Très fréquents: irritabilité (37,4%), pleurs inhabituels (12,3%), agitation (19,7% après la primovaccination, 19,0% après la vaccination de rappel).
Fréquents: excitabilité.
Occasionnels: insomnie.
Affections du système nerveux
Très fréquents: somnolence (31%).
Très rares: crises convulsives (avec ou sans fièvre)***; troubles de la conscience ou perte de conscience; collapsus ou pseudo-état de choc (épisode d'hypotonie-hyporéactivité).
Affections oculaires
Fréquents: conjonctivite.
Affections respiratoires, thoraciques et médiastinales
Fréquents: infections des voies respiratoires supérieures, bronchite, toux*, rhume, pharyngite.
Occasionnels: bronchospasme, laryngite, stridor.
Très rares: respiration irrégulière, apnée.
Affections gastro-intestinales
Fréquents: diarrhée, entérite, gastroentérite, vomissements.
Occasionnels: douleurs abdominales, constipation.
Affections de la peau et du tissu sous-cutané
Fréquents: éruption cutanée, dermatite, prurit.
Occasionnels: eczéma.
Très rares: urticaire.
Troubles généraux et anomalies au site d'administration
Corps entier:
Très fréquents: fièvre ≥38°C (23,5%), pleurs inhabituels (12,3%), instabilité psychomotrice (19,5%).
Fréquents: fièvre > 39,5°C.
Occasionnels: fatigue.
Très rares: réactions allergiques (incluant éruption cutanée et prurit), réactions anaphylactiques (incluant urticaire).
Au site d'injection:
Très fréquents: douleurs (25,9%), rougeur (35,2%), gonflement (25,9%), gonflement local au site d'injection (≤50 mm) [après la primovaccination: 23,8%, grade 3 (> 20 mm) 3,1%; après la vaccination de rappel: 34,1%, grade 3: 7,8%].
Fréquents: gonflement local au site d'injection (> 50 mm)**, induration au site d'injection.
Occasionnels: gonflement diffus du membre dans lequel a été effectuée l'injection, en partie avec implication du membre voisin.
Très rares: gonflement de tout le membre autour du site d'injection.
Effets indésirables identifiés après la mise sur le marché
Affections hématologiques et du système lymphatique
Gonflement des ganglions lymphatiques, thrombocytopénie.
Affections du système immunitaire
Réactions allergiques (incluant éruption cutanée et prurit), réactions anaphylactiques, réactions anaphylactoïdes (incluant urticaire et angio-œdème*).
Affections du système nerveux
Crises convulsives (avec ou sans fièvre); troubles de la conscience ou perte de conscience; collapsus ou pseudo-état de choc (épisode d'hypotonie-hyporéactivité)***.
Affections respiratoires, thoraciques et médiastinales
Respiration irrégulière, apnée (pour les grands prématurés, voir «Mises en garde et précautions»).
Affections de la peau et du tissu sous-cutané
Œdème angioneurotique*.
Au site d'injection:
** Induration au site d'injection, gonflement de tout le membre autour du site d'injection. Chez les enfants primovaccinés avec un vaccin anticoquelucheux acellulaire, le risque de survenue d'une réaction avec un gonflement après l'administration d'une dose de rappel est plus important que chez les enfants ayant été primovaccinés avec un vaccin anticoquelucheux à germes entiers. Ces réactions ont habituellement disparu en l'espace de 4 jours.
* Observé avec d'autres vaccins DTPa de GlaxoSmithKline.
** Voir sous «Effets indésirables identifiés après la mise sur le marché», dernier paragraphe.
*** Dans la comparaison entre les groupes ayant rapporté l'utilisation concomitante d'Infanrix hexa et de Prevenar 13 et les groupes ayant rapporté l'utilisation d'Infanrix hexa seul, l'analyse des taux de déclarations depuis la commercialisation indique un risque potentiellement accru de convulsions (avec ou sans fièvre) et d'EHH lors de l'association des deux vaccins. Il est préférable de dissocier dans le temps l'administration d'Infanrix hexa et celle de Prevenar 13.
Tolérance chez les prématurés
Dans trois études avec environ 300 enfants prématurés (nés entre la fin de la 24e et la fin de la 36e semaine de grossesse) ou ayant présenté un faible poids à la naissance, la sécurité d'Infanrix hexa a été évaluée après la primovaccination avec 3 doses administrées à l'âge de 2, 4 et 6 mois en comparaison avec des enfants nés à terme avec un poids normal. La sécurité d'une vaccination de rappel à un âge de 18 à 24 mois a été évaluée chez environ 200 enfants prématurés ou ayant présenté un faible poids à la naissance. La réactogénicité locale et systémique d'Infanrix hexa chez les enfants prématurés ou ayant présenté un faible poids à la naissance était similaire à celle observée chez les enfants nés normalement à terme. Des cas d'apnée, d'hypoxie et de bradycardie survenus immédiatement après la vaccination par Infanrix hexa et considérés comme étant dus à la vaccination ont été rapportés par les médecins investigateurs surtout chez les prématurés nés avant la 28ème semaine de grossesse. Au total, il y a eu un cas de SIDS parmi les prématurés vaccinés par Infanrix hexa. Les instructions spécifiques du plan de vaccination suisse pour la vaccination des enfants prématurés nés avant la 33e semaine de grossesse ou ayant un poids à la naissance <1500 g doivent être respectées.
Sécurité chez les nourrissons et les enfants nés de mères vaccinées avec le dTpa pendant la grossesse
Infanrix hexa a été administré dans des études cliniques à plus de 500 enfants nés de mères vaccinées avec le dTpa ou avec un placebo pendant la grossesse. Le profil de sécurité d'Infanrix hexa était comparable, indépendamment du fait qu'une exposition au dTpa ait eu lieu ou non pendant la grossesse.
Expérience avec le vaccin contre l'hépatite B
Pendant la phase post-marketing, il y a eu des rapports de méningite, réactions allergiques à type de maladie sérique, paralysie, encéphalite, encéphalopathie, neuropathie, névrite, hypotension, vascularite, lichen plan, érythème polymorphe, arthrite, faiblesse musculaire, syndrome de Guillain-Barré et thrombocytopénie suite à la vaccination avec le vaccin contre l'hépatite B de GlaxoSmithKline (Engerix-B) chez les enfants. Un lien de causalité avec le vaccin n'a pas été établi.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageAucun cas de surdosage n'est connu.
Propriétés/EffetsCode ATC
J07CA09 (vaccin bactérien et viral combiné).
Les anatoxines diphtérique et tétanique sont obtenues par traitement au formaldéhyde de toxines purifiées de Corynebacterium diphtheriae et de Clostridium tetani. Les composants du vaccin anticoquelucheux acellulaire sont obtenus par extraction et purification de cultures de Bordetella pertussis en phase I, suivies d'une détoxification irréversible de la toxine coquelucheuse par un traitement au glutaraldéhyde et au formaldéhyde et d'un traitement de l'HAF et de la PRN au formaldéhyde. L'HBsAg est obtenu à partir de cultures de levures (Saccharomyces cerevisiae) qui expriment l'information génétique pour la formation de la protéine. L'antigène de surface est purifié suite à plusieurs étapes physico-chimiques. Les anatoxines diphtérique et tétanique, les composants coquelucheux acellulaires et hépatite B sont adsorbés sur des sels d'aluminium.
Les trois poliovirus sont cultivés sur lignée cellulaire continue VERO, purifiés et inactivés avec du formaldéhyde.
Les composants DTPa-HBV-IPV sont mis en suspension dans une solution saline.
Le polysaccharide de Hib est obtenu à partir de Haemophilus influenzae de type b, souche 20'752, et - après activation avec du bromure de cyanogène et addition d'une fonction hydrazide adipique - est conjugué à l'anatoxine tétanique par condensation en présence de carbodiimide. Après purification, le conjugué est adsorbé sur des sels d'aluminium, puis lyophilisé avec du lactose utilisé comme stabilisateur.
Infanrix hexa (DTPa-HBV-IPV+Hib) satisfait aux dispositions de l'OMS relatives à la fabrication de produits biologiques, de vaccins antidiphtériques, antitétaniques, anticoquelucheux et combinés, de vaccins contre l'hépatite B produits à l'aide des technologies de l'ADN recombinant, de vaccins antipoliomyélitiques inactivés et de vaccins conjugués Hib.
Mécanisme d'action
Non pertinent.
Pharmacodynamique
Immunogénicité
Des corrélats sérologiques de protection vaccinale ont été déterminés pour la diphtérie, le tétanos, la poliomyélite, l'hépatite B et le Hib. Pour la coqueluche, il n'existe aucun corrélat sérologique de protection vaccinale.
L'immunogénicité d'Infanrix hexa a fait l'objet d'études cliniques menées chez des enfants âgés de 6 semaines et plus et incluant l'utilisation d'Infanrix hexa comme groupe de contrôle actif par rapport à d'autres vaccins hexavalents. Le vaccin a été évalué dans le cadre d'un schéma de primovaccination avec 2 doses et avec 3 doses, incluant le schéma vaccinal de l'Expanded Program on Immunisation de l'OMS, ainsi que comme vaccin de rappel. Les résultats de ces études sont résumés dans les tableaux ci-dessous.
Après une primovaccination avec 3 doses, au moins 95,7% des enfants présentaient des titres d'anticorps séroprotecteurs ou séropositifs contre chacun des antigènes du vaccin. Après la vaccination de rappel (après la 4ème dose), au moins 98,4% des enfants avaient développé des titres d'anticorps séroprotecteurs ou séropositifs contre chacun des antigènes du vaccin.
Proportion d'enfants avec des titres d'anticorps au-dessus de la valeur seuil un mois après la primovaccination avec 3 doses et après une vaccination de rappel avec Infanrix hexa:
|
Anticorps
(valeur seuil)
|
Après la 3ème dose
|
Après la 4ème dose
(vaccination de rappel durant la 2e année de vie après une primovaccination avec 3 doses)
| |
2-3-4 mois
N = 196
(2 études)
|
2-4-6 mois
N = 1'693
(6 études)
|
3-4-5 mois
N = 1'055
(6 études)
|
6-10-14 semaines
N = 265
(1 étude)
|
N=2009
(12 études)
| |
%
|
%
|
%
|
%
|
%
| |
Anti-diphtérie
(0,1 UI/mL) #
|
100
|
99,8
|
99,7
|
99,2
|
99,9
| |
Anti-tétanos
(0,1 UI/mL) #
|
100
|
100
|
100
|
99,6
|
99,9
| |
Anti-PT
(5 EL.U/mL)
|
100
|
100
|
99,8
|
99,6
|
99,9
| |
Anti-HAF
(5 EL.U/mL)
|
100
|
100
|
100
|
100
|
99,9
| |
Anti-PRN
(5 EL.U/mL)
|
100
|
100
|
99,7
|
98,9
|
99,5
| |
Anti-HBs
(10 mUI/mL) #
|
99,5
|
98,9
|
98,0
|
98,5*
|
98,4
| |
Anti-HBs
(100 mUI/mL)
|
84,1
|
92,2
|
85,3
|
79,3
|
84,8
| |
Anti-polio type 1 (dilution au 1/8) #
|
100
|
99,9
|
99,7
|
99,6
|
99,9
| |
Anti-polio type 2 (dilution au 1/8) #
|
97,8
|
99,3
|
98,9
|
95,7
|
99,9
| |
Anti-polio type 3 (dilution au 1/8) #
|
100
|
99,7
|
99,7
|
99,6
|
99,9
| |
Anti-PRP (Hib)
(0,15 µg/mL) #
|
96,4
|
96,6
|
96,8
|
97,4
|
99,7
|
N = nombre d'enfants
* Dans un sous-groupe d'enfants n'ayant pas reçu de vaccin contre l'hépatite B à la naissance, 77,7% des enfants avaient des titres anti-HBs ≥10 mUI/mL.
# Valeur seuil généralement reconnue indiquant un effet protecteur.
Après une vaccination complète avec Infanrix hexa avec deux doses pour la primovaccination et une vaccination de rappel, au moins 97,9% des enfants ont développé des titres d'anticorps séroprotecteurs ou séropositifs contre chacun des antigènes du vaccin.
Proportion d'enfants avec des titres d'anticorps supérieurs à la valeur seuil un mois après une primovaccination avec 2 doses et un mois après une vaccination de rappel avec Infanrix hexa:
|
|
Après la 2ème dose
|
Après la 3ème dose
| |
Anticorps
(valeur seuil)
|
2-4-12 mois
N=223
(1 étude)
|
2-4-12 mois
N=592
(groupe contrôle dans une étude publiée)
|
3-5-11 mois
N=530
(4 études)
|
2-4-12 mois
N=196
(1 étude)
|
2-4-12 mois
N=580
(groupe contrôle dans une étude publiée)
|
3-5-11 mois
N=532
(3 études)
| |
%
|
%
|
%
|
%
|
%
|
%
| |
Anti-diphtérie
(0,01 UI/mL)
(0,1 UI/mL)#
|
NA
99,6#
|
99,47^
39,86
|
NA
98,0#
|
NA
100#
|
99,83^
71,63
|
NA
100#
| |
Anti-tétanos
(0,1 UI/mL)§
|
100
|
97,50
|
100
|
100
|
94,97
|
100
| |
Anti-PT
(5 EL.U/mL)
|
100
|
98,95
|
99,5
|
99,5
|
99,64
|
100
| |
Anti-HAF
(5 EL.U/mL)
|
100
|
96,54
|
99,7
|
100
|
99,12
|
100
| |
Anti-PRN
(5 EL.U/mL)
|
99,6
|
91,58
|
99,0
|
100
|
98,25
|
99,2
| |
Anti-HBs
(10 mUI/mL)§
|
99,5
|
96,35
|
96,8
|
99,8
|
98,72
|
98,9
| |
Anti-HBs
(100 mUI/mL)
|
95,8
|
80,55
|
85,3
|
99,0
|
95,14
|
97,7
| |
Anti-polio type 1
(dilution au 1/8)§
|
89,6
|
96,39
|
99,4
|
98,4
|
99,83
|
99,8
| |
Anti-polio type 2
(dilution au 1/8)§
|
85,6
|
97,42
|
96,3
|
98,4
|
100
|
99,4
| |
Anti- polio type 3
(dilution au 1/8)§
|
92,8
|
95,16
|
98,8
|
97,9
|
99,65
|
99,2
| |
Anti-PRP (Hib)
(0,15 µg/mL)§
|
84,3‡
|
77,87‡
|
91,7‡
|
100*
|
99,37
|
99,6*
|
N = nombre d'enfants
# ELISA avec valeur seuil séroprotectrice de 0,1 UI/mL
^ Test d'inhibition micrométabolique avec valeur seuil séroprotectrice de 0,01 UI/mL
§ Valeur seuil généralement reconnue indiquant un effet protecteur.
‡ Avant la vaccination de rappel, 63,1% des enfants d'une étude (N=196), 48,08% des enfants d'une autre étude (N=600) avec un schéma vaccinal 2-4-12 mois et 86,3% des enfants (N=524) avec un schéma vaccinal 3-5-11 mois présentaient un titre d'anticorps anti-PRP ≥0,15 µg/mL).
* Après la vaccination de rappel, 94,4% des enfants ayant été vaccinés à l'âge de 2, 4, 12 mois et 97,0% des enfants ayant été vaccinés à l'âge de 3, 5, 11 mois présentaient un titre d'anticorps anti-PRP ≥1 µg/mL, ce qui indique une protection à long terme.
Comme la réponse immunitaire aux antigènes coquelucheux est la même après l'administration d'Infanrix hexa et d'Infanrix DTPa, on s'attend à une même efficacité clinique protectrice contre la coqueluche des deux vaccins.
Effet protecteur contre la coqueluche
Les études suivantes ont montré l'effet protecteur clinique des composants coquelucheux d'Infanrix DTPa, obtenu après la primovaccination avec 3 doses, contre une coqueluche typique définie selon les critères de l'OMS (≥21 jours de toux paroxystique):
|
Étude
|
Pays
|
Schéma de vaccination
|
Efficacité du vaccin
|
Remarques
| |
Étude prospective en aveugle chez des sujets exposés dans leur entourage
|
Allemagne
|
3, 4, 5 mois
|
88,7%
|
D'après les données recueillies de sujets exposés dans l'entourage à un cas de coqueluche typique.
| |
Étude d'efficacité sponsorisée par le NIH (National Institute of Health, USA)
|
Italie
|
2, 4, 6 mois
|
84%
|
Lors d'un suivi de la même cohorte, l'efficacité a été confirmée jusqu'à 60 mois après la fin de la primovaccination sans vaccination de rappel contre la coqueluche.
|
Les résultats d'une étude à long terme en Suède montrent que les vaccins anticoquelucheux acellulaires sont efficaces chez les nourrissons qui ont reçu la primovaccination à 3 et 5 mois et une vaccination de rappel à l'âge de 12 mois. Les données suggèrent toutefois que l'effet protecteur contre la coqueluche peut diminuer à l'âge de 7 à 8 ans avec ce schéma vaccinal (3-5-12 mois). Une 2ème vaccination de rappel chez les enfants âgés de 5 à 7 ans qui ont été vaccinés précédemment selon ce schéma vaccinal (3-5-12 mois) semble donc justifiée.
Immunogénicité chez les nourrissons et les jeunes enfants nés de mères vaccinées avec le dTpa pendant la grossesse
L'immunogénicité d'Infanrix hexa chez les nourrissons et les jeunes enfants nés de mères en bonne santé vaccinées avec le dTpa dans la 27ème à la 36ème semaine de grossesse a été évaluée dans deux études cliniques.
Infanrix hexa a été co-administré aux nourrissons avec un vaccin pneumococcique conjugué 13-valent à l'âge de 2, 4 et 6 mois ou 2, 3 et 4 mois dans le cadre du schéma de primovaccination à trois doses (n=241), ou à l'âge de 3 et 5 mois ou 2 et 4 mois dans le cadre du schéma de primovaccination à deux doses (n=27). Les mêmes nourrissons/jeunes enfants ont reçu Infanrix hexa à l'âge de 11 à 18 mois en dose de rappel (n=229).
Après la primovaccination et après la vaccination de rappel, les données immunologiques n'ont pas montré d'interférence cliniquement pertinente de la vaccination maternelle avec le dTpa sur les réponses immunitaires des nourrissons et jeunes enfants aux antigènes de la diphtérie, du tétanos, de l'hépatite B, du poliovirus inactivé, de l'Haemophilus influenzae de type b ou aux antigènes pneumococciques.
Des concentrations d'anticorps plus faibles contre les antigènes de la coqueluche, après la primovaccination (PT, HAF et PRN) et après la vaccination de rappel (PT, HAF), ont été observées chez les nourrissons et les jeunes enfants nés de mères vaccinées avec le dTpa pendant la grossesse. L'augmentation des concentrations d'anticorps anticoquelucheux avant le rappel et jusqu'à un mois après le rappel était similaire pour les nourrissons et les jeunes enfants nés de mères vaccinées avec aussi bien le dTpa qu'avec un placebo, ce qui démontre une primovaccination efficace du système immunitaire. La pertinence clinique de ces observations n'est pas encore bien comprise, faute de corrélats de protection contre la coqueluche. Cependant, les données épidémiologiques actuelles sur la coqueluche, suite à la mise en place de l'immunisation maternelle par le dTpa, ne suggèrent pas de pertinence clinique de cette interférence immunologique.
Immunogénicité chez les prématurés
L'immunogénicité d'Infanrix hexa après la primovaccination par 3 doses administrées aux âges de 2, 4 et 6 mois a été évaluée dans trois études chez environ 300 enfants prématurés (nés entre la fin de la 24ème et la fin de la 36ème semaine de grossesse) ou ayant présenté un faible poids à la naissance. L'immunogénicité d'une vaccination de rappel à un âge de 18 à 24 mois a été évaluée chez environ 200 enfants prématurés ou ayant présenté un faible poids à la naissance.
Un mois après la primovaccination, au moins 98,7% des sujets étaient sérologiquement protégés contre la diphtérie, le tétanos et les poliovirus de types 1 et 2; au moins 90,9% présentaient des titres d'anticorps séroprotecteurs contre les antigènes PRP et poliovirus type 3; tous les sujets étaient séropositifs pour les anticorps anti-HAF et anti-PRN, et 94,9% étaient séropositifs pour les anticorps anti-PT.
Un mois après la vaccination de rappel, au moins 98,2% des sujets présentaient des titres d'anticorps séroprotecteurs ou séropositifs contre les différents antigènes, à l'exception de PT (au moins 96,8%) et de l'hépatite B.
Les deux études DTPa-HBV-IPV-070 et DTPa-HBV-IPV-090 ont examiné l'influence d'Infanrix hexa utilisé pour la primovaccination chez des prématurés selon le schéma vaccinal à 3 doses à l'âge de 2, 4 et 6 mois par rapport à des enfants nés à terme et chez des enfants ayant présenté un faible poids à la naissance par rapport à des enfants nés avec un poids élevé à la naissance. Les études suivantes, DTPa-HBV-IPV-083 BST:070 et DTPa-HBV-IPV-103 BST:090, ont évalué la première vaccination de rappel avec Infanrix hexa (= 4ème dose). Pour la protection vaccinale contre l'hépatite B, l'effet protecteur était encore incomplet après la vaccination de rappel pour les répondeurs atteignant un titre d'anticorps anti-HBs ≥100 mUI/mL (seuil de protection supposé en 2016 pour les vaccins contre l'hépatite B). Il est possible que cela puisse exiger ultérieurement l'administration supplémentaire de vaccins monovalents contre l'hépatite B. Le tableau suivant présente les résultats obtenus en termes de réponses anti-HBs ≥10 mUI/mL, anti-HBs ≥100 mUI/mL et concentrations moyennes géométriques d'anticorps (GMC).
|
Etude
|
Groupe
|
Date
|
N
|
% ≥10 mUI/mL
(IC à 95%)
|
% ≥100 mUI/mL
(IC à 95%)
|
GMC
(IC à 95%)
| |
DTPa-HBV-IPV-070
DTPa-HBV-IPV-083 BST:070
|
Prématurés
|
PreVacc
|
92
|
10,9
(5,3-19,1)
|
2,2
(0,3-7,6)
|
6,6
(5,5-8,0)
| |
PD3
|
91
|
93,4
(86,2-97,5)
|
87,9
(79,4-93,8)
|
634,1
(433,8-927,0)
| |
PreBST
|
84
|
75,0
(64,4-83,8)
|
41,7
(31,0-52,9)
|
56,8
(39,6-81,4)
| |
PostBST
|
83
|
91,6
(83,4-96,5)
|
90,4
(81,9-95,7)
|
1771,0
(1060,3-2958,1)
| |
Nourrissons nés à terme
|
PreVacc
|
87
|
9,2
(4,1-17,3)
|
5,7
(1,9-12,9)
|
7,2
(5,5-9,4)
| |
PD3
|
84
|
95,2
(88,3-98,7)
|
86,9
(77,8-93,3)
|
867,1
(576,6-1303,9)
| |
PreBST
|
67
|
80,6
(69,1-89,2)
|
38,8
(27,1-51,5)
|
58,1
(39,1-86,3)
| |
PostBST
|
68
|
98,5
(92,1-100)
|
88,2
(78,1-94,8)
|
1965,0
(1180,1-3272,0)
| |
DTPa-HBV-IPV-090
DTPa-HBV-IPV-103 BST:090
|
Nouveau-nés avec un faible poids à la naissance
|
PreVacc
|
78
|
6,4
(2,1-14,3)
|
1,3
(0,0-6,9)
|
5,7
(5,1-6,4)
| |
PD3
|
79
|
93,7
(85,8-97,9)
|
83,5
(73,5-90,9)
|
444,1
(303,6-649,4)
| |
PreBST
|
59
|
61,0
(47,4-73,5)
|
18,6
(9,7-30,9)
|
23,5
(15,7-35,3)
| |
PostBST
|
62
|
88,7
(78,1-95,3)
|
85,5
(74,2-93,1)
|
1026,5
(536,6-1963,8)
| |
Nouveau-nés avec un poids élevé à la naissance
|
PreVacc
|
82
|
8,5
(3,5-16,8)
|
0,0
(0,0-4,4)
|
5,6
(5,1-6,2)
| |
PD3
|
79
|
94,9
(87,5-98,6)
|
83,5
(73,5-90,9)
|
576,4
(382,3-869,0)
| |
PreBST
|
56
|
69,6
(55,9-81,2)
|
28,6
(17,3-42,2)
|
32,7
(21,6-49,4)
| |
PostBST
|
57
|
96,5
(87,9-99,6)
|
86,0
(74,2-93,7)
|
1785,6
(1027,0-3104,5)
|
PreVacc: titre d'anticorps avant vaccination
PD3: post-dose 3 (un mois après la primovaccination avec 3 doses d'Infanrix hexa)
PreBST: PreBooster (juste avant la vaccination de rappel par Infanrix hexa dans la deuxième année de vie)
PostBST: PostBooster (un mois après la vaccination de rappel par Infanrix hexa)
Dans une étude d'extension, au moins 95,7% des enfants étaient encore protégés contre les trois types de poliovirus et contre le PRP environ 2,5 à 3 ans après la vaccination de rappel.
Persistance de la réponse immunitaire
La persistance de la réponse immunitaire contre l'hépatite B après la primovaccination par Infanrix hexa ainsi que l'effet, quelques années plus tard, d'une vaccination de rappel monovalente par un vaccin contre l'hépatite B (Engerix-B) ont été examinés dans cinq études. Le tableau suivant indique les titres d'anticorps anti-HBs observés aux valeurs seuils de ≥10 mUI/mL et de ≥100 mUI/mL, en rapport avec le schéma de primovaccination utilisé avec Infanrix hexa y compris la première vaccination de rappel par Infanrix hexa dans la 2ème année de vie, jusqu'à l'administration d'Engerix-B. Dans les cas de forte exposition endémique ou individuelle à l'hépatite B, un titre d'anticorps anti-HBs ≥100 mUI/mL (valeur seuil) offre une protection plus fiable contre l'hépatite B qu'une plus faible valeur seuil d'anticorps anti-HBs.
Persistance de la réponse immunitaire et réponse à une dose de vaccin contre l'hépatite B après la primovaccination et la vaccination de rappel par Infanrix hexa:
|
|
|
|
Persistance
|
Réponse au vaccin de l'hépatite B
| |
Etude
|
Schéma de vaccination
|
Temps depuis la dernière dose d'Infanrix hexa
|
≥10 mUI/mL
|
≥100 mUI/mL
|
≥10 mUI/mL
|
≥100 mUI/mL
| |
%
(IC à 95%)
|
%
(IC à 95%)
|
%
(IC à 95%)
|
%
(IC à 95%)
| |
112
(N=286)
|
3 doses avant l'âge de 9 mois et rappel entre 11 et 18 mois
|
Estimé à env. 3 ans
|
85,3
(80,6-89,2)
|
47,0
(41,1-53,0)
|
98,6
(96,5-99,6)
|
95,8
(92,8-97,8)
| |
111
(N=188)
|
2-4-6 mois et rappel entre 12 et 23 mois ou
3-4-5 mois et rappel entre 12 et 23 mois
|
3,6 ans
|
86,0
(80,2-90,7)
|
53,8
(46,3-61,1)
|
98,4
(95,4-99,7)
|
92,0
(87,2-95,5)
| |
113
(N=284)
|
3 doses avant l'âge de 9 mois et rappel entre 11 et 18 mois
|
Estimé à env. 6 ans
|
72,2
(66,6-77,3)
|
30,6
(25,3-36,4)
|
98,9
(96,7-99,8)
|
95,8
(92,6-97,9)
| |
110
(N=187)
|
3-4-5 mois et rappel entre 12 et 18 mois
|
6,4 ans
|
78,0
(71,3-83,7)
|
33,9
(27,1-41,2)
|
98,9
(96,2-99,9)
|
93,6
(89,1-96,6)
| |
126
(N=95)
|
3-5 mois et rappel à l'âge de 11 mois
|
10,7 ans
|
48,4
(38,0-58,9)
|
14,7
(8,3-23,5)
|
96,8
(91,0-99,3)
|
93,6
(86,6-97,6)
|
N = nombre de sujets
Aucune donnée sur la persistance à long terme des anticorps anti-VHB après la vaccination de nourrissons et d'enfants en bas âge selon un schéma de vaccination à l'âge de 2, 4 et 12 mois n'est disponible.
Dans deux des cinq études, la persistance des anticorps contre d'autres antigènes vaccinaux d'Infanrix hexa (D, T, aP, polio, Hib) jusqu'à l'administration d'une vaccination de rappel monovalente avec un vaccin contre l'hépatite B (Engerix-B) a également été examinée. Le tableau suivant indique l'évolution des anticorps observée en fonction du schéma de vaccination utilisé pour la primovaccination par Infanrix hexa y compris la première vaccination de rappel par Infanrix hexa dans la 2ème année de vie jusqu'à l'administration d'Engerix-B. Aucune donnée sur la persistance des anticorps anti-D, anti-T, anti-Pa, anti-polio et anti-Hib après l'administration d'Infanrix hexa selon un schéma de vaccination 2+1 n'est disponible.
Proportion de sujets avec des titres d'anticorps supérieurs à la valeur seuil après la primovaccination et la vaccination de rappel par Infanrix hexa:
|
Anticorps
(valeur seuil)
|
Enfants âgés de 4 à 5 ans
Schéma de vaccination de 2-4-6 mois et vaccination de rappel à l'âge de 12-23 mois (env. 3,6 ans après la dernière dose d'Infanrix hexa)
|
Enfants âgés de 7 à 8 ans
Schéma de vaccination de 3-4-5 mois et vaccination de rappel à l'âge de 12-18 mois (env. 6,4 ans après la dernière dose d'Infanrix hexa)
| |
N
|
%
|
N
|
%
| |
Anti-diphtérie
(0,1 UI/mL)
|
198
|
68,7
|
51
|
66,7
| |
Anti-tétanos
(0,1 UI/mL)
|
198
|
74,7
|
51
|
64,7
| |
Anti-PT
(5 EL.U/mL)
|
197
|
25,4
|
161
|
32,3
| |
Anti-HAF
(5 EL.U/mL)
|
197
|
97,5
|
161
|
98,1
| |
Anti-PRN
(5 EL.U/mL)
|
198
|
90,9
|
162
|
87,0
| |
Anti-polio type 1 (dilution au 1/8)
|
185
|
95,7
|
145
|
91,0
| |
Anti-polio type 2 (dilution au 1/8)
|
187
|
95,7
|
148
|
91,2
| |
Anti-polio type 3 (dilution au 1/8)
|
174
|
97,7
|
144
|
97,2
| |
Anti-PRP (Hib)
(0,15 µg/mL)
|
198
|
98,0
|
193
|
99,5
|
N = nombre de sujets
Expériences post-commercialisation concernant l'efficacité clinique
L'efficacité du composant Hib d'Infanrix hexa a été étudiée dans une grande étude de surveillance post-commercialisation en Allemagne. Sur une période de 7 ans, l'efficacité des composants Hib de deux vaccins hexavalents, dont l'un était Infanrix hexa, était de 89,6% après une primovaccination complète et de 100% après une primovaccination complète avec rappel (indépendamment du vaccin Hib utilisé pour la primovaccination).
D'après une analyse de sensibilité conservatrice, si tous les cas d'infections à Haemophilus étaient inclus, y compris ceux pour lesquels un typage n'était pas connu ou n'avait pas été réalisé, l'effet protecteur s'élevait à 74,7% (IC à 95% 19,4%-94,6%) dans un groupe qui ne comprenait que des personnes incomplètement immunisées, c'est-à-dire un groupe ayant reçu la dose pendant la 2ème année, mais incomplètement immunisé. L'efficacité estimée du vaccin dans cette hypothèse était de 89,8% (IC à 95% 77,1%-95,4%) après une primovaccination complète et de 98,2% (IC à 95% 87,2%-99,7%) après une primovaccination complète avec rappel.
Depuis 2006, Infanrix hexa est le principal vaccin à composant Hib disponible en Italie. Le vaccin est administré aux âges de 3, 5 et 11 mois. La couverture vaccinale dépasse 95%. L'infection à Hib reste bien contrôlée, les rapports de 2006 à octobre 2011 ne signalent pas plus de trois cas confirmés d'infection à Hib par an chez des enfants italiens de moins de 5 ans.
L'analyse de tous les cas d'infections à Hib déclarés en Italie, indépendamment de l'âge, révèle un nombre annuel de 7 cas de Hib au maximum. Parallèlement à la régression des infections à Haemophilus influenzae de type b, on observe une augmentation relativement importante des infections invasives par des souches non encapsulées d'Haemophilus influenzae, dont la proportion était déjà de 68% dans les études de 2008/2009 portant sur l'Europe entière. Une augmentation absolue des souches non encapsulées de Haemophilus influenzae ne peut actuellement pas encore être confirmée de façon fiable, mais elle ne peut pas non plus être exclue.
Efficacité clinique
Voir sous «Pharmacodynamique».
PharmacocinétiqueL'évaluation des propriétés pharmacocinétiques n'est pas requise pour les vaccins.
Absorption
Non pertinent.
Distribution
Non pertinent.
Métabolisme
Non pertinent.
Élimination
Non pertinent.
Données précliniquesLes résultats d'études précliniques conventionnelles portant sur la sécurité, la toxicité spécifique et répétée ainsi que la compatibilité des composants n'indiquent aucun risque particulier pour l'homme.
Remarques particulièresIncompatibilités
Infanrix hexa (DTPa-HBV-IPV+Hib) ne doit pas être mélangé avec d'autres vaccins dans la même seringue.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques particulières concernant le stockage
Conserver au réfrigérateur (2-8°C), à l'abri de la lumière dans l'emballage d'origine et hors de portée des enfants.
Ne pas congeler la suspension DTPa-HBV-IPV ni le vaccin reconstitué! Tout vaccin congelé doit être jeté.
Remarques concernant la manipulation
Agiter vigoureusement la seringue préremplie avec la suspension DTPa-HBV-IPV avant son emploi jusqu'à l'obtention d'une suspension homogène, trouble et blanche. La suspension DTPa-HBV-IPV doit être examinée visuellement avant son emploi afin de constater toute présence éventuelle de particules étrangères et/ou d'altérations de l'aspect. Si des anomalies sont observées, le vaccin ne doit pas être administré.
Reconstitution du vaccin:
Le vaccin est reconstitué en ajoutant le contenu total de la seringue préremplie avec la suspension DTPa-HBV-IPV au flacon avec la poudre de Hib. Avant administration, le mélange doit être agité vigoureusement jusqu'à ce que la poudre se soit complètement dissoute. Remettre complètement le vaccin dissous dans la seringue préremplie.
Le vaccin reconstitué paraît un peu plus trouble que le composant liquide seul. L'efficacité du vaccin n'en est toutefois pas modifiée.
Le vaccin reconstitué doit être inspecté visuellement quant à la présence éventuelle de particules étrangères et/ou d'altérations de l'aspect. Si des anomalies sont observées, le vaccin ne doit pas être administré.
Le vaccin doit être injecté immédiatement après sa reconstitution. Le vaccin reconstitué peut toutefois être conservé pendant 8 heures au maximum à température ambiante (21°C).
Mode d'emploi de la seringue préremplie:
|
|
|
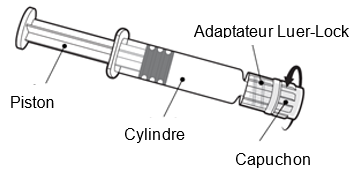
Tenez la seringue par le cylindre, pas par le piston.
Dévissez le capuchon de la seringue en le tournant dans le sens inverse des aiguilles d’une montre.
| |
|
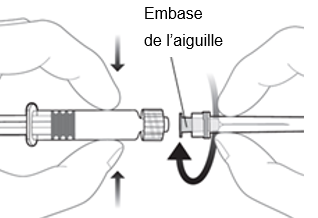
|
Pour fixer l’aiguille à la seringue, connectez l’embase de l’aiguille à l’adaptateur Luer-Lock et tournez l’aiguille d’un quart de tour dans le sens des aiguilles d’une montre jusqu’à ce que vous sentiez qu’elle s’enclenche.
Reconstituez le vaccin comme décrit ci-dessus.
Ne tirez pas le piston de la seringue hors du cylindre. Si cela se devait se produire, n’administrez pas le vaccin.
|
Le vaccin non utilisé et les déchets doivent être éliminés conformément aux exigences nationales.
Numéro d’autorisation00640 (Swissmedic)
PrésentationEmballage avec 1 seringue préremplie de vaccin DTPa-HBV-IPV en suspension et 1 flacon de vaccin Hib sous forme de poudre (aiguilles séparées) (B).
Emballage avec 10 seringues préremplies de vaccin DTPa-HBV-IPV en suspension et 10 flacons de vaccin Hib sous forme de poudre (aiguilles séparées) (B).
Titulaire de l’autorisationGlaxoSmithKline AG, 6340 Baar
Mise à jour de l’informationMai 2024
|


