CompositionPrincipes actifs
Concentré de facteurs humains de coagulation II, VII, IX, X (PPSB) et protéines C et S.
Excipients
Antithrombine III, héparine (correspond à ≤40 U.I. par flacon de Beriplex P/N 500 et ≤80 U.I. par flacon de Beriplex P/N 1000), albumine humaine, chlorure de sodium, citrate de sodium, hydroxyde de sodium, acide chlorhydrique (correspond à ≤3 mmol ou 69 mg de sodium par flacon de Beriplex P/N 500 et ≤6 mmol ou 137 mg de sodium par flacon de Beriplex P/N 1000).
Solvant: eau pour injection.
Indications/Possibilités d’emploi·Prophylaxie périopératoire et thérapie des hémorragies lors d'un déficit acquis en facteurs du complexe prothrombinique, par ex. lors d'un déficit acquis après un traitement avec des antagonistes de la vitamine K ou à la suite d'un surdosage d'antagonistes de la vitamine K quand une correction rapide du déficit est requise.
·Prophylaxie périopératoire et thérapie des hémorragies lors de déficit congénital en facteurs de coagulation dépendants de la vitamine K, dans la mesure où aucun concentré de facteurs isolés n'est disponible.
Posologie/Mode d’emploi(Voir aussi sous «Remarques concernant la manipulation».)
Posologie
Les recommandations suivantes pour les posologies servent exclusivement de guide général. Le traitement doit être effectué sous la surveillance d'un médecin expérimenté dans le traitement de l'hémophilie.
La posologie et la durée du traitement substitutif dépendent de l'indication, du degré de sévérité du trouble de la coagulation, de la localisation et de l'importance de l'hémorragie ainsi que de l'état clinique du patient.
La posologie et la fréquence du traitement doivent toujours être adaptées au cas particulier, en fonction de l'efficacité clinique observée.Les intervalles requis des doses doivent être adaptés en fonction de la demi-vie in vivo des différents facteurs de coagulation complexe prothrombinique (voir chapitre «Pharmacocinétique»).
Les principes d'une posologie individuelle sont la détermination régulière de la concentration plasmatique des facteurs de coagulation correspondants, ou les tests globaux des facteurs de coagulation afin de déterminer la concentration plasmatique en complexe prothrombinique (comme par ex. le temps de Quick/l'INR), ainsi que la surveillance continue de l'état clinique du patient.
Une surveillance rigoureuse de l'hémostase et de la coagulation est indispensable, surtout en cas d'intervention chirurgicale majeure (tests spécifiques pour les facteurs de coagulation et/ou tests globaux de la concentration du complexe prothrombinique).
Hémorragies et prophylaxie périopératoire d'hémorragies pendant le traitement avec des antagonistes de la vitamine K:
La posologie dépend de l'INR initial avant le traitement et de l'INR ciblé. Pour pouvoir calculer le plus précisément possible la dose nécessaire de Beriplex P/N, l'INR avant le traitement sera mesuré si possible juste avant l'administration. Le tableau ci-dessous donne les quantités nécessaires à administrer (ml/kg de poids corporel du produit reconstitué, resp. U.I. FIX/kg de poids corporel) pour arriver à la normalisation de l'INR (i.e. <1,3) lors de taux initiaux d'INR différents:
|
INR avant le début du traitement
|
2,0–3,9
|
4,0–6,0
|
>6,0
| |
Posologie en ml/kg de poids corporel
|
1
|
1,4
|
2
| |
Posologie en U.I. (Facteur IX) / kg de poids corporel
|
25
|
35
|
50
|
Il est recommandé de ne pas dépasser un dosage unique de 5000 U.I. FIX.
La correction du trouble de l'hémostase induit par l'antagoniste de la vitamine K est usuellement obtenue environ 30 minutes après l'injection. Chez les patients qui reçoivent le Beriplex P/N en raison d'une inversion urgente nécessaire de l'effet inhibiteur de la coagulation des antagonistes de la vitamine K, l'administration simultanée de vitamine K devrait toujours être envisagée, car l'effet de la vitamine K débute normalement dans les 4-6 heures. Une administration répétée de Beriplex P/N à des patients qui nécessitent une inversion urgente nécessaire de l'effet inhibiteur de la coagulation d'antagonistes de la vitamine K n'est pas étayée par des données cliniques et n'est donc pas recommandée.
Ces résultats se basent sur les données issues d'expériences cliniques avec un nombre limité de sujets. Un contrôle de l'INR est indispensable pendant le traitement, car le taux de récupération et la durée de l'efficacité peuvent varier.
Hémorragies et prophylaxie périopératoire lors de déficit héréditaire d'un facteur de coagulation dépendant de la vitamine K, lorsqu'un concentré du facteur spécifique de coagulation n'est pas disponible:
Le calcul de la dose nécessaire du concentré du complexe prothrombinique repose sur des données d'études cliniques sur des patients qui étaient traités par des antagonistes de la vitamine K. Il y a lieu d'attendre que:
·1 U.I. de facteur IX par kg de poids corporel élève l'activité plasmatique du facteur IX de 1,3% (0,013 U.I./ml) par rapport à la norme;
·1 U.I. de facteur VII par kg de poids corporel élève l'activité plasmatique du facteur VII de 1,7% (0,017 U.I./ml) par rapport à la norme;
·1 U.I. de facteur II par kg de poids corporel élève l'activité plasmatique du facteur II de 1,9% (0,019 U.I./ml) par rapport à la norme;
·1 U.I. de facteur X par kg de poids corporel élève l'activité plasmatique du facteur X de 1,8% (0,018 UI/ml) par rapport à la norme.
La quantité du facteur de coagulation spécifique à administrer est exprimée en Unités Internationales (U.I.), ramenées aux standards actuels de l'OMS pour les facteurs de coagulation. L'activité des facteurs de coagulation spécifiques dans le plasma est exprimée soit en pourcentage (par rapport au plasma humain normal) soit en U.I. (par rapport aux standards internationaux des facteurs de coagulation).
1 U.I. de facteur de coagulation correspond à la quantité de facteur de coagulation contenue dans 1 ml de plasma humain normal.
Le calcul de la dose nécessaire, par exemple pour le facteur X, se base sur le résultat d'études cliniques selon lequel 1 U.I. de facteur X par kg de poids corporel augmente l'activité plasmatique du facteur X d'environ 0,018 U.I./ml.
La dose nécessaire est déterminée selon la formule suivante:
unités nécessaires = poids corporel (kg) × augmentation souhaitée du taux de facteur X (U.I./ml) × 56, 56 (ml/kg) étant la valeur estimée réciproque de la récupération.
Cette valeur individuelle n'est néanmoins utilisée pour le calcul que si elle est connue.
On dispose d'informations spécifiques sur le produit, qui ont été obtenues à partir d'études cliniques avec des volontaires sains (N = 15) ainsi que d'études relatives à l'inversion de l'effet inhibiteur de la coagulation d'antagonistes de la vitamine K dans le cas d'hémorragies importantes ou pour la prophylaxie périopératoire d'hémorragies (N = 98, N = 43 (cf. «Pharmacocinétique»).
Afin de garantir la traçabilité des médicaments biotechnologiques, il convient de documenter pour chaque traitement le nom commercial et le numéro de lot.
Patients âgés
Le schéma posologique, le mode et la durée d'administration chez les personnes âgées (>65 ans) correspondent aux recommandations générales.
Enfants et adolescents
La sécurité et l'efficacité de Beriplex P/N chez les enfants et les adolescents n'a pas encore été démontrée lors d'études cliniques contrôlées.
Mode d'administration
La reconstitution de Beriplex P/N sera effectuée comme décrit au chapitre «Remarques particulières - remarques concernant la manipulation».
La solution reconstituée, donc prête à l'emploi, est administrée par voie intraveineuse (pas plus de 3 U.I./kg/min, max 210 U.I./min, ce qui correspond à environ 8 ml/min).
Contre-indicationsHypersensibilité connue à l'un des principes actifs ou excipients utilisés dans la formulation.
Lors de coagulopathie de consommation, les préparations de complexes prothrombiniques doivent être administrées uniquement après interruption de la consommation.
Thrombocytopénie induite par l'héparine (TIH) connue par anamnèse.
Mises en garde et précautionsIl est conseillé de demander l'avis d'un spécialiste expérimenté dans le traitement des troubles de la coagulation.
Beriplex P/N ne doit être utilisé chez les patients qui présentent un déficit acquis en facteurs de coagulation dépendant de la vitamine K (par ex. provoqué par un traitement par antagonistes de la vitamine K) uniquement si une augmentation rapide de la concentration en complexe prothrombinique est nécessaire, comme par exemple en cas d'hémorragie grave ou en cas d'intervention chirurgicale urgente. Dans les autres cas, administrer de la vitamine K et/ou réduire la dose de l'antagoniste de la vitamine K sont des mesures souvent suffisantes.
Les patients recevant des antagonistes de la vitamine K peuvent présenter une disposition à l'hypercoagulation qui peut être amplifiée par la perfusion d'un concentré de complexe prothrombinique humain.
En cas de déficit congénital en un facteur de coagulation dépendant de la vitamine K, on devra de préférence utiliser un concentré de facteur spécifique individuel, si celui-ci est disponible.
Si des réactions allergiques ou anaphylactiques se manifestent, cesser immédiatement l'apport de Beriplex P/N (par exemple par interruption de l'injection) et instaurer un traitement adéquat. Les mesures thérapeutiques seront orientées en fonction de la nature et de la sévérité de l'effet indésirable. Suivre les directives médicales actuelles édictées pour le traitement du choc.
Il existe un risque accru de thromboses ou de coagulopathie de consommation lorsque les patients souffrant d'un déficit acquis ou congénital sont traités avec un concentré de complexe prothrombinique – surtout en cas d'administrations répétées.Le risque peut être particulièrement élevé lors de traitement du déficit en facteur VII isolé, car les autres facteurs de coagulation dépendant de la vitamine K peuvent, du fait de leur demi-vie plus longue, s'accumuler avec un taux plasmatique considérablement plus élevé qu'à la normale.Les patients traités par un concentré de complexe prothrombinique doivent être surveillés de près, afin de détecter tout signe annonciateur de thrombose ou de coagulopathie de consommation.
Vu le risque potentiel de complications thromboemboliques, une étroite surveillance s'impose lors de l'utilisation de Beriplex P/N chez les patients atteints de cardiopathie coronarienne, d'infarctus du myocarde, d'affections hépatiques, en phase opératoire ou postopératoire, chez les nouveau-nés ou chez les patients présentant un risque de thromboembolie ou de coagulopathie de consommation, ou lors de carence existante simultanée d'inhibiteurs de la coagulation. Dans tous ces cas, il convient de mettre en balance le bénéfice potentiel d'un traitement avec Beriplex P/N et le risque de telles complications.
On ne dispose pas de données relatives à l'utilisation de Beriplex P/N dans le cas d'une coagulopathie de consommation.
La suppression de l'effet inhibiteur de la coagulation des antagonistes de la vitamine K signifie pour les patients qu'ils sont de nouveau soumis au risque thromboembolique de la maladie sous-jacente. La reprise d'anticoagulants doit par conséquent être envisagée le plus rapidement possible.
Beriplex P/N contient de l'héparine. Par conséquent, une thrombocytopénie de type II induite par l'héparine (TIH type II) peut apparaître (chute du taux de thrombocytes à moins de 50% et/ou apparition de nouvelles thromboses/thromboembolies non expliquées). La manifestation de ces symptômes a lieu de façon très typique dans un laps de temps allant de 4 à 14 jours après le début du traitement par héparine. La TIH peut aussi apparaître dans les 10 heures chez les patients traités à l'héparine durant les 100 derniers jours.
Dans des cas isolés, l'apparition d'un syndrome néphrotique (après tentative d'induction d'une immunotolérance chez les hémophiles B porteurs d'inhibiteurs du facteur IX et ayant des antécédents de réactions allergiques) a été observée.
On ne dispose d'aucune donnée relative à l'administration de Beriplex P/N pour la thérapie d'hémorragies périnatales à la suite d'un déficit en vitamine K chez les nouveau-nés.
Beriplex P/N 500 contient ≤3 mmol (69 mg) de sodium par flacon, ce qui correspond à 3,4% de la dose de sodium alimentaire quotidienne recommandée par l'OMS (2 g).
Beriplex P/N 1000 contient ≤6 mmol (137 mg) de sodium par flacon, ce qui correspond à 6,9% de la dose de sodium alimentaire quotidienne recommandée par l'OMS (2 g).
Sécurité virale
Beriplex P/N est produit à partir de plasma humain. Les mesures habituelles de prévention du risque de transmission d'agents infectieux par les médicaments préparés à partir de sang ou de plasma humain comprennent la sélection clinique des donneurs, la recherche des marqueurs spécifiques d'infection sur chaque don et sur les pools de plasma et l'inclusion dans le procédé de fabrication d'étapes efficaces pour l'inactivation/l'élimination virale. Cependant, lorsque des médicaments préparés à partir de sang ou de plasma humain sont administrés, le risque de transmission d'agents infectieux ne peut pas être totalement exclu. Ceci s'applique également aux virus inconnus ou émergents ou à d'autres types d'agents infectieux. Les mesures mises en place sont considérées comme efficaces vis-à-vis des virus enveloppés tels que par ex. le VIH, le VHB, le VHC ainsi que les virus non enveloppés tels que le VHA et parvovirus B19.
Il est impératif de recommander la vaccination contre l'hépatite A et B aux patients recevant régulièrement des produits sanguins (Beriplex P/N inclus) ou plasmatiques d'origine humaine.
InteractionsLes produits de concentré de complexe prothrombinique humain neutralisent l'efficacité d'un traitement avec des antagonistes de la vitamine K.
Effet d'autres médicaments sur Beriplex P/N
Aucune interaction avec d'autres médicaments n'est connue.
Grossesse, allaitementGrossesse
A ce jour, aucune étude n'a été menée quant à la sécurité de l'administration de facteurs du complexe prothrombinique humain pendant la grossesse ou l'allaitement. Les examens effectués chez l'animal sont insuffisants pour juger des effets sur le cours de la grossesse, sur le développement de l'embryon ou du fœtus, et sur l'accouchement ou le développement postnatal.
C'est pourquoi il convient de bien évaluer le bénéfice et le risque potentiel d'une administration de facteurs du complexe prothrombinique humain pendant la grossesse et l'allaitement.
Allaitement
Voir Grossesse.
Fertilité
On ne dispose d'aucune donnée relative à la fertilité.
Effet sur l’aptitude à la conduite et l’utilisation de machinesAucune étude correspondante n'a été effectuée.
Effets indésirablesRésumé du profil de sécurité
Des réactions d'hypersensibilité, comprenant des réactions d'anaphylaxie graves, sont observées occasionnellement.
Celles-ci peuvent se manifester par un angioœdème, des rougeurs de la peau avec bouffées de chaleur, de l'urticaire généralisée, des papules, de l'hypotension, des nausées, de la nervosité, de la tachycardie, des vomissements ou un stridor.
En outre, des céphalées ont été observées.
Dans le cadre de la thérapie de substitution, un développement d'anticorps neutralisants (inhibiteurs) contre un ou plusieurs facteurs du complexe prothrombinique peut survenir. L'apparition d'inhibiteurs se manifeste par une réponse clinique insuffisante. Dans ce cas, il est recommandé de contacter un centre spécialisé dans le traitement de l'hémophilie pour avis. Chez les patients présentant des anticorps contre les facteurs qui sont contenus dans Beriplex P/N, des réactions anaphylactiques ont été observées.
Il existe un risque d'événements thromboemboliques à la suite de l'administration du complexe prothrombinique humain (voir «Mises en garde et précautions»).
Une augmentation de la température corporelle est fréquemment observée.
Liste des effets indésirables
Les effets indésirables suivants sont basés sur des données d'études cliniques, des analyses de données de l'expérience post-marketing et la littérature scientifique. Les effets indésirables sont rangés par classe de système d'organes selon la classification MedDRA et par fréquence selon la convention suivante: «très fréquents» (≥1/10), «fréquents» (≥1/100 à <1/10), «occasionnels» (≥1/1000 à <1/100), «rares» (≥1/10'000 à <1/1'000), «très rares» (<1/10'000), «fréquence inconnue» (ne peut être estimée sur la base des données disponibles).
Affections hématologiques et du système lymphatique
Fréquence inconnue: coagulopathie de consommation.
Affections du système immunitaire
Occasionnels: hypersensibilité (réactions allergiques).
Fréquence inconnue: réactions anaphylactiques, comprenant un choc anaphylactique; développement d'inhibiteurs.
Affections du système nerveux
Fréquents: céphalées.
Affections vasculaires
Fréquents: événements thromboemboliques*.
Troubles généraux et affections au site d'administration
Fréquents: augmentation de la température corporelle.
* Comprenant des cas avec une issue mortelle.
Informations relatives à la sécurité virale: cf. chapitre «Mises en garde et précautions».
Population pédiatrique
On ne dispose pas de données relatives à l'utilisation de Beriplex P/N chez les enfants et les adolescents.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosagePour éviter un surdosage, il est vivement recommandé de contrôler régulièrement la coagulation pendant le traitement, car des cas d'infarctus du myocarde, de coagulopathie de consommation, de thrombose veineuse et d'embolie pulmonaire ont été observés après administration de fortes doses de concentré de complexe prothrombinique (surdosage). En cas de surdosage, le risque de complications thromboemboliques ou d'une coagulopathie de consommation est accru chez les patients à risque.
Propriétés/EffetsCode ATC
B02BD01
Groupe pharmacothérapeutique: antihémorragique, facteur de coagulation sanguine II, VII, IX et X en combinaison
Beriplex P/N est produit à partir de pools de plasma humain provenant de donneurs sains. Le procédé de fabrication de Beriplex P/N comporte plusieurs étapes contribuant à l'élimination/l'inactivation des virus. Parmi celles-ci, on compte un traitement thermique de la préparation en solution aqueuse, pendant 10 heures à 60 °C, ainsi qu'une étape de filtration spécifique de virus (nanofiltration).
Les facteurs de coagulation II, VII, IX et X sont synthétisés dans le foie sous la dépendance de la vitamine K et sont en général désignés par le nom de complexe prothrombinique. En plus des facteurs de la coagulation, Beriplex P/N contient les inhibiteurs de la coagulation protéine C et protéine S dépendant de la vitamine K.
Mécanisme d'action/Pharmacodynamique
Le facteur VII est le zymogène du facteur VIIa (sérine protéase active) qui initie les voies extrinsèques de la coagulation. Le complexe formé par la thromboplastine tissulaire et le facteur VIIa active les facteurs de coagulation X et IX en facteurs Xa et IXa. Dans la suite de la cascade de coagulation, la prothrombine (facteur II) est transformée en thrombine. Sous l'action de la thrombine, la fibrine se constitue à partir du fibrinogène, ce qui entraîne l'agrégation d'un caillot. La formation physiologique de la thrombine a une importance vitale pour la fonction plaquettaire, notamment dans le cadre de l'hémostase primaire.
Le déficit isolé grave en facteur VII provoque des tendances hémorragiques en raison d'une altération de l'hémostase primaire accompagnée d'une réduction de la formation de thrombine et de fibrine. Le déficit isolé en facteur IX est une des formes classiques de l'hémophilie (hémophilie B). Le déficit isolé en facteur II ou en facteur X spécifiques est très rare, mais peut toutefois, dans les cas graves, être à l'origine d'hémorragies comme celles rencontrées dans les hémophilies classiques.
Les autres composantes, les inhibiteurs de la coagulation protéine C et protéine S, sont également produites dans le foie. L'activité biologique de la protéine C est amplifiée par le cofacteur protéine S.
La protéine C activée inhibe la coagulation en inactivant les facteurs de coagulation Va et VIIIa. La protéine S participe en tant que cofacteur de la protéine C à l'inhibition de la coagulation. Un déficit en protéine C peut être associé à un risque de thrombose.
Un déficit acquis touchant les facteurs de coagulation dépendant de la vitamine K se manifeste dans le cadre d'un traitement par antagonistes de la vitamine K. Les phénomènes déficitaires graves entraînent une tendance hémorragique importante, caractérisée plutôt par des hémorragies rétropéritonéales ou cérébrales que par des saignements musculaires et articulaires. Une insuffisance hépatique grave entraîne également une nette diminution en facteurs de coagulation dépendants de la vitamine K, ainsi qu'une tendance hémorragique complexe due à une réduction simultanée de la coagulation intravasculaire, une baisse de la numération thrombocytaire, une diminution des inhibiteurs de la coagulation et une baisse de la fibrinolyse.
L'administration d'un concentré de complexe prothrombinique humain entraîne une augmentation des facteurs de la coagulation dépendants de la vitamine K dans le plasma et peut corriger de façon transitoire le trouble de coagulation chez les patients qui souffrent d'un déficit touchant un ou plusieurs de ces facteurs.
Efficacité clinique
L'ensemble des preuves cliniques issues des études cliniques centrales et d'appoint montre que Beriplex P/N augmente rapidement la concentration plasmatique des facteurs de coagulation dépendants de la vitamine K et que cette préparation peut corriger de façon transitoire l'anomalie de la coagulation chez les patients atteints d'un déficit acquis ou congénital d'un ou plusieurs de ces facteurs. Au cours de deux études cliniques pivots randomisées et contrôlées de grande envergure, il a été montré que Beriplex P/N peut inverser rapidement et efficacement les effets du traitement par des antagonistes de la vitamine K chez des patients devant subir en urgence une intervention chirurgicale ou invasive ainsi que chez les patients avec des saignements aigus et importants. En outre, Beriplex P/N s'est montré plus efficace que le plasma dans la normalisation de l'INR. Le bénéfice de Beriplex P/N a été montré de manière concordante par plusieurs paramètres d'évaluation complémentaires. Les résultats des études d'autorisation sont concordants avec ceux des études d'appoint en groupe unique.
PharmacocinétiqueLes données pharmacocinétiques et de récupération in vivo ont été obtenues au cours d'une étude sur des volontaires sains (N = 15) ainsi qu'au cours de deux études relatives à l'inversion de l'effet inhibiteur de la coagulation d'antagonistes de la vitamine K dans le cas d'hémorragies importantes ou à la prophylaxie périopératoire d'hémorragies (N = 98, N = 43).
Étude sur des volontaires sains:
15 volontaires sains ont reçu 50 U.I./kg de Beriplex P/N. L'IVR est l'augmentation de la concentration plasmatique mesurable en facteurs de coagulation (U.I./ml), qui est attendue après une perfusion de ces facteurs de coagulation (U.I./kg) sous forme d'une dose de Beriplex P/N. Les IVR incrémentielles des facteurs II, VII, IX, X ainsi que des protéines C et S ont été mesurées. Tous les taux maximums des composants sont apparus dans un intervalle de 3 heures. Les valeurs moyennes des IVR incrémentielles étaient situées entre 0,016 U.I./ml pour le facteur IX et 0,028 U.I./ml pour la protéine C. Le tableau suivant montre la médiane des demi-vies plasmatiques et les IVR incrémentielles.
|
Paramètre
|
Médiane de la demi-vie plasmatique
(plage)/heures
|
IVR incrémentielle
(U.I./ml par U.I./kg de poids corporel)
| |
Moyenne géométrique
|
IC 90%†
| |
Facteur II
|
60 (25–135)
|
0,022
|
(0,020–0,023)
| |
Facteur VII
|
4 (2–9)
|
0,024
|
(0,023–0,026)
| |
Facteur IX
|
17 (10–127)*
|
0,016
|
(0,014–0,018)
| |
Facteur X
|
31 (17–44)
|
0,021
|
(0,020–0,023)
| |
Protéine C
|
47 (9–122)*
|
0,028
|
(0,027–0,030)
| |
Protéine S
|
49 (33–83)*
|
0,020
|
(0,018–0,021)
|
† Intervalle de confiance.
* Demi-vie terminale, modèle à deux compartiments.
Étude relative à l'inversion de l'effet inhibiteur de la coagulation d'antagonistes de la vitamine K lors d'hémorragies sévères:
La valeur moyenne de la récupération in vivo (IVR) a été calculée chez 98 sujets, qui avaient reçu du Beriplex P/N pour le traitement d'hémorragies pendant une thérapie par un antagoniste de la vitamine K. L'IVR incrémentielle se situait entre 0,016 U.I./ml pour le facteur VII et 0,019 U.I./ml pour la protéine C.
Étude relative à l'inversion de l'effet inhibiteur de la coagulation d'antagonistes de la vitamine K lors d'hémorragies importantes ou à la prophylaxie périopératoire d'hémorragies:
La valeur moyenne de la récupération in vivo (IVR) a été calculée chez 43 sujets, qui avaient reçu du Beriplex pour le traitement d'hémorragies ou pour la prophylaxie périopératoire d'hémorragies au cours d'une thérapie par un antagoniste de la vitamine K. L'administration intraveineuse de 1 U.I./kg de Beriplex augmentait le taux plasmatique des facteurs de coagulation dépendants de la vitamine K de 0,013 à 0,023 U.I./ml.
Absorption
Cette préparation est administrée par voie intraveineuse. Elle est immédiatement disponible dans la concentration plasmatique correspondant au dosage.
Distribution
En termes de distribution, Beriplex P/N se comporte dans l'organisme comme les facteurs de coagulation physiologiques II, VII, IX et X.
Métabolisme
Beriplex P/N est dégradé comme les facteurs de coagulation physiologiques II, VII, IX et X.
Élimination
Beriplex P/N est éliminé comme les facteurs de coagulation physiologiques II, VII, IX et X.
Données précliniquesLes composants pharmaceutiques actifs contenus dans Beriplex P/N sont les facteurs du complexe prothrombinique (facteurs II, VII, IX et X). Ils sont produits à partir de plasma humain et se comportent comme les composants plasmatiques endogènes.
Des études de toxicité comprenant une injection d'une dose unique de 200 U.I./kg (dose maximale testée) à des souris du produit prédécesseur, pasteurisé mais toutefois non nanofiltré, a montré une toxicité modérée. Une dose intraveineuse unique d'un maximum de 100 U.I./kg du produit pasteurisé et nanofiltré était tolérée chez les rats. Des études précliniques avec des doses répétées (toxicité chronique, carcinogénicité, toxicité sur la reproduction) ne peuvent pas être réalisées de façon raisonnable dans le modèle animal traditionnel, parce que l'apport de protéines hétérologues humaines conduit au développement d'anticorps.
La tolérance locale après une administration intraveineuse de Beriplex P/N a été démontrée chez le lapin. Chez le lapin également, une étude sur l'apparition de néoantigènes n'a fourni aucun indice sur la formation de neoépitope par le procédé de pasteurisation.
Remarques particulièresIncompatibilités
Beriplex P/N ne peut être mélangé qu'aux médicaments mentionnés sous «Remarques concernant la manipulation».
Influence sur les méthodes de diagnostic
L'héparine contenue dans le complexe prothrombinique doit être prise en considération en cas de réalisation d'analyses de la coagulation sensibles à l'héparine chez les patients ayant reçu de fortes doses de Beriplex P/N.
Stabilité
Beriplex P/N ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques particulières concernant le stockage
Ne pas conserver au-dessus de 25 °C. Ne pas congeler. Conserver le flacon dans l'emballage d'origine fermé pour le protéger de la lumière! Conserver hors de portée des enfants! Les préparations non utilisées ou les déchets à détruire doivent être éliminés selon les exigences locales.
Remarques concernant la manipulation
Indications générales
·La préparation et le prélèvement doivent être réalisés sous conditions aseptiques.
·La solution doit être claire ou légèrement opalescente. Vérifier si le produit reconstitué contient des particules et présente un changement de couleur après la filtration/aspiration de la solution dans la seringue (voir ci-dessous) et avant son utilisation.
·Ne pas utiliser des solutions troubles ou des solutions contenant des résidus (précipitas/particules).
·Faire très attention à ne pas faire passer de sang dans la seringue remplie, car il risquerait de coaguler à l'intérieur de celle-ci et d'entraîner une administration de caillots de fibrine au patient.
·Lorsque plus d'un flacon de Beriplex P/N est nécessaire pour une administration par perfusion unique, on peut rassembler les contenus de plusieurs flacons dans un accessoire de perfusion usuel du commerce.
·En principe, la solution de Beriplex P/N ne peut pas être diluée.
·La solution doit être administrée par une voie d'abord séparée.
Préparation
Amener le solvant à la température ambiante. Avant l'ouverture du dispositif de transfert («Mix2Vial™»), retirer les capuchons protecteurs des flacons puis traiter les bouchons à l'aide d'une solution antiseptique; laisser sécher.
|
|

|
1. Retirer l'opercule du dispositif de transfert «Mix2Vial» de son emballage. Ne pas sortir le dispositif de l'emballage sous blister.
| |
|

|
2. Placer le flacon de solvant sur une surface plane propre et le maintenir fermement. En tenant le dispositif «Mix2Vial» à travers son blister, piquer l'extrémité bleue de l'adaptateur verticalement dans le bouchon du flacon de solvant.
| |
|

|
3. Retirer avec précaution l'emballage du dispositif «Mix2Vial» en saisissant le sceau du blister et en le retirant verticalement vers le haut. Bien s'assurer que seul le blister est retiré, et que le dispositif «Mix2Vial» reste bien en place.
| |
|
|
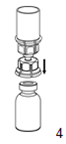
4. Après avoir posé le flacon de poudre sur un plan rigide, retourner l'ensemble flacon-dispositif «Mix2Vial» et de façon analogue piquer l'extrémité transparente verticalement dans le bouchon du flacon de produit. Le solvant est transféré automatiquement dans le flacon de produit.
| |
|

|
5. En maintenant la partie produit reconstitué d'un côté et la partie solvant (vide) de l'autre, séparer prudemment les flacons en dévissant le dispositif «Mix2Vial» dans le sens inverse des aiguilles d'une montre. Eliminer le flacon de solvant avec l'adaptateur bleu «Mix2Vial».
| |
|
|
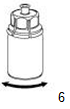
6. Mélanger doucement le flacon de produit avec l'adaptateur transparent jusqu'à ce que le produit soit complètement dissous. Ne pas secouer.
| |
|
|
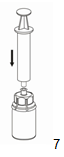
7. Aspirer d'air une seringue stérile, vide. Tout en maintenant le flacon de produit reconstitué verticalement, visser la seringue sur le dispositif «Mix2Vial» avec raccordement Luer Lock en vissant dans le sens des aiguilles d'une montre. Injecter l'air dans le flacon.
| |
Aspiration de la solution dans la seringue et utilisation
| |
|
|
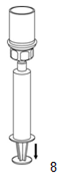
8. Tenir fermement le piston de la seringue. Tourner tout le système et aspirer le produit dans la seringue en retirant lentement le piston.
| |
|
|
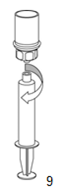
9. Une fois la seringue remplie, tenir fermement le cylindre de la seringue (tenir le piston vers le bas) et dévisser l'adaptateur transparent «Mix2Vial» de la seringue dans le sens inverse des aiguilles d'une montre.
|
Stabilité après ouverture
Après reconstitution, la stabilité physico-chimique est prouvée pendant 24 heures à température ambiante (au maximum +25 °C). Du point de vue microbiologique et parce que Beriplex P/N ne contient aucuns agents conservateurs, il est impératif d'utiliser immédiatement le produit mis en solution.
Numéro d’autorisation00665 (Swissmedic)
PrésentationBeriplex P/N 500 (B):
1 flacon sous vide avec poudre
1 flacon de 20 ml d'eau pour injection
1 filtre de transfusion
Beriplex P/N 1000 (B):
1 flacon sous vide avec poudre
1 flacon de 40 ml d'eau pour injection
1 filtre de transfusion
Titulaire de l’autorisationCSL Behring AG, Bern
Mise à jour de l’informationOctobre 2022
|









