CompositionPrincipes actifs
Metamizolum natricum monohydricum.
Excipients
Comprimés: Carmellosum natricum conexum (E 468), Crospovidonum (E 1202), Cellulosum microcristallinum (E 460), Solani amylum, Magnesii stearas (E 470b).
1 comprimé contient env. 35 mg de sodium.
Solution buvable en gouttes: Natrii dihydrogenoposphas dihydricus (E339), Dinatrii phophas anhydricus (E339), Aqua purificata.
1 ml contient 33.9 mg de sodium.
Solution injectable: Acidum hydrochloridum, Natrii hydroxidum, Aqua ad injectabilia.
1 ml de solution injectable contient 32.8 mg de sodium.
Indications/Possibilités d’emploi·Fortes douleurs pour lesquelles d'autres analgésiques non opioïdes sont inefficaces ou contre-indiqués.
··Forte fièvre ne répondant pas à d'autres mesures médicamenteuses.
Posologie/Mode d’emploiLa posologie et le mode d'emploi dépendent de l'effet analgésique souhaité, ainsi que de l'état du patient. Dans de nombreux cas, une analgésie suffisante pourra être obtenue avec une administration orale. Lors du choix d'un mode d'administration, il faut tenir compte du fait que l'administration parentérale est associée à un risque accru de réactions de type anaphylactique/anaphylactoïde.
1. Administration orale
Adultes
La dose unitaire usuelle est de 500 à 1'000 mg; la dose quotidienne de 1'000 à 3'000 (max. 4'000) mg, fractionnée en 3-4 applications/24 heures, c.-à-d. une dose unitaire de 1-2 comprimés ou de 20-40 gouttes, une dose maximale quotidienne de 4× 2 comprimés ou de 4× 40 gouttes.
Enfants
Les gouttes de Minalgin sont également destinées aux enfants. Chez les nourrissons et les enfants en bas âge, Minalgin ne doit être administré qu'après évaluation critique du bénéfice attendu dans le cas particulier. La dose est fixée selon le poids corporel (1 ml de solution = 20 gouttes) (voir «Contre-indications»).
|
Poids corporel
|
Age (approx.)
|
Dose unitaire
|
Dose quotidienne max.
| |
46–53 kg
|
13–14 ans
|
15–35 gouttes
|
4× 35 gouttes
| |
31–45 kg
|
10–12 ans
|
10-30 gouttes
|
4× 30 gouttes
| |
24–30 kg
|
7–9 ans
|
8–20 gouttes
|
4× 20 gouttes
| |
16–23 kg
|
4–6 ans
|
5–15 gouttes
|
4× 15 gouttes
| |
9–15 kg
|
1–3 ans
|
3–10 gouttes
|
4×10 gouttes
| |
5–8 kg
|
3–11 mois
|
2–5 gouttes
|
4×5 gouttes
|
2. Administration parentérale
L'administration parentérale est réservée aux états douloureux aigus graves, lorsqu'une administration entérale ne peut avoir lieu.
En raison du risque de chute de tension ou de choc, l'injection doit être effectuée lentement (max. 1 ml/min) chez le patient allongé, sous contrôle puis sous surveillance. Les moyens de lutter contre un choc éventuel doivent être disponibles.
N'injecter la solution qu'après l'avoir portée à la température corporelle.
En raison d'une éventuelle incompatibilité, ne pas mélanger Minalgin et d'autres médicaments dans la même seringue. Pour les perfusions i.v., il est possible de diluer Minalgin dans une solution saline isotonique ou du soluté glucosé à 5, 10 ou 20%. Les solutions acides ne sont pas compatibles avec Minalgin. Le pH d'un mélange ne devrait donc pas être inférieur à 6.
Adultes
La dose unitaire usuelle est de 0,5–1 g, soit 1–2 ml à administrer lentement par voie i.m. ou i.v. (max. 500 mg/min). Les doses unitaires plus élevées (max. 2,5 g = 5 ml) requièrent une prudence particulière en raison du risque de chute tensionnelle mentionné plus haut. Les injections peuvent être répétées toutes les 6–8 heures; une dose quotidienne totale de 5 g, soit 10 ml, ne devrait pas être dépassée.
Enfants
Pour les enfants jusqu'à 1 an, seule la voie intramusculaire devrait être utilisée. Le tableau ci-dessous indique les doses unitaires, qui peuvent être administrées toutes les 6–8 heures.
|
Poids corporel
|
Injection
|
Dose unitaire
| |
5–8 kg
|
i.m. uniquement
|
0,1–0,2 ml
| |
9–15 kg
|
i.m. ou i.v.
|
0,2–0,5 ml
| |
16–23 kg
|
i.m. ou i.v.
|
0,3–0,8 ml
| |
24–30 kg
|
i.m. ou i.v.
|
0,4–1,0 ml
| |
31–45 kg
|
i.m. ou i.v.
|
0,5–1,5 ml
| |
46–53 kg
|
i.m. ou i.v.
|
0,8–1,8 ml
|
Insuffisance rénale et hépatique
Lors d'insuffisance rénale ou hépatique, il est recommandé d'éviter des doses élevées de métamizole, son élimination étant réduite dans ces cas. Une réduction posologique n'est toutefois pas requise pour le traitement de courte durée. On ne dispose pas d'expériences avec le traitement prolongé chez les patients souffrant d'insuffisance rénale ou hépatique.
Patients âgés / Etat général précaire
Chez les patients âgés et ceux avec un état général précaire, il faut envisager la possibilité d'une aggravation de la fonction rénale et hépatique.
Contre-indicationsMinalgin ne doit pas être utilisé chez
·les patients avec une hypersensibilité au principe actif ou à l'un des excipients selon la composition;
·les patients avec une allergie aux autres pyrazolones (par ex. phénazone, propyphénazone), aux pyrazolidines (par ex. phénylbutazone), ainsi que, par exemple, des réactions cutanées sévères (SCAR) après la prise de ces substances;
··les patients avec antécédents d'agranulocytose provoquée par le métamizole, d'autres pyrazolones ou pyrazolidines;
·les patients connus pour développer un bronchospasme ou d'autres réactions anaphylactoïdes (par ex. urticaire, rhinite, angioœdème) après la prise d'analgésiques tels que salicylates, paracétamol, diclofénac, ibuprofène, indométacine, naproxène;
·les patients avec une fonction médullaire diminuée ou avec des troubles de l'hématopoïèse;
·les patients avec une porphyrie hépatique;
·les patients avec une carence en glucose-6-phosphate déshydrogénase;
·les nourrissons de moins de 3 mois ou pesant moins de 5 kg.
Minalgin ne doit pas être injecté par voie i.v. aux nourrissons entre 3 et 11 mois.
Minalgin ne doit pas être administré par voie parentérale aux patients hypotoniques ou hémodynamiquement instables.
Grossesse et allaitement: voir la section «Grossesse/Allaitement».
Mises en garde et précautionsEn cas d'insuffisance hépatique ou rénale grave, l'emploi de Minalgin est déconseillé en raison du manque d'expérience dans de telles conditions.
Les principaux effets indésirables attribuables à Minalgin proviennent de réactions d'hypersensibilité.
Agranulocytose
Le traitement par métamizole peut provoquer une agranulocytose qui peut entraîner la mort (voir «Mises en garde et précautions»). Elle peut survenir même si le métamizole a été utilisé auparavant sans complications.
L'agranulocytose provoquée par le métamizole est un effet indésirable idiosyncrasique. Elle n'est pas liée à la dose et peut survenir à tout moment pendant le traitement, même peu après son arrêt.
Les patients doivent être informés d'interrompre le traitement et de consulter immédiatement un médecin en cas d'apparition de symptômes évoquant une agranulocytose (p.ex. fièvre, frissons, maux de gorge et lésions douloureuses des muqueuses, en particulier dans la bouche, le nez et la gorge, ou dans la région génitale ou anale).
En cas de prise de métamizole contre la fièvre, certains symptômes d'une agranulocytose peuvent passer inaperçus. De même, les symptômes peuvent être masqués chez les patients qui suivent un traitement antibiotique.
En cas d'apparition de signes et de symptômes évoquant une agranulocytose, il convient de réaliser immédiatement un hémogramme complet (y compris un hémogramme différentiel) et d'interrompre le traitement jusqu'à l'obtention des résultats. Si l'agranulocytose est confirmée, le traitement ne doit pas être repris (voir «Contre-indications»).
Interaction avec le méthotrexate
La prise simultanée de métamizole et de méthotrexate doit être évitée, car une interaction peut se produire (voir «Interactions»).
Pancytopénie
En cas de pancytopénie, le traitement doit être immédiatement arrêté et un suivi de la formule sanguine complète doit être instauré jusqu'à sa normalisation.
Tous les patients traités doivent être informés qu'une surveillance médicale doit être instaurée immédiatement dès le développement de signes ou de symptômes évoquant l'apparition d'une dyscrasie sanguine tels que malaise général, signes d'infection, fièvre persistante, hématomes, saignements, pâleur.
Choc anaphylactique
Ces réactions se présentent principalement chez les patients sensibles. Pour cette raison, le métamizole doit être prescrit avec prudence aux patients asthmatiques ou présentant des manifestations atopiques (voir «Contre-indications»).
En présence d'un choc anaphylactique, un traitement antiallergique doit être instauré en urgence (position de choc, éventuellement adrénaline s.c. voire i.v., antiasthmatiques, corticostéroïdes, etc.). L'administration de Minalgin doit être suspendue immédiatement et définitivement, ainsi que toute autre administration de pyrazolones/pyrazolidines.
Réactions anaphylactiques/anaphylactoïdes
Lors du choix de la voie d'administration, il faut tenir compte du fait que l'administration parentérale est associée avec un risque plus élevé de réactions anaphylactiques/anaphylactoïdes.
Les patients suivants, en particulier, présentent un risque accru de réactions éventuellement sévères de type anaphylactoïde au métamizole (voir «Contre-indications»):
·patients avec un asthme bronchique, en particulier lors de l'association à une rhino sinusite à polypes;
·patients avec une urticaire chronique;
·patients avec une intolérance à l'alcool;
·patients avec une intolérance aux colorants (par ex. tartrazine) et aux agents conservateurs.
Réactions cutanées sévères
Des effets indésirables cutanés sévères (SCAR), notamment syndrome de Stevens-Johnson (Stevens-Johnson Syndrom, SJS), nécrolyse épidermique toxique (NET) et réactions médicamenteuses avec éosinophilie et symptômes systémiques (DRESS), pouvant mettre en jeu le pronostic vital du patient voire être mortels, ont été observés en association avec un traitement par métamizole.
Les patients doivent être informés des signes et des symptômes et étroitement surveillés pour détecter toute réaction cutanée.
Si des signes ou des symptômes indiquant ces réactions se manifestent, le métamizole doit être immédiatement arrêté et ce traitement ne doit plus jamais être recommencé (voir «Contre-indications»).
Les patients doivent être informés de ces signes et symptômes et suivis de près concernant ces réactions cutanées, ceci tout particulièrement pendant les premières semaines de traitement.
Réactions hypotensives isolées
L'administration de métamizole peut être responsable, dans des cas isolés, de réactions hypotensives (voir «Effets indésirables»). Ces réactions peuvent éventuellement être dose-dépendantes et sont plus susceptibles de survenir suite à une administration parentérale. Pour éviter les réactions hypotensives graves de ce type, il faut:
·administrer l'injection intraveineuse lentement;
·optimiser le statut hémodynamique des patients souffrant d'hypotension préexistante, de déplétion de volume, de déshydratation, de troubles circulatoires ou de début de collapsus cardio-circulatoire;
·être prudent en présence d'états hyperpyrétiques.
Chez ces patients, l'indication d'un traitement par métamizole doit se faire avec une prudence particulière. Une surveillance médicale est nécessaire. Afin de prévenir le risque de réaction hypotensive, des mesures préventives (stabilisation de l'état cardio-vasculaire) peuvent être nécessaires.
Le métamizole ne doit être administré que sous contrôle hémodynamique strict chez les patients où une chute de la pression sanguine doit être impérativement évitée (par ex. lors de maladie coronarienne grave ou de sténoses importantes des vaisseaux sanguins alimentant le SNC).
En cas d'insuffisance rénale ou hépatique, il est recommandé d'éviter d'administrer des doses élevées de métamizole.
L'injection i.v. doit être effectuée très lentement (max. 1 ml/min) pour assurer que l'injection puisse être arrêtée au premier signe de réaction anaphylactique/anaphylactoïde et pour minimiser le risque de réactions hypotensives isolées.
Lésions hépatiques induites par le médicament
Des cas d'hépatite aiguë à prédominance hépatocellulaire ont été signalés chez des patients traités au métamizole, avec un début d'évolution de quelques jours à quelques mois après le début du traitement. Les signes et symptômes comprennent une élévation des enzymes hépatiques sériques avec ou sans jaunisse, souvent dans le contexte d'autres réactions d'hypersensibilité aux médicaments (éruption cutanée, dyscrasie sanguine, fièvre et éosinophilie) ou accompagnés de caractéristiques d'une hépatite auto-immune. La plupart des patients se sont rétablis à l'arrêt du traitement au métamizole; néanmoins, dans des cas isolés, on a signalé une progression vers une insuffisance hépatique aiguë nécessitant une transplantation du foie.
Le mécanisme de la lésion hépatique induite par le métamizole n'est pas clairement élucidé, mais les données indiquent un mécanisme immuno-allergique.
Les patients doivent être informés qu'ils doivent contacter leur médecin en cas de symptômes suggérant une lésion hépatique. Chez ces patients, le métamizole doit être arrêté et la fonction hépatique doit être évaluée.
Le métamizole ne doit pas être réintroduit chez les patients ayant subi un épisode de lésion hépatique au cours d'un traitement au métamizole pour lequel aucune autre cause de lésion hépatique n'a été déterminée.
Minalgin, comprimés contient 35 mg de sodium par comprimé: des doses quotidiennes de 1000 à au maximum 4000 mg de métamizole correspondent à 70-280 mg de sodium, soit 3.5-14% de la quantité maximale recommandée par l'OMS pour l'apport quotidien en sodium alimentaire chez un adulte (2 g).
Minalgin, solution buvable en gouttes contient 33,9 mg de sodium par ml: des doses quotidiennes de 1000 à au maximum 4000 mg de métamizole correspondent à 67,8-271,2 mg de sodium, soit 3,4-13,6 % de la quantité maximale recommandée par l'OMS pour l'apport quotidien en sodium alimentaire chez un adulte (2 g).
Minalgin, solution injectable contient 32.8 mg de sodium par ml: des doses quotidiennes de 500 à au maximum 5000 mg de métamizole correspondent à 32.8-328.2 mg de sodium, soit 1.6-16.4 % de la quantité maximale recommandée par l'OMS pour l'apport quotidien en sodium alimentaire chez un adulte (2 g).
InteractionsMéthotrexate
L'association de métamizole à un traitement de méthotrexate peut augmenter l'hématotoxicité du méthotrexate, en particulier chez les personnes âgées. C'est pourquoi cette association devrait être évitée.
Acide acétylsalicylique (aspirine)
La prise concomitante de métamizole et d'acide acétylsalicylique peut diminuer l'effet antiagrégant plaquettaire de l'acide acétylsalicylique. Par conséquent, cette association doit être prise avec précaution chez les patients traités par l'acide acétylsalicylique à faible dose pour son action cardioprotectrice.
Induction pharmacocinétique des enzymes métabolisantes
Le métamizole peut induire des enzymes métabolisantes, notamment le CYP2B6 et le CYP3A4.
La co-administration de métamizole avec le bupropion, l'éfavirenz, la méthadone, le valproate, la cyclosporine, le tacrolimus ou la sertraline, peut entraîner une réduction des concentrations plasmatiques de ces médicaments avec une diminution potentielle de l'efficacité clinique. Par conséquent, la prudence est de mise lorsque le métamizole est administré en même temps; la réponse clinique et/ou les concentrations de médicament doivent être surveillées de manière appropriée.
Des interférences ont été rapportées, chez les patients utilisant le métamizole, avec des tests en laboratoire basés sur des réactions de Trinder / de type Trinder (par exemple des tests pour mesurer les taux sériques de créatinine, de triglycérides, de HDL cholestérol et d'acide urique).
Grossesse, allaitementGrossesse
Les études de reproduction chez l'animal n'ont pas démontré de risque fœtal, mais on ne dispose pas d'études contrôlées chez la femme enceinte. Minalgin ne doit de ce fait pas être administré à la femme enceinte au cours du premier trimestre. Minalgin ne doit pas être administré au cours du deuxième trimestre, sauf en cas de nécessité absolue.
Bien que le métamizole ne soit qu'un faible inhibiteur de la synthèse des prostaglandines, Minalgin est contre-indiqué au cours du troisième trimestre de la grossesse, dès lors qu'il existe un risque de fermeture prématurée du canal de Botal et que des complications périnatales liées à une aggravation de l'agrégation plaquettaire maternelle et néonatale ne peuvent pas être exclues.
Allaitement
Les métabolites du métamizole passent dans le lait maternel. Pour cette raison, Minalgin ne devrait pas être utilisé en période d'allaitement. Il ne faut pas allaiter jusqu'à 48 heures après l'administration de Minalgin.
Effet sur l’aptitude à la conduite et l’utilisation de machinesCe médicament peut affecter les réactions, l'aptitude à la conduite et l'aptitude à utiliser des outils ou des machines!
Effets indésirablesLes effets indésirables sont rangés par classe de système d'organes de la classification MedDRA et par fréquence selon la convention suivante: «très fréquents» (≥1/10), «fréquents» (≥1/100 à <1/10), «occasionnels» (≥1/1000 à <1/100), «rares» (≥1/10 000 à <1/1000), «très rares» (<1/10 000), «Fréquence inconnue» (ne peut être estimée sur la base des données disponibles).
Affections hématologiques et du système lymphatique
Rares (≥1/10 000 à <1/1000): leucopénie.
Très rares (<1/10 000): agranulocytose (voir «Mises en garde et précautions»), y compris des cas d'issue fatale, thrombocytopénie.
Fréquence inconnue: Anémie aplastique, pancytopénie y compris des cas d'issue fatale.
De très rares thrombocytopénies (diminution du nombre des plaquettes), se traduisant par une tendance accrue aux saignements et/ou par des pétéchies cutanéomuqueuses, peuvent survenir.
L'anémie aplastique, l'agranulocytose ou la pancytopénie y compris fatale, la leucopénie, et la thrombocytopénie sont considérées comme des réactions de nature immunologique. Celles-ci peuvent survenir même si le métamizole a déjà été administré au patient en plusieurs occasions sans problème particulier.
Affections du système immunitaire
Rares (≥1/10 000 à <1/1000): réactions anaphylactoïdes ou anaphylactiques*.
Très rares (<1/10 000): Syndrome asthmatique induit par les analgésiques.
Fréquence inconnue: choc anaphylactique*.
*: Ces réactions peuvent se produire, en particulier après une administration parentérale, peuvent être graves et mettre en danger la vie du patient, voire dans certains cas être fatales. Elles peuvent également se produire lorsque le métamizole a été administré à des occasions précédentes sans complications.
Le métamizole peut causer des chocs anaphylactiques, ainsi que des réactions anaphylactiques/anaphylactoïdes. Ces dernières peuvent être sévères, mettre en danger le pronostic vital, voire causer le décès du patient.
Les réactions anaphylactiques/anaphylactoïdes peuvent survenir tout de suite ou des heures après l'administration. Cependant, elles surviennent principalement au cours de la première heure après l'administration. Elles peuvent également survenir alors que Minalgin a été administré antérieurement sans complications.
Elles comprennent des réactions cutanées et muqueuses (telles qu'un prurit, des brûlures, une rougeur de la peau, une urticaire et des tuméfactions), une dyspnée et plus rarement des troubles gastro-intestinaux, une urticaire généralisée, un angioœdème, un bronchospasme, des troubles du rythme cardiaque, des troubles coronariens («Kounis syndrome»), une chute de la tension artérielle (quelquefois avec une augmentation de la tension artérielle la précédant) et un choc circulatoire.
Chez les patients intolérants aux analgésiques souffrant de syndrome asthmatique, ces réactions se manifestent de manière caractéristique sous forme de crises d'asthme.
Les réactions anaphylactiques/anaphylactoïdes présentent un risque létal.
Par conséquent, Minalgin doit être interrompu immédiatement en cas de réactions cutanées.
Affections cardiaques
Fréquence inconnue: le syndrome de Kounis.
Voir rubrique «Affections du système immunitaire».
Affections vasculaires
Occasionnels (≥1/1000 à <1/100): réactions hypotensives isolées.
Des réactions hypotensives transitoires et isolées avec une chute de pression critique peuvent survenir pendant l'administration (parentérale) ou après celle-ci (parentérale, comprimés, gouttes), sans être associée à d'autres signes en lien avec des réactions anaphylactiques/anaphylactoïdes. Une telle réaction peut évoluer vers une chute sévère de la pression sanguine. Une injection intraveineuse rapide augmente le risque de réaction hypotensive.
L'hyperpyrexie peut également s'accompagner d'une baisse critique de la pression artérielle de manière dose-dépendante et sans autre signe de réaction d'hypersensibilité.
Affections gastro-intestinales
Fréquence inconnue: hémorragies, ulcérations et perforations gastro-intestinales.
Affections hépatobiliaires
Fréquence inconnue: lésions hépatiques induites par le médicament, y compris l'hépatite aiguë, la jaunisse, l'augmentation des enzymes hépatiques (voir rubrique «Mises en garde et précautions»).
Affections de la peau et du tissu sous-cutané
Des cas d'effets indésirables cutanés sévères, notamment syndrome de Stevens-Johnson (SJS), nécrolyse épidermique toxique (NET) et réaction médicamenteuse avec éosinophilie et symptômes systémiques (DRESS) ont été signalés en association avec le traitement par métamizole (voir «Mises en garde et précautions»).
Occasionnels (≥1/1000 à <1/100): exanthème médicamenteux fixe.
Rares (≥1/10 000 à <1/1000): éruption cutanée (par ex., exanthème maculopapulaire).
Très rares (<1/10 000): des allergies graves potentiellement létales peuvent survenir, telles qu'une maladie cutanéomuqueuse bulleuse (syndrome de Stevens-Johnson [SJS] ou nécrolyse épidermique toxique [NET]).
L'administration de Minalgin doit être immédiatement interrompue si des réactions cutanées ou d'hypersensibilité sont constatées (voir «Mises en garde et précautions»).
Fréquence inconnue: réaction médicamenteuse avec éosinophilie et symptômes systémiques (DRESS).
Affections du rein et des voies urinaires
Très rares (<1/10 000): une aggravation aiguë de la fonction rénale (insuffisance rénale aiguë) peut survenir, particulièrement en présence d'une affection rénale préexistante. Dans certains cas, elle peut être accompagnée d'une oligurie, anurie ou protéinurie.
Fréquence inconnue: néphrite interstitielle aiguë.
Troubles généraux et anomalies au site d'administration
En cas d'application parentérale, des douleurs et/ou des réactions locales au site d'injection (y compris une phlébite) peuvent avoir lieu.
Une coloration rouge de l'urine a été signalée, qui peut être due à un métabolite inoffensif du métamizole, l'acide rubazonique, présent en faibles concentrations.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageSignes et symptômes
En cas de surdosage, les manifestations suivantes sont probables: nausées, vomissements, douleurs abdominales, détérioration de la fonction rénale / insuffisance rénale aiguë (par ex. suite d'une néphrite interstitielle) et plus rarement des symptômes nerveux centraux (vertige, somnolence, coma, convulsions) et une chute de la tension artérielle (quelques fois aboutissant à un choc), ainsi que des troubles du rythme cardiaque (tachycardie).
Après des doses élevées, l'élimination d'un métabolite inoffensif (acide rubasonique) peut provoquer une coloration rouge de l'urine.
Traitement
Il n'y a pas d'antidote spécifique connu pour le métamizole. Si l'ingestion vient d'avoir lieu, il convient d'éliminer toute substance non résorbée (lavage gastrique, charbon médicinal). Le métabolite principal (4-N-méthylamino-antipyrine) est éliminable par hémoperfusion, hémodialyse, hémofiltration ou plasmafiltration.
Propriétés/EffetsCode ATC
N02BB02
Mécanisme d'action
Le métamizole est doté d'effets analgésiques, spasmolytiques et antipyrétiques. L'interaction centrale et périphérique de ses principaux métabolites avec des récepteurs nociceptifs exerce un effet analgésique. L'effet spasmolytique repose sur une diminution de l'excitabilité de la musculature lisse périphérique et l'effet antipyrétique découle d'une action sur le récepteur thermique hypothalamique, ainsi que sur la stimulation de l'élimination calorifique.
Pharmacodynamique
Voir rubrique «Mécanisme d'action».
Efficacité clinique
Pas de donnée.
PharmacocinétiqueAbsorption
Le métamizole est en réalité un précurseur qui subit après l'administration orale ou parentérale une hydrolyse en 4-méthylamino-antipyrine. La résorption est rapide et presque complète après une administration orale. Les métabolites sont la 4-formyl-antipyrine et la 4-amino-antipyrine active, qui est par la suite acétylée en 4-acétylamino-antipyrine. Parmi les 8 métabolites connus, ces 4 dérivés du métamizole constituent 65-70% de la dose totale administrée et sont en majeure partie excrétés par voie rénale.
Distribution
Le métamizole n'est pas détectable comme tel dans le plasma ou l'urine. Ses métabolites passent dans le lait maternel et sont détectables jusqu'à 48 heures après son administration. On les détecte également dans la salive. Les données relatives à l'absorption, à la liaison aux protéines plasmatiques et à l'élimination figurent dans le tableau ci-dessous.
|
|
Cmax
mg/l
|
Tmax
h
|
T½
h
|
Liaison aux
protéines
plasmatiques
%
|
Clairance
ml/min
|
Excrétion
urinaire
% de
métamizole
| |
4-méthyl-amino-antipyrine
|
10,5
|
1,4
|
3,3
|
58
|
4,0
|
2,8
| |
4-formyl-amino-antipyrine
|
2,1
|
7,2
|
10,1
|
18
|
39,3
|
12,7
| |
4-amino-antipyrine
| |
AL
|
2,7
|
6,7
|
5,5
|
48
|
30,7
|
6,4
| |
AR
|
1,6
|
3,2
|
3,8
|
48
|
30,7
|
6,4
| |
4-acétyl-amino-antipyrine
| |
AL
|
1,6
|
16,1
|
10,6
|
14
|
36,1
|
22,2
| |
AR
|
4,4
|
10,0
|
10,6
|
14
|
36,1
|
22,2
|
AL: acétyleur lent
AR: acétyleur rapide
Métabolisme
Voir rubriques «Absorption» et «Distribution».
Élimination
Voir rubrique «Distribution».
L'élimination urinaire est plus importante après administration intraveineuse qu'après administration orale. En présence d'une insuffisance rénale (clairance de la créatinine inférieure à 30 ml/min), l'excrétion rénale est diminuée et la demi-vie d'élimination de la 4-méthylamino-antipyrine prolongée.
Données précliniquesLe métamizole présente aussi bien des indices d'effet mutagène que des résultats négatifs. Au cours de plusieurs études à long terme effectuées chez le rat et la souris, on n'a observé aucun indice d'effet cancérogène. Deux des trois études à long terme réalisées chez la souris ont mis en évidence des adénomes hépatiques plus fréquents à des doses élevées. Mais ces résultats sont généralement considérés comme n'ayant pas de valeur pour l'homme.
Des études de toxicité sur la fonction de reproduction chez le rat et le lapin n'ont montré aucun effet tératogène.
Les effets embryonnaires létaux sont apparus à partir de 100 mg/kg. Chez le rat, des doses plus élevées ont été à l'origine de conséquences négatives sur la parturition et d'une mortalité augmentée chez les mères et leur progéniture.
L'examen de la fertilité a montré un taux de gestation légèrement diminué auprès de la génération parentale à une dose au-delà de 250 mg par kg et par jour. La fertilité de la génération F1 n'a pas été touchée.
Remarques particulièresL'élimination d'un métabolite inoffensif, l'acide rubasonique, peut provoquer une coloration rouge des urines jusqu'à l'arrêt du traitement.
Incompatibilités
En raison d'une éventuelle incompatibilité, ne pas mélanger Minalgin et d'autres médicaments dans la même seringue (voir «Posologie/Mode d'emploi»).
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques particulières concernant le stockage
Minalgin doit être conservé à température ambiante (15-25 °C), à l'abri de la lumière et tenu hors de portée des enfants.
Remarques concernant la manipulation
Les informations suivantes sont uniquement destinées au personnel médical:
S'applique uniquement à la solution injectable en ampoule.
Vérifiez l'ampoule. NE PAS UTILISER si elle est cassée ou si vous constatez la présence de particules dans le liquide. Dans tous ces cas, retournez l'emballage complet à la pharmacie.
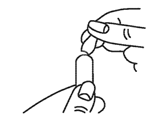
L'anneau blanc sur la partie étroite de l'ampoule marque le point de rupture du col de l'ampoule. L'ampoule peut être ouverte dans n'importe quel sens. Tapotez l'ampoule avec le doigt pour vous assurer qu'il n'y a pas de liquide dans la partie supérieure lorsque vous ouvrez l'ampoule.
|
1.Pour l'ouvrir, tenez l'ampoule en position verticale, voir figure (A).
|
A
|

| |
2.Tenez la partie inférieure de l'ampoule dans une main. Cassez la partie supérieure de l'ampoule au point de rupture en la repoussant avec le pouce de l'autre main, voir figure (B). Une fois l'ampoule ouverte, placez-la à la verticale sur une surface propre et plane.
|
B
|
|
Numéro d’autorisation14746, 14747, 34496 (Swissmedic).
PrésentationComprimés: 20, 50, 100 et 1000 [B].
Solution buvable en gouttes: 20 ml et 100 ml [B].
Ampoules (2 ml): 10 [B].
Titulaire de l’autorisationStreuli Pharma SA, Uznach.
Mise à jour de l’informationMars 2025
|


