CompositionPrincipe actif: facteur VIII de coagulation et facteur de von Willebrand issus de plasma humain.
Excipients: albumine issue de plasma humain, protéines plasmatiques humaines, glycine, chlorure de sodium, citrate de sodium.
Sodium:
Haemate P 250 UI / 600 UI – 0,57 mmol par flacon (environ 2,6 mg/ml)
Haemate P 500 UI / 1200 UI – 1,13 mmol par flacon (environ 2,6 mg/ml)
Haemate P 1000 UI / 2400 UI – 2,25 mmol par flacon (environ 3,5 mg/ml)
Solvant: eau pour préparations injectables.
Indications/Possibilités d’emploiSyndrome de von Willebrand (SvW)
Prévention et traitement des hémorragies ou des hémorragies péri-opératoires, dans le cas où le traitement par la desmopressine (DDAVP) seule n'est pas efficace ou est contre-indiqué.
Hémophilie A (déficience congénitale en facteur VIII de coagulation)
Prophylaxie et thérapie des hémorragies chez les patients atteints d'hémophilie A. Traitement de la déficience acquise en facteur VIII.
Posologie/Mode d’emploiLe traitement du syndrome de von Willebrand et de l'hémophilie A doit être effectué par un médecin ayant de l'expérience dans le domaine du traitement de l'hémophilie.
Afin de garantir la traçabilité des médicaments fabriqués par voie biologique, il est recommandé de documenter le nom commercial et le numéro de lot pour chaque traitement.
Syndrome de von Willebrand
Il est important de calculer la dose en UI en fonction de la proportion de FvW:RCo
En administrant 1 UI de FvW:RCo par kg de poids corporel, on obtient généralement une augmentation du taux plasmatique du FvW:RCo d'environ 0,02 UI/ml (2 %).
Il convient de viser un taux de FvW:RCo >0,6 UI/ml (60%) et un taux de FVIII:C >0,4 UI/ml (40%). Pour obtenir une hémostase, on recommande généralement l'administration de 40 à 80 UI/kg de FvW:RCo et de 20 à 40 UI FVIII:C par kg de poids corporel. Une dose initiale de 80 UI/kg de facteur de von Willebrand peut être nécessaire, en particulier pour le maintien du taux plasmatique adéquat chez les patients souffrant du syndrome de von Willebrand de type 3 qui requiert des doses plus élevées que les autres types du même syndrome.
Prophylaxie des hémorragies en cas d'opérations ou de blessures sévères: pour prévenir les hémorragies abondantes péri- ou post-opératoires, la préparation devra être administrée 1 ou 2 heures avant l'opération.
Une dose adéquate devra être administrée toutes les 12 à 24 heures. La posologie et la durée du traitement dépendent de l'état clinique du patient, de la sévérité et du type d'hémorragie ainsi que des taux de FvW:RCo et de FVIII:C.
En utilisant un produit contenant le FvW, le médecin traitant doit savoir qu'en traitement continu, ce produit peut causer une élévation excessive du taux de FVIII:C. Pour éviter cela, il peut, après un traitement qui dure de 24 à 48 heures, envisager une réduction de la posologie et/ou une prolongation de l'intervalle entre les administrations.
Enfants et adolescents
Chez les enfants et les adolescents, on adaptera la posologie au poids corporel, en suivant les directives généralement appliquées chez l'adulte. Dans chaque cas, la fréquence d'administration sera définie en fonction de l'efficacité clinique.
En cas de déficience en facteur VIII (hémophilie A)
La posologie et la durée du traitement de substitution dépendent de la sévérité du déficit en facteur VIII, de la sévérité et de la localisation de l'hémorragie ainsi que de l'état clinique du patient.
Il est important de calculer la dose en UI en fonction de la proportion de FVIII:C.
La quantité de facteur VIII:C à administrer est exprimée en Unités Internationales (UI), qui correspondent au standard actuel de l'OMS pour les concentrés de facteur VIII. L'activité en facteur VIII dans le plasma est exprimée soit en pourcentage (par rapport au plasma humain normal), soit en UI (par rapport au standard international du facteur VIII plasmatique).
1 UI d'activité de facteur VIII correspond à la quantité de facteur VIII contenue dans 1 ml de plasma humain normal.
Traitement sur demande
Le calcul de la dose nécessaire de facteur VIII se base sur le résultat empirique, selon lequel 1 UI de facteur VIII par kg de poids corporel augmente l'activité plasmatique du facteur VIII d'environ 2 % (2 UI/dl) par rapport à l'activité normale. La dose nécessaire est déterminée selon la formule suivante:
Unités nécessaires = poids corporel (kg) × augmentation souhaitée du taux de facteur VIII (% ou UI/dl) × 0,5.
Dans chaque cas, on ajustera la posologie et la fréquence d'administration en fonction de l'efficacité clinique. Dans les situations suivantes d'hémorragie, l'activité du facteur VIII (en % par rapport à la norme) ne devrait pas diminuer en-dessous des valeurs indiquées durant la période correspondante. Le tableau ci-dessous peut servir de guide dans la détermination des posologies lors d'hémorragies et d'interventions chirurgicales:
|
Importance de l'hémorragie/type d'intervention chirurgicale
|
Taux nécessaire de facteur VIII (% ou UI/dl)
|
Fréquence d'administration (heures)/durée du traitement (jours)
| |
Hémorragies
| |
Hémarthroses précoces, hémorragies musculaires ou hémorragies dans la cavité buccale
|
20-40
|
Répéter les injections toutes les 12 à 24 heures pendant au moins 1 jour, jusqu'à la fin de l'hémorragie (indiquée par la disparition de la douleur) ou jusqu'à la cicatrisation
| |
Hémarthroses plus étendues, hémorragies musculaires ou hématomes
|
30-60
|
Répéter les injections toutes les 12 à 24 heures pendant 3 - 4 jours, ou plus longtemps jusqu'à la disparition de la douleur et des restrictions de mouvements aiguës
| |
Hémorragies sévères engageant le pronostic vital
|
60-100
|
Répéter les injections toutes les 8 à 24 heures jusqu'à ce que le patient soit hors de danger
| |
Interventions chirurgicales
| |
Interventions mineures; extraction dentaire incluse
|
30-60
|
Toutes les 24 heures pendant au moins 1 jour, jusqu'à la cicatrisation
| |
Interventions majeures
|
80-100
(péri- et postopératoire)
|
Répéter les injections toutes les 8 - 24 heures jusqu'à la fin adéquate du traitement, puis poursuivre le traitement pendant au moins 7 jours pour maintenir l'activité du facteur VIII entre 30 et 60% (UI/dl)
|
Prophylaxie
Pour la prophylaxie à long terme des hémorragies chez les patients atteints d'hémophilie A grave, les posologies habituelles sont de 20 à 40 UI de facteur VIII:C par kg de poids corporel, à administrer à des intervalles de 2 à 3 jours. Des intervalles plus rapprochés ou des doses plus importantes peuvent être nécessaires dans certains cas, en particulier chez les jeunes patients.
Pour évaluer la dose à administrer et la fréquence d'injection, il est conseillé d'effectuer à une fréquence appropriée au cours du traitement une détermination du taux de facteur VIII plasmatique. Un contrôle précis du traitement substitutif par une mesure de l'activité du facteur VIII plasmatique est indispensable particulièrement en cas d'intervention chirurgicale majeure.
La réponse des patients au facteur VIII peut varier, entraînant de ce fait différents taux de récupération in vivo et différentes demi-vies.
L'apparition d'anticorps inhibiteurs dirigés contre le facteur VIII doit être étroitement surveillée.
Patients non traités antérieurement
La sécurité et l'efficacité d'Haemate P n'ont pas été étudiées chez les patients n'ayant jamais été traités auparavant.
Enfants et adolescents
A ce jour, aucune étude clinique n'a été menée sur la posologie d'Haemate P chez l'enfant atteint d'hémophilie A.
Mode et durée d'administration
La mise en solution d'Haemate P sera effectuée comme décrit dans la rubrique «Remarques particulières, remarques concernant la manipulation» et doit être administrée par voie intraveineuse. Le produit doit être appliqué immédiatement après transfert dans une seringue.
La vitesse maximale d'injection ne doit pas dépasser 4 ml/min.
Une surveillance étroite du patient est nécessaire en raison de possibles réactions immédiates. En cas de réaction pouvant être liée à l'administration d'Haemate P, diminuer la vitesse ou, suivant l'état clinique du patient, interrompre l'injection (voir également la rubrique «Mises en garde et précautions»).
Contre-indicationsHypersensibilité au principe actif ou à l'un des excipients de la préparation suivant la composition.
Mises en garde et précautionsHypersensibilité
Des réactions d'hypersensibilité sont possibles. Pour déceler la survenue d'éventuels symptômes, garder les patients sous stricte surveillance pendant toute la durée de l'injection. Les patients doivent être informés de la nécessité d'interrompre l'utilisation du produit et de consulter leur médecin en cas de survenue de symptômes. Les patients doivent être informés des signes précoces de réactions d'hypersensibilité comme par exemple: exanthème papuleux, urticaire généralisé, oppression thoracique, stridor, hypotension et anaphylaxie. En cas de choc, suivre les directives médicales actuelles pour le traitement d'un choc.
Teneur en sodium
Haemate P contient jusqu'à 52,5 mg de sodium par 1000 UI FVIII / 2400 UI de FvW, ce qui correspond à 2,63% de la consommation journalière maximum de 2 g de sel avec les aliments recommandée par l'OMS pour une personne adulte. A prendre en considération pour les patients qui doivent suivre un régime pauvre en sel.
Syndrome de von Willebrand
On ne peut exclure l'apparition d'événements thromboemboliques, y compris des embolies pulmonaires, surtout chez les patients à risque (par ex. opérations sans prophylaxie thrombotique, manque de mobilisation précoce, surpoids, surdosage, cancer). Surveiller chez ces patients les signes avant-coureurs et appliquer une prophylaxie des thromboembolies veineuses en suivant les recommandations actuelles.
Le médecin traitant doit savoir que l'utilisation d'un produit à base de FvW en traitement continu peut causer une élévation excessive du taux plasmatique de FVIII:C. Chez les patients recevant des produits à bse de FvW contenant du FVIII, le taux de FVIII:C doit être contrôlé pour éviter un taux excessivement élevé à long terme pouvant augmenter le risque d'événements thrombotiques.
Des mesures antithrombotiques doivent être envisagées.
Des patients souffrant de SvW, en particulier ceux du type 3, peuvent développer des anticorps neutralisants (inhibiteurs) contre le FvW. Si les taux plasmatiques d'activités de FvW:RCo prévus ne sont pas atteints, ou si l'hémorragie ne peut pas être contrôlée après l'administration d'une dose appropriée, il faut effectuer un test approprié pour déceler la présence de tels inhibiteurs. Chez les patients qui présentent un taux élevé d'inhibiteurs, il se peut que le traitement ne soit pas efficace et qu'il faille envisager d'autres mesures thérapeutiques.
Hémophilie A
Inhibiteurs:
La formation d'anticorps neutralisants (inhibiteurs) dirigés contre le facteur VIII est une complication connue dans le traitement de l'hémophilie A. Ces inhibiteurs sont généralement des immunoglobulines G dirigées contre l'activité procoagulante du facteur VIII. Elles sont mesurées en unités Bethesda par ml de plasma par le test de Bethesda modifié. Le risque de développer des inhibiteurs est corrélé à la durée d'exposition au facteur VIII anti-hémophile – le risque le plus élevé étant au cours des 20 premiers jours d'exposition. Les inhibiteurs apparaissent rarement après les 100 premiers jours d'exposition.
Des cas d'apparition récurrentes d'inhibiteurs (avec un titre bas d'inhibiteur) ont été observés après avoir substitué une préparation de FVIII par une autre, chez des patients qui avaient été traités pendant plus de 100 jours auparavant et ayant un antécédent de développement d'inhibiteurs. C'est pourquoi il est recommandé de surveiller avec soin l'apparition éventuelle d'inhibiteurs chez chaque patient après chaque changement de produit.
Au vu de ce qui précède, les patients traités avec des facteurs de coagulation VIII humains doivent être suivis de près et soumis à des observations cliniques et à des tests biologiques appropriés visant à détecter les inhibiteurs. Pour déceler la présence de tels inhibiteurs, un test doit être effectué si le taux d'activité de facteur VIII plasmatique souhaité n'est pas atteint, ou si les hémorragies ne sont pas contrôlées après l'administration d'une dose appropriée. Chez les patients présentant des valeurs élevées en inhibiteurs, il se peut que le traitement par le facteur VIII ne soit pas efficace et qu'il faille envisager d'autres options thérapeutiques. La prise en charge de tels patients doit être effectuée par des médecins ayant de l'expérience dans le traitement de l'hémophilie.
Voir également la rubrique «Effets indésirables».
Sécurité virale
Haemate P est produit à partir de plasma humain. Les mesures habituelles de prévention du risque de transmission d'agents infectieux par les médicaments préparés à partir de sang ou de plasma humain comprennent la sélection clinique des donneurs, la recherche des marqueurs spécifiques d'infection sur chaque don et sur les pools de plasma, et l'inclusion dans le procédé de fabrication d'étapes efficaces pour l'inactivation/l'élimination virale. Cependant, lorsque des médicaments préparés à partir de sang ou de plasma humain sont administrés, le risque de transmission d'agents infectieux ne peut pas être totalement exclu. Ceci s'applique également aux virus inconnus ou émergents ou à d'autres types d'agents infectieux.
Les mesures mises en place sont considérées comme efficaces vis-à-vis des virus enveloppés tels que par ex. le virus de l'immunodéficience humaine (VIH), le virus de l'hépatite B (VHB) et le virus de l'hépatite C (VHC) et les virus non-enveloppés tels que le virus de l'hépatite A (VHA). Elles peuvent être d'une efficacité limitée vis-à-vis des autres virus non-enveloppés tel que par ex. le parvovirus B19.
Il est impératif de recommander la vaccination contre l'hépatite A et l'hépatite B aux patients qui reçoivent régulièrement des préparations de FVIII/FvW issues de produits sanguins ou plasmatiques d'origine humaine.
InteractionsAucune étude concernant des interactions avec Haemate P n'a été effectuée jusqu'à ce jour.
Grossesse, allaitementA ce jour, aucune étude sur la reproduction chez l'animal n'a été effectuée avec Haemate P.
Syndrome de von Willebrand
Les femmes qui souffrent du syndrome de von Willebrand développeront plus souvent que les hommes des complications hémorragiques, à cause de leurs prédispositions naturelles aux hémorragies telles que les menstruations, les grossesses, les contractions, les accouchements et les problèmes gynécologiques. D'après l'expérience généralement acquise, la substitution du FvW peut être recommandée comme prévention ou traitement des hémorragies aiguës. Par contre, aucune étude clinique n'a été menée quant à la thérapie de substitution du FvW pendant la grossesse et l'allaitement.
Hémophilie A
Aucune expérience n'est disponible quant à l'administration du facteur VIII pendant la grossesse et l'allaitement, car les cas d'hémophilie A sont rares chez la femme.
Au vu de ce qui précède, les préparations de FvW et de facteur VIII ne peuvent être administrées pendant la grossesse ou l'allaitement qu'en cas d'indications explicites.
Lors du traitement, il faut considérer que des hémorragies postopératoires et du post-partum peuvent se développer 10 à 12 jours après l'opération ou l'accouchement.
Effet sur l’aptitude à la conduite et l’utilisation de machinesAucune restriction sur l'aptitude à la conduite ou à l'utilisation de machines n'est connue à ce jour.
Effets indésirablesLes informations suivantes sur les réactions d'intolérance sont basées sur l'expérience tirée des annonces spontanées.
Lors du traitement par Haemate P chez les adultes et adolescents, les effets indésirables suivants peuvent apparaître: hypersensibilité ou réactions allergiques, événements thromboemboliques et fièvre. De plus, les patients peuvent développer des inhibiteurs envers le FVIII et le FvW.
Liste des effets indésirables
Les effets indésirables sont rangés par classe de système d'organes de la classification MedDRA et par fréquence selon la convention suivante:
Très fréquents: (≥1/10)
Fréquents: (≥1/100 et <1/10)
Occasionnels: (≥1/1000 et <1/100)
Rares: (≥1/10 '000 et <1/1000)
Très rares: (<1/10 '000).
Affections hématologiques et du système lymphatique:
Cas isolés: hypervolémie, hémolyse
Très rares: inhibiteurs du FvW et du FVIII
Troubles généraux et anomalies au site d'administration
Très rare: fièvre
Affections du système immunitaire:
Très rare: réactions d'hypersensibilité (réactions allergiques)
Affections vasculaires:
Très rares: thromboses, thromboembolies
Description des effets indésirables
Affections hématologiques et du système lymphatique
En cas de besoin de doses très élevées et fréquentes, en présence d'inhibiteurs ou lors d'un traitement pré- ou postopératoire, il faut étroitement surveiller si le patient présente des signes d'hypervolémie. Si le groupe sanguin de ces patients est de type A, B ou AB, il faut contrôler en plus tous signes d'hémolyse intravasculaire et/ou si le taux de l'hématocrite baisse.
Affections du système immunitaire
Des réactions d'hypersensibilité ou des réactions allergiques (telles qu'angioœdème, sensations de brûlure et de picotements au site d'injection, frissons, rougeurs de la peau avec bouffées de chaleur, urticaire généralisée, maux de tête, éruptions cutanées, hypotension, léthargie, nausées, agitation, tachycardie, sensation d'oppression dans la poitrine, tremblements, vomissements et stridor) ont été observées occasionnellement et peuvent dans certains cas évoluer vers une anaphylaxie sévère (y compris un choc).
Syndrome de von Willebrand (SvW)
Affections hématologiques et du système lymphatique
Les patients atteints par le SvW, en particulier ceux du type 3, développent très rarement des anticorps neutralisants (inhibiteurs) contre le FvW. Lorsque ce cas se présente, la réaction se manifeste sous forme de réponse clinique insuffisante. Comme il s'agit d'anticorps précipitants, ils peuvent apparaître simultanément avec des réactions anaphylactiques. C'est la raison pour laquelle les patients présentant une réaction anaphylactique doivent être testés pour déceler la présence d'inhibiteurs. En pareils cas, il est recommandé de s'adresser à un centre d'hémophilie spécialisé.
Affections vasculaires
Des thromboses et/ou des thromboembolies (y compris des embolies pulmonaires) peuvent survenir très rarement. Ce phénomène doit être particulièrement pris en compte chez les patients présentant des facteurs de risque avérés (tels que par ex. intervention chirurgicale sans prophylaxie de thromboses, mobilisation précoce manquante, surpoids).
Une élévation excessive et persistante du taux plasmatique de FVIII:C peut augmenter le risque d'évènements thrombotiques chez les patients qui reçoivent des préparations de FvW (voir aussi la rubrique «Mises en garde et précautions»).
Hémophilie A
Affections hématologiques et du système lymphatique
Les patients atteints d'hémophilie A peuvent développer très rarement des anticorps neutralisants (inhibiteurs) contre le FVIII. Lorsque ce cas se présente, la réaction se manifeste sous forme de réponse clinique insuffisante. En pareils cas, il est recommandé de s'adresser à un centre d'hémophilie spécialisé.
Des informations sur la sécurité virale sont présentées dans la rubrique «Mises en garde et précautions».
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Population pédiatrique
On considère que la fréquence, la nature et la sévérité des effets indésirables chez les enfants correspondent à ceux des adultes.
SurdosageAucun symptôme dû à un surdosage de FvW et de FVIII n'est connu à ce jour.Mais le risque de thrombose ne peut cependant pas être exclu en cas de dosage extrêmement important, surtout avec des préparations de FvW contenant une grande quantité de facteur VIII.
Propriétés/EffetsCode ATC
B02BD06
Classe pharmaco-thérapeutique: antihémorragiques, facteurs de coagulation, complexe facteur VIII de coagulation et facteur de von Willebrand.
Haemate P est produit à partir de pools de plasma humain provenant de donneurs sains. L'information sur le dépistage des dons et des pools de plasma se trouve dans la rubrique «Mises en garde et précautions».
Le procédé de fabrication d'Haemate P comporte plusieurs étapes contribuant à l'élimination/l'inactivation des virus. On compte parmi celles-ci: une étape de précipitation, une étape d'adsorption ainsi qu'un traitement thermique de la préparation en solution aqueuse pendant 10 heures à 60 °C.
Haemate P est un antihémorragique spécifique administré par voie intraveineuse en cas de déficience congénitale ou acquise en facteur VIII de coagulation. L'expérience actuelle concernant l'utilisation lors de la déficience acquise en facteur VIII de coagulation est limitée. L'effet peut être compromis lorsque le sang du patient contient des inhibiteurs du facteur VIII (cf. «Indications/Possibilités d'emploi»).
Mécanisme d'action/Pharmacodynamique
Facteur de von Willebrand
Haemate P se comporte comme le FvW plasmatique endogène. Le facteur de von Willebrand, parallèlement à sa fonction de protéine stabilisant le facteur VIII, permet l'adhésion des thrombocytes sur l'endothélium vasculaire lésé et joue le rôle principal dans l'agrégation plaquettaire.
Chez les patients déficients en FvW, l'administration du FvW corrige les troubles de la coagulation sanguine en 2 étapes:
·Le FvW permet l'adhésion des thrombocytes sur le subendothélium vasculaire endommagé (il se lie au tissu de l'endothélium vasculaire ainsi qu'à la membrane des thrombocytes); il induit ainsi la coagulation primaire, que l'on reconnaît à la diminution du temps de saignement. L'effet est immédiat et dépend en premier lieu de la forte proportion de multimères FvW de haut poids moléculaire
·Le FvW corrige le déficit associé en FVIII de manière retardée. Après l'administration intraveineuse, le FvW se lie au facteur VIII endogène (qui est formé physiologiquement par le patient lui-même) et le stabilise, empêchant ainsi sa dégradation.
C'est pourquoi l'administration de FvW pur (préparation de FvW contenant peu de FVIII), rétablit, comme effet secondaire après la première perfusion, le taux normal du FVIII de manière retardée. L'administration de préparations de FvW contenant du FVIII augmente le taux du FVIII:C au niveau normal immédiatement après la première perfusion.
Facteur VIII
Haemate P se comporte exactement comme le complexe facteur VIII/facteur von Willebrand plasmatique endogène.
Le complexe facteur VIII/facteur von Willebrand se compose de deux protéines (FVIII et FvW) qui ont des effets physiologiques différents. Lors du traitement des patients hémophiles, le FVIII se lie au FvW dans la circulation sanguine.
Le facteur VIII activé agit comme cofacteur du facteur IX activé et accélère ainsi la transformation du facteur X en un facteur X activé. Le facteur X activé transforme la prothrombine en thrombine, laquelle transforme le fibrinogène en fibrine, et un caillot peut se former. L'hémophilie A est une affectation héréditaire de la coagulation sanguine liée au sexe, qui repose sur un déficit en facteur VIII. Ce déficit est la cause d'hémorragies sévères spontanées, accidentelles ou même chirurgicales qui peuvent survenir au niveau des articulations, des muscles ou des organes internes. Un traitement de substitution fera augmenter le taux plasmatique en facteur VIII, et permettra ainsi de corriger temporairement le déficit en facteur VIII et d'infléchir les tendances aux hémorragies.
PharmacocinétiqueFacteur de von Willebrand
La pharmacocinétique d'Haemate P a été étudiée auprès de 28 patients atteints du syndrome de von Willebrand (Type 1 n=10; Type 2A n=10; Type 2M n=1; Type 3 n=7) en phase non hémorragique.
·La demi-vie médiane terminale du FvW:RCo (modèle à 2 compartiments) s'élevait à 9,9 heures (intervalle 2,8-51,1 heures) et la demi-vie médiane initiale est de 1,47 heure (intervalle 0,28-13,86 heures). Le taux de récupération (recovery) in-vivo médian de l'activité FvW:RCo s'élevait à 1,9 (UI/dl)/(UI/kg de poids corporel) [intervalle 0,6-4,5 (UI/dl)/(UI/kg)].
·L'ASC médiane s'élevait à 1664 UI/dl*h (intervalle 142 - 3846 UI/dl*h)
·Le MRT médian était de 13,7 heures (intervalle 3,0-44,6 heures)
·La clairance médiane était de 4,81 ml/kg/h (intervalle 2,08-53,0 ml/kg/h). Les plus hauts taux plasmatiques de FvW peuvent être mesurés approximativement 50 minutes après l'injection. Les plus hauts taux de FVIII apparaissent entre 1 et 1,5 heure après l'injection.
Facteur VIII
Après une administration intraveineuse, l'activité du facteur VIII (FVIII:C) augmente rapidement. Elle est suivie d'une phase de diminution rapide dans un premier temps, et plus lente par la suite. Des études menées auprès de patients atteints d'hémophilie A ont montré que
·La demi-vie médiane s'élevait à 12,6 heures (intervalle 5,0-27,7 heures).
·Le taux de récupération (recovery) général médian in-vivo du FVIII s'élevait à 1,73 UI/dl par UI/kg (intervalle 0,5-4,13).
Lors d'une étude,
·Le MRT (temps principal de résidence) médian s'élevait à 19 heures (intervalle 14,8-40,0 heures),
·L'ASC médiane a été de 36,1 (%*heures)/(UI/*kg) (intervalle 14,8-72,4 (%*heures)/(UI/*kg)
·et la clairance médiane de 2,8 ml/kg/h (intervalle 1,4-6,7 ml/kg/h).
Absorption
Non pertinent (administration i.v.)
Distribution
Sans objet
Métabolisme
Sans objet
Élimination
Sans objet
Enfants et adolescents
Aucune donnée pharmacocinétique n'est connue chez les enfants de moins de 12 ans.
Données précliniquesLe facteur de coagulation VIII et le FvW, qui sont les principes actifs d'Haemate P, sont extraits du plasma humain et se comportent comme les composants physiologiques du plasma. Aucune toxicité n'a été démontrée lors d'administration unique d'Haemate P à diverses espèces animales. Des études précliniques avec des administrations répétées (toxicité chronique, effet carcinogène, effet toxique sur la reproduction) ne peuvent pas être utilement réalisées chez les modèles animaux traditionnels, car l'apport de protéines hétérologues (humaines) conduit au développement d'anticorps.
Remarques particulièresIncompatibilités
A l'exception du solvant mentionné dans la rubrique «Composition», Haemate P ne doit pas être mélangé à d'autres médicaments, solvants ou diluants.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage et le récipient. Pour des raisons microbiologiques, et comme Haemate P ne contient aucun agent conservateur, la solution ne doit pas être conservée plus de 3 heures à température ambiante (max. 25 °C). La stabilité physico-chimique a été démontrée pendant 3 heures. Le produit doit être appliqué sans délai après aspiration de la solution dans une seringue. Ne pas placer au réfrigérateur après reconstitution.
Remarques particulières concernant le stockage
Conserver à une température maximale de 25 °C à l'abri de la lumière. Ne pas congeler.
Conserver les médicaments avec soin et les tenir hors de la portée des enfants!
Remarques concernant la manipulation
Le prélèvement et la préparation doivent se faire sous conditions aseptiques.
La solution doit être claire et légèrement opalescente. Après la filtration/l'aspiration de la solution dans la seringue (voir ci-dessous), s'assurer visuellement avant l'usage que le produit reconstitué ne contient pas de particules et de colorations. Le set de transfert fourni comprend un filtre, qui pourrait retenir des particules ou flocons éventuellement présents. La posologie calculée n'est pas influencée par la filtration. Ne pas utiliser les solutions clairement troubles ou les solutions contenant des particules ou un précipité après filtration.
Préparation
Amener le solvant à la température ambiante. Avant l'ouverture du dispositif de transfert («Mix2Vial™»), retirer les capuchons protecteurs des flacons de solvant et de produit puis nettoyer les bouchons à l'aide d'une solution antiseptique puis laisser sécher.
|
|
|
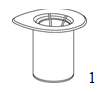
1. Retirer l'opercule en papier du dispositif de transfert «Mix2Vial». Ne pas retirer le «Mix2Vial» de l'emballage!
| |
|
|
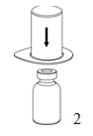
2. Poser et tenir le flacon de solvant sur une surface plane.
Prendre le dispositif «Mix2Vial» par le blister et piquer l'aiguille de l'adaptateur bleu verticalement dans le bouchon du flacon de solvant.
| |
|

|
3. Retirer prudemment le dispositif en tenant le blister par le bord scellé et en le tirant verticalement vers le haut. Ce faisant, il est important que seul le blister soit retiré et non le dispositif «Mix2Vial».
| |
|

|
4. Poser le flacon du produit sur une surface dure. Tourner le flacon de solvant avec le dispositif «Mix2Vial» dessus et percer le bouchon du flacon du produit verticalement avec l'aiguille de l'adaptateur transparent. Le solvant est transféré automatiquement dans le flacon du produit
| |
|
|
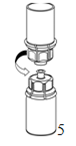
5. En maintenant la partie produit reconstitué d'une main et la partie solvant (vide) de l'autre, séparer les flacons en dévissant prudemment le dispositif Mix2Vial pour éviter une formation de mousse excessive lors de la dissolution du produit. Éliminer le flacon du solvant avec l'adaptateur «Mix2Vial» bleu.
| |
|
|
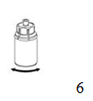
6. Agiter doucement le flacon du produit muni de l'adaptateur transparent pour dissoudre totalement le produit. Ne pas secouer le flacon.
| |
|
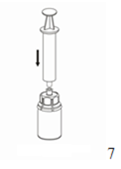
|
7. Remplir d'air une seringue stérile vide. Tout en maintenant le flacon du produit reconstitué verticalement, visser la seringue avec le raccord Luer Lock sur le dispositif «Mix2Vial». Injecter l'air dans le flacon.
|
Aspiration de la solution dans la seringue et utilisation
|
|
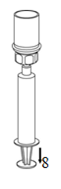
|
8. Maintenir le piston de la seringue appuyé et retourner l'ensemble. Prélever ensuite le contenu du flacon en tirant doucement sur le piston.
| |
|
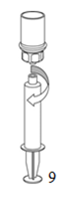
|
9. Une fois la solution complètement aspirée dans la seringue, tenir fermement son cylindre (en maintenant le piston dans sa position) et dévisser le dispositif transparent «Mix2Vial».
|
Numéro d’autorisation45780 (Swissmedic)
PrésentationHaemate P 250 UI / 600 UI (B) (actuellement indisponible dans le commerce)
1 flacon de lyophilisat sous vide de 250 UI de facteur VIII et 600 UI de facteur de von Willebrand + 1 flacon avec 5 ml d'aqua ad iniect.; 1 set pour la dissolution et l'injection.
Haemate P 500 UI / 1200 UI (B)
1 flacon de lyophilisat sous vide de 500 UI de facteur VIII et 1200 UI de facteur de von Willebrand + 1 flacon avec 10 ml d'aqua ad iniect.; 1 set pour la dissolution et l'injection.
Haemate P 1000 UI / 2400 UI (B)
1 flacon de lyophilisat sous vide de 1000 UI de facteur VIII et 2400 UI de facteur de von Willebrand + 1 flacon avec 15 ml d'aqua ad iniect.; 1 set pour la dissolution et pour l'injection.
Contenant chacun:
1 dispositif de transfert 20/20
1 set d'administration (carton intérieur):
1 nécessaire de ponction veineuse, 2 tampons imbibés d'alcool,
1 pansement non stérile, 1 seringue à usage unique
Titulaire de l’autorisationCSL Behring AG, Berne
Mise à jour de l’informationFévrier 2024
|









