CompositionPrincipes actifs
Propofolum (2,6-Diisopropylphénol)
Excipients
Sojae oleum 100 mg/ml, Phosphatidum ovi depuratum, Glycerolum, Dinatrii edetas, Natrii hydroxidum, Aqua ad iniectabile.
1 ml d’émulsion (Disoprivan/Disoprivan PFS 10 mg/ml, 20 mg/ml) contient au maximum 0,086 mg de sodium.
Indications/Possibilités d’emploiInduction et maintien d’une anesthésie générale chez les adultes et les enfants dès 6 mois.
Sédation de courte durée lors de procédures chirurgicales et diagnostiques chez les adultes et les enfants dès 1 mois.
Sédation des adultes ventilés en soins intensifs. L’emploi de Disoprivan pour la sédation des enfants de moins de 16 ans en soins intensifs est contre-indiqué.
Posologie/Mode d’emploiRecommandations d’emploi
L’administration d’analgésiques en complément à Disoprivan est en général nécessaire.
S’il existe un risque spécifique de syndrome de surcharge lipidique (fat overload syndrome), il est recommandé de surveiller la lipémie et d’adapter l’administration de Disoprivan aux résultats d’analyse.
Si le patient reçoit concomitamment d’autres lipides par voie intraveineuse, la quantité de ces lipides devra être réduite afin de prendre en compte la quantité apportée par l’émulsion Disoprivan. 1,0 ml de Disoprivan 10 mg/ml et 20 mg/ml contient environ 0,1 g de lipides.
Disoprivan 20 mg/ml ne doit jamais être injecté en bolus; seul l’emploi en perfusion est autorisé (voir «Mises en garde et précautions»).
Recommandations posologiques
Utilisation chez l’adulte
Induction d’une anesthésie générale chez l’adulte
Chez les patients prémédiqués ou non, il est recommandé de titrer Disoprivan en fonction de la réponse du patient jusqu’à l’obtention des signes cliniques de l’anesthésie (injecter en bolus ou perfuser env. 40 mg/10 s chez les adultes en bonne santé et de constitution moyenne). Les adultes de moins de 55 ans requièrent généralement 1,5 à 2,5 mg/kg de propofol.
On peut réduire la dose totale nécessaire en diminuant la vitesse d’administration (20-50 mg/min).
Disoprivan 10 mg/ml: pour l’induction de l’anesthésie, Disoprivan 10 mg/ml peut être administré en injection lente ou en perfusion. Afin d’atténuer la douleur à l’injection, Disoprivan 10 mg/ml peut être mélangé avec de la lidocaïne.
Disoprivan 20 mg/ml: Disoprivan 20 mg/ml doit être exclusivement utilisé en perfusion et seulement chez les patients dont l’anesthésie sera ensuite maintenue avec Disoprivan 20 mg/ml.
Maintien d’une anesthésie générale chez l’adulte
L’anesthésie peut être maintenue soit par perfusion (Disoprivan 10 mg/ml et 20 mg/ml), soit par des injections répétées en bolus (Disoprivan 10 mg/ml).
Perfusion: Disoprivan 10 mg/ml et 20 mg/ml peuvent être utilisés. La vitesse d’administration requise varie d’un patient à l’autre. Un débit de 4 à 12 mg/kg/h devrait permettre d’obtenir une profondeur d’anesthésie suffisante. Une vitesse de perfusion un peu plus élevée peut être nécessaire durant les 10-20 premières minutes.
Injections répétées en bolus:
À titre d’alternative, on peut administrer des injections répétées en bolus de Disoprivan 10 mg/ml. En fonction de la réponse du patient, on recommande des doses unitaires de 25 à 50 mg (2,5 à 5 ml).
Sédation de courte durée chez l’adulte lors de procédures chirurgicales et diagnostiques
La posologie est choisie en fonction de la profondeur de sédation souhaitée et de la réponse clinique.
La dose administrée pour induire la sédation chez l’adulte est généralement de 0,5 à 1,0 mg de propofol/kg PC en 1 à 5 minutes.
Le maintien de la sédation est obtenu par ajustement de la posologie en fonction de la profondeur de sédation souhaitée. La dose se situe en général entre 1,5 et 4,5 mg de propofol/kg PC/h chez l’adulte.
S’il est nécessaire d’augmenter rapidement la profondeur de la sédation, un bolus de 10 à 20 mg de propofol peut être administré en plus de la perfusion de Disoprivan 10 mg/ml.
Il est possible que, chez les patients ASA grades 3 et 4, une réduction de la dose et de la vitesse de perfusion soient nécessaires. De même, une posologie plus basse peut s’avérer nécessaire chez les patients de plus de 55 ans.
Sédation chez l’adulte ventilé en soins intensifs
Pour la sédation des adultes ventilés en soins intensifs, il est conseillé d’administrer une perfusion continue. La profondeur de la sédation doit être contrôlée régulièrement. Le débit de la perfusion doit être ajusté à la dose minimale nécessaire au maintien d’une sédation suffisante. Des doses de 0,3 à 4,0 mg/kg/h devraient permettre d’obtenir une sédation suffisante (voir «Mises en garde et précautions»).
La perfusion doit être arrêtée progressivement afin de minimiser le risque de symptômes de sevrage (agitation, angoisse).
Instructions posologiques particulières
ASA degrés 3 et 4
Chez ces patients, l’induction doit se faire plus lentement (environ 20 mg toutes les 10 secondes).
Patients âgés (plus de 55 ans)
Les patients âgés de plus de 55 ans requièrent des doses ou des concentrations cibles (TCI) de Disoprivan moins élevées, aussi bien lors de l’induction et du maintien de l’anesthésie que lors d’une sédation en soins intensifs. L’état général et l’âge du patient doivent être pris en considération afin de déterminer la réduction de la dose. Disoprivan doit être titré en fonction de la réaction du patient.
Les patients ASA grades 3 et 4 nécessitent une réduction supplémentaire de la dose et de la vitesse de perfusion.
L’injection par bolus ne doit pas être utilisée chez les patients âgés, étant donné que celle-ci peut entraîner une dépression cardiorespiratoire.
Utilisation chez l’enfant
En règle générale, le Disoprifusor TCI ne doit pas être utilisé chez les enfants (<16 ans).
Induction d’une anesthésie générale chez l’enfant
Disoprivan ne doit pas être utilisé pour l’anesthésie chez les enfants de moins de 6 mois.
Pour induire l’anesthésie chez les enfants de plus de 6 mois, il est recommandé d’administrer Disoprivan lentement jusqu’à l’obtention des signes cliniques de l’anesthésie. La dose doit être adaptée à l’âge et/ou au poids de l’enfant. La plupart des patients de plus de 8 ans nécessitent une dose d’env. 2,5 mg/kg de propofol pour l’induction de l’anesthésie. La dose requise chez les enfants entre 6 mois et 8 ans est vraisemblablement plus élevée. Une dose plus faible est recommandée chez les enfants ASA grades 3 et 4 (voir aussi «Mises en garde et précautions» et «Effets indésirables»).
Afin d’atténuer la douleur à l’injection, Disoprivan 10 mg/ml peut être mélangé dans une seringue de manière aseptique avec de la lidocaïne; mélanger 20 parts de Disoprivan 10 mg/ml avec 1 part de lidocaïne injectable 0,5 % ou 1 % (sans agent antimicrobien), immédiatement avant l’utilisation (voir «Interactions»).
Maintien d’une anesthésie générale chez l’enfant
Disoprivan ne doit pas être utilisé chez les enfants de moins 6 mois.
L’anesthésie peut être maintenue par perfusion ou par injections répétées en bolus. Seul Disoprivan 10 mg/ml doit être utilisé pour des injections en bolus.
La posologie requise varie fortement d’un patient à l’autre; des doses de 9 à 15 mg/kg/h permettent généralement d’atteindre un degré satisfaisant d’anesthésie.
Sédation de courte durée chez l’enfant dès 1 mois lors de procédures chirurgicales et diagnostiques
Disoprivan 10 mg/ml ne doit pas être utilisé chez des enfants de moins de 1 mois.
Disoprivan 20 mg/ml ne doit pas être utilisé chez des enfants de moins de 3 ans.
On administrera Disoprivan 10 mg/ml aux enfants en bas âge de 1 mois à 3 ans. Il est possible d’administrer Disoprivan 10 mg/ml et Disoprivan 20 mg/ml aux enfants de plus de 3 ans.
La posologie est choisie en fonction de la profondeur de sédation souhaitée et de la réponse clinique. La plupart des patients pédiatriques nécessitent 1 à 2 mg de propofol par kg PC pendant au moins 1 minute pour l’induction de la sédation. Le maintien de la sédation se fait par titration de la perfusion de Disoprivan, jusqu’à l’obtention de la profondeur de sédation souhaitée. La plupart des patients pédiatriques nécessitent 1,5 à 9 mg de propofol/kg PC/h pour une sédation satisfaisante.
Si une augmentation rapide de la profondeur de la sédation est requise, il est possible d’injecter des bolus de 1 mg/kg de propofol avec Disoprivan 10 mg/ml, en plus de la perfusion.
Les patients pédiatriques ASA grades 3 et 4 nécessitent vraisemblablement une réduction de la dose et de la vitesse de perfusion.
Sédation chez l’enfant en soins intensifs
Disoprivan ne doit pas être utilisé pour la sédation des enfants (<16 ans), la sécurité et l’efficacité du médicament n’étant pas établies (voir «Mises en garde et précautions»).
Target Controlled Infusion (TCI)
Administration de Disoprivan au moyen du Disoprifusor TCI chez l’adulte
L’administration de Disoprivan au moyen du système Disoprifusor TCI (Target Controlled Infusion) se limite à l’induction et au maintien d’une anesthésie et à la sédation chez l’adulte ventilé en soins intensifs. Le Disoprifusor TCI ne doit pas être utilisé chez les enfants (<16 ans).
Avec le système Disoprifusor TCI, l’anesthésiste peut déterminer et adapter le temps d’induction et la profondeur de l’anesthésie ou de la sédation souhaités en définissant une concentration cible de propofol. Le système Disoprifusor TCI adapte automatiquement la vitesse de perfusion en fonction de la concentration de Disoprivan identifiée. Pour certains systèmes Disoprifusor où d’autres modalités d’administration sont possibles, seul le mode par TCI, qui se base sur des concentrations sanguines de propofol prédéterminées, est recommandé.
Veuillez observer les «Directives posologiques pour l’administration par le Disoprifusor TCI» figurant ci-après. Le système spécialement mis au point pour l’administration de Disoprivan, dénommé Disoprifusor TCI, contient le logiciel Disoprifusor. Ce système ne fonctionne qu’après reconnaissance de la marque électronique de Disoprivan PFS 10 mg/ml ou PFS 20 mg/ml.
Le système Disoprifusor TCI part du principe que la concentration initiale de propofol du patient est nulle. Si la concentration plasmatique de propofol n’est pas nulle au départ, le système Disoprifusor TCI ne doit pas être utilisé. Si la pompe a été désactivée après une sédation par le système Disoprifusor TCI, le système TCI ne doit pas être réactivé, car la suppression des données pharmacocinétiques et des données du patient va entraîner une concentration cible erronée. Dans ce cas, il est recommandé de poursuivre la sédation avec la perfusion conventionnelle de Disoprivan.
Directives posologiques pour l’administration par Disoprifusor TCI
Compte tenu de la variabilité de la pharmacocinétique et de la pharmacodynamie du propofol chez les patients prémédiqués ou non, la concentration cible de Disoprivan doit être titrée en fonction de la réponse du patient, jusqu’à l’obtention de la profondeur d’anesthésie souhaitée.
Induction d'une anesthésie générale à l’aide de Disoprifusor TCI
Adultes de moins de 55 ans: une anesthésie peut généralement être induite avec des concentrations cibles de propofol allant de 4 à 8 µg/ml. Chez le patient prémédiqué, on recommande une concentration cible initiale de 4 µg/ml, contre 6 µg/ml chez le patient non prémédiqué. À ces concentrations, le temps d’induction est généralement de 60 à 120 secondes. Une augmentation de la concentration cible permet de raccourcir le temps d’induction au risque d’une dépression circulatoire et respiratoire accrue.
Patients de plus de 55 ans et patients ASA grade 3 ou 4: on choisira une concentration cible initiale inférieure que l’on pourra augmenter par paliers de 0,5 à 1,0 µg/ml toutes les minutes afin d’obtenir une induction progressive.
Maintien d’une anesthésie générale à l’aide du Disoprifusor TCI
L’administration complémentaire d’analgésiques est généralement requise. La dose de ces médicaments adjuvants permet une réduction de la concentration cible de Disoprivan nécessaire au maintien de l’anesthésie. Des concentrations cibles de 3 à 6 µg/ml permettent normalement de maintenir une anesthésie satisfaisante.
Le patient se réveille généralement avec une concentration cible de 1,0 à 2,0 µg/ml, cela dépendant de la quantité d’analgésiques administrés durant l’anesthésie.
Utilisation chez l’enfant
Disoprifusor TCI ne doit pas être utilisé chez les enfants de moins de 16 ans (voir «Mises en garde et précautions»).
Sédation chez l’adulte à l’aide du Disoprifusor TCI en soins intensifs
Pour la sédation en soins intensifs, une concentration cible de 0,2 à 2,0 µg/ml est généralement nécessaire. L’administration doit débuter avec une faible concentration cible à titrer en fonction de la réponse du patient, jusqu’à l’obtention de la profondeur de sédation souhaitée.
Si le système Disoprifusor TCI a été utilisé pour l’anesthésie, il peut être maintenu pendant la période postopératoire pour la sédation en soins intensifs avec une concentration cible adaptée.
Contre-indicationsDisoprivan ne doit pas être utilisé en cas d’hypersensibilité au principe actif ou à l’un des excipients conformément à la composition.
Disoprivan ne doit pas être utilisé en cas d’hypersensibilité à l’huile de soja.
Disoprivan est contre-indiqué pour la sédation en soins intensifs d’enfants de moins de 16 ans (voir «Mise en garde et précautions»).
Mises en garde et précautionsDisoprivan doit être administré par du personnel spécialisé en anesthésie ou du personnel de soins intensifs, spécialement formé. Les patients doivent être constamment surveillés, et le matériel nécessaire pour le maintien de la perméabilité des voies respiratoires, pour une ventilation artificielle et une réanimation, ainsi que de l’oxygène, doivent être disponibles.
Disoprivan ne doit pas être administré par la personne qui procédera elle-même à l’intervention chirurgicale ou diagnostique.
Pendant l’induction de l’anesthésie, une hypotension et une apnée transitoire peuvent se produire qui dépendent de la posologie du produit, de la prémédication et des autres médicaments utilisés.
Disoprivan n’a pas de propriétés vagolytiques. Une bradycardie, liée à une augmentation du tonus vagal pouvant résulter d’un acte chirurgical ou de l’utilisation concomitante d’autres narcotiques ou de myorelaxants, peut survenir, pouvant conduire à un arrêt cardiaque/une asystolie ou à un bloc cardiaque complet. C’est pourquoi il est conseillé d’administrer un anticholinergique en prémédication ou pendant l’anesthésie, en particulier dans les situations où un tonus vagal peut dominer ou lorsque des médicaments ayant une action chronotrope négative sont utilisés.
En phase postopératoire, une perte de connaissance avec augmentation possible du tonus musculaire peut survenir dans de très rares cas. La perte de connaissance peut également survenir après que le patient a déjà repris connaissance. Bien que cet état soit spontanément réversible, il convient de prendre en charge le patient inconscient de manière adéquate. La possibilité d’une telle complication devra être notamment prise en compte lors d’une anesthésie en ambulatoire.
Lorsque Disoprivan est appliqué pour la sédation pendant des interventions chirurgicales, des mouvements involontaires peuvent survenir comme avec d’autres substances sédatives. Cela peut être dangereux lors d’opérations qui requièrent une immobilité complète.
Disoprivan 20 mg/ml ne doit pas être utilisé pour une injection en bolus.
Une prudence particulière s’impose lors de l’association du propofol à d’autres anesthésiques (comme l’alfentanil, le sévoflurane, etc.), car des effets additifs peuvent survenir (voir «Interactions»).
On observe une augmentation de la température corporelle lorsque le propofol est administré en association avec la dexmédétomidine; la prudence est donc de mise dans cette situation (voir «Interactions»).
La prudence est de mise chez les patients présentant une insuffisance cardiaque, pulmonaire, rénale ou hépatique, une hypovolémie, et chez les patients hypovolémiques ou affaiblis (voir «Instructions posologiques particulières»).
Il y a un risque éventuel de convulsions lorsque Disoprivan est administré à des patients épileptiques.
Il convient d’agir avec circonspection chez les patients présentant des troubles du métabolisme lipidique ou lors de toute autre situation où l’utilisation d’émulsions lipidiques nécessite la prudence.
Neurotoxicité pédiatrique
Des études précliniques montrent que l’utilisation, pendant la période de croissance rapide du cerveau ou de la synaptogenèse, d’anesthésiques (fluranes) ou de sédatifs (propofol, kétamine) qui bloquent les récepteurs NMDA et/ou renforcent l’activité de GABA entraîne une perte de cellules dans le cerveau en développement, ce qui peut être associé à des déficits cognitifs permanents. La signification clinique de ces observations n’est pas connue (voir sous «Grossesse, Allaitement» et sous «Données précliniques»).
Disoprivan ne doit pas être utilisé pour l’anesthésie chez les enfants de moins de 6 mois.
Disoprivan ne doit pas être utilisé pour la sédation des enfants (<16 ans) en soins intensifs, la sécurité et l’efficacité du médicament n’étant pas établies.
Des effets indésirables graves (y compris des décès) ont été rapportés suite à une utilisation non conforme du propofol pour la sédation des patients de moins de 16 ans. Une relation de cause à effet n’a toutefois pas été établie. Acidose métabolique, hyperlipidémie, rhabdomyolyse et/ou défaillance cardiaque ont notamment été observées. Ces effets indésirables sont survenus le plus souvent chez des enfants présentant une infection des voies respiratoires et recevant des doses supérieures à celles recommandées pour la sédation de l’adulte en soins intensifs.
Syndrome de perfusion du propofol
Des cas d’acidose métabolique, de rhabdomyolyse, d’hyperkaliémie, d’hépatomégalie, de défaillance rénale, d’hyperlipidémie, d’arythmie cardiaque, de modifications de l’ECG (sus-décalage du segment ST en forme de dôme similaire aux anomalies de l’ECG du syndrome de Brugada) et/ou de défaillance cardiaque à évolution rapide (dans certains cas avec issue fatale) n’ayant généralement pas répondu au traitement inotrope de soutien ont également été rapportés. La combinaison de ces effets secondaires est appelée syndrome de perfusion du propofol. Il s’agissait principalement (mais pas uniquement) de patients souffrant de traumatismes crâniens et d’hypertension intracrânienne, ou d’enfants présentant des infections respiratoires et ayant reçu des doses supérieures à celles recommandées pour la sédation de l’adulte en soins intensifs. Les facteurs suivants semblent augmenter le risque de développer ces effets secondaires: réduction de l’apport en oxygène dans les tissus, lésions neurologiques graves et/ou septicémie, fortes doses d’une ou de plusieurs des substances pharmacologiques suivantes: vasoconstricteurs, stéroïdes, inotropes et/ou propofol (généralement après une augmentation de la dose avec des doses supérieures à 4 mg/kg/h pendant plus de 48 heures). C’est pourquoi les prescripteurs doivent veiller le plus possible à ne pas dépasser la posologie de propofol de 4 mg/kg PC/h. L’apparition des effets secondaires cités doit être soigneusement surveillée.
Au moindre signe de ces symptômes, la posologie devra être diminuée ou le passage à un autre sédatif envisagé. Lors d’un changement de traitement chez un patient ayant une hypertension intracrânienne, des mesures appropriées doivent être mises en place pour maintenir la perfusion cérébrale.
L’EDTA forme des complexes avec les ions métalliques, y compris avec le zinc. Une substitution de zinc doit être envisagée lors de l’administration prolongée de Disoprivan, la concentration sérique de zinc pouvant baisser d’environ 5 %, en particulier chez les patients prédisposés à une carence en zinc (patients souffrant de brûlures, de diarrhées, d’infections sévères et de cirrhose hépatique). C’est un fait connu qu’une carence en zinc peut déclencher les problèmes suivants: retardement de la croissance, alopécie, dermatite, diarrhée, troubles de la fonction immunitaire, troubles du développement, troubles psychiques, atrophie des gonades, troubles de la spermatogenèse ou malformations congénitales.
Sodium
Ces médicaments (Disoprivan/Disoprivan PFS 10 mg/ml, 20 mg/ml) contiennent moins de 1 mmol (23 mg) de sodium pour 1 ml, c.-à-d. qu’ils sont essentiellement «sans sodium».
InteractionsDisoprivan a été utilisé en association avec des anesthésies rachidiennes et épidurales, avec les prémédications habituelles, des curarisants, des anesthésiques par inhalation et des analgésiques. Aucune incompatibilité pharmacologique n’a été observée.
Alfentanil
L’association de propofol et d’alfentanil renforce l’effet sédatif et anesthésique. De plus, l’alfentanil augmente l’effet dépresseur du propofol sur la pression artérielle systolique et la fréquence cardiaque. En cas d’utilisation concomitante, un ajustement de la dose du propofol ou de l’alfentanil doit être envisagée.
Dexmédétomidine
L’administration concomitante de dexmédétomidine et de propofol entraîne probablement une augmentation de la température corporelle (pyrexie). La dose de propofol nécessaire pour la sédation et l’induction de l’anesthésie doit éventuellement être réduite en cas d’utilisation de dexmédétomidine.
Sévoflurane
Le propofol et le sévoflurane, lorsqu’ils sont utilisés en association, ont un effet additif sur l’anesthésie. Par conséquent, un ajustement de la dose du propofol ou du sévoflurane doit être envisagé en cas d’utilisation concomitante.
Fentanyl
Les taux sanguins de Disoprivan peuvent être accrus en présence de fentanyl.
Ciclosporine
On a signalé une leucoencéphalopathie chez des patients recevant concomitamment de la ciclosporine et des émulsions lipidiques (telles que propofol).
Valproate
Chez les patients prenant du valproate, on a observé le besoin de doses plus faibles de propofol. Une réduction de la dose de propofol doit être envisagée en cas d’utilisation concomitante.
Midazolam
Il a été observé que les patients utilisant du midazolam ont besoin d’une dose plus faible de propofol. L’utilisation concomitante du midazolam avec le propofol est susceptible d’entraîner une sédation accrue et une dépression respiratoire. En cas d’utilisation concomitante, une réduction de la dose de propofol doit être envisagée.
Grossesse, AllaitementGrossesse
Il n’existe aucune donnée clinique sur l’application chez les femmes enceintes. Des études menées sur les animaux ont montré une toxicité sur la reproduction (voir «Données précliniques» et «Mises en garde et précautions»). Le risque potentiel pour l’être humain n’est pas connu.
Des études publiées d’expérimentation animale menées avec des médicaments anesthésiques/sédatifs ont rapporté des effets indésirables sur le cerveau en développement au stade précoce (voir «Mises en garde et précautions» et «Données précliniques»).
Disoprivan ne doit donc pas être utilisé pendant la grossesse.
Le propofol traverse la barrière placentaire et peut provoquer une dépression néonatale. Disoprivan ne doit donc pas être utilisé pendant les interventions obstétricales.
Allaitement
Des études menées auprès de femmes qui allaitent ont montré que le propofol passe en petites quantités dans le lait maternel. Les mères doivent donc cesser d’allaiter jusqu’à 24 heures après l’administration du propofol et jeter le lait maternel correspondant.
Effet sur l’aptitude à la conduite et l’utilisation de machinesAprès une anesthésie générale, il faut prévoir un temps de rétablissement suffisant avant la sortie du patient.
Les patients doivent être informés du fait que leur aptitude à conduire un véhicule ou à utiliser des machines peut être perturbée pendant un certain temps à la suite d’une anesthésie générale.
Effets indésirablesLes effets indésirables les plus souvent rapportés sont des effets indésirables pharmacologiquement prévisibles pour les anesthésiques, comme l’hypotension.
L’anesthésie et les patients en soins intensifs présentant en eux-mêmes un risque plus élevé, les événements rapportés en relation avec l’anesthésie et la médecine intensive peuvent être également dus aux interventions médicales ou à l’état du patient.
Très fréquents: >1/10; fréquents: >1/100, <1/10; occasionnels: >1/1000, <1/100; rares: >1/10 000, <1/1000; très rares: <10 000; fréquence inconnue (ne peut être estimée sur la base des données disponibles.
Infections et infestations
Très rares: fièvre postopératoire.
Affections du système immunitaire
Très rares: angioœdème, bronchospasme, érythème et hypotension, anaphylaxie, y compris choc anaphylactique.
Affections du système nerveux
Des signes d’excitation peuvent être observés au cours de l’induction de l’anesthésie.
Fréquents: céphalées pendant la phase de réveil.
Rares: mouvements épileptiformes, dont convulsions et opisthotonos pendant les phases d’induction, de maintien et de réveil.
Très rares: une perte de connaissance peut survenir en phase postopératoire avec augmentation possible du tonus musculaire.
Affections psychiatriques
Rares: humeur euphorique.
Affections cardiaques
Fréquents: bradycardie. Des bradycardies sévères sont rares. Des cas isolés de progression jusqu’à l’asystolie ont été rapportés (voir «Mises en garde et précautions»).
Occasionnels: thromboses et phlébites.
Très rares: œdème pulmonaire.
Affections vasculaires
Fréquents: hypotension; l’administration de liquides intraveineux et une diminution de la vitesse d’administration de Disoprivan peuvent être occasionnellement nécessaires.
Affections respiratoires, thoraciques et médiastinales
Fréquents: apnée transitoire pendant l’induction de l’anesthésie.
Affections gastro-intestinales
Fréquents: nausées et vomissements pendant la phase de réveil.
Affections hépatobiliaires
Très rares: pancréatite.
*Fréquence inconnue : Hépatite, insuffisance hépatique aiguë
*Après un traitement à long et à court terme et chez des patients sans facteurs de risque sous-jacents.
Affections musculo-squelettiques et systémiques
Très rares: rhabdomyolyse.
Affections des reins et des voies urinaires
Très rares: coloration de l’urine après une utilisation prolongée de Disoprivan.
Affections des organes de reproduction et du sein
Très rares: désinhibition sexuelle et priapisme.
Affections générales et anomalies au site d’administration
Très fréquents: douleurs locales. Elles peuvent survenir au site d’administration pendant l’injection et peuvent être atténuées si Disoprivan 10 mg/ml est injecté dans les grosses veines de l’avant-bras ou du pli du coude. Pour réduire la douleur à l’injection, Disoprivan 10 mg/ml peut également être mélangé à de la lidocaïne (voir «Remarques particulières»: «Remarques concernant la manipulation»).
Effets indésirables après commercialisation
Des rapports d’utilisation «off-label» montrent que l’utilisation de la posologie pédiatrique (entre 6 mois et 16 ans) pendant l’induction d’une anesthésie chez le nouveau-né peut entraîner une dépression cardiorespiratoire (voir «Posologie/Mode d’emploi»).
Syndrome de perfusion du propofol: des cas d’acidose métabolique, de rhabdomyolyse, d’hyperkaliémie, d’hépatomégalie, de défaillance rénale, d’hyperlipidémie, d’arythmie cardiaque, de modifications de l’ECG et/ou de défaillance cardiaque ont été observés dans le cadre de soins intensifs, dans certains cas avec issue fatale (voir «Mises en garde et précautions»).
L’annonce d’effets secondaires présumés après l’autorisation est d’une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d’effet secondaire nouveau ou grave via le portail d’annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageUn surdosage accidentel peut provoquer une dépression cardiorespiratoire.
Traitement
La dépression respiratoire doit être traitée par ventilation artificielle avec de l’oxygène. Une dépression cardiovasculaire nécessite de mettre le patient en position déclive et, dans les cas graves, d’administrer des expanseurs plasmatiques et des vasopresseurs.
Propriétés/EffetsCode ATC
N01AX10
Mécanisme d’action/Pharmacodynamique
Le propofol est un anesthésique général intraveineux à brève durée d’action, d’installation rapide au bout d’environ 30 secondes. Le réveil est généralement rapide. Comme pour tous les anesthésiques généraux, le mécanisme d’action du propofol est peu connu.
Pendant l’induction et le maintien d’une anesthésie générale par Disoprivan, on observe normalement une baisse de la pression artérielle et une diminution de la fréquence cardiaque. Des modifications hémodynamiques défavorables sont rarement observées.
Après l’administration de Disoprivan, une dépression respiratoire peut survenir, dont l’évolution est qualitativement semblable à celle provoquée par d’autres anesthésiques intraveineux.
Disoprivan diminue le flux sanguin cérébral, la pression intracrânienne et le métabolisme cérébral. La réduction de la pression intracrânienne est plus marquée chez les patients ayant une hypertension intracrânienne.
De manière générale, les nausées et les vomissements postopératoires sont plus rares après une anesthésie par Disoprivan que par des anesthésiques par inhalation.
Efficacité clinique
Aucune donnée disponible.
PharmacocinétiqueAbsorption
Deux minutes après une injection IV de 2,5 mg/kg (dose d’induction), la concentration sanguine est d’environ 4 µg/ml. Le patient se réveille avec une concentration sanguine d’environ 1 µg/ml.
Lors d’une perfusion de Disoprivan pour le maintien de l’anesthésie, le taux sanguin se rapproche, de manière asymptotique, d’une concentration d’équilibre («steady state») correspondant à la vitesse de perfusion.
Distribution
Le propofol est lié pour environ 98 % aux protéines plasmatiques. Le volume de distribution est d’env. 10 l/kg de poids corporel.
Métabolisme
Le propofol est inactivé principalement au niveau du foie, tant par conjugaison que par hydroxylation suivie d’une conjugaison.
Élimination
La baisse de la concentration sanguine, après une injection en bolus ou à la fin d’une anesthésie, peut être décrite à l’aide d’un modèle à trois compartiments. Dans la première phase – la phase a –, la demi-vie est de 2 à 4 minutes. Elle est suivie de la phase b, dont la demi-vie est de 30 à 60 minutes. La phase finale, plus lente, est marquée par une redistribution de la substance à partir des tissus plus faiblement vascularisés.
La clairance totale est de 1,5 à 2 l/min. Les conjugués du propofol et leur dérivé quinolique correspondant sont éliminés par les reins.
Le propofol est fortement lipophile; la fraction extrarénale (Q0) est égale à 1,0.
Linéarité/non-linéarité
La pharmacocinétique est linéaire dans les limites des doses recommandées.
Cinétique pour certains groupes de patients
Aucune donnée disponible.
Données précliniquesMutagénicité
Le propofol n’était pas mutagène dans les études de génotoxicité.
Carcinogénicité
Aucune étude de carcinogénicité n’a été réalisée.
Toxicité sur la reproduction et le développement
À hautes doses, on a constaté des effets toxiques sur l’embryon, mais pas d’effets tératogènes.
Des études publiées menées chez l’animal (y compris chez des primates) portant sur les posologies qui provoquent une anesthésie légère à modérée montrent que l’utilisation, pendant la période de croissance rapide du cerveau ou de la synaptogenèse, d’anesthésiques (fluranes) ou de sédatifs (propofol, kétamine) qui bloquent les récepteurs NMDA et/ou renforcent l’activité de GABA entraîne une perte de cellules dans le cerveau en développement, ce qui peut être associé à des déficits cognitifs à long terme. La signification clinique de ces observations non cliniques n’est pas connue.
Remarques particulièresIncompatibilités
Disoprivan est incompatible avec les solutions injectables ou de perfusion et ne doit pas être mélangé avec celles-ci (p. ex. incompatibilité avec les solutions de NaCl ou les solutions de Ringer lactate). Si la même voie d’accès veineux est utilisée pour d’autres médicaments, ceux-ci doivent être ajoutés à la fin de la ligne de perfusion. L’atracurium et le mivacurium sont entre autres incompatibles avec Disoprivan et ne doivent, par conséquent, pas être administrés par la même ligne de perfusion sans rinçage préalable.
Exceptions: voir «Remarques concernant la manipulation».
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l’emballage.
L’utiliser au plus tard dans les 6 heures suivant l’ouverture et la dilution. Tous les restes doivent être jetés. Chaque flacon ou seringue prête à l’emploi est à usage unique et destiné à un seul patient. En cas d'utilisation multiple, il existe un risque de septicémie. Disoprivan doit être ouvert immédiatement avant son emploi et, comme pour les autres émulsions lipidiques, utilisé au plus tard dans les 8 heures qui suivent.
Remarques particulières concernant le stockage
Ne pas conserver l’émulsion au-dessus de 25°C. Ne pas congeler.
Conserver hors de portée des enfants.
Remarques concernant la manipulation
Agiter chaque emballage avant l’emploi.
Disoprivan ne contient pas d’agents conservateurs et offre aux micro-organismes des conditions de croissance favorables. Par conséquent, pendant toute la manipulation, il est indispensable d’observer toutes les précautions visant à assurer l’asepsie. Des filtres antimicrobiens ne peuvent pas être utilisés.
Une fois l’administration de Disoprivan terminée, mais au plus tard après 8 heures, le récipient, de même que le matériel de perfusion, doivent être remplacés. Toute quantité de Disoprivan restant ne doit pas être utilisée ultérieurement.
Disoprivan peut être administré en parallèle à une solution de glucose 5 %, de NaCl 0,9 % ou de glucose 4 % et de NaCl 0,18 % (solutions de perfusion Ph. Helv. VII) au moyen d’un raccord en Y placé près du site d’injection. Disoprivan ne doit cependant pas être mélangé à des solutions de NaCl avant son utilisation.
Disoprivan 10 mg/ml: Disoprivan 10 mg/ml peut être dilué avec du glucose 5 % (solution de perfusion Ph. Helv. VII). Des flacons de perfusion en verre ou en PVC, de même que des poches de perfusion en PVC, conviennent parfaitement. La dilution ne devrait pas dépasser 1:5 (2 mg de propofol par ml). La solution diluée doit être préparée de manière aseptique immédiatement avant l’emploi et utilisée au plus tard dans les 6 heures qui suivent.
Disoprivan 10 mg/ml peut être mélangé à une solution injectable d’alfentanil 0,5 mg/ml selon un rapport entre 20:1 et 50:1 (V/V). Les mélanges doivent être préparés de manière aseptique immédiatement avant l’emploi et utilisés au plus tard dans les 6 heures qui suivent. Afin d’atténuer la douleur à l’injection, Disoprivan 10 mg/ml peut être mélangé dans une seringue de manière aseptique avec de la lidocaïne; mélanger 20 parts de Disoprivan 10 mg/ml avec 1 part de lidocaïne solution injectable 0,5 % ou 1 % (sans agent antimicrobien) immédiatement avant l’utilisation.
Disoprivan peut être administré sans dilution à partir de flacons de perfusion, de seringues en plastique ou de seringues prêtes à l’emploi Disoprivan PFS. Si Disoprivan est utilisé non dilué pour le maintien de l’anesthésie, il est recommandé d’utiliser un pousse-seringue ou une pompe volumétrique pour réguler la vitesse de perfusion.
La perfusion de Disoprivan dilué doit être effectuée au moyen d’un système de perfusion contrôlé (burette, compte-gouttes ou pompe volumétrique) afin d’éviter l’administration accidentelle de quantités excessives de Disoprivan. Au moment de décider du volume maximal que doit contenir le système de perfusion, il convient de tenir compte du risque de perfusion incontrôlée.
Si l’on utilise du matériel de perfusion en PVC, le réservoir de perfusion doit toujours être plein. Aussi, le volume prévu pour Disoprivan doit être d’abord prélevé de la poche de perfusion, puis remplacé par un volume identique de Disoprivan 10 mg/ml.
La seringue en verre de Disoprivan PFS a une résistance de frottement inférieure à celle des seringues usuelles en plastique. Si Disoprivan est administré au moyen d’une seringue Disoprivan PFS tenue à la main, on veillera par conséquent à ne pas laisser la ligne de perfusion ouverte sans surveillance entre la seringue et le patient.
Si l’on utilise une seringue Disoprivan PFS avec un pousse-seringue, il faut veiller à ce que les deux soient compatibles. Le pousse-seringue doit être conçu de manière à exclure notamment un effet siphon et être muni d’une alarme d’occlusion (pas plus de 1000 mm Hg). Si l’on utilise un pousse-seringue programmable compatible avec plusieurs types de seringues, il faut choisir pour Disoprivan PFS la position de réglage «BD 50/60 ml PLASTIPAK».
Les utilisateurs du système TCI doivent être familiarisés non seulement avec le mode de fonctionnement de la pompe de perfusion, mais également avec celui de Disoprivan en TCI et l’emploi correct du système d’identification des seringues.
Les remarques concernant la préparation de la seringue prête à l’emploi de Disoprivan PFS sont énoncées à la fin de l’information professionnelle.
Numéro d’autorisation47162 / 53943 (Swissmedic)
PrésentationDisoprivan 10 mg/ml:
5 flacons de 20 ml [B]
Flacons de perfusion de 50 ml et 100 ml [B]
Seringue prête à l’emploi (PFS) de 50 ml [B]
Disoprivan 20 mg/ml:
Flacons de perfusion de 50 ml [B]
Seringue prête à l’emploi (PFS) de 50 ml [B]
Titulaire de l’autorisationAspen Pharma Schweiz GmbH, Baar
Mise à jour de l’informationJuin 2025
Remarques concernant la préparation de la seringue prête à l’emploi de Disoprivan PFS
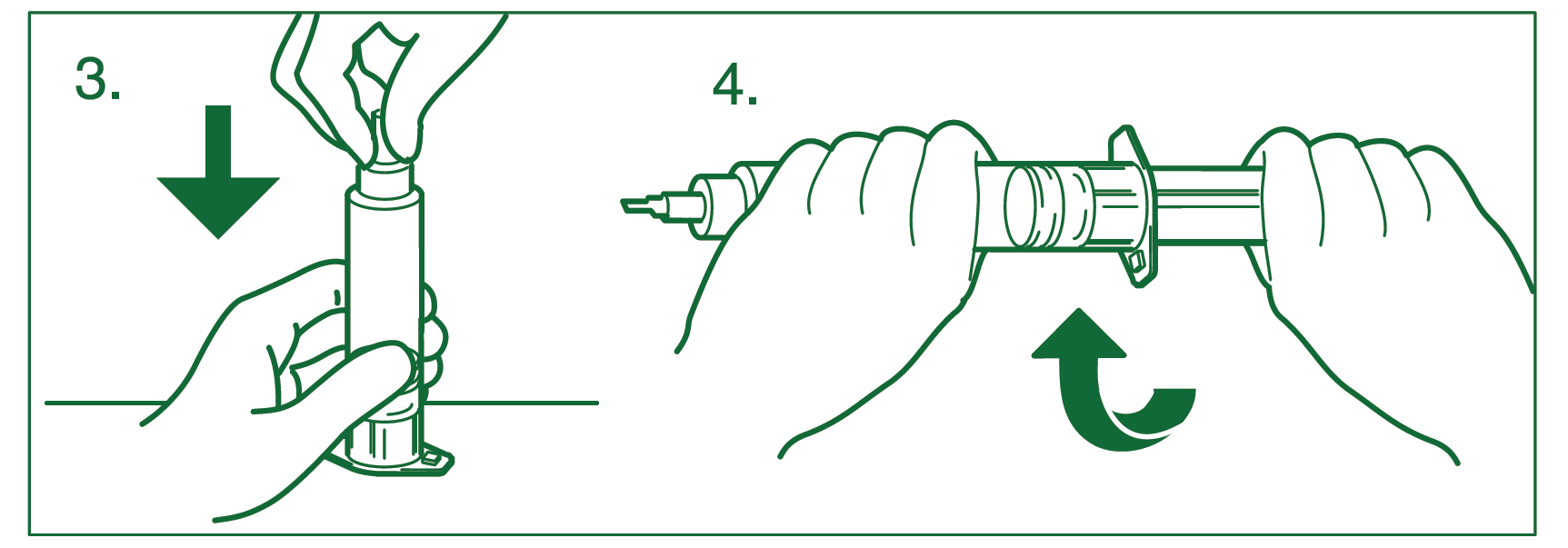
1.Retirer la seringue en verre de l’étui et vérifier son intégrité; agiter. Retirer le capuchon en plastique. Désinfecter le bouchon de caoutchouc avec de l’alcool à 70 % et laisser sécher.
2.Retirer l’unité de connexion Luer de l’étui. Retirer le manchon de l’aiguille.
3.Tenir le corps de la seringue en verre verticalement sur une surface stable. Enfoncer fermement l’aiguille de l’unité de connexion Luer afin qu’elle perce la membrane de caoutchouc et que l’embout masque complètement le capuchon.
4.Insérer le piston dans le cylindre en verre de la seringue en vissant dans le sens des aiguilles d’une montre. Attention: le piston doit être complètement vissé.
5.Visser l’unité de connexion Luer et éliminer les bulles d’air de la seringue. Fixer la seringue à la tubulure et la placer dans le système de perfusion.
DOC-01-09-2025
|

