CompositionPrincipes actifs
Altéplase (produite par la technologie de l'ADN recombinant dans des cellules ovariennes de hamster chinois [CHO]).
Excipients
·Dans le flacon de poudre: Polysorbatum 80, Argininum, Acidum phosphoricum.
·Dans le flacon de solvant: Aqua ad iniectabilia.
Indications/Possibilités d’emploi1.Thrombolyse après infarctus aigu du myocarde.
2.Traitement thrombolytique chez les patients présentant une embolie pulmonaire massive aiguë et une instabilité hémodynamique.
3.Traitement thrombolytique de l'accident vasculaire cérébral ischémique aigu.
Posologie/Mode d’emploiPosologie
L'administration d'Actilyse doit être effectuée et surveillée par un médecin expérimenté dans ce type de traitement.
Actilyse devrait être administré le plus tôt possible après l'apparition des symptômes.
La solution reconstituée doit être administrée par voie intraveineuse immédiatement après la préparation (voir également «Mode d'administration» et «Remarques particulières»).
Infarctus aigu du myocarde
a) Schéma posologique sur 90 minutes pour les patients souffrant d'infarctus aigu du myocarde, chez qui le traitement peut commencer dans les 6 heures suivant le début des symptômes:
Chez les patients avec un poids corporel ≥65 kg:
·15 mg en bolus intraveineux, directement suivis de
·50 mg en perfusion intraveineuse dans les premières 30 minutes, immédiatement suivis d'une perfusion intraveineuse de
·35 mg durant 60 minutes, jusqu'à atteinte de la dose maximale de 100 mg au total.
La dose totale doit être adaptée selon le schéma suivant chez les patients ayant un poids corporel < 65 kg:
·15 mg en bolus intraveineux, suivis directement de
·0,75 mg/kg de poids corporel en perfusion intraveineuse durant les 30 premières minutes (au maximum 50 mg), immédiatement suivis d'une perfusion intraveineuse de
·0,5 mg/kg durant 60 minutes (jusqu'à 35 mg au maximum).
b) Schéma posologique sur 3 heures pour les patients souffrant d'infarctus aigu du myocarde chez qui le traitement peut commencer dans les 6 à 12 heures suivant le début des symptômes. Le schéma suivant correspond à la forme d'administration lente recommandée jusqu'ici.
Chez les patients avec un poids corporel ≥65 kg:
·10 mg en bolus intraveineux, suivis directement de
·50 mg en perfusion intraveineuse durant la première heure, immédiatement suivis d'une perfusion intraveineuse de
·40 mg sur 2 heures, jusqu'à atteinte de la dose maximale de 100 mg au total.
Chez les patients avec un poids corporel < 65 kg:
·10 mg en bolus intraveineux, suivis directement
·d'une perfusion intraveineuse sur 3 heures jusqu'à l'atteinte de la dose totale maximale de 1,5 mg/kg de poids corporel.
Traitement adjuvant:
Un traitement adjuvant antithrombotique est recommandé conformément aux directives internationales actuelles relatives au traitement de l'infarctus du myocarde avec sus-décalage du segment ST.
Embolie pulmonaire massive aiguë
Chez les patients avec un poids corporel ≥65 kg:
Administrer une dose totale de 100 mg en l'espace de 2 heures. Le schéma posologique le plus souvent utilisé est le suivant:
·10 mg en bolus intraveineux en 1 à 2 minutes, suivis directement de
·90 mg en perfusion intraveineuse sur 2 heures jusqu'à atteinte de la dose totale maximale de 100 mg.
Chez les patients avec un poids corporel de < 65 kg:
·10 mg en bolus intraveineux en 1 à 2 minutes, suivis directement
·d'une perfusion intraveineuse sur 2 heures jusqu'à la dose totale maximale de 1,5 mg/kg de poids corporel.
Traitement adjuvant:
Le traitement par l'héparine doit débuter (ou être poursuivi) après le traitement par Actilyse si les valeurs de l'aPTT sont inférieures à 2 fois les valeurs maximales normales. La perfusion doit être ajustée afin de maintenir un aPTT de 50 à 70 secondes (1,5 à 2,5 fois la valeur de référence).
Accident vasculaire cérébral ischémique aigu
La dose totale recommandée est de 0,9 mg de principe actif/kg de poids corporel (dose maximale totale: 90 mg) en commençant par 10% de la dose totale en bolus intraveineux initial, suivi immédiatement du reste de la dose totale en perfusion intraveineuse sur 60 minutes.
Le traitement doit être instauré aussitôt que possible dans les 4,5 heures suivant l'apparition des symptômes (voir «Mises en garde et précautions»). Une hémorragie intracrânienne doit être exclue avant le traitement par un procédé d'imagerie adéquat (p.ex. la tomographie assistée par ordinateur ou par un autre procédé d'imagerie capable de mettre en évidence une hémorragie). L'effet du traitement dépend du temps, ce qui signifie que la probabilité d'une évolution favorable est d'autant plus élevée que le traitement est initié précocement (voir également «Contre-indications» et «Mises en garde et précautions»).
|
TABLE DES DOSES POUR L'ACCIDENT VASCULAIRE CÉRÉBRAL ISCHÉMIQUE AIGU
Lors de l'utilisation de la concentration standard recommandée de 1 mg/ml, le volume à utiliser (ml) correspond au dosage recommandé (mg).
| |
Poids
(kg)
|
Dose totale
(mg)
|
Dose en bolus
(mg)
|
Dose en perfusion*
(mg)
| |
40
|
36,0
|
3,6
|
32,4
| |
42
|
37,8
|
3,8
|
34,0
| |
44
|
39,6
|
4,0
|
35,6
| |
46
|
41,4
|
4,1
|
37,3
| |
48
|
43,2
|
4,3
|
38,9
| |
50
|
45,0
|
4,5
|
40,5
| |
52
|
46,8
|
4,7
|
42,1
| |
54
|
48,6
|
4,9
|
43,7
| |
56
|
50,4
|
5,0
|
45,4
| |
58
|
52,2
|
5,2
|
47,0
| |
60
|
54,0
|
5,4
|
48,6
| |
62
|
55,8
|
5,6
|
50,2
| |
64
|
57,6
|
5,8
|
51,8
| |
66
|
59,4
|
5,9
|
53,5
| |
68
|
61,2
|
6,1
|
55,1
| |
70
|
63,0
|
6,3
|
56,7
| |
72
|
64,8
|
6,5
|
58,3
| |
74
|
66,6
|
6,7
|
59,9
| |
76
|
68,4
|
6,8
|
61,6
| |
78
|
70,2
|
7,0
|
63,2
| |
80
|
72,0
|
7,2
|
64,8
| |
82
|
73,8
|
7,4
|
66,4
| |
84
|
75,6
|
7,6
|
68,0
| |
86
|
77,4
|
7,7
|
69,7
| |
88
|
79,2
|
7,9
|
71,3
| |
90
|
81,0
|
8,1
|
72,9
| |
92
|
82,8
|
8,3
|
74,5
| |
94
|
84,6
|
8,5
|
76,1
| |
96
|
86,4
|
8,6
|
77,8
| |
98
|
88,2
|
8,8
|
79,4
| |
100+
|
90,0
|
9,0
|
81,0
| |
* Administration selon une concentration de 1 mg/ml en 60 minutes
|
Traitement adjuvant:
La sécurité et l'efficacité de ce schéma posologique en association avec de l'héparine ou un antiagrégant plaquettaire comme l'acide acétylsalicylique au cours des 24 premières heures suivant l'apparition des symptômes n'ont pas été suffisamment étudiées. Par conséquent, l'administration d'héparine par voie intraveineuse ou d'un antiagrégant plaquettaire comme l'acide acétylsalicylique doit être évitée au cours des premières 24 heures suivant l'administration d'Actilyse en raison d'un risque d'hémorragie accru. Si l'administration d'héparine est rendue nécessaire pour d'autres indications (p.ex. en prévention d'une thrombose veineuse profonde), la dose ne doit pas dépasser 10 000 UI par jour, par voie sous-cutanée.
Instructions posologiques particulières
Population pédiatrique
La sécurité et l'efficacité d'Actilyse chez les enfants et les adolescents n'ont pas encore été établies jusqu'à présent.
Actilyse est contre-indiqué pour le traitement de l'accident vasculaire cérébral aigu chez les enfants et les adolescents de moins de 16 ans (voir «Contre-indications»). Pour les adolescents de plus de 16 ans, voir «Mises en garde et précautions».
Patients âgés
Pour le traitement de l'accident vasculaire cérébral aigu chez les adultes de plus de 80 ans, voir «Mises en garde et précautions».
Patients atteints d'insuffisance rénale ou hépatique
On ne dispose pas de données cliniques.
Traçabilité
Afin d'assurer la traçabilité des médicaments biotechnologiques, il convient de documenter pour chaque traitement le nom commercial et le numéro de lot.
Mode d'administration
La solution reconstituée doit être administrée par voie intraveineuse et est destinée à être utilisée immédiatement.
Pour les instructions concernant la reconstitution de la solution et l'administration, il convient de se reporter aux consignes de la rubrique «Remarques particulières», sous «Remarques concernant la manipulation».
Contre-indicationsActilyse est contre-indiqué dans les cas suivants:
·Patients ayant une hypersensibilité connue aux principes actifs altéplase ou à l'un des excipients.
·Cas dans lesquels un risque accru de saignement existe; ceci vaut en particulier dans les cas suivants:
·hémorragie grave ou dangereuse, manifeste ou survenue durant les 6 derniers mois, diathèse hémorragique connue,
·patients sous traitement par anticoagulants oraux, associés à des effets anticoagulants cliniquement pertinents, p.ex. sous acénocoumarol ou phenprocoumone avec une valeur INR >1,3,
·tout indice suggérant un traumatisme crânien au cours des 3 derniers mois, intervention chirurgicale intracrânienne ou spinale ou autre affection du SNC telles que néoplasie intracrânienne, malformation artérioveineuse ou anévrisme,
·antécédent ou suspicion d'hémorragie cérébrale,
·hémorragie sous-arachnoïdienne ou suspicion d'hémorragie sous-arachnoïdienne,
·hypertension artérielle sévère non contrôlée,
·intervention chirurgicale importante ou traumatisme durant les 10 derniers jours (y compris tout traumatisme lié à l'infarctus actuel),
·massage cardiaque externe traumatique récent (remontant à moins de 10 jours), accouchement ou ponction récente d'un vaisseau non compressible (p.ex. de la veine sous-clavière ou jugulaire),
·atteinte hépatique sévère, y compris défaillance hépatique, cirrhose, hypertension portale (varices œsophagiennes) et hépatite active,
·endocardite bactérienne, péricardite,
·pancréatite aiguë,
·atteintes ulcéreuses gastro-intestinales documentées au cours des 3 derniers mois, anévrisme artériel, malformations artérielles/veineuses,
·néoplasmes avec risque accru de saignement.
Dans le cas d'infarctus aigu du myocarde ou d'embolie pulmonaire massive aiguë, il faut en outre tenir compte de la contre-indication suivante:
·antécédent d'accident vasculaire cérébral hémorragique ou d'étiologie inconnue
·antécédents d'accident vasculaire cérébral ischémique ou d'accident ischémique transitoire (AIT) au cours des six mois précédents, sauf si l'accident vasculaire cérébral ischémique aigu est survenu dans les 4,5 heures précédentes.
Dans le cas d'accident vasculaire cérébral ischémique aigu, il faut en plus et particulièrement tenir compte des contre-indications suivantes:
·patients chez qui le moment de l'apparition des symptômes remonte à plus de 4,5 heures avant l'initiation de la perfusion ou n'est pas connu,
·antécédent d'accident vasculaire cérébral,
·symptômes d'accident vasculaire cérébral mineurs ou s'étant rapidement améliorés avant le début de la perfusion,
·accident vasculaire cérébral jugé sévère cliniquement (p.ex. NIHSS >25) et/ou par des techniques d'imagerie appropriées,
·chez les enfants et les adolescents de moins de 16 ans (pour les adolescents de plus de 16 ans, voir «Mises en garde et précautions»).
·En cas de crise épileptique au début de l'accident vasculaire cérébral, il faut, avant une éventuelle thrombolyse, mettre en évidence l'obstruction du vaisseau cérébral correspondant par un procédé neuro-radiologique afin de ne pas exposer inutilement les patients présentant une parésie post-épileptique isolée, toutefois sans accident vasculaire cérébral, aux risques liés à la thrombolyse.
·Ceci est également valable lors de suspicion d'hypoglycémie ou d'hyperglycémie ou d'autres troubles métaboliques pouvant expliquer un déficit neurologique focal.
·Administration d'héparine dans les 48 heures avant le début des symptômes et augmentation du temps de prothrombine partiel activé (aPTT) lors de l'admission à l'hôpital.
·Thrombocytes <100'000/mm3,
·Au début de la thrombolyse, il faut effectuer une prise de sang afin de déterminer les paramètres de la coagulation et démarrer la perfusion d'Actilyse. Si les résultats obtenus montrent un temps de prothrombine (TP) supérieur à 15 secondes ou un aPTT prolongé, il faut interrompre la perfusion.
·Pression artérielle systolique >185 mm Hg ou diastolique > 110 mm Hg, ou traitement d'attaque nécessaire pour réduire la pression artérielle au-dessous de ces valeurs.
·Glycémie <50 mg/dl ou >400 mg/dl (<2,8 mmol/l ou >22,2 mmol/l).
·Les doses maximales indiquées ne doivent pas être dépassées en raison de la majoration du risque d'hémorragie intracrânienne.
Mises en garde et précautionsActilyse est disponible en plusieurs dosages pour le traitement de l'infarctus du myocarde aigu, de l'embolie pulmonaire massive aiguë et de l'accident ischémique cérébral aigu. Le dosage adéquat d'Actilyse doit être soigneusement choisi en fonction de l'utilisation prévue. Le dosage de 2 mg d'Actilyse Cathflo 2 mg n'est pas indiqué en cas d'infarctus du myocarde aigu, d'embolie pulmonaire massive aiguë ou d'accident vasculaire cérébral ischémique aigu (en raison du risque de sous-dosage massif). Pour ces domaines d'utilisation, seuls les dosages 10 mg, 20 mg et 50 mg d'Actilyse sont indiqués.
Il est recommandé d'effectuer le traitement par Actilyse en présence d'un équipement de réanimation.
Hypersensibilité
Des réactions d'hypersensibilité à médiation immunitaire en lien avec l'administration d'Actilyse peuvent être provoquées par le principe actif altéplase ou un des excipients (voir «Contre-indications»).
Une production constante d'anticorps contre la molécule d'activateur du plasminogène tissulaire humain recombinant n'a pas été observée après le traitement. On ne dispose pas d'expériences systématiques relatives à une nouvelle administration d'Actilyse.
Il existe en outre un risque de réactions d'hypersensibilité à médiation non immunitaire.
L'œdème de Quincke est la réaction d'hypersensibilité la plus souvent observée en lien avec Actilyse. Ce risque peut être accru dans l'indication « accident vasculaire cérébral ischémique aigu » et/ou en cas de traitement concomitant par des inhibiteurs de l'enzyme de conversion de l'angiotensine (ECA) (voir «Interactions»).
Le risque d'œdème de Quincke doit être surveillé chez les patients traités quelle que soit l'indication autorisée, pendant la perfusion et dans les 24 heures suivant la perfusion. Dans le cas d'une réaction d'hypersensibilité grave (p.ex. œdème de Quincke), la perfusion doit être immédiatement arrêtée et un traitement adéquat (y compris, éventuellement, une intubation) doit être instauré.
Hémorragies
Le risque d'hémorragie intracérébrale augmente chez les patients âgés. Le bénéfice thérapeutique étant justement plus élevé chez les patients âgés, il faut évaluer soigneusement le rapport bénéfice/risque du traitement.
Comme pour tous les thrombolytiques, le bénéfice thérapeutique attendu doit être soigneusement soupesé par rapport à tous les risques lors de l'utilisation d'Actilyse; ceci vaut en particulier dans les cas suivants:
·rétinopathie hémorragique, p.ex. en cas de diabète (des troubles visuels peuvent être les signes d'une rétinopathie hémorragique) ou autres troubles oculaires hémorragiques,
·petits traumatismes récents tels que biopsies, ponction de vaisseaux importants, injections intramusculaires, réanimation par massage cardiaque,
·situations où subsiste un risque élevé de saignement, non mentionnées dans le paragraphe «Contreindications».
Chez les patients ayant subi un traitement préalable par anticoagulants oraux, le statut de la coagulation doit être déterminé avant l'instauration du traitement par Actilyse. Un traitement par Actilyse peut être envisagé lorsqu'aucun effet anticoagulant cliniquement pertinent ne peut être mis en évidence.
L'utilisation de cathéters rigides et une manipulation inutile du patient doivent être évitées pour ne pas blesser les vaisseaux.
En cas de survenue d'hémorragie potentiellement dangereuse (en particulier d'hémorragie cérébrale), la fibrinolyse doit être interrompue et une administration adjuvante d'héparine doit être immédiatement arrêtée. Une substitution des facteurs de coagulation n'est généralement pas nécessaire en raison de la courte demi-vie d'Actilyse et de son faible impact sur les facteurs systémiques de l'hémostase. Pour la plupart des patients chez qui se déclenche une hémorragie, il suffit d'interrompre la thrombolyse et le traitement par les anticoagulants, de compenser les pertes volumiques et de comprimer les vaisseaux sanguins concernés. Dans le cas où de l'héparine a été administrée dans les 4 heures précédant le début de l'hémorragie ou également après, il faut envisager l'administration de protamine. L'utilisation prudente de produits de transfusion peut être indiquée chez les rares patients qui ne répondraient pas à ces mesures conservatrices. On peut envisager d'administrer un cryoprécipité, du plasma frais congelé et des thrombocytes; les paramètres cliniques et les valeurs de laboratoire devant être contrôlés après chaque administration. Si l'on administre un cryoprécipité, un taux de fibrinogène de 1 g/l devrait être atteint. Une autre alternative consiste à utiliser des antifibrinolytiques.
Les doses maximales indiquées ne doivent pas être dépassées en raison de la majoration du risque d'hémorragie intracrânienne (voir également «Effets indésirables»).
En outre, il faut respecter les précautions et les mises en garde suivantes pour le traitement de l'infarctus aigu du myocarde et de l'embolie pulmonaire massive aiguë:
·Tension systolique > 160 mm Hg (voir «Contreindications»).
Pour le traitement de l'infarctus aigu du myocarde, il convient en plus de considérer les mises en garde et précautions suivantes:
·Une thrombolyse coronarienne peut déclencher des arythmies associées à une reperfusion. Les arythmies dues à la reperfusion peuvent conduire à un arrêt cardiaque, mettre la vie du patient en péril et nécessiter un traitement anti-arythmique conventionnel.
·L'administration concomitante d'antagonistes des récepteurs GPIIb/IIIa accroît le risque hémorragique.
·L'utilisation de thrombolytiques peut augmenter le risque d'événements thromboemboliques chez les patients avec un thrombus du cœur gauche (p.ex. sténose mitrale, fibrillation auriculaire).
Pour le traitement de l'accident vasculaire cérébral ischémique aigu, il convient en plus de considérer les mises en garde et précautions suivantes:
Hémorragies
L'hémorragie intracérébrale constitue l'effet secondaire le plus fréquent (jusqu'à 15 % des patients), cependant sans augmentation pertinente de la morbidité globale ou de la mortalité globale dans une étude portant sur 624 patients (étude NINDS).
Comparativement aux autres indications, les patients traités par Actilyse dans le cadre d'un accident vasculaire cérébral ischémique aigu, présentent une augmentation significative du risque d'hémorragie intracrânienne, les hémorragies survenant préférentiellement dans la zone de l'infarctus.
Cette mise en garde s'applique notamment aux conditions suivantes:
·Toutes situations mentionnées au paragraphe «Contre-indications», et plus généralement, toutes situations impliquant un risque hémorragique important.
·Début du traitement tardif.
·Les patients ayant reçu au préalable un traitement par l'acide acétylsalicylique (AAS) peuvent présenter un risque accru d'hémorragie intracrânienne, en particulier si le traitement par Actilyse est mis en place tardivement.
·Par rapport aux patients plus jeunes, les patients ayant un âge avancé (plus de 80 ans) peuvent présenter de moins bons résultats cliniques d'une thrombolyse indépendamment du traitement ainsi qu'un risque accru d'hémorragies intracérébrales en cas de traitement par thrombolyse. En général, le rapport bénéfice/risque d'une thrombolyse chez les patients ayant un âge avancé reste positif. Le bénéfice d'une thrombolyse chez les patients souffrant d'un accident vasculaire cérébral ischémique aigu doit être soupesé individuellement par rapport aux risques escomptés.
Le traitement ne doit pas être initié plus de 4,5 heures après l'apparition des symptômes (voir «Contre-indications»), en raison d'un rapport bénéfice/risque défavorable dû principalement à:
·une diminution des effets bénéfiques du traitement avec le temps,
·une augmentation du taux de mortalité, en particulier chez les patients ayant reçu au préalable un traitement par l'acide acétylsalicylique,
·une augmentation du risque de survenue d'hémorragies symptomatiques.
Surveillance de la pression artérielle
Une surveillance de la pression artérielle pendant, ainsi que jusqu'à 24 heures après l'administration du traitement est nécessaire. Si la pression artérielle systolique est supérieure à 180 mm Hg ou si la pression artérielle diastolique est supérieure à 105 mm Hg, un traitement antihypertenseur par voie intraveineuse est recommandé.
Groupes de patients particuliers présentant un bénéfice diminué par rapport aux risques
Le bénéfice thérapeutique est diminué chez les patients ayant des antécédents d'accident vasculaire cérébral (voir «Contre-indications») ou présentant un diabète mal contrôlé ou non traité. Chez ces patients, le bénéfice thérapeutique est moins favorable, mais reste cependant positif.
Les patients avec des infarctus étendus (p.ex. plus d'un tiers de la zone irriguée par l'artère cérébrale moyenne, effet de masse, décalage de la ligne médiane), ont un risque accru d'évolution défavorable, dont hémorragies sévères et décès. Le rapport bénéfice/risque doit être soigneusement évalué chez ces patients.
Chez les patients présentant un accident vasculaire cérébral, il faut s'attendre à une diminution des chances d'évolution favorable avec le temps s'écoulant entre le début du traitement et la survenue des symptômes, avec l'âge, avec une augmentation de la sévérité de l'accident vasculaire cérébral et avec une élévation de la glycémie au moment de l'hospitalisation; le risque de handicaps sévères permanents, de décès ou d'hémorragies intracrâniennes symptomatiques augmente indépendamment du mode de traitement.
Œdème cérébral
La reperfusion de la zone de l'ischémie peut entraîner un œdème cérébral dans la zone infarcie.
Les patients avec une hypertension artérielle insuffisamment traitée depuis plusieurs années, une fibrillation auriculaire ou une leucoencéphalopathie présentent probablement un risque augmenté d'accident vasculaire cérébral avec handicap ou décès et/ou d'hémorragie cérébrale modérée à sévère. Pour ces patients, l'indication d'une thrombolyse doit être soigneusement évaluée en fonction des risques.
Les patients avec un accident vasculaire cérébral ainsi que leurs proches doivent être très soigneusement informés des risques et bénéfices potentiels d'une thrombolyse.
Population pédiatrique
Jusqu'à présent, on ne dispose que d'une expérience limitée concernant l'utilisation d'Actilyse chez les enfants et les adolescents.
Chez les adolescents ≥16 ans, le bénéfice sera soigneusement soupesé individuellement par rapport aux risques.
Les adolescents ≥16 ans doivent être traités conformément aux lignes directrices du traitement pour adultes après qu'un accident vasculaire cérébral ischémique aigu a été confirmé (exclusion de «Stroke Mimics»).
InteractionsPrincipes actifs ayant des répercussions sur la coagulation sanguine/fonction des thrombocytes
Les dérivés coumariniques, les inhibiteurs de l'agrégation plaquettaire, l'héparine et autres médicaments susceptibles d'influencer la coagulation peuvent augmenter le risque d'hémorragie avant, pendant ou après le traitement par Actilyse et doivent être évités dans les premières 24 heures qui suivent le traitement d'un accident vasculaire cérébral ischémique aigu (voir «Contre-indications»).
Actilyse est une enzyme qui reste active in vitro aux concentrations pharmacologiques, ce qui peut entraîner la dégradation du fibrinogène dans les échantillons de sang recueillis. Ce phénomène peut être partiellement inhibé par l'adjonction d'aprotinine (150 à 200 unités par ml). Les tests de coagulation ou la mesure de l'activité fibrinolytique pendant ou immédiatement après le traitement par Actilyse risquent par conséquent de fournir des résultats incertains.
Inhibiteurs de l'ECA
Le traitement concomitant par des inhibiteurs de l'ECA peut augmenter le risque de réaction d'hypersensibilité (voir «Mises en garde et précautions»).
Grossesse, allaitementGrossesse
On ne dispose que d'une expérience limitée concernant l'utilisation d'Actilyse chez la femme enceinte. Les études expérimentales réalisées chez l'animal à des doses plus élevées que celles administrées aux humains ont montré en plus des effets pharmacologiques connus, une immaturité fœtale et/ou une embryotoxicité (voir «Données précliniques»). En cas de pathologie aiguë menaçant le pronostic vital, le bénéfice attendu doit être évalué par rapport au risque potentiel.
Allaitement
On ignore si l'altéplase est excrété dans le lait maternel.
La prudence est de mise lors de l'administration d'Actilyse à une femme qui allaite. Il est nécessaire de déterminer si l'allaitement doit être interrompu pendant les premières 24 heures qui suivent l'administration d'Actilyse.
Fertilité
Les données cliniques sur la fertilité avec l'altéplase ne sont pas disponibles. Les études animales menées avec l'altéplase n'ont pas démontré d'effets négatifs sur la fertilité (voir «Données précliniques»).
Effet sur l’aptitude à la conduite et l’utilisation de machinesSans objet.
Effets indésirablesLes effets indésirables pour les indications infarctus aigu du myocarde, accident vasculaire cérébral ischémique aigu et embolie pulmonaire ont été évalués avec les résultats de l'étude Assent-2 (étude menée auprès de 8299 patients traités par Actilyse). Pour l'indication accident vasculaire cérébral ischémique aigu, les fréquences de l'effet indésirable «hémorragies intracrâniennes» sont basées sur les résultats des études NINDS et ECASS III (études menées auprès de respectivement 312 et 418 patients traités à un intervalle de 0-4,5 heures par Actilyse).
Les effets indésirables les plus fréquents lors de l'utilisation d'Actilyse sont des hémorragies graves qui peuvent conduire à des situations menaçant le pronostic vital, des handicaps permanents ou des décès.
Des symptômes neurologiques tels que somnolence, aphasie, hémiparésie, convulsions peuvent être associés à des hémorragies intracrâniennes.
Les catégories de fréquence utilisées sont définies comme suit:
«très fréquent» (≥1/10), «fréquent» (≥1/100 à <1/10), «occasionnel» (≥1/1000 à <1/100), «rare» (≥1/10 000 à <1/1000), «très rare» (<1/10 000), «inconnue» (ne peut être estimée sur la base des données disponibles).
Affections du système immunitaire
Rare: Réactions anaphylactoïdes (telles que éruptions cutanées, urticaire, bronchospasme, hypotension, angio-œdème, choc).
Affections du système nerveux
Les fréquences sont spécifiques pour les indications:
·Infarctus aigu du myocarde et embolie pulmonaire massive aiguë:Fréquent: Hémorragies intracrâniennes (telles que hémorragie cérébrale, hématome cérébral, accident vasculaire cérébral hémorragique, transformation hémorragique d'un accident vasculaire cérébral, hématome intracrânien, hémorragie sous-arachnoïdienne).
·Accident ischémique vasculaire aigu:Très fréquent: Hémorragies intracrâniennes (NINDS: 15,4%; ECASS III: 14,1%) telles que hémorragie cérébrale, hématome cérébral, accident vasculaire cérébral hémorragique, transformation hémorragique d'un accident vasculaire cérébral, hématome intracrânien, hémorragie sous-arachnoïdienne.
Les fréquences de ces effets indésirables sont basées sur les résultats des études NINDS et ECASS III.
Affections oculaires
Rare: Hémorragies oculaires, en particulier chez les patients présentant une rétinopathie diabétique.
Affections cardiaques
Rare: Hémorragie péricardique.
Les effets indésirables suivants et les fréquences sont spécifiques pour l'indication Infarctus aigu du myocarde:
Occasionnel: Arythmies lors de la reperfusion (telles qu'arythmie, extrasystoles, fibrillation/flutter auriculaire, bloc auriculo-ventriculaire du 1er degré jusqu'au bloc auriculo-ventriculaire complet, bradycardie, tachycardie, arythmie ventriculaire, fibrillation ventriculaire, tachycardie ventriculaire, dissociation électromécanique (DEM)). Les arythmies de reperfusion peuvent conduire à un arrêt cardiaque, menacer le pronostic vital et nécessiter un traitement antiarythmique conventionnel.
Affections vasculaires
Très fréquent: Hémorragies telles qu'hématome (17,1%).
Rare: Embolie thrombotique.
Inconnue*: Hémorragies des organes parenchymateux (telles que hémorragie hépatique).
Affections respiratoires, thoraciques et médiastinales
Fréquent: Hémorragies des voies respiratoires (telles qu'hémorragie pharyngée).
Occasionnel: Hémoptysie, épistaxis.
Rare: Hémorragie pulmonaire.
Affections gastro-intestinales
Fréquent: Hémorragies gastro-intestinales (telles qu'hémorragie gastrique, hémorragie ulcéreuse gastrique, hémorragie rectale, hématémèse, méléna, hémorragie buccale, saignement des gencives).
Rare: Hémorragies rétropéritonéales (telles que hématome rétropéritonéal), nausées.
Inconnue*: Vomissements.
En outre, les nausées et les vomissements peuvent être des symptômes de l'infarctus du myocarde.
Affections de la peau et du tissu sous-cutané
Fréquent: Ecchymoses.
Affections du rein et des voies urinaires
Fréquent: Hémorragies urogénitales (telles qu'hématurie, hémorragie des voies urinaires).
Troubles généraux et anomalies au site d'administration
Fréquent: Hémorragies au site d'injection telles que des hématomes dus au cathéter, hémorragies au site du cathéter.
Investigations
Fréquent: Baisse de la tension artérielle.
Inconnue*: Augmentation de la température corporelle.
Lésions, intoxications et complications liées aux procédures
Inconnue*: Embolies graisseuses (embolies dues à des cristaux de cholestérol).
Actes médicaux et chirurgicaux
Inconnue*: Nécessité de procéder à une transfusion sanguine.
* Ces réactions indésirables proviennent de rapports spontanés.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageSymptômes
Lorsque la dose maximale recommandée est dépassée, le risque d'hémorragies intracrâniennes augmente.
En cas de surdosage, une diminution cliniquement pertinente du fibrinogène et d'autres facteurs de coagulation peut survenir.
Traitement
En règle générale, on pourra attendre la reprise physiologique de la synthèse de ces facteurs après l'arrêt du traitement par Actilyse. Si une hémorragie massive se manifeste, on aura recours à du plasma frais congelé ou à du sang frais, éventuellement aussi à des antifibrinolytiques de synthèse.
Propriétés/EffetsCode ATC
B01AD02
Groupe pharmacothérapeutique: agent antithrombotique.
Mécanisme d'action
Le principe actif d'Actilyse est une glycoprotéine humaine recombinante, qui active directement la conversion du plasminogène en plasmine. Après administration intraveineuse, Actilyse reste pratiquement inactif dans la circulation jusqu'à sa fixation sur la fibrine du thrombus. Activé par sa fixation à la fibrine, Actilyse induit la conversion du plasminogène en plasmine, provoquant ainsi la lyse du caillot de fibrine.
Pharmacodynamique
Grâce à la spécificité relative d'Actilyse pour la fibrine, l'administration d'une dose totale de 100 mg entraîne une diminution limitée des valeurs de fibrinogène circulant à environ 60% en 4 heures; après 24 heures, elles remontent à 80%. Les valeurs de plasminogène et d'alpha-2-antiplasmine tombent après 4 heures à 20 %, respectivement 35 %; elles remontent après 24 heures à plus de 80 %. On n'a observé une diminution prolongée marquée des taux sanguins de fibrinogène uniquement chez quelques patients.
Efficacité clinique
Patients avec infarctus aigu du myocarde
Chez les patients avec infarctus aigu du myocarde, deux régimes de posologie d'Actilyse ont été étudiés. Aucune évaluation comparative n'a été effectuée entre ces deux régimes.
Perfusion accélérée chez les patients avec infarctus aigu du myocarde
La perfusion accélérée d'Actilyse a été étudiée dans le cadre d'une étude internationale et multicentrique (GUSTO), menée auprès de 41 021 patients avec infarctus aigu du myocarde et randomisés pour quatre régimes de thrombolyse. L'administration de 100 mg d'Actilyse pendant 90 minutes, en association avec une perfusion intraveineuse concomitante d'héparine, a conduit à une mortalité à 30 jours (6,3 %) plus faible que l'administration de streptokinase, 1,5 millions d'UI, pendant 60 minutes avec héparine par voie sous-cutanée ou par voie intraveineuse (7,3 %). La réduction absolue de 1 % de la mortalité à 30 jours sous Actilyse par rapport à la streptokinase a été statistiquement significative (p = 0,001).
Les patients traités par Actilyse ont montré, 60 et 90 minutes après la thrombolyse, une perméabilité des vaisseaux en relation avec l'infarctus plus élevée que les patients traités par streptokinase. Après 180 minutes ou plus tard, aucune différence n'a été observée concernant la perméabilité des vaisseaux.
Une grande étude sur la mortalité (ASSENT 2) menée auprès d'environ 17000 patients a montré que l'altéplase et la ténectéplase sont thérapeutiquement équivalentes au niveau de la réduction de la mortalité (6,2 % pour les deux traitements, après 30 jours). L'utilisation de ténectéplase a été associée à une incidence significativement plus faible d'hémorragies non intracrâniennes que celle d'altéplase (26,4 % contre 28,9 %, p = 0,0003). La diminution du risque hémorragique est probablement en relation avec la plus forte spécificité envers la fibrine de la ténectéplase et le régime de posologie dépendant du poids.
Perfusion de 3 heures chez les patients avec infarctus aigu du myocarde
Au cours d'une étude randomisée en double aveugle (5013 patients) de comparaison entre Actilyse et un placebo (étude ASSET), les patients perfusés par Actilyse dans les 5 heures après le début de l'apparition des symptômes de l'infarctus aigu du myocarde ont montré une amélioration de la survie à 30 jours par rapport aux patients traités par le placebo. Après un mois, le taux de mortalité globale a été de 7,2% dans le groupe de traitement par Actilyse et de 9,8% dans le groupe sous placebo (p = 0,001). Cet avantage dans le groupe sous Actilyse par rapport au groupe sous placebo s'est maintenu pendant 6 mois (10,4% contre 13,1%, p = 0,008).
Au cours d'une étude randomisée en double aveugle (721 patients) de comparaison entre Actilyse et un placebo, chez les patients perfusés par Actilyse dans les 5 heures après le début de l'apparition des symptômes, la fonction ventriculaire gauche a été meilleure 10 – 22 jours plus tard que chez les patients dans le groupe sous placebo, lorsque la fraction d'éjection globale a été déterminée par ventriculographie de contraste (50,7 % contre 48,5 %, p = 0,01). Chez les patients traités par Actilyse, l'infarctus a été réduit significativement de 20 % [détermination par l'activité cumulée de la HBD-(α-hydroxybutyrate déshydrogénase)] par rapport aux patients traités par le placebo (p = 0,001). Chez les patients traités par Actilyse, les épisodes de choc cardiogénique, de fibrillation ventriculaire et de péricardite ont été moins nombreux. En outre, la mortalité à 14 jours a été réduite à 2,8% chez les patients traités par Actilyse contre 5,7% chez les patients sous placebo (non significatif). Dans le groupe sous Actilyse, 6 patients ont souffert d'un accident vasculaire cérébral hémorragique documenté et 1 patient d'un accident vasculaire cérébral ischémique, alors qu'aucun accident vasculaire cérébral n'a été noté sous placebo. Ces résultats n'apportent pas de preuve claire d'une réduction significative de la mortalité au cours de cette étude, mais indiquent une tendance, étayée par les données de l'étude ASSET.
Au cours d'une étude contrôlée contre placebo (LATE) menée auprès de 5711 patients avec infarctus aigu du myocarde et un début des symptômes remontant de 6 à 24 heures, la perfusion de 100 mg d'Actilyse pendant 3 heures a été comparée à un placebo. Sous Actilyse, une réduction non significative de 14,1 % de la mortalité à 30 jours (IC à 95%: 0 – 28,1 %; p > 0,05) a été notée. Au cours d'une analyse demandée par un steering committee sur la survie des patients traités dans les 12 heures suivant le début de l'apparition des symptômes, une réduction significative de la mortalité de 25,6 % en faveur d'Actilyse (IC à 95 %: 6,3 – 45 %; p = 0,023) a été observée.
Patients avec embolie pulmonaire massive aiguë
Au cours d'une étude comparative randomisée entre l'altéplase et l'urokinase menée auprès de 63 patients avec embolie pulmonaire aiguë massive documentée par angiographie, une réduction significative de l'hypertension pulmonaire causée par l'embolie pulmonaire a été notée dans les deux groupes de traitement. La pression artérielle pulmonaire moyenne (PAPm) a diminué dans les deux groupes de 28±7 mm Hg à 17±6 mm Hg dans les 12 heures. L'hémodynamique pulmonaire s'est améliorée significativement plus vite sous Actilyse que sous urokinase (traitement x temps – interaction: p = 0,0006).
Patients avec accident vasculaire cérébral ischémique aigu
Plusieurs études ont été réalisées sur l'accident vasculaire cérébral ischémique aigu. L'étude NINDS est la seule à avoir été menée sans limite d'âge supérieure, elle intègre donc également des patients de plus de 80 ans. Toutes les autres études ont exclu les patients de plus de 80 ans. Le bénéfice d'une thrombolyse chez les patients présentant un accident vasculaire cérébral ischémique aigu doit être soupesé individuellement par rapport aux risques escomptés.
Deux études en double aveugle contrôlées contre placebo (NINDS t-PA Stroke Trial, parties 1 et 2) ont inclus des patients avec des déficits neurologiques mesurables, ayant passé un criblage dans les 3 heures après le début des symptômes et pouvant commencer le traitement. Avant le traitement, une tomographie computorisée (TC) du crâne a été réalisée afin d'exclure une hémorragie intracrânienne symptomatique. En outre, les patients présentant des troubles associés à une élévation du risque hémorragique, un faible déficit neurologique, un tableau symptomatique en voie d'amélioration rapide avant le début du traitement ou une glycémie sanguine < 50 mg/dl ou > 400 mg/dl ont été exclus. Les patients ont été randomisés pour un traitement par 0,9 mg/kg d'Actilyse (maximal 90 mg) ou par un placebo. Actilyse a été administré en bolus initial de 10 % de la dose pendant 1 minute, puis par perfusion intraveineuse longue pendant 60 minutes pour le reste de la dose.
L'étude initiale (NINDS, partie 1, n = 291) a évalué l'amélioration neurologique 24 heures après l'apparition de l'accident vasculaire cérébral. Concernant le critère primaire d'évaluation, la proportion de patients avec une amélioration du score sur l'échelle de l'accident vasculaire cérébral du National Institute of Health (échelle NIHSS) de 4 points ou plus ou un rétablissement complet (score NIHSS = 0), les résultats des deux groupes de traitement n'ont pas été significativement différents. Une analyse secondaire a montré, à l'aide des échelles suivantes destinées à l'évaluation de l'accident vasculaire cérébral, un meilleur résultat thérapeutique après 3 mois avec le traitement par Actilyse: index de Barthel, échelle modifiée de Rankin (mRS), Glasgow Outcome Scale et échelle NIHSS. Au cours d'une deuxième étude (NINDS, partie 2, n = 333), le critère d'évaluation primaire a été le résultat du traitement après 3 mois. Un résultat thérapeutique positif a été défini comme un handicap minimal ou une absence de handicap sur les quatre échelles utilisées pour l'évaluation de l'accident vasculaire cérébral: index de Barthel (nombre de points ≥95), échelle modifiée de Rankin (nombre de points ≤1), Glasgow Outcome Scale (nombre de points = 1) et échelle NIHSS (nombre de points ≤1). Le odds-ratio pour un résultat thérapeutique positif a été de 1,7 dans le groupe sous Actilyse (IC à 95 %: 1,2 – 2,6). Par rapport au placebo, l'augmentation absolue du nombre de patients avec un handicap minimal ou une absence de handicap a été de 13 % (mRS 0 - 1) (OR: 1,7; IC à 95 %: 1,1 – 2,6). De plus, un bénéfice a été observé sous Actilyse avec d'autres échelles neurologiques et d'invalidité. Les analyses secondaires montrent toutes, sur les quatre échelles utilisées pour l'évaluation de l'accident vasculaire cérébral (médianes des scores), une amélioration fonctionnelle et neurologique. Ces résultats indiquent une forte concordance avec les données recueillies au bout de 3 mois sur l'effet du traitement dans la première partie de l'étude. Après le traitement par Actilyse, un nombre significativement plus important d'hémorragies intracrâniennes symptomatiques (selon la définition NINDS) a été noté dans les 36 heures par rapport au placebo (Actilyse 6,4 %; placebo 0,65 %). Par contre, chez les patients traités par Actilyse, ni une élévation de la mortalité à 90 jours n'a été observée ni une élévation de l'incidence des handicaps sévères (Actilyse 20,5 %; placebo 17,3 %).
Une analyse compilée de 2775 patients issus de 6 grandes études cliniques randomisées (NINDS parties 1 et 2, deux études ECASS et ATLANTIS parties A et B) a examiné le degré de handicap des patients traités par Actilyse ou par le placebo. À l'issue de cette analyse, il est apparu que la probabilité d'un résultat thérapeutique positif après 3 mois augmentait de manière inversement proportionnelle à la durée jusqu'au traitement par Actilyse. Les hémorragies intracrâniennes symptomatiques ont été de 5,9 % chez les patients traités par Actilyse contre 1,1 % dans le groupe témoin (p < 0,0001) et ont montré une relation avec l'âge, mais pas avec la durée jusqu'au traitement. Cette analyse étaye fortement le fait qu'un traitement rapide par Actilyse est associé à de meilleurs résultats thérapeutiques après 3 mois. De plus, elle apporte la preuve que la fenêtre thérapeutique peut être étendue jusqu'à 4,5 heures.
Au cours d'une grande étude d'observation (SITS-MOST: The Safe Implementation of Thrombolysis in Stroke-Monitoring Study), la sécurité et l'efficacité d'Actilyse dans le traitement dans les 3 heures de l'accident vasculaire cérébral aigu ont été évaluées lors de la pratique quotidienne clinique. Les résultats ont été comparés avec ceux issus d'études cliniques randomisées (RCT). Les conditions figurant dans l'information professionnelle européenne (EU-SPC) d'Actilyse devaient être respectées chez tous les patients. Les données relatives au traitement et à l'évolution de la condition de 6483 patients issus de 285 centres dans 14 pays européens ont été collectées. Le critère d'évaluation primaire a été constitué par les hémorragies intracrâniennes symptomatiques dans les 24 h et la mortalité après 3 mois. Le taux d'hémorragies intracrâniennes symptomatiques observé lors de l'étude SITS-MOST au jour 7 a été similaire à celui des études randomisées: 7,3 % (IC à 95%: 6,7 – 8,0) dans l'étude SITS-MOST contre 8,6 % (IC à 95%: 6,1 – 11,1) dans les RCT. La mortalité a été de 11,3 % (IC à 95%: 10,5 – 12,1) au cours de l'étude SITS-MOST contre 17 % (IC à 95%: 13,9 – 20,7) dans les RCT. Les résultats de l'étude SITS-MOST indiquent que l'utilisation d'Actilyse dans les 3 heures après l'apparition de l'accident vasculaire cérébral est aussi sûre dans la pratique clinique en routine que lors des études cliniques.
L'étude ECASS-III était une étude en double aveugle contrôlée contre placebo menée auprès de patients avec accident vasculaire cérébral aigu et une fenêtre temporelle de traitement de 3 à 4,5 heures. L'étude a inclus des patients avec des déficits neurologiques mesurables et pour lesquels les conditions de l'information professionnelle européenne (EU-SPC) ont pu être respectées, à l'exception de la fenêtre temporelle. Après exclusion d'une hémorragie cérébrale ou un infarctus plus important par tomographie computorisée, les patients avec accident vasculaire cérébral ischémique aigu ont été randomisés (1:1) et traités en double aveugle soit par altéplase par voie intraveineuse (0,9 mg/kg de poids corporel), soit par le placebo. Le critère d'évaluation primaire a été le handicap après 90 jours, classé en évolution favorable (modifié d'après l'échelle de Rankin [mRS] 0 à 1) ou défavorable (mRS 2 à 6). Le principal critère secondaire a été une analyse de l'évolution globale à l'aide d'une combinaison de quatre échelles neurologiques et d'invalidité. Les critères d'évaluation de la sécurité comprennent la mortalité, les hémorragies intracrâniennes symptomatiques et les événements indésirables sévères. Au total, 821 patients (418 sous altéplase/403 sous placebo) ont été randomisés. Le nombre de patients avec un résultat favorable a été plus important sous altéplase (52,4 %) que sous placebo (45,2 %; odds-ratio [OR]: 1,34; IC à 95% 1,02 – 1,76; p = 0,038). L'analyse globale a également montré un meilleur résultat thérapeutique sous altéplase (OR: 1,28; IC à 95%: 1,00 – 1,65; p = 0,048). Les patients traités par altéplase ont montré une plus forte incidence d'hémorragies intracrâniennes (symptomatiques / non symptomatiques) que ceux sous placebo (hémorragies intracrâniennes totales: 27,0 % contre 17,6 %, p = 0,0012; hémorragies intracrâniennes symptomatiques selon la définition NINDS: 7,9 % contre 3,5 %, p = 0,006); hémorragies intracrâniennes symptomatiques selon la définition ECASS-III 2,4% versus 0,2%, p = 0,008). La mortalité a été faible et n'a pas été significativement différente sous altéplase (7,7 %) par rapport au placebo (8,4 %; p = 0,681). Les résultats de l'étude ECASS-III montrent qu'Actilyse, administré entre 3 et 4,5 heures après le début de l'apparition des symptômes, améliore significativement l'évolution clinique chez les patients avec accident vasculaire cérébral ischémique aigu.
La sécurité et l'efficacité d'Actilyse dans le traitement de l'accident vasculaire cérébral ischémique aigu avec une fenêtre temporelle allant jusqu'à 4,5 heures entre les premiers symptômes et le début du traitement (onset to treatment time, OTT) ont été examinées sur la base d'un registre en cours sur les accidents vasculaires cérébraux ischémiques aigus (SITS-ISTR: The Safe Implementation of Thrombolysis in Stroke registry). Les données relatives au résultat primaire du traitement et à la mortalité issues de 21566 patients traités dans une fenêtre temporelle de 0 à 3 heures ont été comparées à celles issues de 2376 patients traités 3 à 4,5 heures après l'apparition de l'accident vasculaire cérébral ischémique aigu (données de 2010). L'incidence des hémorragies intracérébrales symptomatiques (selon la définition SITS-MOST) était légèrement plus élevée avec la fenêtre temporelle de 3 à 4,5 heures (2,2 %) qu'avec la fenêtre de 3 heures (1,7 %). Le taux de mortalité après 3 mois était comparable entre la fenêtre de 3 à 4,5 heures (12,0 %) et celle de 0 à 3 heures (12,3 %).
Patients âgés (> 80 ans)
Des méta-analyses ajustées des données de 6 756 patients, dont des patients âgés de plus de 80 ans, ayant participé à neuf études randomisées comparant l'altéplase à un placebo ou contrôlés en ouvert, ont été utilisées pour évaluer le rapport bénéfice/risque de l'altéplase chez des patients > 80 ans.
L'effet du traitement par altéplase était similaire pour les patients âgés de 80 ans ou moins [délai moyen de traitement 4,1 heures: 990/2 512 (39 %) patients traités par altéplase vs 853/2 515 (34 %) patients du groupe contrôle qui ont eu une évolution favorable après un accident vasculaire cérébral au jour 90/180; OR: 1,25, IC à 95 %: 1,10 - 1,42] et les patients âgés de plus de 80 ans [délai de traitement moyen 3,7 heures: 155/879 (18 %) patients traités par altéplase vs 112/850 (13 %) patients du groupe contrôle qui ont eu une évolution favorable; OR: 1,56, IC à 95 %: 1,17 - 2,08].
Chez les patients âgés de plus de 80 ans traités par altéplase dans les 3 heures ou moins après l'événement, une évolution favorable était retrouvée chez 55/302 patients (18,2 %) par comparaison avec 30/264 patients (11,4 %) dans le groupe contrôle (OR: 1,86, IC à 95 %: 1,11 -3,13); chez les patients traités par altéplase dans les 3 à 4,5 heures après l'événement, 58/342 (17,0 %) des patients ont eu une évolution favorable par comparaison avec 50/364 (13,7 %) patients dans le groupe contrôle (OR: 1,36, IC à 95 %: 0,87 - 2,14).
Une autre méta-analyse effectuée sur la base de la même banque de données avec une cohorte de patients remplissant les critères de sélection dans l'information professionnelle, a montré que la probabilité d'une évolution favorable après un accident vasculaire cérébral (score mRS de 0 à 1 au jour 90/180) était augmentée jusqu'à 4,5 heures après l'apparition des symptômes de l'accident vasculaire cérébral, le bénéfice étant meilleur lorsque les patients étaient traités plus tôt (p = 0,0203 pour l'interaction) et indépendant de l'âge (p = 0,7383).
Dans les 7 jours suivant l'administration de l'altéplase, une hémorragie parenchymateuse de type 2 est survenue chez 231 (6,8 %) sur 3 391 patients; dans le groupe contrôle, le chiffre était de 44 (1,3 %) sur 3 365 patients (OR: 5,55, IC à 95 %: 4,01 - 7,70).
Dans les 7 jours suivant l'administration de l'altéplase, une hémorragie parenchymateuse de type 2 d'évolution fatale est survenue chez 91 (2,7 %) patients; dans le groupe contrôle, le chiffre était de 13 (0,4 %) patients (OR: 7,14, IC à 95 %: 3,98 - 12,79).
Chez les patients âgés de plus de 80 ans traités par altéplase, une hémorragie intracrânienne d'évolution fatale est survenue dans les 7 jours après traitement chez 32/879 (3,6 %) patients par comparaison avec 4/850 (0,5 %) patients du groupe contrôle (OR: 7,95, IC à 95 %: 2,79 - 22,60).
Chez les patients âgés de 80 ans ou moins traités par altéplase, une hémorragie intracrânienne d'évolution fatale est survenue dans les 7 jours après traitement chez 59/2 512 (2,3 %) patients par rapport à 9/2 515 (0,4 %) patients du groupe contrôle (OR: 6,93, IC à 95 %: 3,42 -14,02).
Chez les patients de plus de 80 ans souffrant d'un accident vasculaire cérébral ischémique aigu, un risque accru d'un résultat défavorable existe en raison de leur âge et d'une valeur initiale NIHSS plus élevée.
Chez ces patients, le traitement par l'altéplase augmente la probabilité d'une évolution favorable (score mRS de 0 à 1) au jour 90/180 sans augmentation de la mortalité au bout de 90 jours par comparaison avec le groupe contrôle (267/879 [30,4 %] par rapport à 259/850 [30,5 %], OR: 0,95, IC à 95 %: 0,76 - 1,18).
Indépendamment du traitement, la mortalité au bout de 90 jours est inférieure (341/2 512 [13,6 %] dans le groupe de patients plus jeunes (≤80 ans) pour les patients ≤80 ans traités par l'altéplase par rapport à 297/2 515 [11,8 %] pour le groupe contrôle ≤80 ans, OR: 1,25, IC à 95 %: 1,5 - 1,49).
Dans la population plus âgée (> 80 ans) souffrant d'accident vasculaire cérébral ischémique aigu traitée par l'altéplase, une hémorragie intracrânienne symptomatique est survenue chez 78 patients sur 879 (8,9 %) par comparaison avec 17 patients sur 850 (2 %) dans le groupe contrôle (OR: 4,80, IC à 95 %: 2,81 - 8,20).
Dans la population plus jeune (≤80 ans) souffrant d'accident vasculaire cérébral ischémique aigu traitée par l'altéplase, une hémorragie intracrânienne symptomatique est survenue chez 153 patients sur 2 512 (6,1 %) par comparaison avec 27 patients sur 2 515 (1,1 %) dans le groupe contrôle (OR: 6,20, IC à 95 %: 4,09 - 9,38).
Le registre SITS-ISTR porte sur 8 658 patients > 80 ans et traités < 4,5 heures après le début d'un accident vasculaire cérébral. Les données de 2 157 patients traités dans la fenêtre > 3 à 4,5 heures après le début de l'accident vasculaire cérébral ont été comparées à celles de 6 501 patients traités < 3 heures.
L'indépendance fonctionnelle à 3 mois (score mRS de 0 à 2) était de 36 %, resp. 37 % (OR ajusté: 0,79, IC à 95 %: 0,68 -0,92), la mortalité était de 29,0 %, resp. 29,6 % (OR ajusté: 1,10, IC à 95 %: 0,95 - 1,28) et l'HICs (selon la définition de SITS-MOST) était de 2,7 %, resp. 1,6 % (OR ajusté: 1,62, IC à 95 %:1,12 - 2,34).
Enfants et adolescents
Des données émanant d'une étude de registre non-randomisée et non comparative portant sur des patients âgés de 16 à 17 ans présentant un accident vasculaire cérébral avec la confirmation d'un traitement par l'altéplase, ont été obtenues à partir du registre SITS-ISTR (Safe Implementation of Treatments in Stroke - International Stroke Thrombolysis Register, un registre international indépendant).
Lors d'une analyse intermédiaire de l'étude de registre en cours, les données d'un total de 32 patients pédiatriques avec utilisation confirmée d'altéplase dans la catégorie d'âge de 16 à 17 ans ont été enregistrées dans le registre SITS. La dose médiane d'altéplase utilisée dans cette catégorie d'âge était de 0,9 mg/kg (0,83 - 0,99 mg/kg). Chez 30 patients sur 32, le traitement a été instauré dans une fenêtre de 4,5 heures après survenue des premiers symptômes d'accident vasculaire cérébral (22 dans les 3 h; 8 dans les 3 à 4,5 h; 1 dans les 5 à 5,5 h; 1 cas: pas de données). Le poids corporel des patients était compris entre 58 et 90 kg. La plupart des patients présentaient, au départ, un accident vasculaire cérébral modéré ou modéré à sévère avec un score NIHSS médian de 9,0 (1 - 30).
Les scores mRS étaient disponibles pour 24 patients sur 32 au 90e jour. Au 90e jour, 16 patients sur 24 présentaient un score mRS de 0 à 1 (aucun symptôme ou pas de handicap significatif) et 5 autres patients présentaient un score mRS=2 (léger handicap). Cela signifie que 21 patients sur 24 (pratiquement 90 %) ont eu un résultat favorable au 90e jour selon le score mRS. L'issue du traitement rapportée pour les 3 patients restants était soit un handicap modérément sévère (mRS =3; n=1), un handicap modéré à sévère (mRS=4; n=1), resp. le décès (mRS=6; n=1) dans les 7 jours.
Pour sept patients, le score mRS n'a pas été rapporté au 90e jour. Les dernières informations disponibles ont montré que 3 patients sur 7 avaient un score mRS=2 le 7e jour, 3 patients sur 7 ont rapporté une nette amélioration globale le 7e jour et 1 patient sur 7 avec un accident vasculaire cérébral modérément sévère à sévère au début de l'étude avec un score mRS=4 le 7e jour.
Le registre disposait également de données de sécurité sur les effets secondaires hémorragies et œdème cérébral chez 31 patients sur 32. Sur les 31 patients dans cette catégorie d'âge de 16 à 17 ans, aucun n'a eu d'hémorragie intracérébrale symptomatique (HICs, HIC de type PH2). Cinq cas ont développé un œdème cérébral après le traitement par l'altéplase. Sur ces 5 patients, 4 avaient soit un score mRS compris entre 0 et 2 au 90me jour, soit présentaient une amélioration globale au 7e jour après le traitement. Un patient avait un score mRS=4 (handicap modérément sévère à sévère) rapporté au 90e jour. Aucun de ces cas n'a été d'issue fatale.
En résumé, il y avait 31 cas rapportés dans le registre SITS concernant des patients âgés de 16 à 17 ans ayant présent un accident vasculaire cérébral ischémique aigu et ayant été traités par l'altéplase selon les recommandations données pour les adultes. Malgré le faible nombre de cas ne permettant pas d'effectuer une analyse statistique, les résultats globaux montrent une tendance positive à l'utilisation de la dose adulte respective chez ces patients. Par comparaison avec les adultes, les données ne semblent pas montrer de risque accru d'hémorragies intracérébrales symptomatiques ou d'œdèmes.
PharmacocinétiqueAbsorption
Le temps de demi-vie T½ alpha pertinente est de 3,5 à 5 minutes, ce qui signifie qu'après 20 minutes, moins de 10 % de la dose administrée se retrouvent dans le plasma.
Distribution
Le volume de distribution est de 2,8 à 4,4 litres (V1), respectivement de 8 à 9 litres (Vss).
Métabolisme/Élimination
L'altéplase est rapidement éliminé de la circulation sanguine et est principalement métabolisé par le foie (clairance plasmatique 550-680 ml/min.). Dans des conditions physiologiques, la majeure partie de l'altéplase dans la circulation sanguine est liée à l'inhibiteur. La clairance hépatique de l'altéplase n'est pas limitée par la présence d'autres protéines, y compris les inhibiteurs de l'altéplase. Les complexes d'altéplase et de son inhibiteur sont éliminés sous forme d'altéplase libre.
On a mesuré un temps de demi-vie bêta d'environ 40 minutes pour la fraction résiduelle du compartiment profond.
Données précliniquesLes tests de mutagenèse n'ont pas mis en évidence de potentiel mutagène.
Aucun effet tératogène n'a été observé après perfusion intraveineuse de doses pharmacologiquement actives chez des animaux gravides. L'administration de plus de 3 mg/kg/jour a induit une embryotoxicité (mortalité embryonnaire, retard de croissance) chez les lapins. Chez les rats, aucun effet sur le développement périnatal et postnatal ou sur les paramètres de fertilité n'a été observé à des doses allant jusqu'à 10 mg/kg/jour.
Remarques particulièresIncompatibilités
Actilyse ne doit pas être mélangé avec d'autres médicaments, ni dans le même flacon de perfusion ni par la même voie veineuse (également valable pour l'héparine).
Stabilité/Remarques particulières concernant le stockage
Conserver la poudre lyophilisée jusqu'à sa préparation à l'abri de la lumière dans son emballage d'origine et à une température ne dépassant pas 25 °C. Conserver hors de la portée des enfants.
Une stabilité chimique et physique de 24 heures à 2-8 °C et de 8 heures à 30 °C a été démontrée pour la solution reconstituée.
En raison des risques de contamination microbiologique, il est recommandé d'utiliser la solution immédiatement après sa reconstitution. Si la reconstitution a été effectuée dans des conditions d'asepsie, la conservation ne doit généralement pas excéder 24 heures à 2-8 °C.
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques concernant la manipulation
Utilisation correcte:
Le contenu d'un flacon de poudre d'Actilyse (10 mg, 20 mg ou 50 mg) est dissous dans des conditions aseptiques dans de l'eau pour préparations injectables fournie dans l'emballage (10 ml, 20 ml ou 50 ml, en fonction du volume du flacon d'Actilyse) à une concentration de 1 mg d'Actilyse par ml. Une canule de transfert est fournie à cet effet avec les présentations de 20 mg et 50 mg. Pour la présentation de 10 mg, une seringue stérile doit être utilisée.
Instructions pour la reconstitution d'Actilyse
|
1
|
Reconstituez immédiatement avant administration.
|
|
| |
2
|
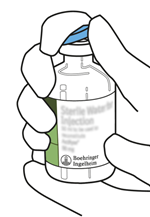
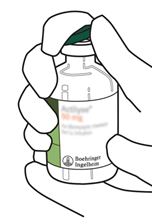
Retirez le capuchon protecteur des deux flacons contenant l'eau pour préparations injectables stérilisée et la poudre d'Actilyse, en soulevant les capuchons avec le pouce.
|
|
|
| |
3
|
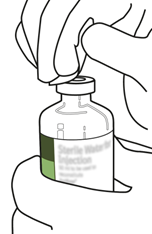
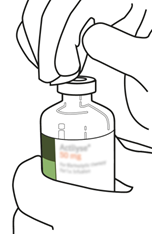
Désinfectez le bouchon en caoutchouc de chaque flacon à l'aide d'un tampon imbibé d'alcool.
|
|
|
| |
4
|
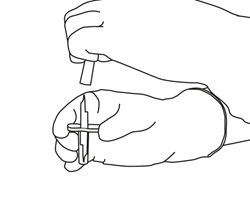
Sortez la canule de transfert* de son étui. Ne désinfectez pas ou ne stérilisez pas la canule de transfert, elle est déjà stérile. Retirez l'un de ses capuchons.
(*Si une canule de transfert est incluse dans la boîte. La reconstitution peut aussi être faite avec une seringue et une aiguille.)
|
|
| |
5
|
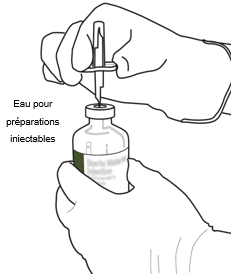
Tenez le flacon contenant l'eau pour préparations injectables stérilisée en position verticale et sur une surface stable. Percez le bouchon en caoutchouc avec la pointe de la canule de transfert, de façon verticale et bien au centre du bouchon, en pressant doucement, mais fermement, sans tourner.
|
|
| |
6
|
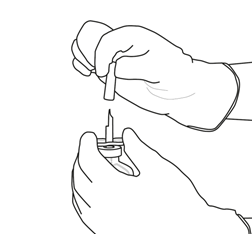
Tenez fermement le flacon contenant l'eau pour préparations injectables stérilisée et la canule de transfert avec une seule main, à l'aide des deux rabats de chaque côté de la canule.
Retirez le capuchon restant sur le dessus de la canule de transfert.
|
|
| |
7
|
Tenez fermement le flacon contenant l'eau pour préparations injectables stérilisée et la canule de transfert avec une seule main, à l'aide des deux rabats de chaque côté de la canule.
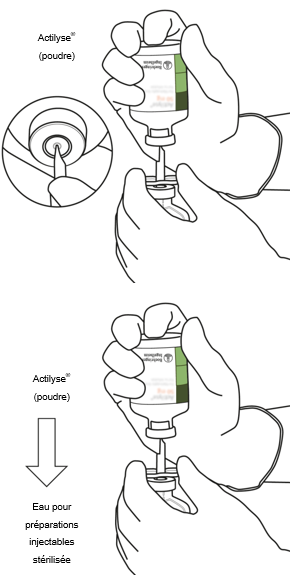
Prenez le flacon d'Actilyse contenant la poudre et tenez-le verticalement au-dessus de la canule de transfert en positionnant l'extrémité pointue de la canule de transfert bien au centre du bouchon.
Poussez verticalement le flacon contenant la poudre sur la canule de transfert et percez le bouchon en caoutchouc de façon verticale en pressant doucement, mais fermement, sans tourner.
|
|
| |
8
|
Retournez ensemble les deux flacons de manière à ce que l'eau pour préparations injectables puisse remplir complètement le flacon contenant la poudre.
|
|
| |
9
|
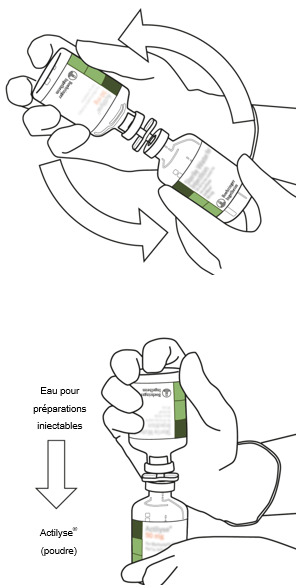
Retirez le flacon vide qui contenait l'eau pour préparations injectables stérilisée en même temps que la canule de transfert et jetez-les.
|
|
| |
10
|
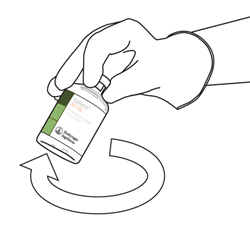
Prenez le flacon contenant la solution reconstituée d'Actilyse et tournez doucement jusqu'à dissoudre tout reste de poudre, mais ne secouez surtout pas, cela produirait de la mousse.
En cas de formation de bulles, laissez la solution reposer quelques minutes et attendez la disparition des bulles.
|
|
|

| |
11
|
La solution reconstituée contient 1 mg/ml d'Actilyse. Elle doit être claire et incolore, voire jaune pâle et ne doit pas contenir de particules.
| |
12
|
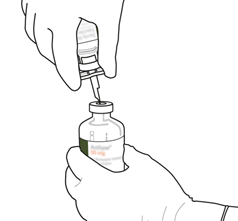
Prélevez la quantité nécessaire en utilisant uniquement une aiguille et une seringue stériles.
N'utilisez pas le même trou de perforation que celui de la canule de transfert pour éviter toute fuite.
|
|
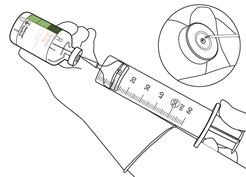
| |
13
|
Utilisez immédiatement.
Jetez la solution non utilisée.
|
La solution reconstituée de 1 mg/ml peut être diluée davantage avec une solution injectable stérile de chlorure de sodium de 9 mg/ml (0,9 %) jusqu'à une concentration minimale de 0,2 mg/ml, la survenue d'une turbidité de la solution reconstituée ne pouvant être exclue.
Une nouvelle dilution de la solution reconstituée de 1 mg/ml avec de l'eau pour préparations injectables ou l'utilisation de solutions glucosées pour perfusion (p.ex. dextrose), n'est pas recommandée en raison d'une formation accrue de turbidité.
Actilyse ne doit pas être mélangé avec d'autres médicaments, ni dans le même flacon de perfusion ni par la même voie veineuse (également valable pour l'héparine).
Pour garantir un dosage précis, Actilyse doit être administré au moyen de perfuseurs/de pompes à perfusion. À défaut, on pourra utiliser un autre dispositif de perfusion à condition que celui-ci garantisse un réglage précis du débit de la perfusion.
Pour que le patient reçoive bien la dose entière d'Actilyse, on limitera au minimum le volume résiduel dans le dispositif de perfusion.
Numéro d’autorisation48313 (Swissmedic)
PrésentationEmballage de 1 flacon à 10 mg de principe actif et 1 flacon de 10 ml d'eau pour préparations injectables.
Emballage de 1 flacon à 20 mg de principe actif et 1 flacon de 20 ml d'eau pour préparations injectables.
Emballage de 1 flacon à 50 mg de principe actif et 1 flacon de 50 ml d'eau pour préparations injectables.
Catégorie de délivrance: B
Titulaire de l’autorisationBoehringer Ingelheim (Schweiz) GmbH, Bâle
Mise à jour de l’informationFévrier 2024
|














