Propriétés/EffetsCode ATC
H01AC01
Mécanisme d'action/Pharmacodynamique
Genotropin contient de la somatropine (r-hGH), une hormone polypeptidique formée de 191 acides aminés, de composition chimique et de structure strictement identiques à celles de l'hormone de croissance humaine d'origine hypophysaire. La somatropine est obtenue par recombinaison génétique et synthétisée sous une forme extra pure dans E. coli.
La somatropine stimule la croissance chez les enfants dont la production endogène d'hormone de croissance est insuffisante. Son action repose sur la stimulation des facteurs de croissance analogues à l'insuline (IGF, somatomédine).
En plus de son effet sur la croissance, la somatropine stimule la division cellulaire, l'assimilation des acides aminés, la synthèse des protéines et la lipolyse. Elle diminue également la mobilisation glucidique (effet anti-insulinique).
La somatropine augmente les concentrations sériques d'IGF-I et d'IGFBP3 (Insulin-like Growth Factor Binding Protein 3).
Un apport externe de somatropine n'aura aucun effet thérapeutique si le retard de la croissance est dû à une incapacité de produire l'IGF (somatomédine) ou à une absence de ses récepteurs.
Efficacité clinique
L'efficacité et l'innocuité de Genotropin dans le traitement des enfants avec retard de croissance intra-utérin (SGA) ont été étudiées dans 4 essais randomisés ouverts. Les schémas thérapeutiques étaient variables d'un essai à l'autre et incluaient dans certains groupes des intervalles sans traitement. Pendant les 24 premiers mois de traitement, les enfants âgés de 2 à 9 ans ont reçu des doses de 0.033 mg/kg/d, 0.067 mg/kg/d ou 0.1 mg/kg/d. Pendant les 48 mois suivants, les doses étaient soit de 0.033 mg/kg/d, soit de 0.067 mg/kg/d.
Modification de l'écart type de la taille corporelle dans chaque groupe de traitement du stade initial jusqu'à 72 mois. Moyenne ± erreur type de la moyenne.
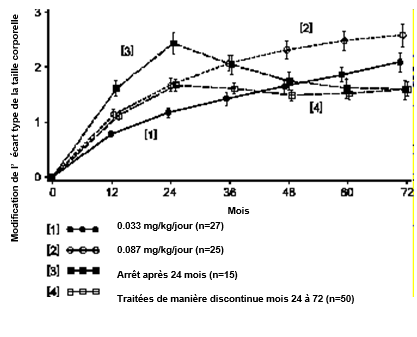
La figure montre que le traitement continu pendant 72 mois est efficace et dose-dépendant. L'écart type de la taille corporelle accuse une nouvelle diminution entre les mois 24 et 72 chez les patients traités seulement pendant les 24 premiers mois. L'écart type de la taille corporelle est resté plus ou moins inchangé chez les patients traités de manière discontinue après les 24 premiers mois. Une interruption du traitement a conduit à une perte de l'avantage de croissance.
Genotropin influence de la manière suivante les effets dus à un déficit en hormone de croissance chez l'adulte
Aucun des paramètres mentionnés n'a été prouvé sans équivoque dans des études en double aveugle, validées statistiquement. Ces paramètres représentent une description des données recueillies auprès d'un total de 110 patients inclus dans 2 études contrôlées et poolées ainsi que dans 3 études non contrôlées.
·Adiposité centrale: est légèrement diminuée.
·Masse non graisseuse: est légèrement augmentée.
·Masse de graisse totale: reste inchangée.
·Densité minérale osseuse (DMO): une légère réduction initiale est suivie en règle générale, au bout de 1-2 ans, d'une augmentation. Il n'existe pas de données concernant les fractures.
·Lipides plasmatiques: baisse du cholestérol total et du cholestérol LDL, élévation du HDL. La signification clinique de ces modifications n'est pas élucidée.
·Force musculaire et performance cardiovasculaire: aucune influence.
·Qualité de vie subjective: influence variable insignifiante.
·À propos de la mortalité (totale et cardiovasculaire), on ne dispose d'aucune donnée.
| 
