CompositionPrincipe actif
Inhibiteur de la C1 estérase issu du plasma humain.
Excipients
Glycine, chlorure de sodium, citrate de sodium (correspond à ≤2,1 mmol ou ≤49 mg de sodium). Solvant: Aqua ad inject.: 10 ml.
Indications/Possibilités d’emploiAngio-œdème héréditaire
·Thérapie des crises aiguës
·Prophylaxie avant des interventions chirurgicales
Posologie/Mode d’emploiPosologie usuelle
Le traitement doit être effectué et supervisé par un médecin expérimenté dans le traitement de la déficience en inhibiteur de la C1 estérase.
Dose unitaire
20 unités internationales/par kg de poids corporel.
Afin d'assurer la traçabilité des médicaments d'origine biologique, il convient de documenter pour chaque traitement le nom commercial et le numéro de lot.
Enfants et adolescents
La posologie chez l'enfant et l'adolescent est la même que chez l'adulte. L'injection peut être répétée en fonction de l'état clinique du patient.
Mode d'administration
La solution est injectée lentement par voie intraveineuse (i.v.), par exemple à l'aide d'une pompe à perfusion (4 ml/min) ou pendant une période de 5 à 10 min.
Contre-indicationsHypersensibilité au principe actif ou à l'un des excipients suivant la composition.
Capillary Leak Syndrome (CLS).
Mises en garde et précautionsPrécautions
Les patients qui ont des réactions allergiques connues à la préparation recevront en prophylaxie des antihistaminiques et des corticostéroïdes. Si des réactions de type allergo-anaphylactoïde se présentent, cesser immédiatement l'apport de Berinert IV (par ex. en interrompant la perfusion) et instaurer un traitement adéquat.
Les mesures thérapeutiques dépendent du type et de la sévérité des effets secondaires. Suivre les directives médicales actuelles pour le traitement d'un choc.
Les patients ayant un œdème du larynx feront l'objet d'une surveillance toute particulière et il faut se tenir prêt à devoir agir en urgence.
Berinert IV a été employé à des doses très élevées lors de tentatives de prévention ou de thérapie d'un «Capillary Leak Syndrome» (CLS), avant, pendant ou après une opération du cœur sous assistance d'un appareil cardiorespiratoire (indication et dosage non approuvés). Dans certains cas, on a rapporté la formation de thrombose, pouvant être mortelle. Cette administration est par conséquent contre-indiquée. Pour toute information complémentaire sur le risque de thrombose (notamment la fréquence), cf. «Effets indésirables».
Berinert IV contient ≤2,1 mmol (49 mg) de sodium par flacon, ce qui correspond à 2,5 % de l'apport quotidien maximal de 2 g pour un adulte, préconisé par l'OMS.
Traitement à domicile et auto-administration
Les données concernant l'utilisation de la préparation pour le traitement à domicile ou l'auto-administration sont limitées. Lors du traitement à domicile les risques d'une réaction d'hypersensibilité doivent être pris en compte. La décision de traiter à domicile doit être prise au cas par cas par le médecin traitant. Le médecin doit s'assurer qu'une instruction adéquate est effectuée et que l'administration correcte est contrôlée régulièrement.
Sécurité virale
Berinert IV est produit à partir de plasma humain. Les mesures habituelles de prévention du risque de transmission d'agents infectieux par les médicaments préparés à partir de sang ou de plasma humain comprennent la sélection clinique des donneurs, la recherche des marqueurs spécifiques d'infection sur chaque don et sur les pools de plasma et l'inclusion dans le procédé de fabrication d'étapes efficaces pour l'inactivation/l'élimination virale. Cependant, lorsque des médicaments préparés à partir de sang ou de plasma humain sont administrés, le risque de transmission d'agents infectieux ne peut pas être totalement exclu. Ceci s'applique également aux virus inconnus ou émergents ou à d'autres types d'agents infectieux. Les mesures mises en place sont considérées comme efficaces vis-à-vis des virus enveloppés tels que par ex. le virus de l'immunodéficience humaine (VIH), le virus de l'hépatite B (VHB) et le virus de l'hépatite C (VHC) ainsi que pour certains virus non enveloppés tels que par ex. le virus de l'hépatite A (VHA) et le parvovirus B 19.
Une vaccination préventive contre l'hépatite A et B sera recommandée aux patients qui reçoivent régulièrement des préparations d'inhibiteur de la C1 estérase produites à partir de plasma.
InteractionsAucune étude concernant les interactions médicamenteuses n'a été menée jusqu'à ce jour.
Grossesse, allaitementGrossesse
Berinert IV est un composant physiologique du plasma humain. Le nombre de données est limité, et d'après ces données, on ne peut pas en déduire qu'il y a une augmentation du risque sur la fécondité, sur le cours de la grossesse et sur le développement postnatal lors du traitement avec Berinert IV de la femme enceinte. Berinert IV ne peut être administré pendant la grossesse qu'en cas d'indications explicites.
Allaitement
On ignore si Berinert IV passe également dans le lait maternel. Un transfert de Berinert IV dans le lait maternel est cependant improbable en raison du poids moléculaire élevé. C'est pourquoi Berinert IV ne devrait être administré en période d'allaitement qu'après une évaluation approfondie du rapport bénéfice-risques de son utilisation.
Fertilité
L'inhibiteur de la C1 est un composant physiologique du plasma humain. Aucune étude animale sur la fertilité n'a été menée avec Berinert IV.
Effet sur l’aptitude à la conduite et l’utilisation de machinesAucune étude n'a été menée quant à l'effet sur l'aptitude à la conduite ou à l'utilisation de machines.
Effets indésirablesListe des effets indésirables
Les effets indésirables médicamenteux (EIM) suivants sont basés sur l'analyse de données post-marketing et sur la littérature scientifique. Les effets indésirables sont présentés selon la classification convenue à l'échelle internationale des classes de systèmes d'organes (SOC) du «Dictionnaire médical des affaires réglementaires (MedDRA)» et par catégories de fréquence:
très fréquents: ≥1/10;
fréquents: ≥1/100 à <1/10;
occasionnels: ≥1/1'000 à <1/100;
rares: ≥1/10'000 à <1/1'000;
très rares: <1/10'000
non connus (impossibles à évaluer sur la base des données disponibles).
Troubles du système immunitaire:
Rares: Réactions allergiques anaphylactiques (p.ex. tachycardie, hyper et hypotension, rougeur, urticaire, dyspnée, maux de tête, vertige, nausée)
Très rares: choc
Troubles vasculaires:
Rares: Formation de thromboses (cf. «Mises en garde et précautions»)
Troubles généraux et anomalies au site d'administration:
Rares: Fièvre et/ou réactions au site de ponction
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageAucun cas de surdosage n'a été rapporté.
Propriétés/EffetsCode ATC
B06AC01
Berinert IV est produit à partir de pools de plasma humain provenant de donneurs sains. L'information sur le dépistage des dons et des pools de plasma est décrite au chapitre «Mises en garde et précautions». Le procédé de fabrication de Berinert IV comporte plusieurs étapes contribuant à l'élimination/l'inactivation des virus. Le traitement par la chaleur, de la préparation en solution aqueuse, pendant 10 heures à 60 °C, a été mis en place pour l'inactivation des virus.
Pour une information sur la sécurité virale, voir également le chapitre «Mises en garde et précautions».
Mécanisme d'action
L'inhibiteur de la C1 estérase est une glycoprotéine plasmatique avec un poids moléculaire de 105 kDa et un taux d'hydrate de carbone de 40%. Sa concentration dans le plasma humain est d'environ 240 mg/l. Outre le plasma humain, le placenta, les cellules hépatiques, les monocytes et les thrombocytes contiennent également de l'inhibiteur de la C1 estérase.
Lors d'angio-œdème héréditaire, l'effet thérapeutique de Berinert IV se forme en substituant l'activité de l'inhibiteur de la C1 estérase manquante.
Pharmacodynamique
L'inhibiteur de la C1 estérase fait partie du système inhibiteur serpin (serine protease inhibitors) du plasma humain, comme par ex. l'antithrombine III, l'alpha-2 antiplasmine, l'alpha-1 antitrypsine et d'autres protéines.
En conditions physiologiques, en inactivant les composants enzymatiques C1s et C1r actifs, l'inhibiteur de la C1 estérase bloque la voie classique de l'activation de la cascade du complément. Les enzymes actifs forment un complexe avec l'inhibiteur dans une proportion de 1:1. De plus, l'inhibiteur de la C1 estérase est le plus important inhibiteur de l'activation de contact, dans la mesure où il bloque le facteur XIIa ainsi que ses fragments, et qu'il est, en dehors de l'alpha-2 macroglobuline, l'inhibiteur le plus important de la kallicréine plasmatique.
Efficacité clinique
L'efficacité clinique de Berinert IV a été étudiée dans le cadre de deux essais.
L'efficacité et l'innocuité de Berinert IV pour le traitement des crises abdominales et faciales d'AOH ont été démontrées dans le cadre d'une étude prospective de fixation de dose, comparée contre placebo, randomisée, en double aveugle, multinationale et qui comportait trois groupes cliniques parallèles. Elle a été réalisée auprès de patients adultes et pédiatriques atteints d'une déficience de l'inhibiteur de la C1 estérase (étude CE1145_3001) et est désignée ci-dessous comme étude clinique randomisée (étude RCT). Les patients étaient âgés de 6 à 72 ans et ont été randomisés afin de recevoir soit une dose unique de 10 U.I./kg de poids corporel de Berinert IV (39 patients), une dose unique de 20 U.I./kg de Berinert IV (43 patients) ou une dose unique de placebo (42 patients), administrées par perfusion intraveineuse lente dans les 5 heures suivant une crise d'AOH. Chez les patients traités à raison de 20 U.I./kg de poids corporel de Berinert IV, une réduction statistiquement significative du délai de soulagement des symptômes d'une crise d'AOH évalué par les patients a été démontrée comparativement au groupe traité par le placebo (délai médian de 30 minutes, comparativement à 90 minutes dans le groupe placebo). L'essai mené sur la dose de 10 U.I./kg de poids corporel de Berinert IV n'a pas été poursuivi car l'efficacité ne s'est pas révélée significative comparativement au placebo.
Les effets du traitement observés lors d'une étude de prolongation (étude CE1145_3003) prospective, ouverte, non contrôlée et multicentrique de l'étude RCT concordent avec les données de l'étude RCT.
PharmacocinétiqueLes propriétés pharmacologiques ont été évaluées auprès de 40 patients présentant un angio-œdème héréditaire (dont 6 patients en dessous de 18 ans). Parmi eux, il y avait 15 patients avec des crises fréquentes/graves qui recevaient un traitement prophylactique, ainsi que 25 patients avec des crises moins fréquentes/bénignes et sous traitement si besoin. Les données ont été collectées pendant un intervalle sans symptômes ou lors de troubles bénins.
Absorption
La préparation est appliquée par voie intraveineuse et elle est immédiatement disponible à une dose qui correspond à la concentration plasmatique.
Distribution
La récupération médiane in vivo était de 86,7% (intervalle 54,0–254,1%). Comparativement, elle était légèrement plus élevée chez les enfants (98,2%, intervalle 69,2–106,8%) que chez les adultes (82,5%, intervalle 54,0–254,1%). Les patients souffrant d'attaques graves présentaient un taux de récupération in vivo plus élevé (101,4%) que les patients souffrant d'attaques bénignes (75,8%, intervalle 57,2–195,9%).
L'élévation moyenne de l'activité (médiane) était de 2,3%/U.I./kg de poids corporel (PC) (intervalle 1,4–6,9%/U.I./kg PC). Entre adultes et enfants, aucune différence significative n'a été décelée. Les patients souffrant de crises graves montraient une légère hausse de l'activité comparativement aux patients présentant des crises bénignes (2,9; intervalle: 1,4–6,9 contre 2,1; intervalle: 1,5–5,1%/U.I./kg PC).
La concentration plasmatique maximale de l'activité de la C1 estérase a été atteinte sans différence significative entre les groupes de patients dans les 0,8 heures après l'administration de Berinert IV.
Métabolisme
Aucune donnée disponible.
Élimination
La demi-vie moyenne (médiane) était de 36,1 heures. Elle était légèrement plus courte chez les enfants que chez les adultes (32,9 contre 36,1 h), de même que chez les patients présentant des crises graves par rapport aux patients souffrant de crises bénignes (30,9 contre 37,0 h).
Données précliniquesBerinert IV contient comme substance active de l'inhibiteur de la C1 estérase. Il est dérivé du plasma humain et agit comme un constituant endogène du plasma. Les études de toxicité à dose unique de Berinert IV chez les rats et les souris et à doses répétées chez les rats n'ont montré aucun effet de toxicité.
Les tests de thrombogénicité in vivo chez le lapin ne montrent aucun risque de thrombose après l'administration intraveineuse de l'inhibiteur de la C1 estérase.Aucune étude sur la cancérogénicité et la toxicité pour la reproduction n'a été réalisée.
Remarques particulièresIncompatibilités
Aucune étude de compatibilité n'ayant été effectuée, ce médicament ne doit pas être mélangé à d'autres médicaments.
Stabilité
Berinert IV ne peut être utilisé au-delà de la date de péremption imprimée sur l'emballage et le récipient.
Stabilité après reconstitution
Après reconstitution, la stabilité physico-chimique a été démontrée pendant 48 heures à la température ambiante (max. 30 °C). Pour des raisons microbiologiques, et étant donné que Berinert IV ne contient aucun agent conservateur, le produit mis en solution devrait être utilisé immédiatement après reconstitution. Si la préparation ne peut pas être utilisée immédiatement, elle ne doit pas être conservée au-delà de 8 heures à température ambiante. Le produit mis en solution ne peut être conservé que dans le flacon.
Remarques concernant le stockage
A conserver à une température ne dépassant pas 30 °C. Ne pas surgeler. Conserver le flacon dans l'emballage extérieur à l'abri de la lumière. En ce qui concerne la stabilité de la solution prête à l'emploi, voir sous «Stabilité après reconstitution». Tenir les médicaments hors de portée des enfants!
Tout médicament non utilisé ou déchet doivent être éliminés conformément à la réglementation en vigueur.
Remarques concernant la manipulation
Préparation de la solution:
Instructions générales:
·La solution doit être limpide ou claire. Après filtration/prélèvement (voir ci-dessous), le produit reconstitué doit être inspecté visuellement afin de mettre en évidence la présence de particules de matière ou un changement de coloration avant son administration.
·Des solutions troubles ou des solutions contenant un résidu (précipités/particules) ne doivent pas être utilisées.
·La reconstitution et le prélèvement doivent être effectués en conditions aseptiques. Utiliser pour cela uniquement la seringue fournie dans l'emballage.
Préparation:
Amener le solvant à la température ambiante. Retirer les capuchons protecteurs des flacons puis nettoyer les bouchons à l'aide d'une solution antiseptique; laisser sécher avant l'ouverture du dispositif de transfert («Mix2Vial™»).
|
|
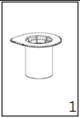
|
1. Ouvrir l'emballage du dispositif «Mix2Vial» en retirant l'opercule. Ne pas enlever le «Mix2Vial» de l'emballage.
| |
|
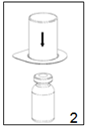
|
2. Placer le flacon de solvant sur une surface plane et propre, et le maintenir fermement. En tenant le dispositif «Mix2Vial» à travers son emballage, pousser l'extrémité bleue tout droit à travers le bouchon du flacon de solvant.
| |
|
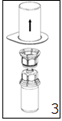
|
3. Retirer avec précaution l'emballage du dispositif «Mix2Vial» en tenant les bords et en tirant verticalement vers le haut. Bien s'assurer que vous avez retiré seulement l'emballage et que le dispositif «Mix2Vial» est resté bien en place.
| |
|
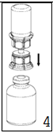
|
4. Poser le flacon du produit sur une surface plane et rigide. Retourner l'ensemble flacon de diluant-dispositif «Mix2Vial» et pousser la partie transparente de l'adaptateur tout droit à travers le bouchon du flacon de produit. Le solvant coule automatiquement dans le flacon de poudre.
| |
|
|
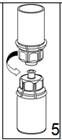
5. En maintenant la partie produit reconstitué d'une main et la partie solvant de l'autre, séparer les flacons en dévissant le dispositif «Mix2Vial» avec précaution. Jeter le flacon de solvant avec la partie bleue attachée de l'adaptateur «Mix2Vial».
| |
|
|
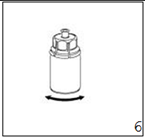
6. Remuer délicatement le flacon de produit avec la partie transparente de l'adaptateur attaché dessus jusqu'à ce que la substance soit totalement dissoute. Ne pas secouer.
| |
|
|
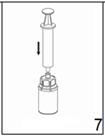
7. Remplir d'air une seringue stérile vide. Utiliser pour cela uniquement la seringue fournie dans l'emballage. Tout en maintenant verticalement le flacon du produit reconstitué, connecter la seringue au Luer Lock du dispositif «Mix2Vial». Injecter l'air dans le flacon du produit.
|
Aspiration de la solution dans la seringue:
|
|
|
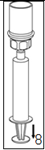
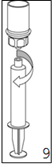
8. Tout en maintenant le piston de la seringue appuyé, retourner l'ensemble et prélever la solution dans la seringue en tirant lentement sur le piston.
| |
|
|
9. Une fois la solution transférée dans la seringue, tenir le corps de la seringue fermement (en maintenant le piston de la seringue dirigé vers le bas) et déconnecter la partie transparente de l'adaptateur «Mix2Vial» de la seringue.
|
Numéro d’autorisation51950 (Swissmedic).
PrésentationBerinert IV (B)
1 flacon contenant la substance lyophilisée (500 U.I.).
1 flacon contenant 10 ml d'eau pour injection.
1 dispositif de transfert 20/20
1 set d'administration (carton intérieur):
1 nécessaire de ponction veineuse
2 tampons imbibés d'alcool
1 pansement non stérile
1 seringue à usage unique
Titulaire de l’autorisationCSL Behring AG, Berne
Mise à jour de l’informationMars 2022
|









