CompositionPrincipe actif: immunoglobuline de lapin anti-lymphocytes T humains
Excipients: phosphate monosodique dihydraté
acide phosphorique (85 %)
eau pour préparations injectables
Indications/Possibilités d’emploiGRAFALON est utilisé en association avec d’autres médicaments immunosuppresseurs (p.ex. méthylprednisolone, prednisone, azathioprine, ciclosporine A) pour la prophylaxie et le traitement de la crise de rejet après transplantation d’organe.
GRAFALON est indiqué, en association avec une prévention standard par ciclosporine A/méthotrexate, pour la prévention de la maladie du greffon contre l'hôte (MGCH) lors de TCS de donneurs HLA-compatibles sans lien de parenté chez des adultes atteints de maladies hématologiques malignes.
Posologie/Mode d’emploiGRAFALON doit être prescrit exclusivement par un médecin expérimenté dans le domaine de l’utilisation des traitements immunodépresseurs. GRAFALON doit être administré sous la supervision d’un personnel médical qualifié.
Posologie recommandée
La dose de GRAFALON dépend de l’indication. Les recommandations posologiques sont basées sur le poids corporel (PC).
Prophylaxie après transplantation d’organes
La dose recommandée est de 2 à 5 mg/kg PC/j de GRAFALON. La dose utilisée est le plus souvent comprise entre 3 et 4 mg/kg PC/j. Le traitement doit être instauré le jour de la transplantation, en phase préopératoire, peropératoire ou immédiatement postopératoire. Selon l’état de santé du patient ainsi que la dose quotidienne choisie et le traitement immunodépresseur concomitant, la durée recommandée du traitement sera comprise entre 5 et 21 jours (durée d’administration la plus fréquente: entre 7 et 14 jours).
Traitement du rejet aigu résistant aux stéroïdes
La dose recommandée est de 3 à 5 mg/kg PC/j de GRAFALON. La dose utilisée est le plus souvent comprise entre 3 et 4 mg/kg PC/j. La durée du traitement, généralement comprise entre 5 et 14 jours, dépendra de l’état de l’organe greffé et de la réponse clinique.
Prévention de la maladie du greffon contre l'hôte (MGCH) lors d'une transplantation de cellules souches (TCS) chez l'adulte
Dans le cadre d'un schéma de conditionnement myélo-ablatif lors d'une TCS, la dose recommandée de GRAFALON est de 20 mg/kg/jour, généralement du jour -3 jusqu'au jour -1 de la TCS. La dose maximale tolérée est de 60 mg/kg (20 mg/kg sur 3 jours). Pour la prévention de la MGCH dans le cadre d'un traitement par des cellules souches, une réduction de la dose doit être envisagée chez les patients présentant un stade avancé du cancer.
Informations complémentaires concernant la posologie
POPULATION PEDIATRIQUE
Les données actuellement disponibles sont décrites à la rubrique « Effets indésirables »
et « Propriétés/Effets » mais aucune recommandation posologique ne peut être donnée. Les données disponibles sont limitées. Il n’existe pas de consensus clair quant à la posologie à utiliser chez les patients pédiatriques. Comme chez l’adulte, la posologie à utiliser chez l’enfant dépend de l’indication, du protocole d’administration et des autres agents immunosuppresseurs associés. Cela devra être pris en compte par les médecins au moment de décider de la posologie appropriée chez les patients pédiatriques.
PATIENTS ÂGÉS
L'expérience disponible auprès de patients âgés est limitée. Il n'existe cependant aucun indice suggérant que ces patients auraient besoin d'une dose modifiée.
Mode d’administration
Administration par voie intraveineuse (après dilution)
GRAFALON est un concentré hypotonique pour la préparation d’une solution pour perfusion avec un pH de 3,7 ± 0,3 qui ne peut pas être injectée directement. Avant d’être administré au patient par voie intraveineuse le médicament doit être dilué dans une solution de chlorure de sodium de 9 mg/ml (NaCl 0,9 %). Un rapport de dilution de 1:7 est recommandé (pour 1 ml de GRAFALON, il convient d’ajouter 6 ml de solution de chlorure de sodium) pour garantir l’osmolalité requise. Des dilutions supérieures, et en l’occurrence, un pH plus élevé de la solution de perfusion peuvent entraîner la formation de particules. Il ne faut pas utiliser des solutions contenant des particules visibles.
La durée standard de la perfusion, pour une greffe d’organe, est de 4 heures. En cas d’administration peropératoire, la durée de la perfusion est généralement de 0,5 à 2 heures. Dans le cadre d'une transplantation de cellules souches, la durée de perfusion recommandée est de 4 à 12 heures.
Pendant l’administration, les symptômes d’hypersensibilité ou d’anaphylaxie doivent être étroitement surveillés. La première dose de GRAFALON doit être administrée à un débit de perfusion réduit pendant les 30 premières minutes. Si aucun symptôme d’intolérance n’est constaté, le débit de perfusion peut être augmenté. En cas de réactions anaphylactiques ou anaphylactoïdes, le médecin en charge doit être préparé à réagir rapidement à ce type d’événement et un traitement médical adéquat doit être immédiatement instauré.
Une veine périphérique à haut débit peut être utilisée comme alternative au cathéter veineux central pour la perfusion. L’administration de méthylprednisolone et/ou d’antihistaminiques peut être envisagée avant la perfusion afin d’améliorer la tolérance systémique et locale. En plus de la préparation hygiénique standard du site d’injection, une réduction de la vitesse de perfusion et/ou le changement du site d’accès veineux sont éventuellement envisageables.
De l’héparine sodique ne doit pas être ajoutée à la solution de perfusion de GRAFALON ou administrée par la même voie, voir rubrique «Incompatibilités».
Afin d’assurer la traçabilité des médicaments biotechnologiques, il convient de documenter pour chaque traitement le nom commercial et le numéro de lot.
Contre-indications- Hypersensibilité par rapport au principe actif ou à l’un des excipients (voir rubrique «Composition»).
- GRAFALON est contre-indiqué chez les patients présentant des infections bactériennes, virales, parasitaires ou mycosiques qui ne sont pas sous contrôle thérapeutique adéquat.
- GRAFALON est contre-indiqué chez les patients greffés présentant une thrombocytopénie sévère (c.-à-d. moins de 50’000 plaquettes/µl) car le médicament peut aggraver la thrombocytopénie et augmenter en conséquence le risque hémorragique.
- GRAFALON est contre-indiqué chez les patients atteints de tumeurs malignes, sauf si une greffe de cellules souches est pratiquée dans le cadre du traitement.
Mises en garde et précautionsLes patients recevant GRAFALON doivent être pris en charge dans un établissement disposant des ressources de laboratoire et d’assistance médicale adéquates en termes d’équipement et de personnel pour qu’un traitement d’urgence puisse être assuré en cas de besoin. GRAFALON doit être administré et contrôlé sous la supervision d’un personnel médical qualifié.
Immunogénicité et réactions d’hypersensibilité
GRAFALON induit une production d'anticorps dirigés contre les immunoglobulines et d'autres protéines du lapin.
Des réactions d’hypersensibilité ont été signalées lors de l’administration de GRAFALON. Avant la première administration de GRAFALON, il faut déterminer si le patient présente une prédisposition allergique anamnestique, en particulier aux protéines de lapin. En cas de réexposition sous la forme d’un renouvellement du traitement par GRAFALON ou d’un traitement par des préparations d’immunoglobulines de lapin d’autres fabricants, le risque d’apparition d’une réaction anaphylactique est accru en raison de la possible sensibilisation lors du traitement antérieur.
Thrombocytopénie sévère
Le traitement par GRAFALON doit être suspendu ou interrompu en cas d’apparition d’une thrombocytopénie sévère chez les patients greffés (c.-à-d. moins de 50’000 plaquettes/µl) car GRAFALON peut aggraver la thrombocytopénie et augmenter en conséquence le risque hémorragique. Le personnel clinicien doit être préparé à prendre les mesures d’urgence appropriées.
Affections hépatiques
GRAFALON doit être administré avec des précautions particulières chez les patients atteints d’affections hépatiques. Les troubles préexistants de la coagulation peuvent s’aggraver. Il est recommandé de surveiller étroitement les thrombocytes et les paramètres de coagulation.
Affections cardiovasculaires
GRAFALON doit être administré avec des précautions particulières chez les patients présentant des affections cardiovasculaires connues ou suspectées. Chez les patients présentant une hypotension ou une décompensation cardiaque avec symptômes orthostatiques (par ex. perte de connaissance, faiblesse, vomissements, nausées), un ralentissement/une interruption de la perfusion doivent être envisagés.
Infections
Le traitement immunodépresseur augmente les risques d’infection en général. Les patients traités par GRAFALON présentent un risque accru d’apparition d’infections bactériennes, virales, parasitaires et/ou mycosiques. Une réactivation ou une aggravation d'infections virales chroniques – par exemple par VHC, VHB ou VIH – peut se produire sous GRAFALON. Une surveillance adéquate et des mesures thérapeutiques sont indiquées.
Chez les patients qui reçoivent une transplantation de cellules souches, il est recommandé de surveiller le statut viral concernant le CMV et l'EBV et d'initier un traitement préventif correspondant.
Vaccinations
Les patients doivent être prévenus que, pendant le traitement par GRAFALON, les vaccins non vivants peuvent être moins efficaces. L’utilisation de vaccins à virus vivant atténué est contre-indiquée chez les patients immunodéprimés.
Mise en garde concernant les agents transmissibles
Des matériaux humains (par ex. cellules Jurkat, érythrocytes) sont aussi utilisés dans les différentes étapes de fabrication de GRAFALON. Les mesures standard de prévention des infections liées à l’utilisation de produits médicamenteux issus de composants humains consistent notamment à sélectionner les donneurs, soumettre les prélèvements à un dépistage individuel des marqueurs infectieux spécifiques et à inclure dans la fabrication des étapes efficaces d’inactivation/élimination des virus. Malgré ces précautions, l’éventualité de la transmission d’agents infectieux ne peut être totalement exclue lors de l’administration de produits médicamenteux issus de composants humains. Cela est également valable pour les virus et autres agents pathogènes nouvellement apparus ou encore inconnus.
Les mesures prises pour GRAFALON sont jugées efficaces pour des virus enveloppés tels que le virus de l’immunodéficience humaine (VIH), le virus de l’hépatite B (VHB) et le virus de l’hépatite C (VHC) et pour des virus non enveloppés que sont le virus de l’hépatite A (VHA) et le parvovirus B19.
InteractionsAucune étude d’interaction n’a été réalisée.
Médicaments immunodépresseurs
Des traitements immunodépresseurs concomitants sont couramment administrés en complément à GRAFALON. Aucune interaction directe n’a été observée entre GRAFALON et les corticostéroïdes, les antipuriques, les inhibiteurs de la calcineurine ou les inhibiteurs de mTOR. L’administration concomitante de ces médicaments peut toutefois augmenter les risques d’infection, de thrombocytopénie et d’anémie. Par conséquent, les patients recevant des associations thérapeutiques d’immunodépresseurs doivent faire l’objet d’une surveillance étroite et un ajustement adéquat des posologies est recommandé.
Grossesse, AllaitementOn ne dispose d’études contrôlées ni chez l’animal ni chez la femme enceinte ou qui allaite. Dans ces conditions, le médicament ne doit être administré que si les bénéfices potentiels sont supérieurs aux risques pour le fœtus. Puisque l’on sait que les IgG passent la barrière placentaire et se retrouvent dans le lait maternel, on doit s’attendre à ce que GRAFALON passe également dans le lait maternel.
Effet sur l’aptitude à la conduite et l’utilisation de machinesNon pertinent.
Effets indésirablesRésumé du profil de sécurité
GRAFALON est une immunoglobuline dotée de propriétés immunodépressives. Les effets indésirables bien connus liés à cette classe de médicaments sont notamment les symptômes liés à la libération de cytokines, les réactions d’hypersensibilité telles que l’anaphylaxie et autres phénomènes allergiques, la sensibilité accrue aux infections et l’apparition de tumeurs malignes.
La nature et la fréquence des effets indésirables décrits dans cette rubrique ont été examinées dans le cadre d’une analyse de sécurité combinée sur la base de 6 essais cliniques portant sur un total de 242 patients traités en prévention d’un rejet lors d’une greffe de rein (136 patients) et en conditionnement avant une greffe de cellules souches (106 patients). Environ 94 % des patients ont connu au moins une (n= 1) réaction indésirable. Le modèle des effets indésirables rapportés reflète partiellement les complications les plus fréquentes pouvant typiquement apparaitre lors de chaque intervention: transplantation rénale (infection des voies rénales, insuffisance rénale) et/ou transplantation de cellules souches (pancytopénie, mucosite).
Les effets indésirables sont rangés par classe de système d’organes de la classification MedDRA et par fréquence selon la convention suivante: «très fréquents» (≥1/10), «fréquents» (≥1/100 à <1/10), «occasionnels» (≥1/1000 à <1/100).
Au sein de chaque groupe de fréquence, les effets indésirables sont présentés suivant un ordre décroissant de gravité.
Liste des effets indésirables
|
Infections et infestations
| |
Très fréquents
|
infection par le CMV*, infection urinaire*
| |
Fréquents
|
sepsie bactérienne**, pneumonie**, pyélonéphrite*, infection par l’herpès, grippe, candidose buccale, bronchite, rhinite, sinusite, rhinopharyngite, infection cutanée
| |
Occasionnels
|
infection sur le site du cathéter, infection par le virus d’Epstein-Barr, infection gastro-intestinale, érysipèle, infection de la plaie
| |
Tumeurs bénignes, malignes et non précisées (y compris kystes et polypes)
| |
Fréquents
|
trouble lymphoprolifératif*
| |
Affections hématologiques et du système lymphatique
| |
Très fréquents
|
anémie
| |
Fréquents
|
pancytopénie**, thrombocytopénie, leucopénie
| |
Occasionnels
|
polyglobulie
| |
Affections du système immunitaire
| |
Fréquents
|
choc anaphylactique**, réaction anaphylactique, hypersensibilité
| |
Affections du métabolisme et de la nutrition
| |
Fréquents
|
hyperlipidémie
| |
Occasionnels
|
rétention hydrique, hypercholestérolémie
| |
Affections du système nerveux
| |
Très fréquents
|
céphalées, tremblements
| |
Fréquents
|
paresthésie
| |
Affections oculaires
| |
Fréquents
|
photophobie
| |
Affections cardiaques
| |
Fréquents
|
tachycardie
| |
Affections vasculaires
| |
Très fréquents
|
bouffées vasomotrices
| |
Fréquents
|
hypotension*, maladie veino-occlusive, hypertension
| |
Occasionnels
|
choc**, lymphocèle
| |
Affections respiratoires, thoraciques et médiastinales
| |
Très fréquents
|
dyspnée
| |
Fréquents
|
toux, épistaxis
| |
Affections gastro-intestinales
| |
Très fréquents
|
vomissements, nausées, diarrhée, douleur abdominale
| |
Fréquents
|
stomatite
| |
Occasionnels
|
oesophagite par reflux gastrooesophagien, dyspepsie
| |
Affections hépatobiliaires
| |
Fréquents
|
hyperbilirubinémie
| |
Affections de la peau et du tissu sous-cutané
| |
Fréquents
|
érythème, prurit, éruption cutanée
| |
Occasionnels
|
toxidermie
| |
Affections musculosquelettiques et du tissu conjonctif
| |
Fréquents
|
myalgie, arthralgie, dorsalgie, raideur musculo-squelettique
| |
Affections du rein et des voies urinaires
| |
Fréquents
|
nécrose tubulaire rénale*, hématurie
| |
Occasionnels
|
insuffisance rénale**, nécrose rénale*
| |
Troubles généraux et anomalies au site d’administration
| |
Très fréquents
|
pyrexie**, frissons
| |
Fréquents
|
asthénie, douleur thoracique, hyperthermie, inflammation de la muqueuse, œdème périphérique
| |
Occasionnels
|
œdème
| |
Investigations
| |
Fréquents
|
élévation de la créatinine sanguine*, positivité à l’antigène du cytomégalovirus, élévation de la protéine C réactive
| |
Occasionnels
|
élévation des enzymes hépatiques
|
* Réaction grave
** Réaction grave, avec issue fatale dans des cas isolés
Description d’effets indésirables spécifiques et informations complémentaires
Symptômes liés à la libération des cytokines
Ces réactions surviennent en raison de la libération des cytokines et se manifestent notamment par une fièvre, des frissons, des céphalées, des nausées, des vomissements, une tachycardie et des modifications de la régulation de la circulation. Ces réactions peuvent être réunies sous l’appellation clinique de syndrome de libération de cytokines. Elles sont fréquemment observées pendant ou après l’administration de GRAFALON. Les symptômes peuvent généralement être pris en charge convenablement. Un traitement prophylactique peut être administré afin d’atténuer ces symptômes.
Réactions d’hypersensibilité
Des réactions de type bouffées vasomotrices, éruption cutanée, érythème, œdème, dyspnée avec ou sans bronchospasme, et toux sont fréquemment observées pendant et après l’administration. Ces réactions répondent généralement bien au traitement. L’administration d’un traitement prophylactique approprié peut permettre d’atténuer ces symptômes. En cas d’anaphylaxie ou de choc anaphylactique, la perfusion doit être immédiatement arrêtée. La maladie du sérum, observée lorsque GRAFALON a été administré de façon prolongée et à dose plus faible, est rarement sévère et répond généralement bien au traitement symptomatique. Une maladie du sérum apparait généralement 8 à 14 jours après le début du traitement.
Modifications hématologiques
Une thrombocytopénie ou une leucopénie transitoires sont fréquemment observées après l’administration de GRAFALON. Une anémie est aussi très fréquemment observée après l’administration de GRAFALON.
Infections
Les patients recevant des traitements immunodépresseurs présentent une sensibilité accrue aux infections. Pendant la première année suivant la greffe d’organe solide, la majorité des patients ayant reçu GRAFALON ont développé des infections d’origine bactérienne, virale ou mycosique. L’infection urinaire est une infection bactérienne très fréquente. Les infections virales sont très fréquemment causées par le CMV. Les infections signalées fréquemment sont notamment les septicémies bactériennes, les pneumonies bactériennes, les pyélonéphrites, les infections virales herpétiques et les candidoses buccales. Les infections par le VEB, la pneumonie à CMV, la gastroentérite à CMV et la colite sont des infections virales occasionnelles. La candidose systémique est une infection fongique occasionnellement observée. La majorité des infections peuvent généralement être prises en charge par un traitement approprié. Des cas isolés d’infections mettant en jeu le pronostic vital, voire fatales, ont été signalés. Une surveillance appropriée et un traitement prophylactique peuvent permettre de réduire le taux d’infection.
Tumeurs malignes
L’incidence des tumeurs malignes apparaissant suite au traitement par GRAFALON est généralement faible dans les études et publications, et comparable à l’incidence observée dans les traitements combinés avec d’autres médicaments immunodépresseurs. Des troubles lymphoprolifératifs après une transplantation ont été observés uniquement chez les patients ayant reçu une transplantation de cellules souches allogènes (1,7 %).
Hémolyse
De rares cas (moins de 1 patient sur 1’000) d’hémolyse, ayant conduit au décès dans des cas isolés, ont été signalés en liaison avec l’administration de GRAFALON.
Population pédiatrique
Les données actuellement disponibles sont limitées. Les informations disponibles indiquent que le profil de sécurité de Grafalon chez les patients pédiatriques n’est pas fondamentalement différent de celui observé chez les adultes.
L’annonce d’effets secondaires présumés après l’autorisation est d’une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d’effet secondaire nouveau ou grave via le portail d’annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageEn cas de surdosage, il est recommandé de recourir immédiatement à un traitement par des antibiotiques à large spectre, des antimycosiques et des virostatiques. Le traitement par GRAFALON doit être interrompu et les autres traitements immunodépresseurs concomitants doivent être ajustés en fonction de l’hémogramme (en particulier, les leucocytes et les lymphocytes). La numération plaquettaire doit être étroitement surveillée et un traitement de substitution instauré si nécessaire.
Propriétés/EffetsCode ATC: L04AA04
GRAFALON est obtenu à partir du sérum de lapins préalablement immunisés contre des lymphoblastes T humains. GRAFALON est une immunoglobuline hautement purifiée dont l’efficacité spécifique est dirigée contre les lymphocytes T humains. Pour la production de GRAFALON, on utilise le sérum de nombreux lapins.
Lors d’études in vitro (menées en permanence, parallèlement à la production), il a été démontré que GRAFALON se lie surtout aux lymphocytes T, mais aussi aux lymphocytes B (la littérature et la caractérisation des cellules suggèrent une activité dirigée contre les CD2+, CD3+, CD4+, CD4+/CD28+, CD5+, CD7+). Dans ce cadre, les lymphocytes sont soit opsonisés soit, selon disposition, lysés par le complément.
D’autre part, on assiste à une inhibition de la formation spontanée de rosettes par les lymphocytes T humains avec des érythrocytes de mouton en présence de GRAFALON. Grâce à GRAFALON, chez des singes rhésus, la durée de survie de transplantations de peau allogène a pu être prolongée.
L’effet suppresseur de GRAFALON se prolonge au-delà de son application effective, comme cela a été démontré à l’exemple des lymphocytes B et T.
GRAFALON est très largement dépourvu d’anticorps susceptibles de provoquer une réaction croisée contre les érythrocytes et contre les membranes basales glomérulaires. Sur la base de l’immunisation spécifique visée lors de sa production et des nombreuses méthodes de purification, GRAFALON montre un effet marqué sur les lymphocytes T ainsi qu’une excellente tolérance.
La solution ne contient ni stabilisateur ni agent conservateur.
Étude sur la transplantation de cellules souches
Dans une étude sur la greffe de cellules souches de donneurs HLA-compatibles sans lien de parenté avec le patient, on a pu démontrer que l'incidence de MGCH aiguë (MGCHa), de MGCH chronique (MGCHc) et de la mortalité était plus faible chez les patients ayant reçu GRAFALON en plus de la prévention standard que chez les patients n'ayant reçu que la prévention standard contre la MGCH. La mortalité totale était inchangée. Ces résultats ont été obtenus dans le cadre d'une période d'observation de deux ans après la transplantation.
Méthodes
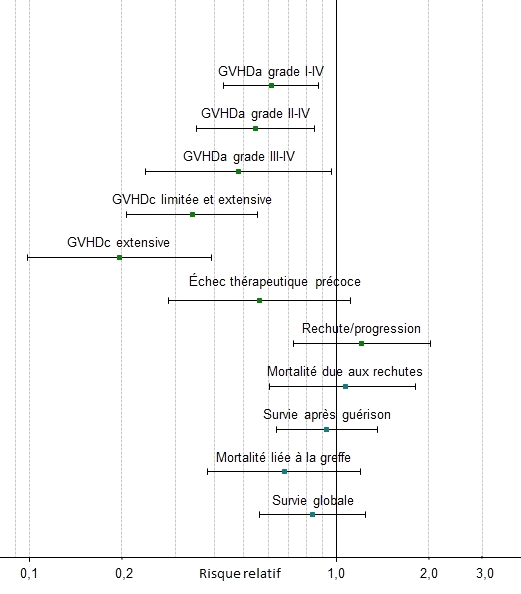
Il s'agissait d'une étude prospective ouverte multicentrique de phase III, randomisée, réalisée dans 31 centres de 10 pays européens, auprès de 202 patients adultes atteints de maladies hématologiques. Un groupe (98 patients) a reçu une prévention standard par ciclosporine et méthotrexate, tandis que l'autre groupe (103 patients) a reçu la même prévention standard en association avec un traitement par GRAFALON 20 mg/kg administré pendant les trois jours précédant la transplantation de cellules souches. La transplantation a été réalisée après un conditionnement myélo-ablatif des patients. Les greffons provenaient de donneurs HLA-compatibles sans lien de parenté avec les patients. Les greffons ont été prélevés de la moelle osseuse des donneurs dans 18 % des cas (37 patients) et du sang périphérique des donneurs dans 82 % des cas (164 patients). Le critère primaire examiné était l'échec précoce du traitement, défini comme une MGCHa de grade III–IV ou un décès du patient dans les 100 jours suivant la transplantation.
Résultats
L'administration de GRAFALON en plus de la prévention standard a permis une réduction de l'incidence de toutes les formes de MGCH: MGCHa (grades I–IV, II–IV et III–IV) et MGCHc (forme limitée et forme extensive). Aucune différence n'a été constatée entre les deux groupes de traitement en termes de récidives de la maladie de base, de mortalité associée à la transplantation ou de survie totale.
Au cours du suivi de 2 ans après la transplantation, on a observé pour la forme extensive de MGCHc une incidence de 12,2% chez les patients ayant reçu GRAFALON, par rapport à une incidence de 45,0 %; (HR ajusté 0,196, IC [0,10 à 0,39]; p <0,0001) dans le groupe témoin n'ayant pas reçu GRAFALON dans le cadre de la prévention.
Figure 1 Représentation graphique du risque relatif associé à la prévention avec GRAFALON versus groupe de contrôle sans GRAFALON, concernant les paramètres primaires et secondaires d'efficacité (estimation du point et IC à 95 %)
Pédiatrie
De multiples rapports ont été publiés concernant l’utilisation de GRAFALON chez les enfants. Ces rapports suggèrent que les profils de sécurité et d’efficacité du médicament chez les patients pédiatriques ne sont pas fondamentalement différents de ceux observés chez les adultes.
PharmacocinétiqueGRAFALON est administré par voie i.v. et est de ce fait biodisponible à 100 %.
En tant qu’anticorps antihumain, GRAFALON est une protéine dégradée de manière analogue aux protéines de l’organisme. On ne lui connaît aucun métabolite non physiologique. La demi-vie de GRAFALON est d’environ 14 jours (avec une posologie de 4 mg de GRAFALON/kg PC/j pendant 7 jours).
Données précliniquesLa toxicité aiguë a été déterminée chez des lapins et des singes rhésus. Même lors d’application i.v. de 900 mg/kg PC, les lapins n’ont montré aucune modification pathologique de leur tableau clinique ou des tests hématologiques.
Pour une posologie de 100 mg/kg PC chez des singes rhésus, on a observé au cours des 3 premiers jours seulement une légère inhibition motrice, un déplacement des granulocytes neutrophiles et une baisse temporaire des réticulocytes et des thrombocytes.
La toxicité subaiguë a été déterminée chez le singe rhésus. L’administration i.v. de 300 et de 500 mg/kg PC/jour a entraîné la mort des animaux au 7e jour (300 mg), resp. au 5e jour (500 mg). Les symptômes toxiques et la mort étaient dus à un choc anaphylactique avec collapsus circulatoire. Par rapport au groupe contrôle, on a observé une baisse du taux de lymphocytes de tous les groupes de posologie. Les caractéristiques histologiques et autres signes hématologiques se situaient dans des valeurs normales. On n’a observé aucune activation des organes lymphatiques, chez aucun animal testé.
Une influence sur le SNC après administration de GRAFALON peut être exclue sur la base des résultats obtenus chez des chats en état d’éveil. Des études chez le chat anesthésié n’ont montré aucun signe d’effet indésirable cardio-vasculaire.
GRAFALON n’a montré aucun effet mutagène lors de 3 tests in vitro avec ou sans activation métabolique.
Remarques particulièresIncompatibilités
La solution à diluer pour perfusion de GRAFALON ne doit pas être mélangée avec du glucose, du sang, des dérivés sanguins, des solutions contenant des lipides et de l’héparine sodique.
Le prélèvement de Grafalon dans les flacons et la préparation de la solution pour perfusion ne doivent pas être effectués avec des seringues siliconées.
Stabilité
Ne pas utiliser le médicament après la date de péremption mentionnée sur l’emballage après «EXP».
La stabilité chimique et physique de la solution diluée prête à l'emploi a été démontrée pendant 24 heures à température ambiante. Pour des raisons microbiologiques, le produit dilué doit être utilisé immédiatement. Dans le cas contraire, l’utilisateur est responsable de la durée et des conditions de conservation jusqu’à l’utilisation de la solution.
Aucun prélèvement multiple n’est prévu.
Remarques particulières concernant le stockage
Conserver au réfrigérateur (2°C – 8°C). Conserver le flacon dans l’emballage extérieur, à l’abri de la lumière.
Conserver hors de portée des enfants.
Remarques concernant la manipulation
Pour connaître les instructions de préparation et d’administration du médicament, voir rubrique «Posologie/Mode d’emploi».
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Numéro d’autorisation52412 (Swissmedic)
Présentation1 flacon 5 ml solution à diluer pour perfusion (B)
10 flacons 5 ml solution à diluer pour perfusion (B)
Titulaire de l’autorisationNeovii Pharmaceuticals AG, 8645 Jona, Suisse
Mise à jour de l’informationJanvier 2025
|

