CompositionPrincipes actifs
Dornasum alfa.
Désoxyribonucléase I recombinante humaine (rhDNase), produite par génie génétique à partir de cellules ovariennes du hamster chinois, se composant d'un mélange actif de DNase et de désamido-DNase (spécification: 65 ± 17% de désamido-DNase).
Excipients
Natrii chloridum, calcii chloridum dihydricum, aqua ad iniectabile.
Indications/Possibilités d’emploiTraitement symptomatique de la mucoviscidose, en association avec un traitement standard, chez les patients dont la capacité vitale forcée (CVF) est supérieure à 40% de la valeur normale.
Jusqu’à présent, l’expérience porte sur des patients de 5 ans ou plus, ayant été traités pendant 2 ans au maximum.
Un traitement à long terme par Pulmozyme est indiqué pour prévenir les complications respiratoires qui surviennent par suite de l’accumulation d’ADN dans le mucus infecté, qui lui aussi s’accumule dans les voies respiratoires lors de mucoviscidose. Un tel traitement à long terme entraîne:
·une diminution des infections symptomatiques à répétition, qui nécessitent un traitement parentéral par des antibiotiques et l’hospitalisation du patient;
·une amélioration de la fonction respiratoire et une régression de symptômes tels qu’essoufflement, toux et accumulation de mucus;
·une amélioration de l’état général du patient.
Posologie/Mode d’emploiPosologie usuelle
Chez les patients atteints de mucoviscidose, il est recommandé de procéder à un traitement permanent par 2,5 mg de dornase alfa par jour, ce qui représente une inhalation par jour du contenu non dilué d'une ampoule de 2,5 ml de solution (voir «Remarques concernant la manipulation»).
Chez des patients âgés de plus de 21 ans, l'administration de la dose quotidienne deux fois par jour peut s'avérer avantageuse.
Instructions spéciales pour la posologie
Afin de garantir la traçabilité de médicaments issus de la biotechnologie en cas d'apparition d'événements indésirables, le nom commercial et les numéros de lots doivent être documentés à chaque traitement.
Enfants et adolescents
L'expérience est limitée en ce qui concerne l'utilisation chez les patients de moins de 5 ans. D'après les études observationnelles pharmacocinétiques et prospectives conduites après la mise sur le marché, l'administration de Pulmozyme aux enfants de moins de 5 ans à l'aide d'un masque facial à la même posologie que celle utilisée chez les enfants plus âgés est cependant sûre. Une telle utilisation ne doit toutefois être considérée que s'il existe un bénéfice potentiel au niveau de la fonction pulmonaire et du risque d'infection des voies respiratoires (voir «Effets indésirables»).
L'efficacité et la sécurité à long terme n'ont pas été documentées dans cette tranche d'âge.
Mode d'administration
Chez la majorité des patients, le bénéfice thérapeutique optimal est obtenu avec une utilisation quotidienne régulière de Pulmozyme. Des études au cours desquelles Pulmozyme a été administré de manière intermittente montrent en effet que l'amélioration de la fonction pulmonaire régresse en quelques jours après l'arrêt du traitement. Seule une utilisation quotidienne et continue fait baisser la fréquence des exacerbations d'infections respiratoires, ainsi que l'attestent diverses études cliniques. Aussi convient-il de dire aux patients de prendre le médicament chaque jour.
Pendant le traitement par Pulmozyme, il convient de poursuivre les thérapeutiques en cours, y compris la physiothérapie standard visant à améliorer la fonction pulmonaire.
Les patients chez lesquels survient une infection respiratoire peuvent poursuivre sans inconvénient leur traitement par Pulmozyme. Il convient également qu'ils continuent leur physiothérapie afin d'améliorer leur fonction pulmonaire.
L'efficacité et l'innocuité de l'utilisation de Pulmozyme chez les patients dont la capacité vitale forcée se trouve en dessous de 40% de la valeur normale n'ont à l'heure actuelle pas encore été démontrées au cours des études cliniques.
Contre-indicationsPulmozyme ne doit pas être administré aux patients présentant une hypersensibilité au principe actif ou à d’autres composants du produit.
Mises en garde et précautionsAucune précaution particulière n’est nécessaire.
InteractionsLes traitements standard de la mucoviscidose, notamment les antibiotiques, les bronchodilatateurs, les préparations à base d’enzymes pancréatiques, les vitamines, les corticoïdes (administrés tant par inhalation que par voie générale) ainsi que les analgésiques, peuvent être utilisés sans problème en même temps que Pulmozyme. Ce dernier ne doit toutefois pas être mélangé à de tels produits dans l’inhalateur (voir sous «Remarques particulières – Incompatibilités»).
Grossesse, allaitementGrossesse
L’innocuité de la dornase alfa au cours de la grossesse n’est pas prouvée. Des études chez l’animal n’ont fait apparaître aucun élément plaidant en faveur de répercussions néfastes, directes ou indirectes, sur la gestation ou sur le développement de l’embryon ou du foetus (voir «Données précliniques»), mais on ne dispose pas d’études contrôlées chez la femme enceinte. La prudence est donc de rigueur en cas d’utilisation de Pulmozyme pendant la grossesse.
Allaitement
L’absorption systémique de la dornase alfa est minimale lorsqu’elle est administrée au patient selon les recommandations posologiques. Pour cette raison, on ne s’attend pas à retrouver la dornase alfa à des concentrations mesurables dans le lait maternel. La prudence est toutefois de rigueur lorsque la dornase alfa est administrée aux femmes qui allaitent (voir «Absorption» et «Données précliniques»).
Après l’administration intraveineuse de doses élevées de dornase alfa à des singes Cynomolgus allaitant, seules de faibles concentrations de ce principe actif ont été retrouvées dans le lait (<0,1% des concentrations mesurées dans le sérum des singes Cynomolgus gravides).
Effet sur l’aptitude à la conduite et l’utilisation de machinesAucune répercussion sur l’aptitude à conduire un véhicule ou à commander une machine n’a été rapportée.
Effets indésirablesLes effets indésirables sont rangés par classe de système d’organes de la classification MedDRA et par fréquence selon la convention suivante:
«très fréquents» (≥1/10), «fréquents» (≥1/100 à <1/10), «occasionnels» (≥1/1000 à <1/100), «rares» (≥1/10’000 à <1/1000), «très rares» (<1/10’000).
Dans la plupart des cas, les effets indésirables sont légers et temporaires et ne nécessitent pas de modifications de la posologie.
Affections oculaires
Fréquents: conjonctivite.
Affections respiratoires, thoraciques et médiastinales
Très fréquents: dysphonie, pharyngite, rhinite (toutes non infectieuses).
Fréquents: laryngite (non infectieuse).
Occasionnels: dyspnée (non infectieuse).
Affections gastro-intestinales
Occasionnels: dyspepsie.
Affections de la peau et du tissu sous-cutané
Très fréquents: éruption, urticaire.
Troubles généraux et anomalies au site d’administration
Très fréquents: douleurs thoraciques (d’origine pleurale et non cardiaque).
Occasionnels: fièvre.
Examens diagnostiques
Occasionnels: diminution du résultat du test de la fonction pulmonaire.
Les effets indésirables suivants ont été observés au cours d'études en double insu, contrôlées contre placebo:
|
Effets indésirables
|
Placebo
(n = 325)
|
1× 2,5 mg/j
(n = 322)
|
2× 2,5 mg/j
(n = 321)
| |
Affections oculaires
| |
Conjonctivite
|
2%
|
4%
|
5%
| |
Affections respiratoires, thoraciques et médiastinales
| |
Pharyngite
|
33%
|
36%
|
40%
| |
Modification de la voix
|
7%
|
12%
|
16%
| |
Laryngite
|
1%
|
3%
|
4%
| |
Affections de la peau et du tissu sous-cutané
| |
Erythème
|
7%
|
10%
|
12%
| |
Troubles généraux et anomalies au site d’administration
| |
Douleur thoracique
|
16%
|
18%
|
21%
|
Comme en témoigne la forte proportion de patients ayant participé jusqu’à leur terme aux études cliniques sur Pulmozyme, les malades présentant les complications habituelles de la mucoviscidose peuvent généralement poursuivre sans problème leur traitement par Pulmozyme.
Au cours des études cliniques, les patients souffrant d’affections concomitantes nécessitant l’arrêt du traitement par la dornase alfa ont été peu nombreux. Les taux d’abandons sous placebo (2%) et dornase alfa (3%) étaient comparables.
Au début du traitement par la dornase alfa, il peut se produire, comme avec tout aérosol, une dégradation de la fonction pulmonaire ainsi qu’une majoration des expectorations.
Moins de 5% des patients ont développé des anticorps anti-dornase alfa. Aucun de ces patients ne présentait d’anticorps IgE spécifiquement dirigés contre la dornase alfa. Même après l’apparition d’anticorps anti-dornase alfa, une amélioration des épreuves fonctionnelles respiratoires a été obtenue.
Enfants de moins de 5 ans
Dans une étude de pharmacocinétique au cours de laquelle 65 enfants de moins de 5 ans ainsi que 33 enfants âgés de 5 à 9 ans ont reçu 2,5 mg de Pulmozyme une fois par jour pendant 14 jours, aucune différence cliniquement significative n’a été relevée entre les deux groupes d’âge du point de vue de la tolérance de Pulmozyme (voir «Pharmacocinétique chez certains groupes particuliers de patients»).
Le suivi prospectif d’enfants de moins de 5 ans mené tant après le traitement par Pulmozyme que pendant la phase sans traitement n’a fait apparaître aucune augmentation des effets indésirables sévères observés pendant l’administration de Pulmozyme.
Pulmozyme ne doit être administré aux enfants de moins de 5 ans que s’il existe un bénéfice potentiel pour la fonction pulmonaire ou du point de vue du risque d’infections respiratoires.
Effets indésirables identifiés après la mise sur le marché
Les annonces spontanées effectuées après la mise sur le marché ainsi que les données au sujet de la sécurité collectées de manière prospective au cours des études observationnelles confirment le profil de sécurité décrit dans les études cliniques.
L’annonce d’effets secondaires présumés après l’autorisation est d’une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d’effet secondaire nouveau ou grave via le portail d’annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageAucun cas de surdosage de Pulmozyme n’est connu. Des patients présentant une fibrose kystique ont inhalé jusqu’à 20 mg de Pulmozyme deux fois par jour (seize fois la dose journalière recommandée) pendant une période allant jusqu’à 6 jours, et 10 mg deux fois par jour (huit fois la dose journalière recommandée) de façon intermittente (2 semaines avec/2 semaines sans traitement) pendant 168 jours.
Une toxicité systémique de Pulmozyme n’a jusqu’à présent pas été observée et elle est d’ailleurs peu probable vu la faible absorption et la courte demi-vie sérique de la dornase alfa.
Propriétés/EffetsCode ATC
R05CB13
Mécanisme d’action
La DNase recombinante humaine est la forme produite par génie génétique, d'une enzyme naturellement présente chez l'homme, qui clive l'ADN extra-cellulaire.
L’accumulation de sécrétions visqueuses et purulentes dans les voies respiratoires contribue à la dégradation de la fonction respiratoire et favorise les exacerbations infectieuses. Les sécrétions purulentes contiennent des concentrations très élevées d’ADN extra-cellulaire, un polyanion visqueux libéré par les leucocytes altérés qui s’accumulent en réponse à l’infection. In vitro, la dornase alfa hydrolyse l’ADN du mucus et réduit ainsi la viscosité des expectorations chez les patients souffrant de mucoviscidose.
Pharmacodynamique
L’inhalation in vivo de dornase alfa améliore la fonction pulmonaire et abaisse la fréquence des exacerbations typiques de la mucoviscidose en permettant une meilleure élimination des sécrétions et du mucus des voies respiratoires.
Efficacité clinique
Pulmozyme a été évalué chez des patients atteints de fibrose kystique âgés de plus de 5 ans et en présence de différents degrés de sévérité de l’atteinte pulmonaire. La majorité des études ont été conduites en double aveugle et contrôlées versus placebo. Tous les patients ont bénéficié d’autres mesures thérapeutiques selon l’appréciation de leurs médecins traitants.
Patients de plus de 5 ans avec une CVF >40% de la valeur normale
Pulmozyme 2,5 mg administré une ou deux fois par jour à l’aide d’un nébuliseur Hudson T Up Draft II avec un compresseur Pulmo-Aide a diminué l’incidence d’une première infection des voies respiratoires (infection ayant nécessité l’administration parentérale d’antibiotiques) et a amélioré le FEV1 moyen (volume expiratoire forcé en 1 seconde) par rapport au placebo.
Lors d’une administration une fois ou deux fois par jour, Pulmozyme a respectivement réduit le risque relatif d’une exacerbation d’une infection des voies respiratoires de 27% et respectivement de 29% (voir tableau 1). La sous-analyse des données indique qu’il est possible que l’effet de Pulmozyme sur la péjoration des infections soit plus faible chez les patients plus âgés (de plus de 21 ans) et qu’il pourrait être nécessaire d’administrer ce médicament deux fois par jour chez ces patients. Les patients présentant une CVF de départ >85% profitent éventuellement aussi d’une administration biquotidienne (voir tableau 1). La réduction du risque de l’exacerbation d’une infection chez les patients qui ont été traités par Pulmozyme s’est maintenue au cours des six mois de la durée de l’étude et elle n’était pas directement corrélé avec une amélioration du FEV1 au cours des deux premières semaines du traitement.
Tableau 1: Incidence au cours d’une étude contrôlée de la survenue d’une première infection des voies respiratoires qui a nécessité l’administration parentérale d’antibiotiques
|
|
Placebo
n = 325
|
2,5 mg une fois par jour
n = 322
|
2,5 mg deux fois par jour
n = 321
| |
Pourcentage des patients présentant une infection
|
43%
|
34%
|
33%
| |
Risque relatif (vs. placebo)
|
|
0,73
|
0,71
| |
Valeur p (vs. placebo)
|
|
0,015
|
0,007
| |
Sous-groupes selon l’âge et la CVF de départ
|
Placebo
(n)
|
2,5 mg une fois par jour
(n)
|
2,5 mg deux fois par jour
(n)
| |
Âge
| |
5-20 ans
|
42% (201)
|
25% (199)
|
28% (184)
| |
21 ans et plus
|
44% (124)
|
48% (123)
|
39% (137)
| |
CVF de départ
| |
40-85% de la valeur normale
|
54% (194)
|
41% (201)
|
44% (203)
| |
>85% de la valeur normale
|
27% (131)
|
21% (121)
|
14% (118)
|
Au cours des huit premiers jours après le début du traitement par Pulmozyme administré une fois ou deux fois par jour, une amélioration de 7,9% et respectivement de 9,0% du FEV1 moyen a été obtenue par rapport à la valeur de départ. Après six mois de traitement, l’amélioration du FEV1 par rapport à la valeur de départ s’élevait respectivement à 5,8% et à 5,6% lors de l’administration quotidienne et biquotidienne. Les patients qui ont reçu le placebo n’ont pas présenté de modifications significatives des résultats des tests de la fonction pulmonaire pendant la durée de l’étude (voir la figure 1).
Figure 1: Modification moyenne en pour cent à partir du FEV1 de départ chez les patients de plus de 5 ans avec une CVF >40% de la valeur normale
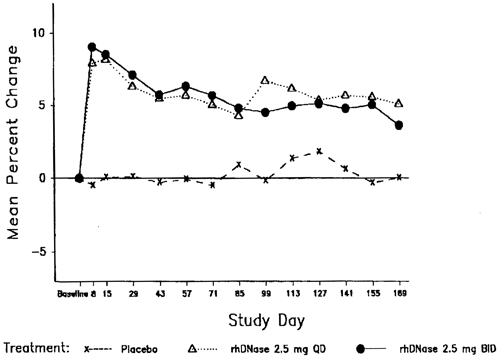
Patients de moins de 5 ans
Les données pharmacocinétiques d’une étude conduite auprès de 65 enfants âgés de 3 mois à 5 ans et 33 enfants de 5 à 10 ans indiquent qu’avec l’administration de 2,5 mg de Pulmozyme à l’aide du nébuliseur Pari Baby et du compresseur Proneb (= PariBoy), des concentrations similaires de DNase sont obtenues dans les poumons des patients de moins de 5 ans comme avec le nébuliseur Pari LC Plus et le même compresseur dans les poumons des enfants plus âgés qui ont répondu au traitement par Pulmozyme (voir «Pharmacocinétique chez certains groupes particuliers de patients»).
Voir «Effets indésirables» pour ce qui concerne la sécurité au sein de cette population de patients.
Aucune étude n’a été effectuée au sujet de l’efficacité clinique chez les patients de moins de 5 ans.
PharmacocinétiqueRésultats des études précliniques
Absorption
Des études effectuées sur la base d'inhalations réalisées chez le rat et des primates non humains ont montré que seule une faible fraction de la dornase alfa passe dans la circulation générale (<15% chez le rat et <2% chez le singe). En accord avec ces résultats, il apparaît que la dornase alfa administrée aux patients sous forme d'aérosol ne subit qu'une faible absorption systémique.
Après administration orale à des rats, l'absorption de la dornase alfa à partir du tractus gastro-intestinal s'est avérée négligeable.
Distribution
Des études réalisées chez le rat et le singe ont montré que Pulmozyme administré par voie intraveineuse est rapidement éliminé du sérum. Dans ces études, le volume initial de distribution correspondait à peu près au volume sérique.
Métabolisme
Aucune donnée.
Élimination
Des études menées chez le rat indiquent qu'après administration d'un aérosol la demi-vie d'élimination pulmonaire de la dornase alfa est de 11 heures.
Cinétique pour certains groupes de patients
Aucune donnée de pharmacocinétique n'a jusqu'à présent été recueillie chez des animaux très jeunes ou âgés.
Résultats des études cliniques
Absorption
La DNase est normalement présente dans le sérum humain. L'inhalation de doses de dornase alfa allant jusqu'à 40 mg pendant 6 jours au maximum n'a pas entraîné d'augmentation notable de la concentration sérique de dornase alfa par rapport aux concentrations endogènes normales. Il n'a pas été observé, dans le sérum, d'augmentation de la concentration de DNase supérieure à 10 ng/ml. Après administration de 2,5 mg de dornase alfa deux fois par jour pendant 24 semaines, les concentrations sériques moyennes de DNase n'étaient pas différentes des valeurs moyennes relevées avant traitement (3,5 ± 0,1 ng/ml). Cela renvoie à une faible absorption systémique sans accumulation (voir sous «Données précliniques»).
Distribution
Chez des patients atteints de mucoviscidose, l'inhalation de 2,5 mg de dornase alfa entraîne en l'espace de 15 minutes des concentrations maximales moyennes d'environ 3 µg/ml de dornase alfa dans le mucus bronchique. La concentration de dornase alfa dans les expectorations diminue rapidement après l'inhalation.
Métabolisme
Il faut partir du principe que la dornase alfa est dégradée par les protéases présentes dans les liquides corporels.
Élimination
Les études conduites chez l'être humain en administration intraveineuse indiquent que la demi-vie d'élimination sérique est de trois à quatre heures. Les expériences conduites sur des rats et des singes ont également montré que la DNase est rapidement éliminée du sérum après une administration intraveineuse.
Après l'administration d'un aérosol à des rats, la dornase alfa a été éliminée des poumons avec une demi-vie de 11 heures.
Chez l'être humain, les concentrations de DNase dans les expectorations diminuent en l'espace de deux heures à moins de la moitié des taux mesurés directement après l'administration. Les effets sur la rhéologie des expectorations persistent par contre pendant plus de 12 heures.
Pharmacocinétique chez certains groupes particuliers de patients
Pulmozyme a été évalué au cours d'une étude de deux semaines conduite en ouvert chez des patients atteints de fibrose kystique âgés de 3 mois à 9 ans. Pulmozyme a été administré par inhalation à 98 patients (dont 65 patients entre 3 mois et <5 ans et 33 patients entre 5 et <10 ans) à une posologie de 2,5 mg par jour. Un lavage broncho-alvéolaire (LBA) a été effectué dans l'intervalle de 90 minutes suivant l'administration de la première dose. Un nébuliseur Pari Baby (avec lequel un masque facial est utilisé au lieu d'un embout buccal) a été employé chez les patients qui n'étaient pas en mesure d'inspirer et d'expirer par la bouche pendant le traitement tout entier (54 (83%) des 65 patients plus jeunes et 2 (6%) des 33 patients plus âgés). Les concentrations de DNase qui ont pu être mises en évidence dans le liquide de rinçage utilisé pour le LBA étaient cependant dans l'ensemble de tous les patients réparties sur un large intervalle (0,007 à 1,8 µg/ml). Pendant le traitement d'une durée moyenne de 14 jours, les taux sériques de DNase (moyenne et déviation standard) ont augmenté de 1,1 ± 1,6 ng/ml au sein de la tranche d'âge entre 3 mois et <5 ans et de 0,8 ± 1,2 ng/ml dans le groupe au sein de la tranche d'âge entre 5 et <10 ans.
Données précliniquesMutagénicité
Aucun signe témoignant d'un potentiel génotoxique n'a été mis en évidence par le test d'Ames, par le test du lymphome chez la souris, par le test des aberrations chromosomiques dans des cultures de lymphocytes périphériques humains ou par le test du micronoyau chez la souris.
Carcinogénicité
Une étude de 2 ans conduite sur des rats n'a pas révélé de potentiel oncogène lors de l'administration par inhalation.
Au sein de groupes de 60 rats pour chaque sexe, la dornase alfa a été appliquée dans le tractus respiratoire inférieur à des doses de 51, 101 ou 246 µg/kg/jour pendant une durée allant jusqu'à deux ans. Deux groupes de contrôle de taille égale ont reçu de l'air ou la substance vectrice. La dornase alfa a été bien tolérée et n'a conduit ni à une survenue de tumeurs inhabituelles, ni à une survenue plus fréquente de tumeurs des voies respiratoires ou d'autres organes ou tissus du rat qui seraient à mettre sur le compte de l'oncogénicité de la dornase alfa.
Toxicité sur la reproduction
Les études chez le rat portant sur la dornase alfa n'ont pas mis en évidence de troubles de la fertilité, de tératogénicité ou de troubles du développement.
Chez le lapin et chez les rongeurs, les études portant sur la dornase alfa n'ont pas mis en évidence de troubles de la fertilité et n'ont pas révélé de tératogénicité.
Autres données
Une étude conduite sur des singes cynomolgus femelles en lactation auxquelles des doses élevées de dornase alfa ont été administrées par voie intraveineuse (bolus de 100 µg/kg suivi de 80 µg/kg/heure pendant 6 heures) a montré de faibles concentrations dans le lait (<0,1% de la concentration sérique).
Au cours d'une étude de quatre semaines au sujet de la toxicité par inhalation conduite chez des jeunes rats, l'administration de doses de 0, 51, 102 et 260 µg/kg/jour a été initiée 22 jours après la naissance. La dornase alfa a été bien tolérée. Aucune lésion n'a été constatée dans le tractus respiratoire.
Remarques particulièresIncompatibilités
Pulmozyme est une solution aqueuse non tamponnée pour inhalation par nébuliseur, qui ne doit être ni diluée ni mélangée à d'autres médicaments. Le fait de mélanger la solution pourrait entraîner des modifications structurelles ou fonctionnelles indésirables de Pulmozyme ou de la substance ajoutée.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques particulières concernant le stockage
Conserver au réfrigérateur (2-8 °C).
Conserver le récipient dans son carton pour le protéger de la lumière.
Le médicament doit être conservé au réfrigérateur (2-8 °C) dans l'emballage original afin de protéger le contenu de la lumière.
Eviter toute chaleur importante. L'exposition de l'ampoule non ouverte à une température élevée pendant une brève durée et à une seule reprise (pas plus de 24 heures à une température ne dépassant pas 30 °C) ne compromet pas la stabilité du produit. Ne pas utiliser ce dernier en cas de coloration ou de turbidité.
Stabilité après ouverture
Pulmozyme ne contient aucun conservateur; après l'ouverture de l'ampoule, tout son contenu doit être utilisé immédiatement, en une seule fois. Les restes de solution non utilisés doivent être éliminés.
Remarques concernant la manipulation
La solution stérile pour inhalation par nébuliseur d'une ampoule en matière plastique à usage unique Pulmozyme doit être inhalée une fois par jour à l'aide d'un nébuliseur recommandé.
A cet effet, le contenu d'une ampoule de Pulmozyme est versé dans la chambre d'un système nébuliseur tel que Hudson T Up-Draft II/Pulmo-Aide, Airlife Misty/Pulmo-Aide ou encore un système Respirgard/Pulmo-Aide ou AcornII/Pulmo-Aide adapté au cas par cas.
Pulmozyme peut également être utilisé avec un nébuliseur tel que les systèmes Pari LL/Inhalierboy, Pari LC/Inhalierboy ou Master, Aiolos/2 Aiolos, Side Stream/CR50, MobilAire ou Porta-Neb, ainsi qu'avec le nébuliseur Pari eRapid, un nébuliseur universel électronique, qui repose sur la technologie de membrane vibrante.
Les patients qui ne sont pas en mesure d'inspirer et d'expirer par la bouche pendant toute la durée de l'inhalation peuvent utiliser le nébuliseur Pari Baby avec un masque facial.
Les nébuliseurs ultrasoniques peuvent ne pas être adaptés à l'administration de Pulmozyme en raison d'un risque d'inactivation du produit ou de caractéristiques inappropriées de l'aérosol délivré.
Se conformer au mode d'emploi fourni par les fabricants pour ce qui est de l'utilisation et de l'entretien des nébuliseurs et des compresseurs.
Il n'est pas nécessaire de prévoir des mesures destinées à empêcher que l'aérosol passe de l'inhalateur dans l'environnement.
Les ampoules de Pulmozyme sont à usage unique.
Pulmozyme ne doit être ni injecté ni avalé.
Numéro d’autorisation52623 (Swissmedic).
PrésentationAmpoules de 2,5 mg/2,5 ml (1,0 mg/ml): 30 [B]
Titulaire de l’autorisationRoche Pharma (Suisse) SA, Bâle.
Mise à jour de l’informationAvril 2021.
|

