CompositionPrincipes actifs
Facteur VIII de coagulation et facteur de von Willebrand humain
Excipients
Albumine humaine, glycine, chlorhydrate de lysine, chlorure de sodium, citrate de sodium dihydraté, chlorure de calcium dihydraté, quantité totale de sodium ca. 1.96 mg/ml
Solvant: Eau pour préparations injectables
Indications/Possibilités d’emploiThérapie et prophylaxie des hémorragies chez les patients atteints d'hémophilie A (déficit congénital en facteur VIII, hémophilie A avec inhibiteur du facteur VIII, déficit acquis en facteur VIII dû au développement spontané d'inhibiteurs du facteur VIII).
Maladie de von Willebrand avec déficit en facteur VIII.
Remarque: L'efficacité et la sécurité d'Immunate S/D lors de la maladie de von Willebrand n'a été étudiée sur le plan clinique que chez un petit nombre de patients, ce qui est valable notamment pour le type 3.
Posologie/Mode d’emploiLe traitement doit être effectué sous la surveillance d'un médecin expérimenté dans le traitement de l'hémophilie A.
Posologie usuelle
La posologie et la durée du traitement de substitution dépendent de la sévérité du déficit en facteur VIII, de la localisation et de l'importance de l'hémorragie et de l'état du patient.
Les unités de facteur VIII administrées sont indiquées en unités internationales (UI), conformément aux standards de l'OMS pour les produits à base de facteur VIII. L'activité du facteur VIII dans le plasma est exprimée soit sous en pourcentage (par rapport au plasma normal humain) soit en UI (par rapport au standard international pour le facteur VIII du plasma).
Une UI d'activité du facteur VIII correspond à la quantité de facteur VIII contenue dans un millilitre de plasma humain normal.
Posologie lors de l'hémophilie A
Le calcul de la dose nécessaire de facteur VIII est basé sur les résultats empiriques selon lesquels 1 UI de facteur VIII par kg de poids corporel élève l'activité plasmatique du facteur VIII de 1,5% à 2%. La posologie requise est calculée selon la formule suivante:
Unités requises (UI) = poids corporel (kg) x augmentation désirée du facteur VIII (%) x 0,5.
La posologie et la fréquence d'administration doivent être adaptées au cas particulier en fonction de l'efficacité clinique du produit.
Hémorragies et opérations:
Lors des évènements hémorragiques décrits ci-dessous, l'activité du facteur VIII au cours de la période correspondante ne doit pas descendre au-dessous du taux plasmatique indiqué (en % de la norme ou en UI/dl). Le tableau suivant fournit les valeurs indicatives pour la posologie en cas d'hémorragies et d'interventions chirurgicales:
|
Importance de l'hémorragie / type d'intervention chirurgicale
|
Taux plasmatique requis de facteur VIII (% ou UI/dl)
|
Fréquence des injections (heures) / durée de traitement (jours)
| |
Hémorragie
Hémarthrose au stade précoce, hémorragies musculaires ou buccales.
|
20 – 40
|
Injection toutes les 12 à 24 heures pendant au moins un jour, jusqu'à l'arrêt de l'hémorragie – sur la base de la disparition des douleurs – ou jusqu'à la guérison.
| |
Hémarthrose marquée, hémorragie musculaire ou hématome.
|
30 – 60
|
Répéter l'injection toutes les 12 – 24 heures pendant 3 à 4 jours ou plus, jusqu'à ce que les douleurs et la limitation aiguë aient disparu.
| |
Hémorragie mettant la vie en danger.
|
60 – 100
|
Répéter l'injection toutes les 8 à 24 heures jusqu'à ce que le patient soit hors de danger.
| |
Interventions chirurgicales
Interventions mineures
Y compris extraction dentaire.
|
30 – 60
|
Toutes les 24 heures pendant au moins 1 jour, jusqu'à guérison de la plaie.
| |
Interventions majeures
|
80 – 100
(pré- et post-opératoire)
|
Répéter l'injection toutes les 8 à 24 heures jusqu'à ce que la plaie soit suffisamment cicatrisée, puis poursuivre le traitement pendant 7 jours au moins, afin de maintenir une activité du facteur VIII de 30 à 60% (UI/dl).
|
La posologie et la fréquence d'administration doivent être adaptées au cas particulier en fonction de l'efficacité clinique du produit. Dans certaines conditions définies (p.ex. présence de faibles titres d'inhibiteurs du facteur VIII), en particulier au début du traitement, des posologies plus élevées que celles calculées peuvent s'avérer nécessaires.
Si l'hémorragie ne peut pas être contrôlée avec la dose ordonnée de facteur VIII, le taux plasmatique de facteur VIII doit être déterminé et une dose suffisante d'Immunate S/D doit être administrée afin d'obtenir une réaction clinique satisfaisante.
Pendant le traitement, afin de contrôler la dose à administrer et la fréquence des injections, il est recommandé de mesurer le taux plasmatique de facteur VIII de manière adéquate. Lors d'interventions chirurgicales majeures, une surveillance soigneuse du traitement de substitution au moyen de contrôles de l'activité plasmatique du facteur VIII est indispensable. Chaque patient peut réagir différemment au facteur VIII, atteindre une récupération in vivo individuelle et présenter des demi-vies variables.
Prophylaxie à long terme
Pour la substitution à long terme d'hémorragies chez des patients atteints d'hémophilie A sévère, des doses comprises entre 20 et 40 UI/kg de facteur VIII doivent être administrées tous les 2 à 3 jours. Dans certains cas, en particulier chez les patients jeunes, des intervalles d'administration plus courts ou des doses plus élevées peuvent s'avérer nécessaires.
Patients avec inhibiteurs du facteur VIII
Les patients doivent subir des contrôles réguliers à la recherche d'inhibiteurs du facteur VIII. Si l'activité plasmatique attendue du facteur VIII n'est pas atteinte ou si l'hémorragie n'est pas maîtrisée au moyen d'une posologie adaptée, il convient de rechercher la présence d'inhibiteurs. Chez les patients présentant un taux d'inhibiteurs élevé, il est possible que le traitement par facteur VIII soit inefficace et qu'il faille envisager d'autres mesures thérapeutiques. Ce type de traitements ne peut être administré que par des médecins expérimentés dans le traitement des patients atteints d'hémophilie. Cf. également «Mises en garde et précautions».
Maladie de von Willebrand avec déficit en facteur VIII
Immunate S/D est indiqué dans le traitement et la prophylaxie du facteur VIII chez les patients atteints de maladie de von Willebrand chez lesquels l'activité du facteur VIII est abaissée, et chez lesquels un traitement par desmopressine est inefficace ou contre-indiquée. Pour un traitement de substitution par Immunate S/D destiné au contrôle des hémorragies et pour la prophylaxie des hémorragies péri-opératoires, il convient d'appliquer les mêmes directives que pour l'hémophilie A.
Les expériences cliniques sont limitées chez l'enfant.
Les patients doivent être contrôlés à la recherche d'inhibiteurs du facteur von Willebrand si l'activité plasmatique attendue du facteur von Willebrand n'est pas atteinte ou si l'hémorragie n'est pas maîtrisée au moyen d'une posologie adaptée.
Chez des patients présentant un taux élevé d'inhibiteurs du facteur von Willebrand, il est possible que le traitement par Immunate S/D soit inefficace et d'autres mesures thérapeutiques doivent être envisagées (cf. «Mises en garde et précautions»).
Quand un produit de facteur von Willebrand contenant du facteur VIII est utilisé, le médecin traitant doit avoir conscience du fait qu'avec un traitement à long terme le taux de facteur VIII:C peut fortement augmenter. Afin d'éviter un taux de facteur VIII:C trop élevé on doit envisager de réduire la posologie et/ou prolonger les intervalles de dose après une durée du traitement de 24 à 48 heures.
Enfants et adolescents
Ce produit doit être utilisé avec prudence chez les enfants de moins de 6 ans qui n'ont guère été en contact avec des produits contenant du facteur VIII. Aucune étude formelle clinique n'a été menée dans ce groupe d'âge, néanmoins des rapports de cas cliniques chez des enfants permettent de conclure à son efficacité et à sa tolérance.
Mode d'administration
Procéder à la dissolution telle que décrite dans le paragraphe «Remarques concernant la manipulation». Immunate S/D doit être injecté lentement par voie intraveineuse. La vitesse d'administration dépend du bien-être du patient et ne doit pas dépasser 2 ml/min.
Contre-indicationsHypersensibilité au principe actif ou l'un des excipients.
Mises en garde et précautionsComme c'est le cas de toutes les substances administrées par voie intraveineuse, des réactions d'hypersensibilité peuvent apparaître. Les patients doivent être avertis des signes précoces de réactions d'intolérance, comme par exemple hypotonie, tachycardie, douleur thoracique, dyspnée, œdèmes (y inclus œdèmes faciaux et palpébraux), urticaire, éruption, bouffée congestive et prurit ainsi qu'anaphylaxie jusqu'au choc anaphylactique.
Les patients doivent être avisés du fait que, si ces symptômes apparaissaient, ils doivent interrompre le traitement et consulter leur médecin sans attendre. Le traitement de l'état de choc doit respecter les directives de traitement modernes.
On a également rapporté d'autres réactions à l'infusion, comme frissons, fièvre et nausées, en rapport avec Immunate S/D.
La quantité de sodium pouvant dépasser 200 mg lors de l'administration de doses quotidiennes maximales, les personnes sous régime hyposodé peuvent présenter des effets défavorables.
250 et 500 UI flacon-ampoule:
Immunate S/D contient 9.8 mg de sodium par flacon-ampoule, ce qui équivaut à 0.5% de l'apport alimentaire quotidien maximal recommandé par l'OMS de 2 g de sodium par adulte.
1000 UI flacon-ampoule:
Immunate S/D contient 19.6 mg de sodium par flacon-ampoule, ce qui équivaut à 1% de l'apport alimentaire quotidien maximal recommandé par l'OMS de 2 g de sodium par adulte.
La formation d'anticorps neutralisants (inhibiteurs) contre le facteur VIII est une complication connue du traitement des patients atteints d'hémophilie A. Ces inhibiteurs sont des immunoglobulines IgG toujours dirigées contre l'activité procoagulante du facteur VIII et sont quantifiés en unités Bethesda (B.U.) par ml de plasma au moyen du test Bethesda modifié. Le risque de développer des inhibiteurs est corrélé à la gravité de la maladie ainsi qu’à la sévérité de l'exposition au facteur VIII, le risque étant maximal au cours des 50 premiers jours d'exposition. Le risque persiste toute la vie, mais est classé comme un risque rare. Les patients qui reçoivent un facteur VIII de coagulation humain doivent être soigneusement surveillés sur le plan clinique et au moyen de tests de laboratoire adéquats, afin de dépister le développement d'inhibiteurs. Cf. également «Effets indésirables».
Le risque de développer des inhibiteurs dépend de plusieurs facteurs liés aux caractéristiques de chaque patient. Le type de mutation génétique du facteur VIII, l'anamnèse familiale et l'affiliation ethnique sont comptés parmi les facteurs de risque les plus importants.
Des inhibiteurs ont été observés en majorité chez des patients non préalablement traités.
Immunate S/D est produit à partir de plasma humain. Les mesures habituelles de prévention d'infections (p.ex. virales) par les médicaments préparés à partir de sang ou de plasma humain comprennent la sélection des donneurs, la recherche de marqueurs spécifiques d'infection sur chaque don et sur les pools de plasma et l'inclusion dans le procédé de fabrication d'étapes efficaces pour l'inactivation/élimination virale.
Cependant, lorsque des médicaments préparés à partir de sang ou de plasma humain sont administrés, le risque de transmission d'agents infectieux ne peut pas être totalement exclu. Ceci s'applique également aux virus inconnus ou émergents ou autres types d'agents infectieux.
Les mesures de sécurité prises sont considérées comme efficaces contre les virus enveloppés tels que VIH, VHB et VHC ainsi que contre le virus non enveloppé de l'hépatite A (VHA). Les mesures prises peuvent être d'efficacité limitée vis-à-vis de virus non enveloppés tels que le parvovirus B19.
L'infection par le parvovirus B19 peut être grave chez les femmes enceintes (infection foetale) et chez les sujets immunodéprimés ou présentant une augmentation de la production de globules rouges (par ex. anémie hémolytique).
Le traitement à long terme avec un produit de facteur von Willebrand contenant du facteur VIII peut augmenter fortement le taux de facteur VIII:C. Pendant le traitement de patients souffrant de la maladie de von Willebrand, il existe un risque de survenance d'événements thrombotiques, en particulier en présence de facteurs de risque cliniques connus ou prouvés par des analyses de laboratoire. Par conséquent, il convient de contrôler l'apparition précoce de thromboses chez les patients à risque. Chez des patients avec un historique de thromboembolies veineuses, un taux endogène élevé de facteur VIII a été mis en rapport avec des événements thrombotiques apparus ultérieurement.
Chez les patients traités avec un produit de facteur von Willebrand contenant du facteur VIII, le taux de facteur VIII:C doit absolument être contrôlé afin d'éviter une augmentation persistante comme cela est accompagné d'un risque élevé d'événements thrombotiques.
Une prophylaxie de la thromboembolie doit être menée conformément aux recommandations actuelles.
Les patients souffrant de la maladie de von Willebrand, en particulier du type 3, peuvent développer des anticorps neutralisants (inhibiteurs) contre le facteur de von Willebrand. De tels anticorps peuvent aussi déclencher une anaphylaxie. Des patients qui ont une réaction anaphylactique doivent donc être examinés pour des inhibiteurs du facteur von Willebrand.
Si l'augmentation attendue de l'activité cofacteur de la ristocétine du facteur de von Willebrand n'est pas atteinte ou si les hémorragies ne peuvent pas être contrôlées avec une dose adéquate, il convient de réaliser des tests adéquats pour rechercher la présence d'inhibiteurs de von Willerbrand. Chez les patients présentant un taux d'inhibiteurs élevé, il est possible que le traitement von Willebrand soit inefficace et qu'il convienne d'envisager d'autres mesures thérapeutiques. Ce type de traitement ne peut être administré que par des médecins expérimentés dans le traitement des patients présentant des troubles de la coagulation sanguine.
Pour les patients qui reçoivent régulièrement des préparations dérivées de sang ou de plasmas humains, une vaccination contre l'hépatite A et l'hépatite B est recommandée par principe.
Lors de chaque administration de Immunate S/D à un patient, il est recommandé de documenter le nom et le numéro de lot de la préparation pour pouvoir établir un rapport entre le patient et le lot du produit.
Immunate S/D contient des isoagglutinines (anti-A et anti-B). Chez des patients de groupe sanguin A, B ou AB une hémolyse peut se produire après une administration répétée à intervalles courts ou une administration de très fortes doses. De très fortes doses pendant une courte période sont éventuellement appliquées dans le cadre d'une thérapie d'immunotolérance dans le traitement d'hémophilie A avec inhibiteur du facteur VIII.
Avant l'application d'Immunate S/D il faut absolument assurer que le trouble de la coagulation porte effectivement sur un manque de facteur VIII (hémophilie A) ou un manque de facteur von Willebrand (maladie de von Willebrand).
InteractionsDes études d'interaction n'ont pas été effectuées.
Grossesse, allaitementOn ne dispose pas d'étude de reproduction sur le facteur VIII chez l'animal. Vu la rareté de l'hémophilie A chez la femme, on ne dispose d'aucune expérience sur l'utilisation du facteur VIII pendant la grossesse et l'allaitement. Le facteur VIII ne doit donc être utilisé pendant la grossesse ou l'allaitement qu'en cas d'indication absolue. Informations sur les infections par le parvovirus B19 cf. «Mises en garde et précautions».
Effet sur l’aptitude à la conduite et l’utilisation de machinesAucun effet sur l'aptitude à la conduite et l'utilisation de machines est connu.
Effets indésirablesLes effets indésirables indiqués ci-dessous sont basés sur des études cliniques et des déclarations spontanées après l'autorisation d'Immunate S/D. Leur fréquence a été calculée selon les critères suivants: très fréquents (≥10%), fréquents (≥1% à <10%), occasionnels (≥0,1% à <1%), rares (≥0,01% à <0,1%), très rares (<0.01%).
Etudes cliniques
L'incidence totale des effets indésirables déclarés au cours des études cliniques a été «occasionnelle» (≥0,1% à<1%).
Affections du système immunitaire
Occasionnellement: Réactions allergiques
Effets indésirables après commercialisation
Déclarations spontanées après autorisation
Le taux d'incidence a été «très rare» (<0,01%) pour tous les effets indésirables déclarés, mentionnés ci-dessous.
Affections hématologiques et du système lymphatique
Troubles de la coagulation, inhibition du facteur VIII
Affections psychiatriques
Impatiences
Affections cardiaques
Palpitations, tachycardie
Affections gastro-intestinales
Vomissement, nausées
Troubles généraux et anomalies au site d'administration
Douleur thoracique, gêne thoracique, œdèmes (faciaux et périphériques), irritations au site d'injection (y inclus sensation de brûlure), frissons, douleur, fièvre
Affections du système immunitaire
Hypersensibilité
Affections du système nerveux
Maux de tête, vertiges, paresthésie
Affections respiratoire, thoraciques et médiastinales
Toux, dyspnée
Affections vasculaires
Hypotension, bouffée congestive, pâleur
Affections oculaires
Conjonctivite, œdème palpébral
Affections de la peau et du tissu sous-coutané
Érythème, exanthème, neurodermatite, prurit, éruption cutanée, éruption érythémateuse, éruption papuleuse, urticaire, hyperhidrose
Affections musculosquelettiques et du tissu conjonctif
Myalgies
Les effets indésirables suivants n'ont jamais été rapportés à ce jour, mais pourraient survenir sous Immunate S/D:
Affections hématologiques et du système lymphatique
Hémolyse chez les patients de groupe sanguin A, B ou AB
Troubles généraux et anomalies au site d'administration
Baisse de la réponse thérapeutique
Description de certain effets indésirables
Dans de rares cas on a observé des réactions d'hypersensibilité ou allergiques (y compris: angioedème, sensation de brûlure et de piqûre au site d'injection, frissons, érythème, urticaire généralisé, céphalées, éruption d'urticaire, hypotension, léthargie, nausées, impatiences, tachycardie, sensation d'oppression thoracique, fourmillements, vomissements, stridor et inhibition du facteur von WIllebrand) qui peuvent entraîner une anaphylaxie sévère dans de rares cas (y compris un choc). Il convient de recommander au patient présentant de tels symptômes de consulter son médecin.
De la fièvre a été observée dans quelques cas rares.
Chez les patients souffrant d'hémophilie A qui développent des anticorps neutralisants (inhibiteurs) contre le facteur VIII, cet état se manifeste sous la forme d'une réponse clinique insuffisante. Il est recommandé dans ce cas de consulter un centre d'hémophilie.
Après administration de doses très élevées (lorsqu'il est nécessaire p.ex. d'atteindre un taux plasmatique de facteur VIII supérieur à 100%), les patients de groupe sanguin A, B ou AB peuvent, vu leur taux d'isoagglutinines, développer une hémolyse.
Pour toute information concernant la sécurité virale, cf. «Mises en garde et précautions».
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageJusqu'à présent, on n'a rapporté aucun symptôme de surdosage avec le facteur de la coagulation sanguine VIII humain. Toutefois, en principe, il existe un risque d'événements thromboemboliques. Chez des patients de groupe sanguin A, B ou AB il y a un risque d'hémolyse.
Cf. «Mises en garde et précautions».
Propriétés/EffetsCode ATC
B02BD06
Groupe pharmacothérapeutique: Anti-hémorragique: facteur de la coagulation sanguine VIII.
Mécanisme d'action
Le complexe facteur VIII / facteur de von Willebrand est composé de deux molécules (facteur VIII et facteur de von Willebrand) aux fonctions physiologiques différentes.
Le facteur VIII activé agit en tant que co-facteur du facteur IX activé et accélère la formation du facteur X activé à partir du facteur X. Le facteur X activé transforme la prothrombine en thrombine. Celle-ci transforme le fibrinogène en fibrine et la formation du caillot peut avoir lieu. L'hémophilie A est un trouble congénital de la coagulation sanguine, lié au sexe, dû à un déficit en facteur VIII:C. Ceci entraîne, soit spontanément soit suite à de traumatismes accidentels ou chirurgicaux, de fortes hémorragies des articulations, des muscles ou des organes internes. Le traitement de substitution élève le taux plasmatique de facteur VIII, ce qui entraîne une correction transitoire du déficit en facteur VIII et de la tendance aux hémorragies.
Le facteur de von Willebrand (vWF), en plus de son rôle de protéine stabilisant le facteur VIII, contrôle l'adhérence des thrombocytes aux sites de lésion vasculaire, joue un rôle dans l'agrégation des thrombocytes et est indispensable au traitement de substitution chez les patients atteints de maladie de von Willebrand.
PharmacocinétiqueUne étude pharmacocinétique portant sur 18 patients a montré, après analyse complète, les résultats ci-dessous.
Le tableau suivant indique les propriétés pharmacocinétiques du facteur de coagulation VIII:
|
Paramètre
|
Nombre
|
Val. Moy.
|
DS
|
Médiane
|
IC 90%
| |
AUC0-48h ([UI x h]/ml)
|
18
|
11,4
|
2,8
|
11,6
|
10,9 – 12,7
| |
AUC0-∞ ([UI x h]/ml)
|
18
|
12,2
|
3,1
|
12,4
|
11,1 – 13,2
| |
Cmax (UI/ml)
|
18
|
1,0
|
0,3
|
0,9
|
0,8 – 1,0
| |
Tmax (h)
|
18
|
0,3
|
0,1
|
0,3
|
0,3 – 0,3
| |
Demi-vie terminale (h)
|
18
|
12,7
|
3,2
|
12,2
|
10,8 – 15,3
| |
Clearance (ml/h)
|
18
|
283
|
146
|
232
|
199 – 254
| |
Durée de présence moy.(h)
|
18
|
15,3
|
3,6
|
15,3
|
12,1 – 17,2
| |
Vss (ml)
|
18
|
4166
|
2021
|
3613
|
2815 – 4034
| |
Incremental Recovery ([UI/ml]/
[UI/kg])
|
18
|
0,020
|
0,006
|
0,019
|
0,016 – 0,020
|
Le tableau suivant indique les propriétés pharmacocinetique de vWF:Ag:
|
Paramètre
|
Nombre
|
eMédian
|
IC 90%
| |
AUC0-∞ ([UI xh]/ml)
|
15
|
24.6
|
12.8 – 48.3
| |
Cmax (UI/ml)
|
17
|
1.40
|
1.15 – 1.51
| |
Tmax (h)
|
17
|
0.28
|
0.25 – 1.00
| |
Demi-vie terminale (h)
|
16
|
13.6
|
10.5 – 47.2
| |
Clearance (ml/h)
|
15
|
136
|
68 – 178
| |
Durée de présence moy.(h)
|
15
|
23.1
|
12.4 – 57.1
| |
Vss (ml)
|
15
|
3156
|
2391 – 4672
| |
Incremental Recovery ([UI/ml]/
[UI/kg])
|
17
|
0.028
|
0.024 – 0.030
|
Données précliniquesLe facteur de coagulation VIII humain contenu dans Immunate S/D est un composant physiologique du plasma humain et il se comporte comme le facteur de coagulation VIII de l'organisme.
Les données pré-cliniques basées sur les études de toxicité aiguë, la tolérance locale et l'immunogénicité n'indiquent aucun danger particulier pour l'être humain.
Remarques particulièresIncompatibilités
Immunate S/D ne doit pas être mélangé à d'autres médicaments ou solutions, car leur sécurité ou leur efficacité pourraient s'en voir réduites. Il convient d'utiliser exclusivement la trousse fournie car l'adsorption du facteur de coagulation VIII sur les faces internes de certains sets de perfusion peut être responsable d'un échec du traitement.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient (cf. «Remarques concernant le stockage»). Après dissolution, conserver à température ambiante (15-25 °C) et administrer dans les 3 heures. Du point de vue microbiologique, le produit devrait être toujours reconstitué juste avant son application.
Remarques particulières concernant le stockage
Conserver à 2-8°C. Ne pas congeler. Conserver à l'abri de la lumière dans son emballage original.
Pendant la durée de validité, le produit peut être conservé une seule fois à température ambiante (au maximum 25°C) pendant une période allant jusqu'à 6 mois. Le début du stockage à température ambiante doit être inscrit au-dessous de la date de péremption imprimée. Après la conservation à température ambiante, ne pas replacer le produit au réfrigérateur, mais soit l'utiliser soit le jeter.
Conserver hors de la portée des enfants.
Remarques concernant la manipulation
Immunate S/D doit être reconstitué immédiatement avant utilisation. La solution devrait être utilisée immédiatement car elle ne contient aucun agent conservateur. Inspecter la solution visuellement avant l'administration pour s'assurer de l'absence de particules en suspension et de décoloration. Jeter les solutions troubles ou contenant un précipité. Il est recommandé de rincer toute voie veineuse commune à l'aide d'une solution saline avant et après l'administration d'Immunate S/D.
Dissolution de la substance sèche: travailler dans des conditions aseptiques comme suit:
1.Réchauffer le solvant (eau stérile pour préparations injectables) dans son flacon non ouvert à température ambiante (37°C au maximum).
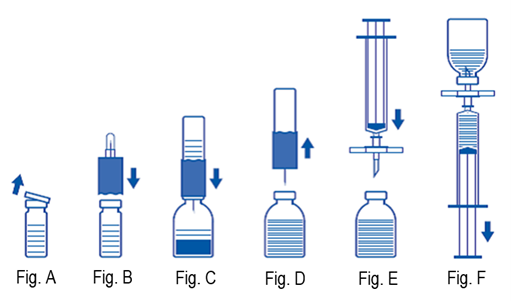
2.Retirer les capuchons protecteurs des flacons contenant le produit et le solvant (Fig. A) et désinfecter les bouchons en caoutchouc des deux flacons.
3.Placer le set de transfert, côté ondulé, sur le flacon de solvant et presser (Fig. B).
4.Retirer le capuchon protecteur à l'autre extrémité du set de transfert. Ne pas toucher l'aiguille nue!
5.Piquer le set de transfert avec le flacon de solvant fixé, depuis le haut, dans le flacon de produit (Fig. C). Le vide constitué dans le flacon aspire le solvant.
6.Après 1 minute environ, retirer le set de transfert et le flacon de solvant du flacon de produit (Fig. D). Le produit se dissolvant rapidement, seul un léger renversement du flacon du produit suffit. NE PAS AGITER LE CONTENU DU FLACON DE PRODUIT. NE RETOURNER LE FLACON DE PRODUIT QUE JUSTE AVANT D'EN PRELEVER LE CONTENU.
7.Les produits parentéraux tels qu'Immunate S/D doivent faire l'objet d'une inspection visuelle après dissolution et avant utilisation afin de déceler toute particule et décoloration. Même si l'on respecte strictement les étapes de travail, il est possible que de petites particules soient détectables. Le filtre pour seringue fourni permet d'éliminer ces particules. Cela ne réduit pas la concentration du composant médicamenteux actif indiquée sur l'emballage.
Travailler dans des conditions aseptiques comme suit:
1.Afin d'empêcher l'administration de particules de caoutchouc du bouchon (danger de micro-embolies), il convient d'utiliser, pour aspirer le produit dissout, le filtre pour seringue fourni. Fixer le filtre pour seringue sur la seringue jetable fournie et piquer le bouchon de caoutchouc (Fig. E)
2.Oter de temps à autre la seringue du filtre permet de purger le flacon de produit, ce qui fait disparaître la mousse qui s'est éventuellement formée. Aspirer ensuite la solution injectable dans la seringue à travers le filtre (Fig. F).
3.Retirer le filtre de la seringue et administrer lentement la solution au moyen du set de perfusion fourni (ou de l'aiguille jetable) par voie intraveineuse (vitesse d'injection maximale: 2 ml par minute).
Eliminer dans les règles de l'art les solutions restantes, les flacons vides, les aiguilles et seringues utilisées.
Numéro d’autorisation52715 (Swissmedic)
PrésentationImmunate S/D 250 UI
Flacon-ampoule contenant 250 UI de facteur VIII lyophilisé
Flacon-ampoule contenant 5 ml d'eau pour préparations injectables
Trousse pour la reconstitution et l'injection
Immunate S/D 500 UI
Flacon-ampoule contenant 500 UI de facteur VIII lyophilisé
Flaconampoule contenant 5 ml d'eau pour préparations injectables
Trousse pour la reconstitution et l'injection
Immunate S/D 1000 UI
Flacon-ampoule contenant 1000 UI de facteur VIII lyophilisé
Flacon contenant 10 ml d'eau pour préparations injectables
Trousse pour la reconstitution et l'injection
Catégorie de remise: B
Titulaire de l’autorisationTakeda Pharma AG, 8152 Opfikon
Mise à jour de l’informationMars 2024
|

