CompositionPrincipes actifs
Dinoprostonum.
Excipients
Hydrogel polymérique
Macrogolum 8000 (E1521), 1,2,6-Hexantriolum, Dicyclohexylis methani-4,4'-diisocyanas, Ferri chloridum.
Retiré du système
Polyesterum.
Indications/Possibilités d’emploiMaturation cervicale médicamenteuse pour l'induction du travail à terme (dès la 37e semaine de grossesse révolue) lorsque le score de Bishop est ≤6 et si le déclenchement du travail est indiqué en l'absence de contre-indications relatives à la mère ou à l'enfant.
Posologie/Mode d’emploiPropess ne doit être utilisé qu'au sein de cliniques disposant de services d'obstétrique parfaitement équipés et dotés d'installations de soins intensifs permettant une surveillance continue de l'activité utérine et du fœtus, sous la supervision de médecins spécialistes qualifiés.
Après l'insertion du dispositif vaginal, l'activité utérine et l'état du fœtus doivent être surveillés attentivement et régulièrement.
Dès le déclenchement du travail, le dispositif vaginal doit être retiré. Il s'enlève en tirant légèrement sur le cordon en polyester.
Propess doit être retiré 24 h au plus tard après l'insertion, indépendamment du fait qu'une maturation cervicale ait eu lieu ou non. Si un traitement par l'ocytocine s'impose après le retrait du dispositif vaginal, on observera un intervalle d'au moins 30 min. Il est déconseillé d'administrer un deuxième dispositif vaginal Propess.
Mode d'emploi
Voir «Remarques particulières», rubrique «Remarques concernant la manipulation».
Instructions posologiques particulières
Enfants et adolescents
La sécurité et l'efficacité de Propess n'ont pas été étudiées chez des femmes enceintes âgées de moins de 18 ans.
Patientes âgées
Propess n'a pas d'indication chez les femmes après la ménopause.
Patientes présentant des troubles de la fonction rénale
Propess n'a pas été étudié chez des patientes atteintes d'insuffisance rénale. Il n'est donc pas possible d'émettre des recommandations posologiques. Propess ne doit pas être utilisé chez des patientes atteintes d'insuffisance rénale sévère ou terminale, car le métabolisme et l'élimination des prostaglandines peuvent être altérés.
Patientes présentant des troubles de la fonction hépatique
Propess n'a pas été étudié chez des patientes atteintes d'insuffisance hépatique. Il n'est donc pas possible d'émettre des recommandations posologiques.
Contre-indications·Signes de complications maternelles ou fœtales, notamment souffrance fœtale ou hyperstimulation utérine;
·Antécédents de chirurgie utérine majeure, par exemple une césarienne, une myomectomie (voir «Mises en garde et précautions»);
·Antécédents de rupture du col de l'utérus ou d'interventions chirurgicales majeures du col de l'utérus (c'est-à-dire autre que des biopsies et abrasions cervicales);
·Conditions défavorables à un accouchement naturel, soit p.ex. présentation par le siège, présentations défléchies, disproportion fœto-pelvienne marquée, détresse fœtale supposée ou confirmée, antécédents d'accouchements difficiles ou traumatisants;
·Placenta prævia;
·Inflammations pelviennes;
·Hémorragies utérines inexpliquées au cours de la grossesse actuelle;
·Multipares avec plus de 3 accouchements antérieurs à terme;
·Grossesse multiple;
·Administration d'ocytocine et/ou d'autres substances induisant le travail (voir «Interactions»);
·Après déclenchement du travail;
·Avant amniotomie;
·Hypersensibilité connue ou supposée aux prostaglandines ou à l'un des excipients.
Mises en garde et précautionsPropess ne doit être utilisé qu'au sein de cliniques disposant de services d'obstétrique spécialisés et dotés d'installations permettant une surveillance fœtale et utérine continue.
Avant d'utiliser Propess, on déterminera avec soin l'aptitude de la patiente à le recevoir, notamment en ce qui concerne l'état du col. Après l'insertion du dispositif vaginal, l'activité utérine et l'état du fœtus doivent être surveillés attentivement et régulièrement par des professionnels de santé qualifiés, ou à intervalles brefs et réguliers par le biais d'appareils électroniques. La dilatation du col doit être régulièrement contrôlée. En cas de complications chez la mère ou le fœtus ou d'autres effets indésirables, le traitement doit être interrompu par retrait du dispositif vaginal hors du vagin.
Propess ne doit pas être utilisé chez les patientes ayant préalablement subi une césarienne ou une autre chirurgie utérine, en raison du risque de rupture utérine et des complications qui y sont associées. Des cas de rupture utérine ont été rapportés dans le cadre de l'utilisation de Propess, notamment chez des patientes chez lesquelles le médicament a été administré malgré la présence de contre-indications (voir «Contre-indications»).
Propess ne doit être administré qu'avec prudence chez les patientes présentant des antécédents d'hypertonie utérine.
En cas de survenue de contractions utérines excessives ou prolongées, le dispositif vaginal Propess doit être retiré immédiatement, en raison du risque d'hypertonie ou de rupture utérine.
Des modifications de CTG et une souffrance fœtale aspécifique ont été observées pendant et après l'application intravaginale de dinoprostone. Une activité utérine accrue à contractions hypertoniques avec ou sans souffrance fœtale s'est également manifestée. Etant donné que les prostaglandines potentialisent l'effet utérotonique des médicaments pour le déclenchement du travail, le risque d'une hyperstimulation augmente si la dinoprostone n'est pas arrêtée avant d'administrer un ocytocique.
Des cas de mort fœtale in utero ainsi que de décès chez les nouveau-nés après le déclenchement du travail avec Propess ont été observés après l'autorisation de mise sur le marché, notamment après des complications préalables graves, telles qu'une rupture utérine.
L'expérience est limitée quant à l'utilisation de Propess chez des patientes avec rupture précoce de la poche. Il convient donc d'observer une grande prudence en l'appliquant chez ces patientes. Etant donné que le liquide amniotique peut accélérer la libération du principe actif hors du dispositif vaginal (voir «Pharmacocinétique»), l'activité utérine et la vitalité fœtale sont à surveiller avec un soin particulier.
On ne dispose d'aucune donnée concernant l'utilisation de Propess en cas de maladies caractérisées par une altération de la fonction pulmonaire, hépatique ou rénale. Le métabolisme de la prostaglandine E2 pouvant être modifié en présence de ces maladies, l'utilisation de Propess chez ces patientes n'est pas recommandée.
Après le déclenchement du travail, un risque accru de coagulation intravasculaire disséminée (CIVD) a été décrit post partum. Sont considérés comme des facteurs de risque d'une CIVD un âge ≥35 ans et un âge gestationnel >40 semaines, des complications durant la grossesse telles qu'une hypertension artérielle, un diabète gestationnel ou une hypothyroïdie. Ces facteurs peuvent en outre augmenter le risque de CIVD chez les femmes pour lesquelles le travail a été déclenché de façon pharmacologique. En présence de tels facteurs de risque, les médicaments utérotoniques tels que Propess doivent donc être utilisés avec une prudence particulière et, dans la période post-partum, le médecin doit porter surveiller attentivement tous les signes éventuels de CIVD (comme une fibrinolyse).
Le médecin traitant doit tenir compte du fait que l'utilisation de dinoprostone et d'autres méthodes de déclenchement du travail peut entraîner une altération ou un décollement involontaire du placenta et une embolie consécutive du tissu antigénique. Dans de rares cas, il peut en résulter un syndrome anaphylactoïde de la grossesse (embolie amniotique).
Lors d'infections du vagin ou du col, celles-ci sont à traiter avant l'induction du travail.
Si une anesthésie péridurale est induite avant la rupture de la poche des eaux et avant le début attendu du travail, il est recommandé de retirer préalablement le dispositif vaginal Propess.
Propess ne doit être utilisé qu'avec prudence dans les situations suivantes: troubles de la fonction cardiovasculaire, asthme ou glaucome.
Une répétition du traitement avec une deuxième dose de Propess n'est pas recommandée car ses effets n'ont pas été étudiés.
Avant l'utilisation de Propess, il convient d'arrêter un traitement par des anti-inflammatoires non stéroïdiens (acide acétylsalicylique inclus), car il pourrait diminuer l'effet de Propess (voir «Interactions»).
InteractionsAucune étude d'interaction n'a été réalisée avec Propess.
Les prostaglandines peuvent potentialiser l'action utérotonique d'autres médicaments pour le déclenchement du travail. Par conséquent, il ne faut pas administrer Propess simultanément avec ces autres médicaments. En cas d'administration séquentielle d'ocytocine à la suite d'une utilisation de Propess, l'intervalle doit être au moins de 30 min, et l'activité utérine et la vitalité fœtale doivent être contrôlées en permanence.
Les anti-inflammatoires non stéroïdiens (AINS) diminuent la synthèse endogène des prostaglandines, ce qui peut antagoniser l'effet pharmacodynamique de la dinoprostone sur le myomètre et retarder son début d'action. C'est pourquoi il convient d'arrêter l'administration de ces médicaments avant d'utiliser la dinoprostone.
Grossesse, allaitementGrossesse
Propess est exclusivement destiné à la maturation du col à terme chez la femme enceinte, lors d'une indication favorable à un déclenchement du travail.
Propess ne doit pas être utilisé pendant les phases antérieures de la grossesse (c.-à-d. avant la 37e semaine de grossesse révolue).
Allaitement
Aucune étude n'a été réalisée pour quantifier la dinoprostone dans le colostrum ou le lait maternel après administration de Propess. La dinoprostone pourrait passer dans le colostrum et le lait maternel. Compte tenu de la courte demi-vie de la dinoprostone et de ses métabolites principaux, un effet négatif de l'allaitement sur l'enfant n'est toutefois pas attendu.
Effet sur l’aptitude à la conduite et l’utilisation de machinesNon pertinent.
Effets indésirablesLes effets indésirables les plus fréquemment rapportés sous application de Propess au cours des études cliniques contrôlées, en double aveugle, menées chez n=1116 patientes, ont été des troubles de la fréquence cardiaque fœtale (6,9%), des contractions utérines anormales (6,2%) et un travail anormal ayant une incidence sur le fœtus (2,6%).
Les effets indésirables indiqués ci-après en fonction du système d'organes et de leur fréquence sont ceux qui ont été observés pendant l'accouchement lors de l'administration de Propess, au cours des études cliniques et dans le cadre de la pharmacovigilance.
Les fréquences sont définies comme suit: très fréquents (≥1/10), fréquents (≥1/100 et <1/10), occasionnels (≥1/1000 et <1/100), rares (≥1/10'000 et <1/1000), très rares (<1/10'000), fréquence indéterminée (basée essentiellement sur des rapports spontanés issus de la pharmacovigilance, la fréquence exacte ne peut donc pas être évaluée).
Affections hématologiques et du système lymphatique
Fréquence inconnue: coagulation intravasculaire disséminée.
Affections du système immunitaire
Fréquence inconnue: réactions d'hypersensibilité (réactions anaphylactiques incluses).
Affections du système nerveux
Occasionnels: céphalées.
Affections cardiaques
Fréquents: troubles de la fréquence cardiaque fœtale.
Occasionnels: hypotension.
Affections gastro-intestinales
Fréquence inconnue: douleurs abdominales, nausées, vomissements, diarrhée.
Affections de la peau et du tissu sous-cutané
Occasionnels: prurit.
Affections gravidiques, puerpérales et périnatales
Fréquents: travail anormal (incluant les cas avec dommage au fœtus), méconium dans le liquide amniotique.
Occasionnels: hémorragie du post-partum, décollement prématuré du placenta, arrêt du travail, chorioamniotite, atonie utérine.
Fréquence inconnue: rupture utérine, syndrome anaphylactoïde de la grossesse, souffrance fœtale, mortinatalité (voir «Mise en garde et précautions»).
Affections des organes de reproduction et du sein
Occasionnels: sensation de brûlure dans la région vulvovaginale.
Fréquence inconnue: œdèmes dans la région génitale.
Troubles généraux et anomalies au site d'administration
Rares: troubles fébriles.
Les effets indésirables suivants ont été décrits chez le nouveau-né après utilisation de Propess au cours de l'accouchement:
Affections du système nerveux
Au cours des études cliniques, un cas d'encéphalopathie néonatale a été observé lors de l'utilisation de Propess. En raison du type de maladies sous-jacentes de la mère ainsi que des multiples comédications maternelles pré- et périnatales, l'évaluation d'un éventuel rapport causal avec la dinoprostone n'est pas possible.
Affections respiratoires, thoraciques et médiastinales
Occasionnels: syndrome de détresse respiratoire.
Affections hépatobiliaires
Occasionnels: hyperbilirubinémie néonatale.
Affections gravidiques, puerpérales et périnatales
Occasionnels: score d'Apgar bas.
Fréquence inconnue: mort néonatale.
On sait que la dinoprostone maintient le canal artériel ouvert pendant la grossesse. Aucune cyanose n'a cependant été décrite pendant la phase néonatale après l'utilisation de Propess.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageUn surdosage ou une hypersensibilité à la PGE2 peut provoquer de fortes contractions utérines trop fréquentes allant jusqu'à l'hypertonie utérine avec ou sans souffrance fœtale. En pareils cas, le dispositif vaginal Propess doit être retiré immédiatement et la souffrance fœtale doit, le cas échéant, être traitée. Si l'hyperstimulation utérine persiste malgré l'arrêt du traitement, une tocolyse doit être effectuée (p.ex. avec des bêtamimétiques appropriés).
Propriétés/EffetsCode ATC
G02AD02
Mécanisme d'action
Le dispositif vaginal Propess se compose d'un polymère plat rectangulaire non dégradable aux angles arrondis qui sert de matrice au principe actif, et est pourvu d'un filet en polyester comportant un cordon qui facilite le retrait du dispositif vaginal.
Le principe actif de Propess est la dinoprostone qui correspond à la prostaglandine naturelle E2 (PGE2).
Au cours de la maturation cervicale, la dinoprostone entraîne de multiples modifications biochimiques et structurelles dont l'action combinée réduit la résistance du segment inférieur de l'utérus. Le col ramollit alors, et l'ostium se dilate jusqu'à permettre le passage du fœtus dans la filière pelvi-génitale. L'enzyme collagénase est activée en même temps.
L'administration locale continue de la dinoprostone entraîne la maturation du col et des contractions utérines rythmiques, ce qui provoque ainsi l'induction du travail.
Pharmacodynamique
Voir «Mécanisme d'action».
Efficacité clinique
Voir «Mécanisme d'action».
PharmacocinétiqueAbsorption
La matrice non biodégradable du dispositif vaginal libère en moyenne env. 0,3 mg/h de dinoprostone pendant 24 h chez la patiente aux membranes intactes dont le pH vaginal se situe à 4. Chez la patiente présentant une rupture prématurée de la poche des eaux (et dont le pH vaginal qui en résulte se situe à 6), la libération cumulée après 3 à 12 h de dinoprostone par la matrice du dispositif vaginal est généralement plus élevée d'env. 2 mg.
Le réservoir de 10 mg sert à assurer une libération constante du principe actif.
Distribution
La dinoprostone est liée à 73% à l'albumine sérique et rapidement distribuée dans les tissus.
Métabolisme
La dinoprostone est métabolisée dans les poumons, le rein, le foie et la rate par différents systèmes enzymatiques. Lors d'un passage pulmonaire, 90% sont métabolisés. Au moins 9 métabolites ont été retrouvés dans le sang et l'urine. Le métabolite principal, 11 alpha-hydroxy-9,15 dioxoprost-5-énoïque, exerce 50% de l'activité thérapeutique de la dinoprostone.
Élimination
La demi-vie de la dinoprostone dans le sang est d'1 à 3 minutes. La majeure partie de la dose administrée est éliminée par voie rénale sous forme d'acides dicarboxyliques et de lactones.
Cinétique pour certains groupes de patients
On ne dispose de données relatives à la pharmacocinétique ni chez les insuffisantes hépatiques ou rénales ni chez les patientes adolescentes.
Données précliniquesL'expérimentation animale a fourni des indices de prolifération osseuse sous prostaglandines des groupes E et F fortement dosées. Des effets semblables ont été observés chez des nouveau-nés lors d'un traitement prolongé par prostaglandines. L'administration de courte durée de Propess aux fins de la maturation cervicale précédant l'induction du travail n'a pas révélé d'effets de ce genre.
Les composants en hydrogel et en polyester du dispositif vaginal sont inertes. La tolérance locale est bonne.
La toxicité de reproduction, la génotoxicité et la cancérogénicité des polymères n'ont pas été étudiées; toutefois la durée d'exposition est courte, elle est au maximum de 24 h.
Remarques particulièresStabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques particulières concernant le stockage
Propess doit être conservé au congélateur à moins de –15°C.
Conserver hors de portée des enfants.
Remarques concernant la manipulation
Propess doit être mis en place uniquement à l'hôpital et par du personnel formé spécialisé en obstétrique. Le dispositif vaginal doit être sorti du congélateur immédiatement avant l'insertion. Aucune décongélation n'est nécessaire avant utilisation. Le dispositif vaginal doit être conservé dans le sachet en aluminium/polyéthylène scellé jusqu'à l'utilisation. Sur l'un des côtés du sachet se trouve un trait repère pour l'ouverture de l'emballage. Ouvrez l'emballage en suivant ce trait repère tout le long de l'extrémité supérieure du sachet. À cette fin, n'utilisez pas de ciseaux ou d'autres objets coupants qui pourraient endommager le dispositif vaginal ou le cordon de retrait.
Le dispositif vaginal ne doit en aucun cas être retiré du système de retrait.
Le dispositif vaginal est introduit haut dans le cul-de-sac postérieur du vagin (voir Figure a). Afin de s'assurer que Propess reste en place, il doit être tourné de 90° pour se retrouver transversalement dans le cul-de-sac postérieur du vagin (Figure b). Pour faciliter l'insertion, une petite quantité de lubrifiant hydrosoluble peut être utilisée le cas échéant.
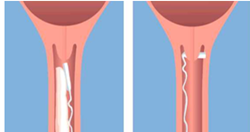
Fig. a Fig. b
Une fois Propess inséré, le cordon de retrait peut être coupé avec des ciseaux en le faisant dépasser du vagin seulement de quelques centimètres afin de faciliter le retrait. L'extrémité du cordon ne doit pas être placée dans le vagin, car cela pourrait compliquer le retrait.
Après l'insertion, la patiente doit rester allongée pendant 20 à 30 minutes avant de pouvoir se lever. Il convient de s'assurer que Propess ne soit pas retiré accidentellement lors du passage aux toilettes ou lors d'examens vaginaux.
Retrait: Propess est retiré en tirant légèrement sur le cordon de retrait.
Après l'insertion, Propess gonfle et est malléable. Après le retrait, on vérifiera que le produit complet (dispositif et cordon de retrait) a été retiré du vagin.
Numéro d’autorisation53915 (Swissmedic)
PrésentationEmballage hospitalier avec 5 dispositif vaginal. (A)
Titulaire de l’autorisationFerring AG, 6340 Baar
Mise à jour de l’informationNovembre 2021
| 
