CompositionPrincipe actif
Facteur de coagulation VIII de plasma humain.
Excipients
Glycine, saccharose, chlorure de sodium (correspondant à 2,3 mg/ml de sodium resp. 11,5 par U.I. et 23 mg par 1000 U.I.), chlorure de calcium.
Indications/Possibilités d’emploi·Thérapie et prophylaxie des hémorragies chez les patients atteints de déficience congénitale en facteur VIII (hémophilie A).
·Le produit peut être utilisé lors de déficience acquise du facteur de coagulation VIII.
·Beriate ne contient pas de facteur de von Willebrand en quantité pharmacologiquement active; par conséquent, il ne peut être utilisé pour traiter le syndrome de von Willebrand-Jürgens.
Posologie/Mode d’emploiLe traitement ne peut être instauré que sous la surveillance d'un médecin expérimenté dans le traitement de l'hémophilie.
Posologie
La posologie et la durée du traitement de substitution dépendent de la gravité du déficit en facteur VIII, de la sévérité et de la localisation du saignement ainsi que de l'état clinique du patient.
La dose de facteur VIII administrée est exprimée en Unités Internationales (U.I.), ramenées au standard de l'OMS pour les concentrés de facteur VIII. L'activité en facteur VIII dans le plasma est exprimée soit en pourcentage (par rapport au plasma humain), soit en U.I. (par rapport au Standard International du facteur VIII plasmatique). Une U.I. de facteur VIII correspond à la teneur en facteur VIII dans 1 ml de plasma humain normal.
Le calcul de la posologie de facteur VIII nécessaire se base sur le résultat empirique, selon lequel une U.I. de facteur VIII/kg de poids corporel augmente l'activité du facteur VIII d'environ 2% (2 U.I./dl) dans le plasma par rapport à l'activité normale. La dose nécessaire est déterminée selon la formule suivante:
Dose initiale: Unités nécessaires = poids corporel (kg) × élévation souhaitée du facteur VIII (% ou U.I./dl) × 0,5.
IMPORTANT:
Dans chaque cas, on orientera la posologie et la durée du traitement en fonction de l'efficacité clinique.
Dans les situations suivantes d'hémorragie, l'activité plasmatique du facteur VIII (en % par rapport à la norme ou en U.I./dl) ne devrait pas s'abaisser au-dessous des valeurs indiquées, durant la période correspondante:
Le tableau ci-dessous peut servir de guide pour les posologies lors d'épisodes hémorragiques et interventions chirurgicales.
|
Importance de l'hémorragie/type d'intervention chirurgicale
|
Taux nécessaire de déficience en facteur VIII (% ou U.I./dl)
|
Fréquence de posologie (heures)/durée de traitement (jours)
| |
Hémorragies
| |
Hémarthroses précoces, saignements musculaires ou saignements dans la cavité buccale
|
20 à 40
|
Répéter les perfusions toutes les 12 à 24 heures pendant au moins 1 jour, jusqu'à la fin de l'épisode hémorragique (indiquée par la disparition de la douleur) ou jusqu'à la cicatrisation complète
| |
Hémarthroses plus étendues, saignements musculaires ou hématomes
|
30 à 60
|
Répéter les perfusions toutes les 12 à 24 heures pendant 3 à 4 jours, ou plus longtemps, jusqu'à la disparition de la douleur et des restrictions de l'appareil locomoteur
| |
Hémorragies susceptibles de mettre la vie en danger
|
60 à 100
|
Répéter les perfusions toutes les 8 à 24 heures jusqu'à ce que le patient soit hors de danger
| |
Interventions chirurgicales
| |
Interventions mineures y compris avulsion de dents
|
30 à 60
|
Toutes les 24 heures pendant au moins 1 jour, jusqu'à la cicatrisation complète
| |
Interventions majeures
|
80 à 100 (pré- et postopératoire)
|
Répéter les perfusions toutes les 8 à 24 heures jusqu'à la cicatrisation adéquate complète, puis poursuivre le traitement pendant au moins 7 jours supplémentaires pour maintenir un taux d'activité de facteur VIII entre 30% et 60% (U.I./dl)
|
Comme mesure prophylactique à long terme des hémorragies chez les patients atteints d'hémophilie A grave, les doses usuelles sont de 20 à 40 U.I. de facteur VIII par kg de poids corporel, à des intervalles de 2 à 3 jours. Dans certains cas, et surtout chez les patients jeunes, des intervalles de traitement plus courts et des doses plus élevées peuvent être nécessaires. Au cours du traitement, il est conseillé d'effectuer une détermination appropriée des taux de facteur VIII plasmatique pour régler la dose à administrer et la fréquence des injections. Une surveillance rigoureuse de l'hémostase et de la coagulation (activité plasmatique du facteur VIII) est indispensable lors de thérapie de substitution, surtout en cas d'intervention chirurgicale majeure. La réponse des patients au facteur VIII peut varier, entraînant différents taux de récupération in vivo et différentes demi-vies.
Le développement d'inhibiteurs contre le facteur VIII doit être régulièrement surveillé chez les patients.
Patients non traités antérieurement
La sécurité et l'efficacité de Beriate sur des patients non traités antérieurement n'a pas été étudiée jusqu'à présent.
Afin d'assurer la traçabilité des médicaments biologiques, il est recommandé d'enregistrer le nom commercial et le numéro de lot lors de chaque traitement.
Enfants et adolescents
Chez l'enfant, la posologie sera adaptée au poids corporel, en suivant généralement les mêmes directives que chez l'adulte. Dans chaque cas, la fréquence de l'administration doit toujours être adaptée en fonction de l'efficacité clinique. De l'expérience dans le traitement d'enfants âgés de plus de 6 ans a été acquise et l'on dispose aussi de données de traitement pour 16 enfants de moins de 6 ans. Les résultats disponibles sur l'efficacité clinique et la sécurité étaient en concordance avec les données groupant les patients plus âgés.
Mode d'emploi
Reconstituer Beriate comme décrit dans le chapitre «Remarques particulières» (cf. «Remarques concernant la manipulation»). Beriate doit être administré lentement par voie intraveineuse. La vitesse d'administration ne doit pas excéder 2 ml/min.
Contre-indicationsHypersensibilité par rapport au principe actif ou à l'un des excipients selon la composition.
Mises en garde et précautionsLa prudence est de rigueur lorsque le patient a des réactions allergiques connues à l'un ou l'autre des composants de la préparation. Les patients à diathèse allergique connue recevront à titre prophylactique des antihistaminiques et des corticostéroïdes.
En cas de réactions allergiques ou anaphylactoïdes, interrompre immédiatement l'administration du produit. En cas de chocs anaphylactiques, observer les standards de la médecine actuelle (voir aussi sous chapitre «Effets indésirables»).
Beriate contient des quantités mineures d'isoagglutinines des groupes sanguins. Cela n'a aucune importance clinique tant que le choix est porté sur les posologies usuelles pour la thérapie d'hémorragies mineures ou moyennes. Il faut cependant faire attention aux signes d'hémolyse et surveiller le taux baissant de l'hématocrite, si l'on administre des doses uniques fréquentes ou élevées à des patients des groupes sanguins A, B resp. AB.
Inhibiteurs
L'apparition d'anticorps neutralisants (inhibiteurs) du facteur VIII est une complication connue dans le traitement des patients atteints d'hémophilie A. Ces inhibiteurs sont habituellement des immunoglobulines IgG dirigées contre l'activité procoagulante du facteur VIII, et sont mesurés en Unités Bethesda par ml de plasma par le test de Bethesda modifié. Le risque de développer des inhibiteurs est corrélé à la durée de l'exposition au facteur VIII – le risque étant le plus élevé au cours des 20 premiers jours d'exposition. Plus rarement, les inhibiteurs peuvent apparaître après les 100 premiers jours d'exposition. Des cas de retour d'inhibiteurs (avec un faible titre/niveau d'inhibiteur) ont été observés lors d'un changement d'un produit FVIII à un autre chez des patients traités antérieurement, présentant des antécédents de développement d'inhibiteurs. Il est dès lors recommandé de surveiller attentivement le développement d'inhibiteurs chez tous les patients après chaque changement de produit. Fondamentalement, tous les patients traités par le facteur de coagulation VIII d'origine humaine doivent être surveillés attentivement eu égard à l'apparition d'inhibiteurs. Si le niveau plasmatique attendu de l'activité du FVIII n'est pas atteint ou lorsqu'une hémorragie n'est pas régulée par une dose appropriée, un test de détection d'inhibiteurs du FVIII doit être réalisé. Chez des patients présentant des niveaux d'inhibiteur élevés, le traitement par le FVIII peut être inefficace et d'autres possibilités de traitement doivent être envisagées. Le traitement de ces patients doit être réalisé par des médecins expérimentés dans la thérapie de patients atteints d'hémophilie A et de patients présentant des inhibiteurs du FVIII (voir également sous chap. «Effets indésirables»).
Beriate ne peut être utilisé pour la thérapie du syndrome de von Willebrand, parce qu'aucun effet n'est à espérer dans ce cas.
Sécurité virale
Beriate est produit à partir de plasma humain. Les mesures habituelles de prévention du risque de transmission d'agents infectieux par les médicaments préparés à partir de sang ou de plasma humain comprennent la sélection clinique des donneurs, la recherche des marqueurs spécifiques d'infection sur chaque don et sur les pools de plasma et l'inclusion dans le procédé de fabrication d'étapes efficaces pour l'inactivation/l'élimination virale. Cependant, lorsque des médicaments préparés à partir de sang ou de plasma humain sont administrés, le risque de transmission d'agents infectieux ne peut pas être totalement exclu. Ceci s'applique également aux virus inconnus ou émergents ou à d'autres types d'agents infectieux.
Les mesures mises en place sont considérées comme efficaces vis-à-vis des virus enveloppés tels que par ex. le virus de l'immunodéficience humaine (VIH), le virus de l'hépatite B (VHB) et le virus de l'hépatite C (VHC) ainsi que vis-à-vis des virus non-enveloppés tels que le virus de l'hépatite A VHA et le parvovirus B19.
Une vaccination préventive contre l'hépatite A et B sera recommandée aux patients qui reçoivent régulièrement des préparations de sang ou de plasma humain.
Enfants et adolescents
Les mises en garde et précautions s'appliquent aux adultes et aux enfants.
Beriate 500 U.I. contient moins de 1 mmol de sodium (23 mg) par flacon, ce qui signifie qu'il est quasiment exempt de sodium.
Beriate 1000 U.I. contient 23 mg de sodium par flacon, ce qui correspond à 1,4% de l'apport alimentaire quotidien maximal de 2 g recommandé par l'OMS pour un adulte.
InteractionsAucune étude concernant des interactions du facteur VIII avec d'autres médicaments n'a été effectuée.
Grossesse, allaitementA ce jour, aucune examen de reproduction chez l'animal n'a été effectué avec Beriate, de même qu'il n'y a aucunes données sur l'utilisation avec des concentrés de facteur VIII pendant la grossesse et l'allaitement du fait que l'hémophilie A est rare chez la femme. Au vu de ce qui précède, la préparation ne peut être administrée pendant la grossesse ou l'allaitement qu'en cas d'indications explicites.
Fertilité
On ne dispose d'aucune donnée concernant la fertilité.
Effet sur l’aptitude à la conduite et l’utilisation de machinesBeriate n'a aucun effet sur l'aptitude à la conduite et l'utilisation de machines.
Effets indésirablesRésumé du profil de sécurité
On a observé très rarement des réactions d'hypersensibilité ou des réactions allergiques (pouvant inclure: angio-œdème, brûlure et picotements au site d'injection, frissons, rougeur de la peau avec flush, urticaire généralisée, céphalées, exanthème, hypotension, léthargie, nausées, nervosité, tachycardie, oppression thoracique, tremblements, vomissements et stridors), ces réactions pouvant quelquefois mener à une anaphylaxie sévère (choc inclus).
Les patients souffrant de l'hémophilie A peuvent développer des anticorps neutralisants (inhibiteurs) du facteur VIII (voir chap. «Mises en garde et précautions»).. Si de tels inhibiteurs surviennent, la réaction se manifeste sous forme de réponse clinique insuffisante. Dans ce cas, il est recommandé de contacter un centre spécialisé en hémophilie.
Les effets indésirables suivants sont basés sur l'analyse de données postmarketing ainsi que de la littérature scientifique.
La liste ci-dessous correspond à la classification MedDRA, par système et organe.
Pour la fréquence, les définitions standards suivantes ont été adoptées:
très fréquents (≥1/10), fréquents (≥1/100 et <1/10), occasionnels (≥1/1000 et <1/100), rares (≥1/10'000 et <1/1000) et très rares (<1/10'000).
Description de certains effets indésirables
Affections hématologiques et du système lymphatique
Très rares: inhibiteurs du facteur VIII.
Troubles généraux et affections du site d'injection
Très rares: fièvre.
Affections du système immunitaire
Très rares: réactions d'hypersensibilité (réactions allergiques).
Pour une information sur la sécurité virale, voir également le chapitre «Mises en garde et précautions».
Enfants et adolescents
Il est attendu que la fréquence, le type et la gravité des effets secondaires chez les enfants correspondent à ceux des adultes.
Il est extrêmement important de signaler les effets secondaires suspectés après l'autorisation de mise sur le marché. Cela permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé sont priés de signaler tout effet indésirable nouveau ou grave, suspecté via le portail en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageAucun symptôme dû à un surdosage avec des facteurs de coagulation VIII humain n'est connu à ce jour.
Propriétés/EffetsCode ATC
B02BD02
Groupe pharmaco-thérapeutique: Antihémorragique: facteur de coagulation VIII
Beriate est produit à partir de pools de plasma humain provenant de donneurs sains. L'information sur le dépistage des dons et des pools de plasma se trouve au chapitre «Mises en garde et précautions».
Le procédé de fabrication de Beriate comporte plusieurs étapes contribuant à l'élimination/l'inactivation des virus. On compte parmi celles-ci: une procédure de chromatographie, une étape de précipitation, une étape d'adsorption ainsi qu'un traitement thermique, de la préparation en solution aqueuse, pendant 10 heures à 60 °C.
Les isoagglutinines des groupes sanguins et le fibrinogène (méthode selon Clauss) sont largement éliminés par une étape de purification spécifique.
Effet
Beriate est un coagulant spécifique pour l'administration intraveineuse lors de déficience congénitale du facteur sanguin VIII.
Mécanisme d'action
Le complexe du facteur VIII/facteur de von Willebrand comprend deux sous-unités (F VIII et FvW) qui possèdent des effets physiologiques différents. Le facteur VIII adhère au facteur de von Willebrand dans la circulation sanguine des patients traités contre l'hémophilie.
Le facteur VIII activé agit comme un cofacteur du facteur IX activé, accélérant la conversion du facteur X en facteur X activé. Le facteur X activé transforme la prothrombine en thrombine. La thrombine transforme le fibrinogène en fibrine et un caillot peut alors se former. L'hémophilie A est une affection héréditaire de la coagulation sanguine liée au sexe, qui repose sur un déficit en facteur VIII:C. Suite à ce manque, des hémorragies spontanées ou accidentelles, ou même chirurgicales peuvent survenir au niveau des articulations, des muscles ou des organes internes. Le taux plasmatique en Facteur VIII est augmenté grâce au traitement substitutif, ce qui permet de corriger temporairement le déficit en Facteur VIII et les tendances hémorragiques.
Le facteur de von Willebrand, parallèlement à sa fonction de protéine stabilisant le facteur VIII, permet l'adhésion des thrombocytes sur l'endothélium vasculaire blessé et joue le rôle principal dans l'agrégation des thrombocytes.
PharmacocinétiqueAbsorption et distribution
La préparation est administrée par voie intraveineuse. Après administration de 1 U.I. de facteur VIII par kg de poids corporel (taux de récupération de type incrémental), l'augmentation de l'activité du facteur VIII a été estimée à environ 2%, avec un intervalle de variation interindividus de 1,5 à 3%.
Élimination
L'activité du facteur VIII diminue sur le mode exponentiel en une ou deux phases. La demi-vie terminale varie entre 5 et 22 heures, soit une moyenne d'environ 12 heures.
La durée moyenne du temps de séjour était de 17 heures (SD 5,5 heures). L'AUC moyenne était de 0,4 h × kg/ml (SD 0,2), la clearance moyenne de 3 ml/h/kg (SD 1,5 ml/h/kg).
Enfants et adolescents
Aucune étude pharmacocinétique sur des enfants n'a été réalisée.
Données précliniquesDes études de toxicité avec des doses répétées n'ont pas été réalisées, parce que l'apport de doses répétées conduit au développement d'anticorps contre les protéines hétérologues.
Aucune toxicité n'a été démontrée lors d'expérimentations animales, même lors d'administration de doses beaucoup plus hautes que la dose humaine recommandée par kg de poids corporel. Les analyses de la préparation de facteur VIII traitée thermiquement par des anticorps polyclonaux précipitants (lapins) avec la méthode Ouchterlony et dans l'anaphylaxie cutanée passive du cobaye, ne montrent pas de différences par rapport aux réactions immunitaires comparées avec la protéine non-modifiée. Comme l'expérience clinique n'a rapporté aucun indice d'un effet carcinogène ou mutagène du facteur de coagulation VIII humain, des expérimentations animales, surtout sur les espèces hétérologues, ne sont pas jugées nécessaires.
Remarques particulièresIncompatibilités
Étant donné qu'aucune étude de compatibilité n'a été réalisée, le médicament ne peut pas être mélangé à d'autres médicaments, à l'exception du solvant indiqué au chapitre «Forme galénique et quantité de principe actif par unité».
Stabilité
Beriate ne peut être utilisé que jusqu'à la date indiquée par «EXP» sur l'emballage. Du point de vue microbiologique et parce que Beriate ne contient aucuns agents conservateurs, il est impératif d'utiliser immédiatement le produit reconstitué.
Stabilité après ouverture
La stabilité chimique et physique en cours d'utilisation du produit reconstitué a été démontrée pendant 8 heures à une température ambiante de 25 °C. D'un point de vue microbiologique, le produit doit être utilisé immédiatement. S'il n'est pas administré immédiatement, le stockage dans le flacon ne doit pas dépasser 8 heures à température ambiante. Une fois aspiré dans la seringue, le produit doit être utilisé immédiatement.
Remarques particulières concernant le stockage
Conserver le médicament hors de portée des enfants.
Conserver Beriate au réfrigérateur (2-8 °C), à l'abri de la lumière (dans l'emballage d'origine). Ne pas surgeler le produit.
Pendant la durée de conservation, Beriate peut être conservé à température ambiante (jusqu'à 25 °C) pendant une période n'excédant pas 1 mois au total.
Remarques concernant la manipulation
La solution doit être claire et légèrement opalescente. Certains flocons ou particules peuvent parfois apparaître dans le flacon. Le filtre contenu dans le set de transfert «Mix2vial™» élimine ces particules. Le calcul du dosage n'est pas influencé par cette filtration. Une fois filtré et aspiré dans la seringue jetable (voir ci-dessous), le produit reconstitue doit être inspecté visuellement à la recherche de particules et de décoloration avant d'être administré.
Ne pas utiliser les solutions troubles ou les solutions contenant un sédiment ou des particules. Une fois aspiré dans la seringue, le produit doit être utilisé immédiatement. Ne stockez pas le produit dans la seringue.
La préparation et l'administration doivent se faire sous conditions aseptiques.
Préparation:
Amener le solvant à la température ambiante. Retirer les capuchons protecteurs des flacons puis nettoyer les bouchons à l'aide d'une solution antiseptique; laisser sécher avant l'ouverture du dispositif de transfert («Mix2Vial™»).
|
|
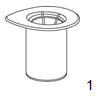
|
1. Retirer l'opercule du dispositif de transfert «Mix2Vial». Ne pas sortir le dispositif de l'emballage sous blister
| |
|

|
2. Placer le flacon de solvant sur une surface plane, propre, et le maintenir fermement. En tenant le dispositif «Mix2Vial» verticalement à travers son emballage, enclencher l'extrémité bleue sur le bouchon du flacon de solvant.
| |
|
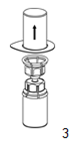
|
3. Retirer avec précaution l'emballage, en prenant le blister au niveau du bord de scellement et le retirer verticalement vers le haut. Bien s'assurer que seul cet emballage est retiré, et que le dispositif «Mix2Vial» reste bien en place.
| |
|
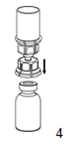
|
4. Après avoir posé le flacon de poudre sur un plan rigide, retourner l'ensemble flacon solvant- dispositif «Mix2Vial» et introduire la pointe de l'adaptateur transparent verticalement dans le bouchon du flacon de produit. Le solvant est transféré automatiquement dans le flacon de poudre.
| |
|
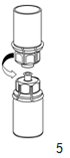
|
5. Dévisser le set en maintenant la partie produit reconstitué d'un côté et la partie solvant (vide) de l'autre. Jeter le flacon de solvant doté de l'adaptateur «Mix2Vial» bleu.
| |
|
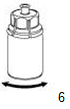
|
6. Remuer doucement le flacon de produit portant l'adaptateur transparent jusqu'à ce que le produit soit complètement dissous. Ne pas secouer.
| |
|
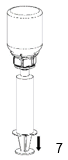
|
7. Remplir d'air une seringue stérile, vide. Tout en maintenant le flacon du produit reconstitué verticalement, visser la seringue avec le raccord Luer du dispositif «Mix2Vial».
Maintenir le piston de la seringue appuyé, retourner l'ensemble et aspirer le produit dans la seringue en tirant doucement sur le piston.
|
Aspiration de la solution dans la seringue et utilisation
|
|
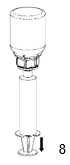
|
8. Maintenir le piston de la seringue appuyé, retourner l'ensemble et aspirer le produit dans la seringue en tirant doucement sur le piston.
| |
|
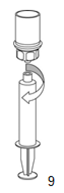
|
9. Lorsque la solution a été complètement transférée dans la seringue, tenir le cylindre de la seringue (en maintenant le piston dans sa position) et dévisser la seringue de l'adaptateur Mix2Vial transparent.
|
Le produit non utilisé après l'injection ou le matériau usagé doit être éliminé de manière appropriée.
Numéro d’autorisation54824 (Swissmedic)
PrésentationBeriate 500 (B)
1 lyophilisat de 500 U.I. + 1 flacon de solvant avec 5 ml d'eau pour injection; 1 set d'utilisation.
Beriate 1000 (B)
1 lyophilisat de 1000 U.I. + 1 flacon de solvant avec 10 ml d'eau pour injection; 1 set d'utilisation.
Contenant chacune:
1 dispositif de transfert 20/20
1 set d'administration (carton intérieur):
1 nécessaire de ponction veineuse
2 tampons imbibés d'alcool
1 pansement non stérile
1 seringue à usage unique
Titulaire de l’autorisationCSL Behring AG, Bern
Mise à jour de l’informationMai 2020.
|









