CompositionPrincipes actifs
Tiotropium (ut Tiotropii bromidum monohydricum).
Excipients
Lactose monohydraté (contient de protéines de lait) 5.5 mg.
Indications/Possibilités d’emploiLe tiotropium est un bronchodilatateur pour le traitement chronique des bronchopneumopathies chroniques obstructives (BPCO).
Posologie/Mode d’emploiPosologie usuelle
Il est recommandé d'inhaler le contenu d'une capsule, une fois par jour, à la même heure, à l'aide du HandiHaler (voir le mode d'emploi du HandiHaler).
Les capsules de tiotropium ne doivent pas être avalées.
Patients présentant des troubles de la fonction hépatique
La sécurité et l'efficacité n'ont pas été étudiées chez les patients présentant des troubles de la fonction hépatique. Par conséquent, le tiotropium ne devrait pas être utilisé chez les patients présentant des troubles sévères de la fonction hépatique.
Patients présentant des troubles de la fonction rénale
Les patients présentant une insuffisance rénale peuvent utiliser le tiotropium à la dose recommandée. En cas d'insuffisance rénale modérée à sévère (clairance de la créatinine ≤50 ml/min.), voir les rubriques «Mises en garde et précautions» et «Pharmacocinétique».
Patients âgés
Les patients âgés peuvent utiliser le tiotropium à la dose recommandée.
Enfants et adolescents
La sécurité et l'efficacité du tiotropium sous forme de poudre pour inhalation n'ont pas été étudiées chez les enfants. Le tiotropium ne devrait donc pas être utilisé chez les enfants.
Contre-indicationsHypersensibilité connue au tiotropium, à l'atropine ou à l'un de ses dérivés tels que p.ex. l'ipratropium ou l'oxitropium, ou à l'un des autres composants du médicament (voir composition des excipients).
Mises en garde et précautionsCe médicament contient 5.5 mg de lactose monohydraté par capsule.
Ce médicament ne doit pas être administré aux patients atteints d'une rare intolérance au galactose héréditaire, d'un déficit en lactase ou d'une malabsorption du glucose/galactose.
Le tiotropium, un bronchodilatateur pour le traitement chronique, administré en une prise par jour, ne doit pas être utilisé comme traitement initial des épisodes aigus de bronchospasme, comme par exemple en traitement d'urgence.
Des réactions d'hypersensibilité de type immédiat sont possibles après l'administration de tiotropium sous forme de poudre pour inhalation.
Comme pour d'autres médicaments anticholinergiques, le tiotropium doit être utilisé avec prudence chez les patients atteints de glaucome à angle fermé, d'hyperplasie de la prostate ou d'un rétrécissement du col vésical.
Les médicaments administrés par voie inhalée sont susceptibles de déclencher un bronchospasme induit par l'inhalation.
L'expérience clinique avec le tiotropium est limitée dans les situations suivantes: glaucome à angle fermé, hyperplasie symptomatique de la prostate, obstruction du col vésical, insuffisance de la fonction rénale avec des valeurs de la créatinine > 176 µmol/l et/ou une clairance ≤50 ml/min., hépatopathie avec ASAT ou ALAT > 80 UI/l, infarctus du myocarde récent, troubles du rythme cardiaque nécessitant un traitement et insuffisance cardiaque ayant nécessité un traitement hospitalier.
La concentration plasmatique augmentant avec la diminution de la fonction rénale chez les patients présentant une insuffisance rénale modérée à sévère (clairance de la créatinine ≤50 ml/min.), le tiotropium ne devrait être utilisé que si le bénéfice attendu dépasse le risque potentiel.
Les patients devront être mis en garde d'éviter la projection intraoculaire de poudre par une manipulation incorrecte. Ils doivent être informés du fait que celle-ci peut provoquer ou aggraver un glaucome à angle fermé, une douleur ou une gêne oculaire, une vision floue transitoire, des halos et des images colorées accompagnant une rougeur oculaire due à une congestion de la conjonctive ou à un œdème de la cornée. La survenue de l'un de ces symptômes doit conduire le patient à arrêter immédiatement le traitement par le tiotropium et à consulter un médecin.
Les collyres myotiques ne sont pas considérés comme un traitement efficace de ces symptômes.
Le tiotropium ne doit pas être administré plus d'une fois par jour (voir «Surdosage»).
Les capsules de tiotropium ne doivent être utilisées qu'avec le HandiHaler (voir le mode d'emploi du HandiHaler).
InteractionsBien qu'aucune étude spécifique d'interactions médicamenteuses n'ait été effectuée, le tiotropium a été utilisé en association avec d'autres médicaments habituellement utilisés dans le traitement de la BPCO sans que des preuves cliniques d'interactions médicamenteuses n'aient été observées. Il s'agissait de bronchodilatateurs sympathomimétiques, de méthylxanthines, de corticostéroïdes oraux ou inhalés.
Dans une étude portant sur la disponibilité systémique, l'exposition à l'état d'équilibre au tiotropium et au salmétérol était pratiquement identique chez les patients atteints de BPCO après l'administration de 18 µg de tiotropium une fois par jour et de 50 µg de salmétérol deux fois par jour, soit en association libre ou en monothérapies.
Deux études cliniques fournissent des informations limitées sur l'administration concomitante d'autres anticholinergiques avec Spiriva: l'administration d'une dose unique de bromure d'ipratropium avec Spiriva en tant que traitement continu chez des patients atteints de BPCO (n=64) et des volontaires sains (n=35) n'a pas été associée à une fréquence accrue d'effets indésirables, des modifications des signes vitaux ou des résultats de l'ECG. L'administration supplémentaire de bromure d'ipratropium a toutefois été liée à une diminution de la sécrétion des glandes salivaires (-16%).
La co-administration continue d'autres médicaments anticholinergiques avec Spiriva n'a pas été étudiée et est, par conséquent, déconseillée.
On suppose que le tiotropium est éliminé activement par des transporteurs de cations non identifiés jusqu'ici. Des interactions avec des transporteurs de cations sont généralement décrites surtout avec la cimétidine, le triméthoprime et les inhibiteurs de protéase. Pour le tiotropium, il existe une étude d'interaction avec la cimétidine (concentrations thérapeutiques à l'état d'équilibre). La clairance du tiotropium (administration IV unique avec une dose quasi suprathérapeutique) a diminué d'environ 20% et l'exposition (AUC0-4h) a augmenté d'environ 20%. En revanche, aucune interaction n'a été observée avec la ranitidine.
Grossesse, allaitementGrossesse
On ne dispose d'aucune donnée clinique concernant l'utilisation du tiotropium pendant la grossesse. Les études réalisées chez l'animal ont montré qu'il existait également des effets toxiques sur la reproduction lors de toxicité maternelle (voir rubrique Données précliniques). Par mesure de précaution, Spiriva ne sera pas utilisé pendant la grossesse.
Allaitement
On ne dispose pas de données cliniques concernant l'utilisation du tiotropium pendant l'allaitement. Les études réalisées chez les rongeurs ont montré qu'une faible quantité de tiotropium est excrétée dans le lait maternel.
Par conséquent, le tiotropium ne doit être utilisé pendant l'allaitement qu'après avoir soigneusement évalué le rapport bénéfices/risques.
Fertilité
Il n'existe pas de données cliniques sur la fécondité pour le tiotropium. Une étude préclinique effectuée avec du tiotropium n'a pas révélé d'indications d'effets négatifs sur la fertilité (voir rubrique Données précliniques).
Effet sur l’aptitude à la conduite et l’utilisation de machinesLes effets sur l'aptitude à conduire des véhicules n'ont pas été étudiés. La survenue de vertiges et d'une vision trouble peut avoir des répercussions sur l'aptitude à conduire des véhicules et à utiliser des machines.
Effets indésirablesL'observation des réactions indésirables repose sur des données issues d'études cliniques et de notifications spontanées intervenues dans le cadre de l'usage du médicament depuis son autorisation. La banque de données des études cliniques porte sur 9647 patients ayant pris du tiotropium dans le cadre de 28 études cliniques contrôlées contre placebo, pour des périodes de traitement allant de quatre semaines à quatre ans, ce qui correspond à 12469 années-personnes d'exposition au tiotropium.
Les fréquences sont définies comme suit:
fréquents (≥1/100 - <1/10); occasionnels (≥1/1000 - <1/100); rares (≥1/10'000 - <1/1'000), très rares (<1/10'000); fréquence inconnue (principalement basée sur des notifications spontanées issues de la surveillance du marché, la fréquence exacte ne pouvant pas être évaluée).
Affections cardiaques
Occasionnels: fibrillation auriculaire.
Rares: tachycardie, palpitations, tachycardie supraventriculaire.
Affections oculaires
Occasionnels: vision floue.
Rares: augmentation de la pression intraoculaire, glaucome.
Affections gastro-intestinales
Fréquents: sécheresse buccale habituellement légère.
Occasionnels: constipation, reflux gastro-œsophagien, candidose oropharyngée.
Rares: occlusion intestinale, y compris iléus paralytique, nausées, gingivite, glossite, dysphagie, stomatite.
Fréquence inconnue: caries.
Troubles du métabolisme et de la nutrition
Fréquence inconnue: déshydratation.
Affections musculo-squelettiques et systémiques
Fréquence inconnue: tuméfaction articulaire.
Affections du système nerveux
Occasionnels: vertiges, céphalées, dysgueusies.
Rares: insomnie.
Affections du rein et des voies urinaires
Occasionnels: miction difficile et rétention urinaire (chez des sujets âgés de sexe masculin, présentant des facteurs prédisposants).
Rares: infections urogénitales.
Affections respiratoires, thoraciques et médiastinales
Occasionnels: enrouement, toux, pharyngite.
Rares: bronchospasmes, épistaxis, laryngite, sinusite.
Affections de la peau et du tissu sous-cutané
Occasionnels: rash.
Rares: angio-œdème, urticaire, prurit, réactions d'hypersensibilité (y compris réactions d'hypersensibilité immédiate).
Fréquence inconnue: infections et ulcères cutanés, sécheresse cutanée.
La plupart des effets indésirables cités ci-dessus peuvent être attribués aux propriétés anticholinergiques de Spiriva.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageL'administration de doses élevées de tiotropium peut déclencher l'apparition de symptômes anticholinergiques.
Cependant, aucun effet indésirable anticholinergique systémique n'a été observé chez des volontaires sains, après inhalation d'une dose unique de tiotropium allant jusqu'à 282 µg. En plus d'une sécheresse buccale, une conjonctivite bilatérale a été observée chez des volontaires sains après inhalation journalière répétée d'une dose de 141 µg. Celle-ci a disparu au cours du traitement. Aucun effet indésirable significatif n'a été observé lors d'une étude à doses multiples réalisée chez des patients atteints de BPCO, recevant une dose journalière maximale de 36 µg de tiotropium pendant 4 semaines. La sécheresse buccale était le seul effet indésirable observé qui a été attribué au tiotropium.
L'intoxication aiguë, en cas d'ingestion orale accidentelle de capsules de tiotropium est peu probable du fait de la faible biodisponibilité orale du tiotropium.
Propriétés/EffetsCode ATC
R03BB04
Le tiotropium est un dérivé d'ammonium quaternaire non chiral, peu soluble dans l'eau.
Le tiotropium est administré sous forme de poudre par voie inhalée. Le tiotropium est un agent antimuscarinique spécifique à longue durée d'action, souvent appelé anticholinergique dans la pratique médicale.
Mécanisme d'action
Il possède une affinité similaire pour les sous-types de récepteurs muscariniques M1 à M5. La dissociation du récepteur M2 est toutefois plus rapide que celle du récepteur M3, montrant ainsi dans les études fonctionnelles in vitro une sélectivité (cinétiquement contrôlée) supérieure pour les sous-types du récepteur M3 par rapport à M2.
Pharmacodynamique
Dans les voies aériennes, l'inhibition des récepteurs M3 au niveau du muscle lisse se traduit par une relaxation. La nature compétitive et réversible de l'antagonisme a été mise en évidence sur des récepteurs d'origine humaine et animale ainsi que sur des préparations d'organes isolés. Aussi bien dans les études précliniques in vitro que in vivo, l'effet bronchospasmolytique était dose-dépendant et durait plus de 24 heures. La longue durée d'action est probablement due à la dissociation très lente des récepteurs M3, la demi-vie de dissociation étant significativement plus longue que celle observée avec l'ipratropium.
La bronchodilatation consécutive à l'inhalation de tiotropium est principalement due à un effet direct localisé et non pas à un effet systémique.
Électrophysiologie cardiaque
Dans une étude ciblée portant sur le QT menée sur 53 volontaires sains pendant 12 jours, Spiriva (18 µg et 54 µg, c.-à-d. à la posologie thérapeutique triple) n'a pas prolongé l'intervalle QT sur les ECG.
Efficacité clinique
Le plan de développement clinique incluait quatre études d'un an et deux de 6 mois, randomisées et en double aveugle, auprès de 2663 patients (1308 sous tiotropium). Parmi les études menées sur un an, deux étaient contrôlées contre placebo et deux contre un témoin actif (ipratropium). Les études de six mois étaient toutes deux contrôlées contre placebo et salmétérol. L'effet bronchodilatateur et l'influence sur la dyspnée ont été étudiés en premier lieu.
Fonction pulmonaire
Au cours de ces études, l'administration de tiotropium en dose unique journalière a permis d'obtenir une amélioration significative de la fonction pulmonaire (volume expiratoire maximal en une seconde (VEMS) et capacité vitale forcée (CVF)) dans les 30 minutes suivant la première dose et se maintenant pendant 24 heures. L'état d'équilibre pharmacodynamique a été atteint en une semaine, la majeure partie de l'effet bronchodilatateur étant observée dès le troisième jour. Les mesures effectuées quotidiennement par le patient ont montré que le tiotropium améliorait significativement le DEP (débit expiratoire de pointe) du matin et du soir. L'effet bronchodilatateur du tiotropium s'est maintenu pendant l'année complète d'administration sans signe de développement d'une tolérance.
Une étude clinique randomisée, contrôlée contre placebo, réalisée chez 96 patients souffrant de BPCO, a démontré le maintien de la bronchodilatation sur l'intervalle de prise de 24 heures, comparativement au placebo, indépendamment du moment d'administration du médicament, le matin ou le soir.
Études cliniques de BPCO au long cours (6 et 12 mois)
Dyspnée, tolérance à l'effort
Le tiotropium a significativement amélioré la dyspnée (mesurée d'après l'indice de dyspnée transitionnel). Cette amélioration a été maintenue pendant toute la durée du traitement.
L'impact de l'amélioration de la dyspnée (détresse respiratoire) sur la tolérance à l'effort a été étudié au cours de deux études cliniques randomisées, en double aveugle et contrôlées contre placebo chez 433 patients atteints de BPCO modérée à sévère. Lors de ces études, un traitement de six semaines par Spiriva a significativement amélioré le temps d'endurance, limité en raison des symptômes, au cours d'un test sur cyclo-ergomètre à 75% de la puissance maximale, de 19,7% (étude A: 640 secondes avec Spiriva contre 535 secondes avec le placebo, par comparaison avec un temps de 492 secondes avant le début du traitement) et de 28,3% (étude B: 741 secondes avec Spiriva contre 577 secondes pour le placebo, par comparaison avec un temps avant le début du traitement de 537 secondes). Les améliorations ont été observées 2,25 heures après administration et s'expliquent en premier lieu par les effets bronchodilatateurs de Spiriva sur le flux expiratoire et le volume pulmonaire.
Qualité de vie liée à la santé
Le tiotropium a amélioré la qualité de vie liée à la santé d'après le questionnaire spécifique aux symptômes respiratoires (St. George's Respiratory Questionnaire). Cette amélioration s'est maintenue pendant toute la durée du traitement.
Exacerbations de la BPCO
Dans une étude clinique randomisée, en double aveugle, contrôlée contre placebo chez 1829 patients atteints de BPCO modérée à sévère, le bromure de tiotropium a réduit de façon statistiquement significative la proportion de patients présentant des exacerbations de la BPCO (de 32,2% à 27,8%) et réduit de façon statistiquement significative le nombre d'exacerbations de 19% (de 1,05 à 0,85 exacerbations par patient et par an).
De plus, 7,0% des patients du groupe tiotropium contre 9,5% des patients du groupe placebo ont été hospitalisés pour une exacerbation de la BPCO (p = 0,056). Le nombre d'hospitalisations dues à la BPCO a été réduit de 30% (de 0,25 à 0,18 événements par patient et par an).
Une étude randomisée en double aveugle, à double placebo et en groupes parallèles menée pendant un an a comparé l'effet d'un traitement par 18 µg de Spiriva avec celui d'un traitement par β2-mimétique à longue durée d'action (LABA) sur l'incidence des exacerbations moyennes et sévères chez 7376 patients atteints de BPCO qui avaient présenté des exacerbations l'année précédente.
Comparé avec un LABA, Spiriva a prolongé de façon significative la durée précédant l'apparition de la première exacerbation et la durée précédant l'apparition de la première exacerbation sévère (liée à une hospitalisation). En outre, le nombre annuel d'exacerbations moyennes ou sévères (liées à une hospitalisation) a été significativement réduit.
Données à long terme
Études cliniques au long cours (>1 à <4 ans)
Dans une étude d'une durée de 4 ans menée auprès de 5993 patients, Spiriva n'a pas permis de modifier le taux annuel de diminution du VEMS1 (critère d'évaluation primaire). L'étude a cependant mis plusieurs avantages en évidence pour Spiriva concernant les critères d'évaluation secondaires. Ainsi, l'effet supplémentaire se manifestant par une amélioration du VEMS1 constaté au début du traitement associé par Spiriva a pu être maintenu tout au long de l'étude.
Illustration: Modification du VEMS1 matinal avant prise de la préparation (autrement dit concentrations résiduelles) par rapport à la valeur initiale dans les groupes de patients recevant du tiotropium ou un placebo pendant une période de 4 ans.
P < 0,001 pour tous les moments après la randomisation.
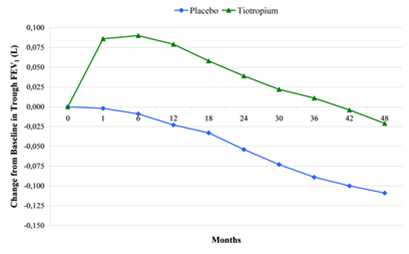
De même, on a constaté une mortalité inférieure pendant le traitement par Spiriva (la mortalité n'était pas un critère d'évaluation primaire dans cette étude).
L'incidence de la mortalité était de 4,79 pour 100 patients dans le groupe placebo contre 4,10 pour 100 patients dans le groupe tiotropium (rapport de risque (tiotropium/placebo) = 0,84; 95% IC: 0,73; 0,97).
PharmacocinétiqueGénéralement, lorsque l'inhalation est la voie d'administration, la majorité de la dose délivrée se dépose dans le tube digestif et, dans une moindre mesure, dans l'organe cible, c'est-à-dire le poumon. La plupart des données pharmacocinétiques décrites ci-dessous ont été obtenues avec des doses supérieures à celles recommandées pour le traitement.
Absorption
Après inhalation de poudre sèche chez de jeunes volontaires sains, la biodisponibilité absolue est de 19,5%, ce qui suggère que la fraction atteignant le poumon présente une biodisponibilité élevée. Les solutions orales de tiotropium ont une biodisponibilité absolue de 2–3%. Les concentrations plasmatiques maximales de tiotropium sont atteintes 5 minutes après inhalation. La prise d'aliments ne semble pas influencer la résorption de cet ammonium quaternaire.
Les concentrations plasmatiques maximales de tiotropium sont atteintes au bout de 5 à 7 minutes après inhalation. Chez les patients atteints de BPCO, la concentration plasmatique maximale de tiotropium à l'état d'équilibre était de 12,9 pg/ml et a diminué rapidement selon un schéma multicompartimental. La valeur la plus basse de la concentration plasmatique à l'état d'équilibre était de 1,71 pg/ml.
Distribution
Le tiotropium est lié à 72% aux protéines plasmatiques et présente un volume de distribution de 32 l/kg. La concentration pulmonaire locale n'est pas connue, mais le mode d'administration suggère une concentration beaucoup plus élevée dans les poumons. Les études chez le rat ont montré que le tiotropium ne traverse pas la barrière hémato-encéphalique de façon significative.
Métabolisme
Le métabolisme du tiotropium est faible puisque 74% d'une dose administrée par voie intraveineuse chez de jeunes volontaires sains sont éliminés sous forme inchangée par voie rénale.
L'ester de tiotropium est clivé de manière non enzymatique en alcool (N-méthylscopine) et en acide (acide dithiénylglycolique) inactifs sur les récepteurs muscariniques.
Des études in vitro sur des microsomes hépatiques et des hépatocytes d'origine humaine suggèrent qu'une autre partie de la substance (<20% de la dose administrée par voie intraveineuse) est métabolisée par oxydation dépendante du cytochrome P450 suivie d'une conjugaison avec le glutathion, donnant naissance à plusieurs métabolites de phase II.
Les études in vitro effectuées sur les microsomes hépatiques révèlent une inhibition du métabolisme enzymatique par les inhibiteurs du CYP450 2D6 (et 3A4), la quinidine, le kétoconazole et le gestodène. Les CYP450 2D6 et 3A4 sont, par conséquent, impliqués dans la voie métabolique responsable d'une petite partie du métabolisme du tiotropium. Le tiotropium, même en concentrations suprathérapeutiques, n'inhibe pas les iso-enzymes 1A1, 1A2, 2B6, 2C9, 2C19, 2D6, 2E1 ou 3A du système du cytochrome P450 dans les microsomes hépatiques d'origine humaine.
Élimination
Chez les volontaires sains et chez les patients atteints de BPCO, la demi-vie effective du tiotropium est de 27 à 45 heures. La clairance totale était de 880 ml/min. après une dose intraveineuse chez de jeunes volontaires sains. Le tiotropium, administré par voie intraveineuse, est principalement excrété par voie urinaire sous forme inchangée (74%). Après inhalation de la poudre sèche par les patients atteints de BPCO jusqu'à l'état d'équilibre, 7% (1,3 μg) de la dose inchangée sont excrétés par voie urinaire dans les 24 heures, le reste, essentiellement de la substance non absorbée dans l'intestin, étant éliminé par les fèces. La clairance rénale du tiotropium est supérieure à la clairance de la créatinine, ce qui indique une élimination rénale active. Après inhalation chronique d'une dose par jour chez des patients atteints de BPCO, l'état d'équilibre pharmacocinétique est atteint après le jour 7, sans accumulation par la suite.
Linéarité/non-linéarité
La pharmacocinétique du tiotropium est linéaire aux doses thérapeutiques, tant après administration par voie intraveineuse que par inhalation sous forme de poudre.
Cinétique pour certains groupes de patients
Troubles de la fonction hépatique
Le tiotropium est essentiellement éliminé par voie rénale (74% chez les jeunes volontaires sains) et métabolisé par simple hydrolyse non enzymatique des liaisons esters en produits ne se liant pas aux récepteurs muscariniques. La pharmacocinétique du tiotropium n'a pas été étudiée chez les patients présentant une insuffisance hépatique.
Troubles de la fonction rénale
Par rapport aux patients présentant une fonction rénale normale (CLCR > 80 ml/min.), l'inhalation de tiotropium une fois par jour jusqu'à l'état d'équilibre a entraîné une ASC0-6,ss plus élevée (de 1,8% à 30% plus élevée) et une Cmax,ss comparable chez les patients atteints de BPCO présentant une insuffisance rénale légère (CLCR 50-80 ml/min.).
Il n'existe pas d'expérience à long terme chez des patients présentant des troubles sévères de la fonction rénale. Chez les patients atteints de BPCO et présentant une insuffisance rénale modérée à sévère (CLCR <50 ml/min.), la concentration plasmatique est doublée après administration intraveineuse de tiotropium (82% d'augmentation de l'AUC0-4h et Cmax de 52% plus élevée par rapport aux patients atteints de BPCO présentant une fonction rénale normale), ce qui a également été confirmé après inhalation de poudre sèche.
Patients âgés
Comme cela est attendu avec tous les médicaments principalement excrétés par voie rénale, la clairance rénale du tiotropium diminue avec l'âge (365 ml/min. chez des sujets atteints de BPCO de moins de 65 ans jusqu'à 271 ml/min. chez des patients atteints de BPCO de plus de 65 ans), ce qui peut s'expliquer par l'altération de la fonction rénale. En moyenne, ceci n'a pas entraîné d'augmentation correspondante de l'ASC0-6,ss et de la Cmax,ss.
Enfants et adolescents
Voir «Posologie/Mode d'emploi»
Données précliniquesPharmacologie de sécurité
De nombreux effets observés dans les études conventionnelles de pharmacologie de sécurité, de toxicité en administration répétée et de toxicité des fonctions de reproduction peuvent s'expliquer par les propriétés anticholinergiques du tiotropium. Une diminution de la consommation de nourriture, une inhibition de la prise de poids, une sécheresse buccale et nasale, une réduction de la sécrétion lacrymale et salivaire, une mydriase ainsi qu'une augmentation du rythme cardiaque ont été observées de manière typique chez l'animal. D'autres effets notables ont été observés lors des études de toxicité en administration répétée: irritations légères des voies respiratoires chez le rat et la souris, se manifestant par des rhinites et des modifications épithéliales des fosses nasales et du larynx ainsi que prostatites liées à des dépôts riches en protéines et lithiases vésicales chez le rat. Les modifications respiratoires (irritations) et urogénitales (prostatites) ainsi que les effets délétères sur la reproduction ont été observés après administration locale ou systémique de doses plus de 5 fois supérieures aux doses thérapeutiques.
Mutagénicité
Des examens de la génotoxicité et du potentiel cancérogène n'ont démontré aucun risque particulier pour l'être humain.
Toxicité sur la reproduction
Des effets délétères sur la gestation, le développement embryonnaire/fœtal, la parturition ou le développement post-natal n'ont été mis en évidence qu'à des doses toxiques pour les mères. Le tiotropium n'a pas montré d'activité tératogène chez le rat ou le lapin. Dans une étude approfondie portant sur les effets du tiotropium sur la reproduction et la fertilité chez le rat, aucune des posologies examinées n'a indiqué d'effet négatif sur la fertilité ou le comportement d'accouplement chez les deux parents traités ou leur progéniture.
Remarques particulièresIncompatibilités
Non applicable.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Stabilité après ouverture
Les capsules ne doivent pas être utilisées plus de 9 jours après la première ouverture du blister.
Le HandiHaler peut être utilisé pendant un an.
Remarques particulières concernant le stockage
Ne pas conserver au-dessus de 25°C.
Ne pas réfrigérer et ne pas congeler.
Conserver hors de portée des enfants.
Remarques concernant la manipulation
Voir le mode d'emploi du HandiHaler.
Numéro d’autorisation55855 (Swissmedic).
PrésentationBoîte de 30 capsules (3 blisters) (B)
Boîte de 90 capsules (9 blisters) (B)
Titulaire de l’autorisationBoehringer Ingelheim (Schweiz) GmbH, Bâle
Mise à jour de l’informationMai 2021
|

