CompositionPrincipes actifs
Toxinum botulinicum A*.
* de Clostridium botulinum.
Excipients
Albuminum humanum, 0,9 mg Natrii chloridum. Un flacon contient 0.35 mg de sodium.
Indications/Possibilités d’emploiVISTABEL est indiqué dans l'amélioration temporaire de l'apparance lorsque la sévérité des caractéristiques du visage énumérées ci-après entraîne un retentissement psychologique important chez les patients adultes:
·des rides verticales intersourcilières modérées à sévères observées lors du froncement maximal des sourcils (rides glabellaires) et/ou
·des rides canthales latérales modérées à sévères (pattes d'oie) observées lors d'un sourire forcé et/ou
·des rides du front modérées à sévères observées lors de l'élévation maximale des sourcils
·platysma visible modéré à sévère lors d'une contraction maximale.
Posologie/Mode d’emploiPosologie usuelle
Se reporter aux recommandations spéciales pour chacune des indications décrites ci-dessous.
Les unités de toxine botulique étant différentes pour chaque préparation médicinale, les doses de toxine botulique ne sont pas interchangeables d'un produit à l'autre.
Afin d'assurer la traçabilité des médicaments biotechnologiques, il convient de documenter pour chaque traitement le nom commercial et le numéro de lot.
Instructions posologiques particulières
Patients âgés
On ne dispose que de peu de données cliniques d'études de phase 3 chez les patients âgés de plus de 65 ans pour VISTABEL (voir «Propriétés/Effets»). Tant que plus d'études n'auront pas été effectuées dans ce groupe d'âge, l'administration de VISTABEL n'est pas recommandée chez les patients de plus de 65 ans.
Enfants et adolescents
La sécurité et l'efficacité de VISTABEL pour le traitement des rides verticales intersourcilières (dite rides glabellaires), des pattes d'oie, des rides du front ou d'un platysma visible lors d'une contraction maximale n'ont pas été étudiées chez les personnes de moins de 18 ans. L'utilisation de VISTABEL chez les personnes de moins de 18 ans n'est pas recommandée (voir «Mises en garde et précautions»).
Mode d'administration
VISTABEL doit seulement être administré par des médecins ayant les qualifications adéquates, ayant une bonne expérience de ce traitement et disposant de l'équipement nécessaire.
VISTABEL doit uniquement être utilisé pour le traitement d'un seul patient lors d'une séance.
La dose optimale et le nombre de sites d'injection par muscle peuvent varier d'un patient à l'autre. Un dosage individuel doit, en conséquence, être établi par le médecin.
Il faut veiller à prendre des précautions particulières lors de la préparation de la solution injectable et de l'utilisation ainsi que lors de l'inactivation et de l'élimination de restes non utilisés de la solution injectable (voir «Mises en garde et précautions» et «Remarques particulières»). Voir la section «Remarques particulières» pour les instructions d'utilisation, le tableau de dilution, la manipulation et l'élimination des flacons.
Il faut faire attention à ne pas injecter VISTABEL dans un vaisseau sanguin.
La sécurité et l'efficacité d'une utilisation de VISTABEL plus fréquente que tous les 3 mois n'ont pas été étudiées. Les intervalles de traitement ne devraient donc pas être inférieur à 3 mois.Lors du traitement des adultes avec VISTABEL et BOTOX dans le cadre d'une ou de plusieurs indications autorisées, la dose maximale cumulée, administrée pendant une période de 3 mois ne doit généralement pas dépasser 400 unités.
Instructions d'administration pour les rides glabellaires:
VISTABEL, après reconstitution (100 unités Allergan/2,5 ml) est injecté à l'aide d'une aiguille stérile de 30 gauges. On injecte 0,1 ml (4 unités Allergan) dans chacun des 5 sites d'injection (voir figure 1): 2 injections dans chaque muscle corrugator et 1 injection dans le muscle procerus, soit une dose totale de 20 unités Allergan.
Avant et pendant l'injection, appuyer le pouce ou l'index fortement sous le bord de l'orbite afin d'éviter une diffusion de la solution dans cette zone. L'aiguille doit être orientée dans la direction supérieure et médiale. Afin de réduire les risques de ptôse, il convient d'éviter les injections à proximité du muscle releveur de la paupière supérieure (levator palpebrae superioris), en particulier chez les patients présentant d'importants complexes abaisseurs des sourcils. Les injections dans le muscle corrugator doivent être effectuées dans la partie médiane du muscle au moins à 1 cm au-dessus de l'arcade sourcilière.
Figure 1:
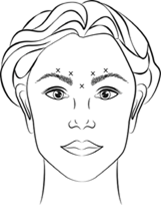
L'amélioration des rides verticales intersourcillières (rides glabellaires) s'observe en général dans la semaine suivant le traitement. L'effet du traitement dure de 3 à 4 mois après l'injection.
L'innocuité et l'efficacité d'une administration plus fréquente n'ont pas été étudiées et par conséquent une administration fréquente n'est pas recommandée.
Si le médecin traitant le juge nécessaire, le traitement peut être répété en cas de diminution de l'effet de l'injection précédente.
Instructions d'administration pour les pattes d'oie:
VISTABEL, après reconstitution (100 unités Allergan/2,5 ml) est injecté à l'aide d'une aiguille stérile de 30 gauges. On injecte 0,1 ml (4 unités Allergan) dans chacun des 3 sites d'injection par côté (6 injections au total) dans les muscles orbiculaires de l'œil. Ceci correspond à une dose totale de 24 unités Allergan et à un volume total de 0,6 ml (12 unités Allergan par côté).
Pour la réalisation d'injections, la pointe de l'aiguille doit être tenue en position inclinée vers le haut et à distance de l'œil. La première injection (A) doit être réalisée à environ 1,5 à 2,0 cm du coin de l'œil en position latérale et directement en position temporale du bord orbital. Si les rides dans la région des pattes d'oie se trouvent au-dessus et en-dessous du coin de l'œil, l'injection doit être réalisée comme indiqué sur la figure 2. Si les rides dans la région des pattes d'oie se trouvent par contre principalement sous le coin de l'œil, l'injection doit être réalisée comme indiqué sur la figure 3.
Figure 2: Figure 3:
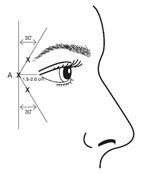
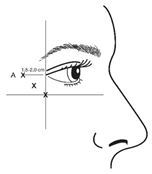
Pour le traitement simultané de rides glabellaires, la posologie est de 24 unités Allergan pour les pattes d'oie et 20 unités Allergan pour les rides glabellaires (se reporter aux instructions d'application pour les rides glabellaires et à la figure 1); la dose totale atteint alors 44 unités Allergan et le volume total est 1,1 ml.
Une amélioration du degré de gravité des pattes d'oie a été relevée selon une évaluation par les patients, en moyenne dans les 3 à 4 jours suivant le traitement. L'effet du traitement a pu être observé jusqu'à 5 mois après l'injection.
Instructions d'administration pour les rides du front:
VISTABEL, après reconstitution (100 unités Allergan/2,5 ml) est injecté à l'aide d'une aiguille stérile de 30 gauges. On injecte 0,1 ml (4 unités Allergan) dans chacun des 5 sites d'injection dans le muscle frontal, soit une dose totale de 20 unités Allergan dans un volume total de 0,5 ml (voir figure 4).
La dose totale pour le traitement des rides du front (20 unités Allergan) et des rides glabellaires (20 unités Allergan) est de 40 unités Allergan/1,0 ml.
Pour déterminer l'emplacement des sites d'injection appropriés dans le muscle frontal, le rapport total entre la taille du front du patient et la répartition de l'activité du muscle frontal doit être évalué.
Les lignes horizontales de traitement, énumérées ci-dessous, doivent être localisées en palpant légèrement le front au repos et lors de l'élévation maximale des sourcils:
·Bord supérieur de l'activité du muscle frontal: environ 1 cm au-dessus du pli supérieur du front
·Ligne inférieure de traitement: à mi-distance entre le bord supérieur de l'activité du muscle frontal et le sourcil, mais au moins 2 cm au-dessus du sourcil
·Ligne supérieure de traitement: à mi-distance entre le bord supérieur de l'activité du muscle frontal et la ligne inférieure de traitement
Les 5 injections doivent être pratiquées à l'intersection des lignes de traitement horizontales et des repères verticaux suivants:
·Sur la ligne inférieure de traitement, au niveau de la ligne médiane du visage et à 0,5 - 1,5 cm du milieu de la ligne de fusion temporale (crête temporale) repérée par palpation; recommencer pour l'autre côté.
·Sur la ligne supérieure de traitement, à mi-distance entre les sites latéral et médian le long de la ligne inférieure de traitement; recommencer pour l'autre côté.
Figure 4:
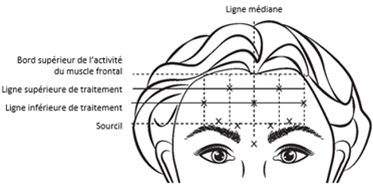
Une réduction de la sévérité des rides du front observées lors de l'élévation maximale des sourcils est survenue en une semaine après le traitement. L'effet persiste pendant environ 4 mois après l'injection.
Pour un traitement simultané des rides glabellaires et des pattes d'oie, la dose totale est de 64 unités Allergan, réparties en 20 unités Allergan pour les rides du front, 20 unités Allergan pour les rides glabellaires (voir Instructions d'administration pour les rides glabellaires, et figure 1), et 24 unités Allergan pour les pattes d'oie (voir Instructions d'administration pour les pattes d'oie, et figures 2 et 3).
Instruction d'administration pour le platysma visible:
À l'aide d'une seringue et d'une aiguille stériles de taille appropriée (taille d'aiguille recommandée: 30-33 gauges) et en respectant une technique aseptique, injecter 2 unités Allergan/0,05 ml de VISTABEL après reconstitution de chaque côté dans chacun des 4 sites d'injection situés dans la partie supérieure du platysma sous la ligne de la mâchoire. En outre, injecter 1 unité/0,025 ml de VISTABEL après reconstitution dans chacun des 5 sites d'injection situés le long de chaque bande musculaire verticale du cou, dans 1 à 2 bandes musculaires du cou par côté. En fonction de la sévérité du platysma visible, la dose totale peut être de 26 unités Allergan (1 bande/côté), 31 unités Allergan (1 bande d'un côté, 2 bandes de l'autre côté) ou 36 unités Allergan (2 bandes/côté) (voir tableau 1 et figures 5 et 6 ci-dessous).
Détermination du site de traitement: Sur chaque côté, les 4 injections sont réalisées sur la ligne de la mâchoire dans la partie supérieure du muscle platysma à environ 1 à 2 cm en dessous et parallèlement au bord inférieur de la mandibule. Le site d'injection antérieur est aligné avec la commissure des lèvres, le site d'injection postérieur se situe en avant de l'angle mandibulaire. Les 2 injections restantes sont pratiquées à une distance égale (à environ 1 à 2 cm l'une de l'autre) entre les points d'injection antérieur et postérieur (voir figures 5 et 6).
Pour chaque bande verticale du muscle platysma (1–2 par côté), 5 injections sont réparties verticalement avec un écart d'environ 1 à 2 cm (voir figures 5 et 6). Le site d'injection situé le plus en haut doit se trouver à environ 1 à 2 cm en dessous des sites d'injection de la ligne de la mâchoire.
Le muscle platysma est une fine couche musculaire située directement sous la surface de la peau. Par conséquent, toutes les injections dans le muscle platysma doivent être administrées superficiellement et en intra-musculaire, l'aiguille étant positionnée à angle droit par rapport à la surface de la peau. Lors d'injections dans les bandes musculaires verticales du cou, chaque bande doit être identifiée tandis que le patient contracte le platysma. Pincer délicatement la bande, pour isoler le muscle des structures anatomiques voisines pendant l'administration (voir tableau 1).
|
Figure 1: Sites d'injection pour le platysma visible (2 bandes du muscle du cou)
|

|
Figure 2: Sites d'injection pour le platysma visible (1 bande du muscle du cou)
|

|
Afin d'éviter les complications liées à l'injection, celle-ci doit être effectuée au moins 1 cm en dessous du bord inférieur de la mandibule. Ne pas injecter dans les structures situées en profondeur du muscle platysma, gros vaisseaux sanguins compris, notamment dans la zone du cou antérieure.
Tableau 1: Posologie en cas de platysma visible
|
Injection dans la ligne de la mâchoire (en dessous du bord inférieur de la mandibule)
|
Injection dans les bandes verticales du muscle du cou
|
Dose totale (nombre de sites d'injection)
| |
2 unités Allergan/0,05 ml sur chacun des 4 sites d'injection de chaque côté (16 unités à 8 sites)
|
1 unité Allergan/0,025 ml sur chacun des 5 sites d'injection par bande musculaire
(1 à 2 bandes/côté)
|
1 bande sur les deux côtés
(10 unités Allergan sur 10 sites)
|
26 unités Allergan
(18 sites)
| |
1 bande sur un côté et 2 bandes sur l'autre côté
(15 unités Allergan sur 15 sites)
|
31 unités Allergan
(23 sites)
| |
2 bandes sur les deux côtés
(20 unités Allergan sur 20 sites)
|
36 unités Allergan
(28 sites)
|
Informations générales
En cas d'échec du traitement initial, c'est-à-dire en l'absence, un mois après l'injection, d'un effet thérapeutique, les mesures suivantes doivent être envisagées:
·analyse des causes de l'échec, par exemple mauvaise sélection des muscles à injecter, technique d'injection, formation d'anticorps neutralisants, dose insuffisante;
·réévaluation du bien-fondé du traitement par la toxine botulique de type A.
En l'absence de tout effet indésirable à l'issue de la première séance de traitement, il est possible de mettre en œuvre un traitement répétitif, dans la mesure où un délai d'au moins 3 mois est respecté entre les deux séances.
En cas de posologie insuffisante pour des rides glabellaires et en l'absence de tout effet indésirable à l'issue de la première séance de traitement, il est possible de mettre en œuvre un traitement répétitif en ajustant la dose à une dose totale allant jusqu'à 40 ou 50 unités Allergan, en tenant compte de l'analyse de l'échec du traitement précédent.
Contre-indicationsVISTABEL ne doit pas être utilisé:
·chez des personnes avec une hypersensibilité connue au principe actif ou à l'un des excipients selon la composition.
·en cas de troubles généraux de l'activité musculaire (par ex. myasthénie grave ou syndrome de Lambert-Eaton).
·en cas d'infection au niveau du (des) site(s) d'injection anticipé(s).
Mises en garde et précautionsUne prudence particulière est nécessaire pendant la reconstitution du produit et son administration ainsi que lors de l'inactivation et l'élimination de la solution restante non utilisée (voir «Posologie/Mode d'emploi» et «Remarques particulières»).
Ce médicament contient moins de 1 mmol (23 mg) de sodium par dose, c'est-à-dire qu'il est presque «sans sodium».
Il est nécessaire d'étudier avec pertinence l'anatomie du patient, et toute altération de celle-ci due à de précédentes interventions chirurgicales avant d'administrer VISTABEL et des injections dans les structures anatomiques sensibles sont à éviter. La posologie et la fréquence d'administration de VISTABEL recommandées ne doivent pas être dépassées.
Dans des cas très rares, une réaction d'hypersensibilité peut se manifester après l'injection de la toxine botulique. De l'adrénaline ou d'autres mesures contre une réaction anaphylactique devraient, par conséquent, être à disposition.
Également en cas d'administration de doses usuelles de la toxine botulique de type A, un risque accru d'effets systémiques cliniquement importants, y compris de dysphagie grave et d'entrave respiratoire, peut exister chez les patients atteints d'affections neuromusculaires non diagnostiquées. Dans certains de ces cas, la dysphagie a duré plusieurs mois et a exigé la mise en place d'une sonde gastrique (voir «Contre-indications»).
La prudence s'impose également lorsque VISTABEL est utilisé pour le traitement de patients atteints de sclérose latérale amyotrophique ou présentant un trouble neuromusculaire périphérique.
Des effets indésirables pouvant être liés à la diffusion de la toxine à distance du site d'administration ont été très rarement rapportés après le traitement par la toxine botulique (voir aussi «Effets indésirables»). Les symptômes correspondent au mode d'action de la toxine botulique et ont été signalés quelques heures à quelques semaines après l'injection. Le risque d'effets indésirables est probablement maximal chez les patients présentant des maladies sous-jacentes et des comorbidités qui les prédisposent à ces effets indésirables, dont les enfants et les adultes traités en raison d'une spasticité et ceux traités à des doses élevées. Les patients traités à doses thérapeutiques peuvent présenter une faiblesse musculaire excessive. Les troubles de la déglutition et les troubles respiratoires sont graves et peuvent entraîner la mort. L'injection de VISTABEL n'est pas recommandée chez les patients ayant des antécédents de dysphagie ou d'aspiration.
Il convient d'informer les patients et le personnel soignant de la nécessité de consulter immédiatement un médecin en urgence en cas d'apparition de troubles de la déglutition, de l'élocution ou de la respiration.
Des injections trop élevées ou des doses trop fréquentes peuvent augmenter le risque d'une formation d'anticorps. La formation d'anticorps peut aussi mener à un échec du traitement par la toxine botulique de type A dans d'autres indications.
Comme il faut s'y attendre pour toute injection, les effets suivants ont été associés à l'injection: douleur locale, inflammation, paresthésie, hypoesthésie, sensibilité, gonflement/œdème, érythème, infection locale, saignement et/ou ecchymose. Des douleurs et/ou de l'anxiété liées à l'injection peuvent induire des réactions vasovagales, y compris une hypotension passagère et une syncope.
VISTABEL doit être utilisé seulement avec prudence en présence d'une inflammation au(x) site(s) d'injection ou lorsque le muscle cible présente une faiblesse excessive ou une atrophie.
La prudence s'impose lorsque VISTABEL est utilisé chez des patients présentant un problème dermatologique inflammatoire au niveau du site d'injection, une asymétrie faciale prononcée, une ptôse, une dermatochalasie excessive, une cicatrice dermique profonde, une peau sébacée épaisse, ou enfin une impossibilité de réduire les rides glabellaires même par séparation physique, dans la mesure où ces patients ont été exclus des études de phase 3 sur l'innocuité et l'efficacité.
L'administration simultanée de toxine botulique dans la région du platysma et d'autres régions de traitement n'a pas été étudiée, et les risques potentiels d'effets indésirables qui y sont associés sont inconnus.
Au cours des essais cliniques étudiant l'innocuité et la sécurité du traitement des rides glabellaires, les patients traités ont reçu jusqu'à trois traitements et ont été suivis pendant 12 mois au total. À la fin de cette période de 12 mois, aucun anticorps neutralisant n'a été mis en évidence dans les échantillons de patients évaluables.
Il faut s'assurer que VISTABEL ne soit pas injecté dans un vaisseau sanguin.
L'administration de VISTABEL n'est pas recommandée chez les patients de moins de 18 ans ou de plus de 65 ans.
Ce médicament contient moins de 1 mmol de sodium (23 mg) par unité de dosage, c'est-à-dire qu'il est pratiquement «sans sodium».
InteractionsEn théorie, l'effet de la toxine botulique peut-être potentialisé par l'administration conjointe de VISTABEL avec des antibiotiques aminoglycosides, la spectinomycine ou d'autres médicaments interférant avec la transmission neuromusculaire (par ex. relaxants musculaires).
L'effet d'une administration concomitante ou d'une utilisation pendant plusieurs mois de plusieurs sérotypes différents de neurotoxine botulique n'est pas connu. Une faiblesse neuromusculaire prononcée peut encore se potentialiser lorsqu'une autre toxine botulique est administrée avant que les effets de la toxine botulique injectée préalablement n'aient disparu.
Aucun test spécifique n'a été effectué pour évaluer les possibles interactions cliniques avec d'autres médicaments. Aucune autre interaction cliniquement significative n'a été rapportée.
Grossesse, allaitementGrossesse
Les études réalisées sur les animaux ont mis en évidence des effets indésirables sur les fœtus (toxicité reproductive) et il n'existe aucune étude contrôlée chez l'homme.
Le risque potentiel pour l'homme est inconnu. VISTABEL ne doit par conséquent pas être utilisé pendant la grossesse ni par les femmes en âge de procréer qui n'utilisent pas de méthode contraceptive.
Allaitement
Il n'existe aucune donnée concernant l'excrétion de VISTABEL dans le lait maternel. L'utilisation de VISTABEL pendant l'allaitement ne peut pas être recommandée.
Effet sur l’aptitude à la conduite et l’utilisation de machinesAucune étude portant sur les effets sur l'aptitude à la conduite et l'utilisation de machines n'a été effectuée. VISTABEL peut cependant provoquer une asthénie, une faiblesse musculaire, des vertiges et des troubles visuels, ce qui pourrait influencer la capacité à conduire des véhicules et à utiliser des machines.
Effets indésirablesEn général
Dans des études cliniques contrôlées menées sur les rides glabellaires chez 23,5% des patients (placebo: 19,2%) des effets indésirables ont été rapportés, qui, selon l'opinion de l'investigateur, étaient associés à VISTABEL.
Les études cliniques pivots contrôlées menées sur les pattes d'oie ont rapporté ce type d'effets indésirables chez 7,6% (24 unités Allergan pour les pattes d'oie seulement) et 6,2% (44 unités Allergan: 24 unités Allergan pour les pattes d'oie et administration concomitante de 20 unités Allergan pour les rides glabellaires) des patients, contre 4,5% avec le placebo.
Les effets indésirables peuvent être associés au traitement, à la technique d'injection ou aux deux.
Lors du premier cycle de traitement des études cliniques menées sur les rides du front observées lors de l'élévation maximale des sourcils, des effets indésirables considérés comme étant liés à VISTABEL par l'investigateur ont été rapportés chez 20,6% des patients traités par 40 unités Allergan (20 unités Allergan dans le muscle frontal et 20 unités Allergan dans le complexe glabellaire), et 14,3% des patients traités par 64 unités Allergan (20 unités Allergan dans le muscle frontal, 20 unités Allergan dans le complexe glabellaire et 24 unités Allergan dans la zone des rides canthales latérales), contre 8,9% des patients du groupe sous placebo.
Au cours du premier cycle du traitement réalisé dans le cadre d'études cliniques en cas de platysma visible lors d'une contraction maximale, des effets indésirables ont été observés chez 4,7% des patients traités par 26 unités Allergan, par 31 unités Allergan ou par 36 unités Allergan, qui ont été évalués par les médecins investigateurs comme étant liés à VISTABEL, en comparaison avec 5,0% des patients qui recevaient le placebo.
En général, les effets indésirables s'observent dans les premiers jours qui suivent l'injection et sont transitoires. La plupart de ces effets indésirables rapportés jusqu'ici étaient de sévérité légère à modérée.
L'action pharmacologique attendue de la toxine botulique est une faiblesse musculaire locale. L'apparition d'une blépharoptôse, qui peut être due à la technique d'injection, correspond à l'action pharmacologique de VISTABEL. Comme avec toute injection, des douleurs, des brûlures, des picotements, des œdèmes et/ou des hématomes dus à l'injection peuvent survenir. De la fièvre et des symptômes pseudo-grippaux ont été également rapportés après des injections de toxine botulique.
Les effets indésirables suivants ont été observés après traitement par VISTABEL:
Les indications de fréquence sont définies comme suit: très fréquents (≥1/10), fréquents (≥1/100 à <1/10), occasionnels (≥1/1000 à <1/100), rares (≥1/10 000 à <1/1000), très rares (<1/10 000).
Rides glabellaires
Les effets indésirables suivants ont été rapportés dans des études cliniques en double aveugle et contrôlées contre placebo, après injection de 20 unités Allergan de VISTABEL dans les rides glabellaires uniquement:
Infections et infestations
Occasionnels: infection.
Affections psychiatriques
Occasionnels: anxiété.
Affections du système nerveux
Très fréquents: céphalées (13,3%).
Fréquents: paresthésie.
Occasionnels: vertiges.
Affections oculaires
Fréquents: ptôse palpébrale.
Occasionnels: douleur oculaire, inflammation de la paupière (blépharite), troubles visuels (y compris vue trouble).
Affections gastro-intestinales
Fréquents: nausées.
Occasionnels: sécheresse buccale.
Affections de la peau et du tissu sous-cutané
Fréquents: érythème, tension de la peau.
Occasionnels: œdème (visage, paupière, péri-orbitaire), sensibilité à la lumière, prurit, peau sèche.
Affections musculosquelettiques et du tissu conjonctif
Fréquents: faiblesse musculaire localisée.
Occasionnels: tressaillements musculaires, signe de Méphisto (élévation latérale des sourcils).
Troubles généraux et anomalies au site d'administration
Fréquents: douleurs au visage, ecchymoses, œdèmes au site d'injection, douleurs ou irritations au site d'injection.
Occasionnels: symptômes grippaux, asthénie, fièvre.
Pattes d'oie avec ou sans rides glabellaires
Les effets indésirables suivants ont été rapportés dans des études cliniques en double aveugle et contrôlées contre placebo, après injection de VISTABEL pour le traitement des rides des pattes d'oie, avec ou sans traitement des rides glabellaires:
Affections oculaires
Occasionnels: œdème palpébral.
Troubles généraux et anomalies au site d'administration
Fréquents: hématome au site d'injection*.
Occasionnels: saignements au site d'injection*, douleurs au site d'injection*, paresthésie au site d'injection*.
*effets indésirables liés à la procédure
Rides du front et rides glabellaires avec ou sans pattes d'oie
Les effets indésirables suivants ont été rapportés dans des études cliniques en double aveugle, contrôlées contre placebo, après injection de VISTABEL pour le traitement simultané des rides du front et des rides glabellaires, avec ou sans traitement des pattes d'oie:
Affections du système nerveux
Fréquents: céphalées.
Affections oculaires
Fréquents: ptôse de la paupière1.
Affections de la peau et du tissu sous-cutané
Fréquents: constriction de la peau, ptôse du sourcil2.
Affections musculosquelettiques et du tissu conjonctif
Fréquents: signe de Méphisto (élévation latérale des sourcils).
Troubles généraux et anomalies au site d'administration
Fréquents: ecchymose au site d'injection*, hématome au site d'injection*.
Occasionnels: douleurs au site d'injection*.
1 Le délai médian d'apparition de la ptôse palpébrale était de 9 jours après le traitement
2 Le délai médian d'apparition de la ptôse du sourcil était de 5 jours après le traitement
* Effets indésirables liés à la procédure
Aucun changement dans le profil de sécurité global n'a été observé après application répétée.
Platysma visible
La sécurité de VISTABEL a été évaluée dans le cadre d'études cliniques en double aveugle contrôlées contre placebo, visant à atténuer un platysma visible. Aucun effet indésirable n'a été rapporté par ≥1% des participants aux études traités par VISTABEL, qui sont aussi survenus plus souvent que chez les participants traités par placebo.
La sécurité de jusqu'à 4 traitements de VISTABEL en cas de platysma visible a également été étudiée. Les participants éligibles, qui étaient traités dans l'étude introductive en double aveugle, contrôlée contre placebo avec VISTABEL ou le placebo, ont reçu dans le cadre de l'étude d'extension en ouvert jusqu'à 3 traitements supplémentaires par VISTABEL. Les effets indésirables suivants ont été rapportés pendant la phase de traitement en ouvert du platysma visible:
Affections gastro-intestinales
Occasionnels: Dysphagie
Affections du système nerveux
Occasionnels: Parésie faciale
Lors de l'administration répétée de jusqu'à 4 traitements par VISTABEL, aucune modification du profil général de sécurité n'a été observée.
La sécurité des traitements par VISTABEL en cas de platysma visible a également été évaluée à une dose supérieure à celle recommandée. Les effets indésirables suivants ont été observés chez les participants à l'étude ayant reçu 52, 62 ou 72 unités de VISTABEL: dyspnée, faiblesse musculaire, raideur musculaire, tensions musculaires, crampes musculaires, myalgie et douleurs à la nuque.
Informations supplémentaires
Des réactions d'hypersensibilité sévères et/ou immédiates, comprenant choc anaphylactique, maladie sérique, urticaire, œdème des parties molles et dyspnée, ont rarement été rapportées. Quelques-unes de ces réactions sont survenues soit après utilisation de la toxine botulique seule soit après utilisation de la toxine botulique associée à d'autres préparations dont l'utilisation s'accompagne de réactions similaires.
Des crises survenant pour la première fois ou de façon répétée ont été rapportées, en général chez des patients prédisposés à de telles manifestations. La relation exacte entre ces événements et l'injection de la toxine botulique n'a pas été établie.
Des effets indésirables pouvant être liés à la diffusion de la toxine à distance du site d'administration ont été très rarement rapportés après le traitement par la toxine botulique (par ex. faiblesse musculaire, dysphagie, constipation ou pneumopathie d'inhalation pouvant être fatale) (voir aussi «Mises en garde et précautions»).
Des effets indésirables liés au système cardiovasculaire, y compris arythmie et infarctus du myocarde, ayant dans certains cas été fatals, ont été rarement rapportés. Certains de ces patients présentaient des facteurs de risque comme des maladies cardio-vasculaires. La relation exacte de ces événements et l'injection de la toxine botulique n'a pas été établie.
L'administration simultanée de toxine botulique dans la région du platysma et d'autres régions de traitement n'a pas été étudiée, et les risques potentiels d'effets indésirables qui y sont associés sont inconnus.
Effets indésirables après commercialisation
Les effets indésirables suivants ou des effets indésirables médicalement importants ont été rapportés depuis la mise sur le marché du médicament pour le traitement des rides glabellaires, des pattes d'oie et pour d'autres indications cliniques:
Affection du système immunitaire
Anaphylaxie, angio-œdème, maladie sérique et urticaire.
Troubles du métabolisme et de la nutrition
Anorexie.
Affection du système nerveux
Plexopathie brachiale, dysphonie, dysarthrie, parèse faciale, hypoesthésie, faiblesse musculaire, myasthénie grave, neuropathie périphérique, paresthésie, radiculopathie, syncope et paralysie du visage.
Affections oculaires
Glaucome à angle étroit (à cause du traitement du blépharospasme), ptôse palpébrale, strabisme, vue trouble, troubles de la vue, sécheresse oculaire, lagophtalmie et œdème palpébral.
Affections de l'oreille et du labyrinthe
Hypoacousie, acouphène et vertiges.
Affections respiratoires, thoraciques et médiastinales
Pneumonie d'aspiration, dyspnée, bronchospasme, dépression respiratoire et insuffisance respiratoire.
Affections gastro-intestinales
Douleurs abdominales, diarrhée, sécheresse buccale, dysphagie, nausées et vomissements.
Affections de la peau et du tissu sous-cutané
Alopécie, ptôse du sourcil, dermatite psoriasiforme, érythème multiforme, hyperhidrose, madarose, prurit et exanthème.
Affections musculosquelettiques et du tissu conjonctif
Atrophie musculaire, myalgie, augmentation du tonus musculaire et contractions musculaires localisées/contractions musculaires involontaires.
Troubles généraux et anomalies au site d'administration
Dénervation/atrophie musculaire, malaise et pyrexie.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageLe surdosage de VISTABEL est un terme relatif et dépend de la posologie, du site d'injection et des propriétés tissulaires de base. Aucun cas de toxicité systémique résultant d'une injection accidentelle de solution de toxine botulique de type A n'a été rapporté. Des doses excessives peuvent déclencher une paralysie neuromusculaire locale ou éloignée du site d'injection, généralisée et profonde. Aucun cas d'ingestion de toxine botulique de type A n'est connu.
Signes et symptômes
Les signes de surdosage ne s'observent pas immédiatement après l'injection. En cas d'injection ou d'ingestion accidentelle, le patient doit être mis sous observation médicale pendant plusieurs jours, afin de rechercher d'éventuels signes de faiblesse générale ou de paralysie musculaire. Si un patient présente des symptômes d'intoxication par la toxine botulique de type A (faiblesse généralisée, ptôse, diplopie, dysphagie et troubles de l'élocution ou paralysie des muscles respiratoires), il convient d'envisager son hospitalisation.
Propriétés/EffetsCode ATC
M03AX01
Mécanisme d'action
La toxine de type A de Clostridium botulinum bloque la libération périphérique d'acétylcholine au niveau des terminaisons nerveuses présynaptiques par clivage de la SNAP-25, une protéine nécessaire à l'ancrage et à la libération de l'acétylcholine par les vésicules situées au sein des terminaisons nerveuses.
Après injection, il se produit une liaison initiale rapide et de haute affinité entre la toxine et des récepteurs cellulaires de surface spécifiques. Celle-ci est suivie du transfert de la toxine à travers la membrane plasmique par endocytose. Enfin, la toxine est libérée dans le cytoplasme. Ce processus est accompagné d'une inhibition progressive de la libération d'acétylcholine. Les signes cliniques sont manifestes dans un délai de 2 à 3 jours, avec un effet maximal constaté 5 à 6 semaines après l'injection.
Pharmacodynamique
Après une injection intramusculaire, la transmission de l'influx nerveux se rétablit normalement en l'espace de 12 semaines après injection, lorsque les terminaisons nerveuses repoussent et se reconnectent avec les plaques motrices.
Efficacité clinique
Rides glabellaires
Deux études de phase 3 randomisées, multicentriques, en double aveugle, contrôlées contre placebo en groupes parallèles et menées de façon identique ont été effectuées pour évaluer l'effet de VISTABEL dans l'amélioration provisoire des rides glabellaires modérées à sévères. Les études ont porté sur des adultes en bonne santé (âgés de 18 à 75 ans) présentant des rides glabellaires d'une gravité au minimum modérée lors du froncement maximal des sourcils. Les patients étaient exclus s'ils présentaient une infection ou un problème dermatologique au site de l'injection, s'ils avaient des antécédents de paralysie faciale nerveuse, s'ils étaient atteints d'une asymétrie faciale marquée, de ptôse, d'une dermatochalasie excessive, d'une cicatrice dermique profonde, d'une peau sébacée épaisse, d'une inaptitude à réduire substantiellement les rides glabellaires même par séparation physique ou s'ils avaient un antécédent connu de trouble neuromusculaire ou tout autre trouble susceptible d'interférer avec la fonction neuromusculaire. Un traitement unique par injection intramusculaire de VISTABEL (n = 405, études combinées) ou de placebo (n = 132, études combinées) a été administré aux patients. Le volume de l'injection était de 0,1 ml/site d'injection, pour une dose/site d'injection dans les groupes de traitement actif de 4 unités Allergan. Les patients ont reçu une injection intramusculaire dans cinq sites, une dans le muscle procerus et deux dans chaque muscle corrugator upercilii, pour une dose totale de 20 unités Allergan dans les groupes de traitement actif.
Les deux mesures primaires d'efficacité étaient l'évaluation par l'investigateur de la sévérité des rides glabellaires au froncement maximal au jour 30 après l'injection et l'évaluation globale par le patient du changement d'aspect des rides glabellaires au jour 30 après l'injection.
Un guide photographique a été fourni à chaque centre d'étude afin de faciliter l'évaluation de la sévérité des rides glabellaires par l'investigateur en utilisant une échelle d'évaluation de 4 points (0 = aucune, 1 = faible, 2 = modérée, 3 = sévère). Le succès du traitement a été défini par un degré de gravité de 0 ou de 1.
Afin d'évaluer globalement le changement d'aspect des rides glabellaires, le patient a répondu à la question: «Comment évalueriez-vous le changement d'aspect de vos rides glabellaires par rapport à leur aspect immédiatement avant la dernière injection?» L'évaluation des réponses par les patients variait de +4 (amélioration de 100%) à -4 (aggravation très marquée, pire à environ 100% ou plus). Le succès du traitement a été défini par un score de +2 au minimum (amélioration modérée, environ 50%).
L'âge moyen était de 46,0 ans (de 22 à 78 ans), 68,2% (366/537) des patients ayant ≤50 ans, 31,8% (171/537) ≥51 ans et 6,0% ≥65 ans.
La majorité des patients étaient des femmes, 81,9% (440/537), et caucasiennes, 83,8% (450/537).
Au cours des études cliniques, les patients ont reçu jusqu'à trois injections sur une période de 12 mois. La première phase en double aveugle de l'étude a duré 16 semaines. Après la fin de la phase en double aveugle, les participants ont été invités à prendre part à la phase ouverte de traitement répété par VISTABEL à un intervalle de 4 mois selon le protocole.
30 jours après l'injection, l'investigateur a considéré que le traitement était un succès chez 80% des 405 patients traités par VISTABEL (rides légères ou absentes au froncement maximal du front) contre 4% des patients traités par le placebo. Lors de la même visite, 89% des patients traités par VISTABEL ont estimé qu'ils présentaient une amélioration modérée ou plus importante, contre 7% des patients traités par le placebo.
120 jours après l'injection, l'investigateur a considéré que le traitement était un succès chez 25% des patients traités par VISTABEL (rides légères ou absentes au froncement maximum du front), contre 1,6% de patients traités par le placebo. Lors de la même visite, 39% des patients traités par VISTABEL ressentaient une amélioration modérée ou plus importante, contre 1% des patients traités par le placebo.
Pattes d'oie
Au total, 1362 patients présentant uniquement des pattes d'oie modérées à sévères lors de l'expression maximale du sourire (n = 445, étude 191622-098) ou des rides glabellaires modérées à sévères lors du froncement maximal des sourcils (n = 917, étude 191622-099) ont été inclus.
Par comparaison au placebo, les injections de VISTABEL ont permis une réduction significative de la marque des pattes d'oie pendant une durée de 5 mois maximum, lors de toutes les mesures (p < 0,001). L'évaluation a reposé sur la proportion de patients qui ont présenté, dans les deux études pivots, un niveau de sévérité des pattes d'oie en expression maximale du sourire inexistant à faible jusqu'au jour 150 (fin de l'étude) dans l'étude 191622-098 et jusqu'au jour 120 (fin du premier cycle de traitement) dans l'étude 191622-099. Le tableau 2 synthétise les résultats au jour 30 (moment de mesure du critère d'évaluation primaire de l'efficacité).
Dans l'étude 191622-104 (extension de l'étude 191622-099), 101 patients qui avaient auparavant été randomisés pour recevoir le placebo, ont été traités pour la première fois par une dose de 44 unités Allergan. Par comparaison au placebo, les patients traités par VISTABEL ont tiré un bénéfice significatif de leur premier traitement par le principe actif concernant le critère d'évaluation primaire d'efficacité au jour 30. Le taux de réponse était similaire à celui du groupe recevant 44 unités Allergan au jour 30 suivant le premier traitement dans l'étude 191622-099.
Tableau 2: Jour 30 - Évaluation par le médecin et les patients des pattes d'oie en expression maximale du sourire – taux de réponse (% des patients, qui ont évalué le niveau de sévérité des pattes d'oie comme inexistant à faible)
|
Étude clinique
|
Dose
|
VISTABEL
|
Placebo
|
VISTABEL
|
Placebo
| |
Évaluation par le médecin
|
Évaluation par le patient
| |
191622-098
|
24 unités Allergan
(pattes d'oie)
|
66,7%*
(148/222)
|
6,7%
(15/223)
|
58,1%*
(129/222)
|
5,4%
(12/223)
| |
191622-099
|
24 unités Allergan
(pattes d'oie)
|
54,9%*
(168/306)
|
3,3%
(10/306)
|
45,8%*
(140/306)
|
3,3%
(10/306)
| |
|
44 unités Allergan (24 unités Allergan (pattes d'oie)
20 unités Allergan (rides glabellaires))
|
59,0%*
(180/305)
|
3,3%
(10/306)
|
48,5%*
(148/305)
|
3,3%
(10/306)
|
*p < 0,001 (VISTABEL par comparaison au placebo)
Dans les deux études pivots, selon l'évaluation des participants, l'amélioration des pattes d'oie par rapport au relevé initial au jour 30 et lors de la mesure après chaque cycle de traitement était statistiquement significative pour VISTABEL (24 unités Allergan et 44 unités Allergan) par rapport au placebo (p < 0,001).
Dans un questionnaire relatif au résultat du traitement des rides (Facial Line Outcomes, FLO-11), la proportion de patients indiquant avoir ressenti une amélioration des conséquences psychologiques des pattes d'oie sur la perception de l'âge, de l'attractivité et de la fatigue était statistiquement significative (p < 0,001) pour VISTABEL (24 unités Allergan et 44 unités Allergan) par rapport au placebo dans les deux principales études à la date d'évaluation primaire après 30 jours. La significativité statistique a également pu être démontrée lors de toutes les dates ultérieures.
Dans les études pivots, 3,9% (53/1362) des patients étaient âgés de plus de 65 ans. Le taux de réponse au traitement par VISTABEL (24 unités Allergan et 44 unités Allergan) atteignait 36% pour les patients de cette classe d'âge selon l'évaluation de l'investigateur (au jour 30).
Pour 916 patients (517 patients avec 24 unités Allergan et 399 patients avec 44 unités Allergan) traités par VISTABEL, on a analysé des échantillons prélevés afin d'identifier un éventuel développement d'anticorps. La présence d'anticorps neutralisants n'a été détectée chez aucun patient.
Rides du front
Au total, 822 patients présentant des rides du front et des rides glabellaires modérées à sévères observées à la contraction maximale, soit seules (N = 254, étude 191622-142) soit associées à des pattes d'oie modérées à sévères observées lors d'un sourire forcé (N = 568, étude 191622-143), ont été inclus dans l'étude et dans la population principale d'analyse de tous les critères d'efficacité principaux. Les rides du front étaient traitées en même temps que les rides glabellaires pour minimiser le potentiel d'une ptôse de sourcil.
La proportion de patients présentant une sévérité cotée «absence de rides» ou «rides d'intensité légère» pour les rides du front observées lors de l'élévation maximale des sourcils après les injections de VISTABEL, évaluée par les patients et les investigateurs, était supérieure à celle des patients du groupe traité par le placebo. Les évaluations ont été réalisées au jour 30 (jour de l'évaluation des critères d'efficacité principaux; Tableau 3).
Tableau 3: Jour 30 - Évaluation par l'investigateur et le patient des rides du front et des rides supérieures du visage à la contraction maximale et au repos
|
Étude clinique
|
Critère d'évaluation
|
VISTABEL
|
Placebo
|
VISTABEL
|
Placebo
| |
Évaluation de l'investigateur
|
Évaluation du patient
| |
Étude 191622-142 40 unités Allergan
(20 unités Allergan pour les rides du front + 20 unités Allergan pour les rides glabellaires)
|
Rides du front à la contraction maximalea
|
94,8%
(184/194)
|
1,7%
(1/60)
|
87,6%
(170/194)
|
0,0%
(0/60)
| |
p < 0,0005
|
p < 0,0005
| |
Rides du front au reposb
|
86,2%
(162/188)
|
22,4%
(13/58)
|
89,7%
(174/194)
|
10,2%
(6/59)
| |
p < 0,0001
|
p < 0,0001
| |
Étude 191622-143 40 unités Allergan
(20 unités Allergan pour les rides du front + 20 unités Allergan pour les rides glabellaires)
|
Rides du front à la contraction maximalea
|
90,5%
(201/222)
|
2,7%
(3/111)
|
81,5%
(181/222)
|
3,6%
(4/111)
| |
p < 0,0005
|
p < 0,0005
| |
Rides du front au reposb
|
84,1%
(185/220)
|
15,9%
(17/107)
|
83,6%
(184/220)
|
17,4%
(19/109)
| |
p < 0,0001
|
p < 0,0001
| |
Étude 191622-143 64 unités Allergan
(20 unités Allergan pour les rides du front + 20 unités Allergan pour les rides glabellaires + 24 unités Allergan pour les pattes d'oie)
|
Rides du front à la contraction maximalea
|
93,6%
(220/235)
|
2,7%
(3/111)
|
88,9%
(209/235)
|
3,6%
(4/111)
| |
p < 0,0005
|
p < 0,0005
| |
Rides supérieures du visage à la contraction maximalec
|
56,6%
(133/235)
|
0,9%
(1/111)
|
non applicable
| |
p < 0,0001
|
a Pourcentage de patients ayant présenté une sévérité cotée «absence de rides» ou «rides d'intensité légère» pour les rides du front lors de l'élévation maximale des sourcils
b Pourcentage de patients présentant une amélioration d'au moins 1 grade par rapport à l'inclusion pour la sévérité des rides du front au repos
c Pourcentage de répondeurs défini comme un même patient ayant présenté une sévérité cotée «absence de rides» ou «rides d'intensité légère» pour les rides du front, les rides glabellaires et les pattes d'oie pour chaque région du visage à la contraction maximale
VISTABEL a significativement réduit la sévérité des rides du front observées lors de l'élévation maximale des sourcils par comparaison au placebo pendant une durée allant jusqu'à 6 mois (p < 0,05). Le pourcentage de patients ayant présenté une sévérité des rides du front cotée «absence de rides» ou «rides d'intensité légère» lors de l'élévation maximale des sourcils dans les deux études pivots, était de 21,6% dans le groupe sous VISTABEL contre 0% dans le groupe sous placebo jusqu'au jour 150 (étude 191622-142) et de 6,8% dans le groupe sous VISTABEL contre 0% des patients dans le groupe sous placebo jusqu'au jour 180 (étude 191622-143).
Lorsque les trois zones étaient traitées simultanément (étude 191622-143), VISTABEL a réduit de façon significative la sévérité des rides glabellaires pendant une durée allant jusqu'à 6 mois (5,5% des patients sous VISTABEL contre 0% des patients sous placebo), la sévérité des rides canthales latérales pendant une durée allant jusqu'à 6 mois (3,4% des patients sous VISTABEL contre 0% des patients sous placebo), et la sévérité des rides du front pendant une durée jusqu'à 6 mois (9,4% des patients sous VISTABEL contre 0% des patients sous placebo).
Au total, 116 et 150 patients ont reçu sur un an 3 cycles de traitement par 40 unités Allergan de VISTABEL (20 pour les rides du front et 20 pour les rides glabellaires) et par 64 unités Allergan (20 pour les rides du front, 20 pour les rides glabellaires et 24 pour les pattes d'oie), respectivement. Le taux de réponse pour l'amélioration des rides du front était similaire pour tous les cycles de traitement.
Dans les études pivots, 3,7% des patients étaient âgés de plus de 65 ans. Les taux de réponse dans ce sous-groupe traité par VISTABEL étaient similaires à ceux de la population globale, mais la significativité statistique n'a pas été atteinte en raison du faible nombre de patients.
Platysma visible
Au total, 834 patients présentant un platysma visible lors d'une contraction maximale, modéré à sévère ont été inclus dans les études cliniques (n = 408, étude M21-309; n = 426, étude M21-310). Parmi ces participants aux études, 748 étaient psychologiquement affectés par leur platysma visible.
Le critère principal d'évaluation de l'efficacité était l'évaluation du platysma visible lors d'une contraction maximale à l'aide de l'évaluation en cinq étapes effectuée par les médecins investigateurs (Clinician Allergan Platysma Prominence Scale, C-APPS) et par les participants aux études (Participant Allergan Platysma Prominence Scale, P-APPS). Pour les deux échelles, les catégories sont les suivantes: 1 = minimal, 2 = léger, 3 = modéré, 4 = sévère, 5 = extrême. Les évaluations à l'aide de C-APPS et P-APPS ont été effectuées indépendamment l'une de l'autre. Le moment d'évaluation principal était le 14ème jour après le premier traitement.
Tableau 4: Degrés de sévérité pour le platysma et descriptions (par côté)
|
Degré
|
Description du degré de sévérité par côté
| |
1
|
Minimal; aucune bande verticale visible dans le cou et aucune influence sur la définition de la ligne de la mâchoire
| |
2
|
Modéré; bandes verticales visibles dans le cou et aucune influence sur la définition de la ligne de la mâchoire
| |
3
|
Modéré; 1 bande verticale visible traversant dans le cou avec une influence sur la définition de la ligne de la mâchoire
| |
4
|
Sévère; 2 bandes verticales visibles traversant dans le cou avec une influence sur la définition de la ligne de la mâchoire
| |
5
|
Extrême; 3 ou plusieurs bandes verticales visibles avec une influence sur la définition de la ligne de la mâchoire
|
Non seulement dans l'étude M21-309 mais aussi dans l'étude M21-310, les améliorations du degré de sévérité du platysma visible lors d'une contraction maximale sous traitement par VISTABEL étaient supérieures à celles observées sous placebo au jour 14 (p < 0,0001) et à tous les moments ultérieurs jusqu'au jour 120 (fin de l'étude). Le résultat a été mesuré à l'aide de la proportion de participants aux études ayant obtenu une amélioration ≥2 degrés par rapport au début de l'étude, sur base de l'évaluation effectuée par le médecin investigateur et par le participant à l'étude (Tableau 4).
Tableau 5: Évaluation du platysma visible lors de la contraction maximale par le médecin investigateur et par le participant à l'étude – Taux de répondants (% de participants ayant obtenu une amélioration au 14ème jour ≥2 degrés par rapport au début de l'étude)
|
Étude clinique
|
VISTABEL
26, 31 ou 36 unités Allergan
|
Placebo
|
VISTABEL
26, 31 ou 36 unités Allergan
|
Placebo
| |
Évaluation du médecin investigateur
|
Évaluation du participant à l'étude
| |
M21-309
|
43,8 %*
(79/181)
|
3,9 %
(7/186)
|
45,6 %*
(83/181)
|
3,9 %
(7/186)
| |
M21-310
|
41,0 %*
(76/186)
|
2,2 %
(4/195)
|
40,8 %*
(76/186)
|
3,9 %
(8/195)
|
*p < 0,0001 (VISTABEL par rapport au placebo)
Dans l'étude M21-323, une étude de prolongation en ouvert de l'étude M21-309, 292 participants aux études au total ont reçu jusqu'à 4 traitements sur une période d'un an. 261 de ces participants aux études étaient psychologiquement affectés par leur platysma visible. Les taux de réponse pour une amélioration du platysma visible étaient comparables dans tous les cycles de traitement.
À l'aide du questionnaire relatif à l'apparence du cou et de la partie inférieure du visage (Appearance of Neck and Lower Face Questionnaire, ANLFQ): Point 5: satisfaction (suivi), 63,6% (115/181) des participants à l'étude M21-309 et 61,2% (114/186) des participants à l'étude M21-310 ont indiqué le jour 14 être «satisfaits» ou «très satisfaits» du traitement par VISTABEL, par rapport aux participants aux études traités par placebo (11,7% [22/186] ou 11,8% [23/195]) (p < 0,0001 dans les deux études).
Sécurité et efficacité chez les patients âgés
Les études cliniques concernant VISTABEL n'incluaient pas un nombre suffisant de patients âgés de plus de 65 ans pour déterminer statistiquement s'ils répondent différemment des patients plus jeunes. Cependant, dans les deux études d'efficacité de phase 3 randomisées (pour les rides glabellaires) suivant un rapport de 3:1, multicentriques, en double aveugle et contrôlées contre placebo, les taux de répondeurs pour les deux variables primaires d'efficacité combinées étaient plus élevés chez les patients âgés de ≤50 ans que ceux chez les patients âgés de ≥65 ans.
L'analyse basée sur un ensemble de données combinées a montré que, concernant l'évaluation faite par l'investigateur au jour 30 portant sur des patients âgés de 65 ans et plus, 39% (9/23) des patients répondaient au traitement contre 22% (2/9) dans le groupe traité par le placebo. Cette différence n'est pas statistiquement importante (p = 0,228); elle n'excède pas non plus la différence pré-spécifiée de 30% requise pour être définie comme cliniquement significative. Il n'existait aucune différence statistiquement significative entre les groupes lors de l'évaluation par l'investigateur du froncement maximum pour ce groupe d'âge. Il existait une différence statistiquement significative en faveur de VISTABEL lors de l'évaluation globale faite par les patients à tous les points temporels (p = 0,036) hormis au jour 120 (p = 0,214).
À ce jour, trop peu de patients âgés de plus de 75 ans ont été traités pour permettre une comparaison fiable.
PharmacocinétiqueDes études classiques portant sur l'absorption, la distribution, la biotransformation et l'élimination du principe actif n'ont pas été réalisées en raison de la nature de ce produit.
Les études portant sur la distribution chez les rats indiquent une lente diffusion musculaire de la toxine botulique de type A radiomarquée dans le muscle gastrocnémien après injection.
Elle est suivie d'une métabolisation systémique rapide et d'une excrétion urinaire.
La demi-vie du produit radiomarqué était d'environ 10 heures. Au site d'injection, les éléments radioactifs étaient liés à de grosses molécules protéiques, tandis que dans le plasma, la radioactivité était liée à de petites molécules. Cela suggère une métabolisation systémique rapide du substrat. Dans les 24 heures suivant l'administration de la dose, 60% de la radioactivité étaient excrétés dans les urines. La toxine est probablement métabolisée par des protéases et les composants moléculaires sont recyclés par les voies métaboliques normales.
Distribution
Distribution du principe actif chez les patients:
La distribution systémique des doses thérapeutiques de VISTABEL est supposée être faible. Des études cliniques utilisant des techniques électromyographiques à fibre unique ont mis en évidence une augmentation de l'activité électrophysiologique neuromusculaire dans les muscles distants du point d'injection, sans aucun signe ou symptôme clinique associé.
Données précliniquesToxicité sur la reproduction
Des souris, des rates et des lapines gravides ont reçu pendant la période d'organogenèse des injections de VISTABEL par voie intramusculaire. La dose sans effet toxique observé (NOAEL) au cours de la phase de développement était de 4, de 1 et de 0,125 unités/kg de poids corporel, respectivement. Les doses plus élevées ont entraîné une réduction du poids du fœtus et/ou un retard d'ossification. On a constaté des avortements chez le lapin.
Autres données (toxicité locale, phototoxicité, immunotoxicité)
Outre la toxicité pour la reproduction, les études de sécurité précliniques suivantes ont été conduites avec VISTABEL: toxicité aiguë, toxicité chronique, tolérance locale, potentiel mutagène, pouvoir antigénique, compatibilité sanguine chez l'homme. Ces études n'ont révélé aucun risque particulier chez l'homme aux doses cliniquement significatives.
Ceci est également confirmé par de nombreuses années d'expérience d'utilisation de ce produit aussi bien pour plusieurs indications cliniques employant des doses similaires à celles du traitement des rides glabellaires, comme par exemple le blépharospasme, le spasme hémifacial et le strabisme, que pour les indications nécessitant des doses plus élevées, telles que la dystonie cervicale ou la spasticité focale chez les adultes à la suite d'un accident vasculaire cérébral et chez les enfants avec parésie cérébrale. La DL50 intramusculaire reconnue dans la littérature est de 39 unités/kg chez le jeune singe.
Remarques particulièresIncompatibilités
En l'absence d'étude d'incompatibilité, ce médicament ne doit pas être mélangé à d'autres médicaments.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «Exp» sur le récipient.
Stabilité après ouverture
Les études physicochimiques ont montré que le médicament peut être conservé après reconstitution jusqu'à 3 jours à 2-8°C. Comme le médicament ne contient pas de conservateur, il faut, pour des raisons microbiologiques, utiliser la préparation prête à l'emploi immédiatement après dilution, sauf si cette dernière a été effectuée dans des conditions aseptiques contrôlées et validées. Le médicament ne doit normalement pas être conservé plus de 24 heures à 2-8°C.
Remarques particulières concernant le stockage
Flacons fermés: à conserver au réfrigérateur entre 2-8°C ou au congélateur à -5°C ou en dessous.
Conserver hors de portée des enfants.
Remarques concernant la manipulation
Préparation de la solution injectable
La reconstitution du produit et la préparation de la seringue doivent être effectuées sur des serviettes en papier plastifié afin d'absorber tout liquide renversé. Reconstituer VISTABEL avec du sérum physiologique stérile sans agent conservateur (solution de chlorure de sodium à 0,9% pour préparations injectables).
Prélever la quantité indiquée de diluant (voir tableau ci-dessous) dans une seringue de taille appropriée et injecter le diluant dans le flacon.
|
Quantité de diluant ajoutée:
|
Dose reconstituée (unités par 0,1 ml):
| |
2,5 ml
|
4,0 unités Allergan
|
Le flacon ne doit pas être utilisé si le diluant n'est pas aspiré par le vide à l'intérieur du flacon. Mélanger doucement VISTABEL avec la solution saline en faisant tourner le flacon.
VISTABEL reconstitué est une solution incolore à légèrement jaunâtre, exempte de particules visibles. La solution reconstituée doit être contrôlée visuellement avant utilisation afin de vérifier qu'elle est claire et ne contient pas de particules.
Toute solution de toxine non utilisée doit être éliminée de manière appropriée.
Élimination de la solution de toxine
Pour la sécurité de l'élimination, les flacons non utilisés doivent être reconstitués avec un peu d'eau et autoclavés. Tous les flacons utilisés, seringues, restes de solution renversée, etc. doivent également être inactivés par autoclave. Les résidus de toxine botulique peuvent également être inactivés avec une solution d'hypochlorite diluée à 0,5%. La solution doit être appliquée pendant au moins 5 minutes.
Identification du médicament
Si le produit VISTABEL utilisé est authentique, des lignes horizontales aux couleurs de l'arc-en-ciel et le nom «abbvie» sont visibles sur l'étiquette (hologramme) en tournant le flacon à droite et à gauche sous une lampe de bureau ou un néon. Si cela n'est pas le cas et/ou si la perforation n'est plus intacte, alors le produit ne doit pas être utilisé et AbbVie doit être contacté.
En outre, l'autocollant avec le numéro de lot et la date d'expiration peut être détaché de l'étiquette du flacon de VISTABEL et collé dans le dossier du patient pour faciliter la traçabilité du lot. Après le décollement de l'autocollant de l'étiquette du flacon, la mention «Verwendet/Utilisé» apparaît.
Numéro d’autorisation55955 (Swissmedic)
PrésentationEmballage avec 1 flacon contenant 100 unités Allergan [A]
Titulaire de l’autorisationAbbVie AG, 6330 Cham
Mise à jour de l’informationMai 2025
|






