CompositionPrincipes actifs
Octocogum alfa (Factor VIII coagulationis humanus (ADNr))
Excipients
Mannitolum, Natrii chloridum, Histidinum, Trehalosum, Calcii chloridum, Trometamolum, Polysorbatum 80, Antiox.: Glutathionum 0.4 mg
Solvant: Aqua ad iniectabilia
Indications/Possibilités d’emploiTraitement et prophylaxie des épisodes hémorragiques chez les patients atteints d'hémophilie A (déficit congénital en facteur VIII).
ADVATE ne contient pas de facteur de von Willebrand en quantité pharmacologiquement active. Par conséquent, il n'est pas indiqué dans le traitement de la maladie de von Willebrand.
Posologie/Mode d’emploiLe traitement doit être instauré sous la responsabilité d'un médecin expérimenté dans la prise en charge de l'hémophilie A.
Posologie
La dose et la durée du traitement substitutif dépendent de la sévérité du déficit en facteur VIII, de la localisation et de l'importance de l'hémorragie ainsi que de l'état clinique du patient.
La dose de facteur VIII administrée est exprimée en Unités Internationales (UI), ramenées au standard de l'OMS pour les concentrés de facteur VIII. L'activité en facteur VIII dans le plasma est exprimée soit en pourcentage (par rapport au plasma humain), soit en UI (par rapport au Standard international du facteur VIII plasmatique).
Une Unité internationale (UI) d'activité de facteur VIII correspond à la quantité de facteur VIII contenue dans un ml de plasma humain normal. Le calcul de la dose nécessaire de facteur VIII est basé sur le résultat empirique que 1 UI de facteur VIII par kg de poids corporel augmente l'activité plasmatique du facteur VIII de 2 UI/dl. La dose nécessaire est déterminée à l'aide de la formule suivante:
Nombre d'unités (UI) nécessaires = poids corporel (kg) x augmentation souhaitée du taux de facteur VIII (%) x 0,5
Lors des événements hémorragiques suivants, l'activité de facteur VIII ne doit pas chuter en dessous du taux d'activité plasmatique indiqué (en % de la normale ou UI/dl) pendant la durée mentionnée. Le tableau ci-dessous peut servir de guide pour les posologies lors d'épisodes hémorragiques et de chirurgie:
Tableau 1
|
Degré de l'hémorragie/type d'intervention chirurgicale
|
Niveau de facteur VIII nécessaire (% ou UI/dl)
|
Fréquence des doses (heures)/durée du traitement (jours)
| |
Hémorragie
| |
Début d'hémarthrose, de saignement musculaire ou buccal
|
20 - 40
|
Répéter les injections toutes les 12 à 24 heures pendant au moins 1 jour, jusqu'à la fin de l'épisode hémorragique, indiquée par la disparition de la douleur ou l'obtention d'une guérison
| |
Hémarthrose plus étendue, saignements musculaires ou hématome
|
30 - 60
|
Répéter les injections toutes le 12 – 24 heures pendant 3-4 jours ou plus longtemps jusqu'à disparition de la douleur et de l'invalidité aiguë.
| |
Hémorragie mettant en jeu le pronostic vital
|
60 - 100
|
Répéter les injections toutes les 8 à 24 heures jusqu'à ce que le danger pour le patient soit écarté.
| |
Chirurgie
| |
Mineure dont extraction dentaire
|
30 - 60
|
Toutes les 12 heures, au moins 1 jour, jusqu'à l'obtention d'une cicatrisation.
| |
Majeure
|
80 - 100
(pré- et postopératoire)
|
Répéter les injections toutes les 8-24 heures jusqu' à cicatrisation satisfaisant de la plaie, puis poursuivre le traitement pendant au moins 7 jours supplémentaires pour maintenir un taux de facteur VIII entre 30% et 60% (UI/dl).
|
Afin d'assurer la traçabilité des médicaments biotechnologiques, il convient de documenter pour chaque traitement le nom commercial et le numéro de lot.
Instructions posologiques particulières
La dose et la fréquence d'administration d'ADVATE doivent être adaptées à chaque cas individuel en fonction de l'efficacité clinique du produit. Dans certaines circonstances (présence d'un inhibiteur faible répondeur, «low-responder»), des doses plus importantes peuvent être nécessaires.
Au cours du traitement, il est conseillé d'effectuer une détermination appropriée des taux de facteur VIII plasmatique afin d'évaluer la dose à administrer ainsi que la fréquence à laquelle il faut répéter les injections. Dans le cas particulier d'intervention chirurgicale majeure ou en cas d'hémorragies mettant en jeu le pronostic vital, un contrôle précis du traitement substitutif par une mesure de l'activité du facteur VIII plasmatique est indispensable. Selon les patients, la réponse au facteur VIII peut varier, entraînant différents taux de récupération in vivo et demi-vies différentes.
Pour le traitement de longue durée des hémorragies chez les patients hémophiles A sévères, les posologies habituelles sont de 20 à 40 UI de facteur VIII par kg de poids corporel à intervalles de 2 à 3 jours. Dans certains cas, en particulier chez le sujet jeune, des intervalles plus rapprochés ou des doses plus importantes peuvent être nécessaires.
Patients avec inhibiteurs
L'apparition d'inhibiteur anti-facteur VIII doit être régulièrement surveillée chez les patients. Si le taux d'activité de facteur VIII plasmatique souhaité n'est pas atteint ou si les hémorragies ne sont pas contrôlées après administration d'une dose appropriée, un test pour déterminer la présence d'un inhibiteur doit être effectué. Chez les patients présentant des valeurs élevées en inhibiteur, il se peut que le traitement par facteur VIII ne soit pas efficace et qu'il faille envisager d'autres options thérapeutiques. La prise en charge de tels patients doit être effectuée par des spécialistes dans le traitement de l'hémophilie. Voir également «Mise en garde et précautions».
Mode d'administration
ADVATE doit être administré par voie intraveineuse. En général, l'injection intraveineuse du bolus se fait sur une période ≤5 minutes. La vitesse d'administration sera déterminée en fonction du niveau de confort du patient et ne devra pas être supérieure à 10 ml/min.
Pour des instructions concernant la reconstitution du médicament avant l'administration, voir sous «Remarques concernant la manipulation».
Contre-indicationsHypersensibilité au principe actif, à l'un des excipients ou aux protéines de souris ou de hamster.
Mises en garde et précautionsHypersensibilité
Comme avec tout médicament injectable, des réactions allergiques de type hypersensibilité peuvent apparaître. Le produit contient des traces de protéines de souris et de hamster. Des réactions d'hypersensibilité de type allergique, notamment l'anaphylaxie, ont été rapportées après administration d'ADVATE. Celles-ci se perçoivent par vertiges, paresthésie, rash, bouffées congestives, gonflement facial, urticaire et prurit. Les patients doivent être informés des signes précoces des réactions d'hypersensibilité, comme, démangeaisons, prurit, urticaire généralisée, angiooedème, hypotension (par ex., vertige ou syncope), choc et détresse respiratoire aiguë (par ex., oppression thoracique, respiration sifflante). En cas de survenue de ces symptômes, il faut indiquer aux patients d'interrompre immédiatement l'administration du produit et de contacter leur médecin. En cas de choc anaphylactique, une thérapie du choc basée sur les règles actuelles de la médecine doit être appliquée.
Inhibiteurs
L'apparition d'anticorps neutralisants (inhibiteurs) du facteur VIII est une complication connue dans le traitement des patients atteints d'hémophilie A. Ces inhibiteurs sont habituellement des immunoglobulines G dirigées contre l'activité procoagulante du facteur VIII et sont mesurées en Unités Bethesda (UB) par ml de plasma par le test de Bethesda modifié. Le développement d'inhibiteurs se manifeste, chez les patients traités, par une réponse clinique insuffisante. Dans ce cas, il est recommandé de s'adresser à un centre spécialisé dans le traitement de l'hémophilie. Le risque de développer des inhibiteurs est corrélé à la durée de l'exposition au facteur VIII, le risque étant le plus élevé au cours des 20 premiers jours d'exposition, et à d'autres facteurs génétiques et environnementaux. Rarement, les inhibiteurs peuvent apparaître après les 100 premiers jours d'exposition.
Chez les patients non préalablement traités (PUPs) qui ont été traités avec des produits de facteur VIII, l'incidence totale d'apparition d'inhibiteurs est entre 3% et 13% en cas hémophilie mineure jusqu'à modérée et de 30% environ chez les patients avec une hémophile sévère.
Des cas de réapparition d'inhibiteurs (faible titre) ont été observés après le changement d'un facteur VIII recombinant pour un autre, chez des patients préalablement traités (PTPs) ayant plus de 100 jours d'exposition et qui avaient des antécédents de développement d'inhibiteur. Il est donc recommandé de surveiller avec précaution l'apparition d'inhibiteurs chez les patients traités avec ADVATE par des observations cliniques et à l'aide de tests biologiques appropriés.
De manière générale, tous les patients traités avec des produits de facteur VIII de coagulation doivent faire l'objet d'une surveillance soigneuse pour détecter l'apparition d'inhibiteurs par un suivi clinique et à l'aide de tests biologiques appropriés.
Complications liées au cathéter lors du traitement
Si un dispositif d'accès veineux central est requis, le risque de complications liées au dispositif d'accès veineux central, notamment des infections locales, une bactériémie et une thrombose au site du cathéter, doit être pris en compte.
Considérations liées à l'excipient
Après reconstitution, ce médicament contient 0,45 mmol (10 mg) de sodium par flacon. A prendre en compte par les patients suivant un régime contrôlé en sodium.
InteractionsAucune interaction d'ADVATE avec d'autres spécialités pharmaceutiques n'est connue.
Grossesse, allaitementADVATE n'a pas fait l'objet d'études de reproduction chez l'animal. En raison de la rareté de l'hémophilie A chez les femmes, il n'y a pas de données sur l'utilisation d'ADVATE pendant la grossesse et l'allaitement. Par conséquent, il faut peser l'intérêt de l'utilisation d'ADVATE au cours de la grossesse et de l'allaitement par rapport au risque pour la mère et l'enfant et ADVATE ne doit être prescrit qu'en cas de nécessité absolue.
Effet sur l’aptitude à la conduite et l’utilisation de machinesADVATE a un effet négligeable sur l'aptitude à la conduite ou sur la capacité à utiliser des machines.
Effets indésirablesRésumé du profil de sécurité
Durant les études cliniques avec ADVATE, un total de 93 effets indésirables a été rapporté chez 45 des 418 patients traités. Les effets indésirables qui ont été observés le plus fréquemment étaient le développement d'anticorps neutralisants du facteur VIII (inhibiteurs), des maux de tête et de la fièvre. Sur les 93 effets indésirables, causalement en rapport avec ADVATE, aucun n'a été observé chez les nouveau-nés, 30 ont été signalés chez 20 nourrissons parmi 60, 7 chez 3 enfants parmi 68, 10 chez 5 adolescents parmi 38 et 46 chez 17 adultes parmi 147.
Fréquence des effets indésirables au cours des études cliniques ainsi des signalements spontanés:
La fréquence a été définie selon les critères suivants: très fréquent (≥10%), fréquent (≥1% à <10%), occasionnel (≥0.1% à <1%), rare (≥0.01% à <0.1%), très rare (<0.01%), cas isolés (fréquence ne peut pas être estimée sur la base des données disponibles).
Infections et infestations
Occasionnel: grippe, laryngite
Affections hématologiques et du système lymphatique
Très fréquent: inhibition du facteur VIII 29% (PUP)
Occasionnel: lymphangite, inhibition du factor VIII (PTP)
Affections cardiaques
Occasionnel: palpitations
Affections du système immunitaire
Cas isolés: réactions anaphylactiques, hypersensibilité, gonflement facial
Affections du système nerveux
Fréquent: maux de tête
Occasionnel: vertiges, trouble du goût, migraine, atteinte de la mémoire, tremblements, syncope
Affections oculaires
Occasionnel: inflammation oculaire
Affections vasculaires
Occasionnel: bouffée de chaleur, hématomes, pâleur
Affections respiratoires, thoraciques et médiastinales
Occasionnel: dyspnées
Affections gastro-intestinales
Occasionnel: diarrhée, nausée, douleur abdominale haute, vomissements
Affections de la peau et du tissu sous-coutané
Occasionnel: hyperhidrose, prurit, rash, urticaire
Affections généraux et anomalies au site d'administration
Fréquent: pyrexie
Occasionnel: douleurs thoracique, inconfort thoracique, œdème périphérique, frissons, état anormal, hématome au site de ponction vasculaire
Cas isolés: réaction au site d'injection, fatigue, malaise
Investigations
Occasionnel: diminution de l'hématocrite, test biologique anormal, diminution du facteur VIII de coagulation, monocytes augmentés (Cette diminution inattendue du taux de facteur VIII de coagulation est survenue chez un patient sous perfusion continue d'ADVATE après chirurgie (jours postopératoires 10-14). L'hémostase a été maintenue à tout moment pendant cette période. Quinze jours après l'opération, le taux de facteur VIII et la clairance sont revenus à la normale. Les recherches d'inhibiteur réalisées à la fin d'étude se sont révélées négatives.)
Cas isolés: taux d'éosinophiles élevé
Lésions, intoxications et complications d'interventions
Occasionnel: complication post-procédure, hémorragie post-procédure, réaction sur le site de l'intervention
Description des effets indésirables individuels
Développent d'inhibiteurs
Dans une étude, terminée et non contrôlée, 16 des 45 (35.6%) patients non préalablement traités, souffrant d'hémophile A sévère (FVIII < 1%) et ayant été exposés au moins 25 jours au FVIII, ont développé des inhibiteurs du FVIII: 7 (15.6%) sujets ont développé des inhibiteurs de titre élevé et 9 (20%) sujets ont développé des inhibiteurs de faible titre, dont 1 a également été comme un inhibiteur transitoire.
Dans cette étude, les facteurs de risque liés à l'apparition d'inhibiteurs comprenaient le fait de ne pas être caucasien, les antécédents familiaux d'inhibiteurs et le traitement intensif à haute dose au cours de 20 premiers jours d'exposition. Aucun des 20 sujets qui ne présentaient pas ces facteurs de risque n'a développé d'inhibiteurs.
L'immunogénicité d'ADVATE a été évaluée chez des patients préalablement traités. Au cours des essais cliniques avec ADVATE, 276 patients, dont enfants (entre 2 et 12 ans), adolescents (entre 12 et 16 ans) et adultes (âgés de 16 ans et plus) ayant fait l'objet d'un diagnostic d'hémophilie A sévère à modérément sévère (FVIII ≤2 %) et précédemment exposés à des concentrés de facteur VIII pendant au moins 150 jours (adultes et enfants plus âgées) et >50 jours (enfants < 6 ans), un sujet a développé un inhibiteur de faible titre (2,4 UB selon le test Bethesda modifié) après 26 jours d'exposition. Les tests de suivi de la formation d'inhibiteurs, effectués sur ce sujet après sa sortie de l'étude, étaient négatifs.
Réactions spécifiques aux résidus du processus de fabrication
La réponse immunitaire des patients à des traces de protéines contaminantes a été analysée en examinant les titres en anticorps dirigés contre ces protéines, les paramètres biologiques et les effets indésirables rapportés. Sur les 182 sujets traités, pour lesquels le taux d'anticorps dirigés contre les protéines de cellules CHO a été évalué, 3 cas d'augmentation statistiquement significative des anticorps de hamster dans les titres par analyse de régression linéaire et 4 cas de pics prolongés ou provisoires ont été observés. Un sujet, a présenté à la fois une hausse statistiquement significative des anticorps dirigés contre les protéines de cellules CHO et un pic prolongé mais ce sujet n'a développé aucun autre signe ou symptôme de réponse allergique ou d'hypersensibilité. Sur les 182 patients traités, pour lesquels les anticorps dirigés contre les IgG d'origine murine ont été évalués, 10 cas d'augmentation statistiquement significative des anticorps dirigés contre les antigènes murins par analyse de régression linéaire et 2 cas de pics prolongés ou provisoires ont été observés. Un sujet a présenté à la fois une hausse statistiquement significative et un pic prolongé des anticorps dirigés contre les antigènes murins. Chez quatre de ces sujets, des cas isolés d'urticaire, de prurit, de rash et de numérations éosinophiles légèrement élevées ont été constatés au cours des expositions nombreuses et répétées au produit pendant l'étude.
Réactions d'hypersensibilité
Les réactions de type allergique englobent l'anaphylaxie et se sont manifestées sous forme de vertiges, paresthésie, rash, bouffées congestives, gonflement facial, urticaire et prurit.
Enfants et adolescents
Outre le développement d'inhibiteurs chez les patients pédiatriques non préalablement traités (PUPs), et les complications liées au cathéter, aucune différence d'effets indésirables liée à l'âge n'a été constatée dans les études cliniques.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageAucun signe de surdosage faisant suite à l'administration d'ADVATE n'a été rapporté.
Propriétés/EffetsCode ATC
B02BD02 (facteur VIII de coagulation)
Le complexe facteur VIII/facteur von Willebrand se compose de deux molécules (facteur VIII et facteur von Willebrand) aux fonctions physiologiques différentes.
ADVATE contient du facteur VIII de coagulation recombinant, une glycoprotéine dont la séquence d'acides aminés est comparable au facteur VIII humain, et dont les modifications post-translationnelles sont semblables à celles d'une molécule dérivée du plasma.
Le facteur VIII de coagulation recombinant est obtenu à partir de cellules ovariennes d'hamster chinois (CHO) génétiquement modifiés et contenant le gène du facteur VIII humain. ADVATE contient des traces d'IgG de souris, de protéines cellulaires de CHO et de facteur de von Willebrand recombinant (voir également ''Contre-indications'').
L'activité (UI) est déterminée par un test chromogénique par rapport à un standard interne lui-même référencé au huitième standard de l'OMS. L'activité spécifique est d'environ 4520 – 11300 UI/mg de protéine.
ADVATE est une préparation lyophilisée stérile et apyrogène, qui ne contient ni conservateur ni additif d'origine animale ou humaine.
ADVATE est une glycoprotéine constituée de 2332 acides aminés avec un poids moléculaire approximatif de 280 kD. Lorsqu'il est perfusé à un patient hémophile, le facteur VIII se lie au facteur de von Willebrand dans la circulation sanguine. Le facteur VIII activé agit comme un cofacteur du facteur IX activé et accélère la conversion du facteur X en facteur X activé. Le facteur X activé convertit la prothrombine en thrombine. La thrombine convertit ensuite le fibrinogène en fibrine, ce qui aboutit à la formation d'un caillot.
L'hémophilie A est une maladie de la coagulation sanguine, héréditaire liée au sexe, due à la diminution du taux de facteur VIII provoquant des accidents hémorragiques au niveau des articulations, des muscles ou des organes internes, spontanés ou provoqués par des traumatismes accidentels ou chirurgicaux. Grâce au traitement substitutif, le taux plasmatique en facteur VIII est augmenté, ce qui permet de corriger temporairement le déficit en facteur VIII et les tendances hémorragiques.
Efficacité hémostatique
Au total, 107 patients âgés de plus de 10 ans, atteints d'hémophilie A sévère à modérément sévère et précédemment traités par FVIII (exposés pendant au moins 150 jours à des préparations de FVIII recombinant ou dérivé du plasma) ont été inclus dans l'étude pivot de phase II/III et y ont reçu un traitement prophylactique. Des taux annuels d'épisodes hémorragiques de 4,1 (hémorragies spontanées) et 4,7 (épisodes hémorragiques provoqués par un traumatisme) ont été enregistrés sous traitement prophylactique standard (25-40 UI/kg, 3-4x/semaine). Chez les patients ayant observé le traitement, le taux annuel d'épisodes hémorragiques spontanés et le taux annuel d'épisodes hémorragiques provoqués par des traumatismes étaient respectivement de 3,3 (vs 5,2) et de 3,4 (vs 10). Au total, 510 épisodes hémorragiques ont été traités par ADVATE. L'efficacité hémostatique a été jugée bonne ou excellente dans 86 % des cas (439/510). Au total, 93 % (473) des épisodes hémorragiques ont été traités par 1-2 injections. Un inhibiteur transitoire de faible titre a été constaté (après 26 jours d'exposition) lors d'une exposition d'une durée moyenne de 117 jours.
Dans l'étude de prolongation de phase II/III, qui comprenait 82 patients ayant terminé l'étude pivot, 837 épisodes hémorragiques sont survenus chez 70 patients sur 81. L'efficacité hémostatique d'ADVATE a été jugée bonne ou excellente pour 673 épisodes hémorragiques (80,4 %). 23 épisodes hémorragiques n'étaient pas évaluables (aucune indication ou aucun traitement nécessaire). Une à deux injections ont été suffisantes pour 737 épisodes hémorragiques (88 %). Des taux annuels d'épisodes hémorragiques de 1,74 (hémorragies spontanées) et 3 (épisodes hémorragiques provoqués par un traumatisme) ont été enregistrés sous traitement prophylactique standard (n = 54, au moins une perfusion); sous traitement prophylactique modifié (n = 53, au moins une perfusion), les taux annuels d'épisodes hémorragiques étaient de 1,45 (hémorragies spontanées) et 2 (épisodes hémorragiques provoqués par un traumatisme). Le taux annuel d'épisodes hémorragiques observés sous traitement à la demande (n = 9) était de 18,47. Comme dans l'étude pivot, le taux d'épisodes hémorragiques était plus faible en cas d'observance du traitement qu'en cas de non observance du traitement. Aucun inhibiteur n'a été constaté lors d'une exposition d'une durée moyenne de 246 jours.
Dans une étude réalisée chez 53 enfants âgés de moins de 6 ans (parmi lesquels 24 avaient moins de 3 ans) et préalablement traités (exposés pendant au moins 50 jours à différentes préparations de FVIII recombinant ou dérivé du plasma), 430 épisodes hémorragiques ont été recensés chez 47 enfants. Parmi ces épisodes hémorragiques, 57 (13,3 %) n'ont nécessité aucune perfusion; l'efficacité d'ADVATE a été jugée bonne ou excellente pour 345 des épisodes hémorragiques traités (93,8 %) et modérée pour 18 (4,9 %). Aucune indication n'était disponible pour 5 épisodes (1,4 %).
Le taux annuel d'épisodes hémorragiques était de 4 (nombre médian) sous traitement prophylactique standard (n=21; 25-50 UI/kg, 3-4x/semaine) ou traitement prophylactique modifié (n=37), par rapport à 24 (nombre médian) sous traitement à la demande (n=5). Une à deux injections (durée ≤ 5 min) ont suffi pour obtenir une hémostase dans 89 % des 368 épisodes hémorragiques traités. L'efficacité peropératoire et post-opératoire a également été satisfaisante lors des 7 opérations généralement mineures qui ont été subies par 7 patients. Aucun inhibiteur n'a été constaté chez ces 53 enfants traités lors d'une exposition d'une durée moyenne de 156 jours.
PharmacocinétiqueToutes les études pharmacocinétiques avec ADVATE ont été réalisées chez des hémophiles A sévères à modérément sévères (taux de base de facteur VIII ≤ 2%). Les paramètres pharmacocinétiques repris d'en tout 260 patients, sont reportés dans le tableau ci-dessous.
|
Résumé des paramètres pharmacocinétiques pour ADVATE par tranche d'âge
| |
Paramètre pharmacocinétique (moyenne ± écart-type)
|
Petit enfants (1 mois à < 2 ans)
N = 7
|
Enfants (2 à < 12 ans)
n = 56
|
Adolescents (12 à < 16 ans)
n = 35
|
Adultes (16 ans et plus)
n = 162
| |
AUC totale (I.E. * h/dl)
|
1240 ± 330
|
1263 ± 471
|
1300 ± 469
|
1555 ± 508
| |
Récupération incrémentielle corrigée à Cmax (I.E./dl/I.E./kg)*
|
2.1 ± 0.5
|
1.9 ± 0.5
|
2.1± 0.5
|
2.2 ± 0.6
| |
Demi-vie (h)
|
8.7 ± 1.4
|
10.2 ± 2.7
|
12.0 ± 2.9
|
13.0 ± 4.0
| |
Cmax (I.E./dl)
|
104 ± 27
|
97.2 ± 27.1
|
103 ± 25
|
112.4 ± 30.3
| |
Temps de séjour moyen (h)
|
10.4 ± 2.5
|
12.9 ± 3.7
|
14.9 ± 4.6
|
16.4 ± 5.8
| |
Vss (dl/kg)
|
0.4 ± 0.1
|
0.6 ± 0.2
|
0.6 ± 0.1
|
0.6 ± 0.2
| |
Clairance (ml/kg*h)
|
4.3 ± 1.0
|
4.5 ± 1.5
|
4.2 ± 1.2
|
3.6 ± 1.2
|
*Calculée à l'aide de la formule (Cmax – taux basal de facteur VIII) divisée par la dose en UI/kg, où Cmax représente le taux maximal de facteur VIII après la perfusion.
Cinétique pour certains groupes de patients
Enfants et adolescents
Aucune différence des paramètres pharmacocinétiques a été observée entre les tranches d'âge chez les adultes (16 ans et plus comparé à 18 ans et plus). Entre les enfants (2 à < 12 ans), les enfants plus âgées (5 à < 12 ans) avaient des taux plus élevés des paramètres pharmacocinétiques AUC totale, récupération incrémentielle à Cmax, t½, Cmax et temps de séjour moyen que les enfants plus jeunes (2 à < 5 ans). Le paramètre pharmacocinétique volume de distribution à l'état d'équilibre était comparable entre les deux groupes d'enfants et la clairance était plus basse chez les enfants plus âgés (5 à < 12 ans) que chez les enfants plus jeunes (2 à < 5 ans).
La récupération corrigée ainsi que la demi-vie sont environ 20% inférieures à celles des adultes.
Il n'existe actuellement aucune donnée de pharmacocinétique avec ADVATE pour des patients non préalablement traités.
Données précliniquesDes études de toxicologie chez le rat et le lapin ont démontré qu'ADVATE ne produisait aucun effet significatif lié au traitement lorsqu'il est administré à des doses considérablement plus élevées que la dose clinique maximale recommandée. ADVATE était non irritant lorsqu'il était administré par voie péri- ou intraveineuse au lapin.
L'expérience clinique étendue avec le facteur VIII recombinant ne présentant aucun signe d'effet cancérigène et mutagène, aucune étude à long terme chez l'animal n'a été effectuée pour évaluer son pouvoir carcinogène.
Remarques particulièresIncompatibilités
En l'absence d'études de compatibilité, ADVATE ne doit pas être mélangé avec d'autres médicaments ou solvants.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient (voir ''Remarques particulières concernant le stockage'').
Stabilité après ouverture
Conserver à température ambiante (15 – 25 °C) après reconstitution et administrer dans les 3 heures.
Remarques particulières concernant le stockage
Conserver au réfrigérateur (2 - 8 °C). Ne pas congeler.
ADVATE avec le dispositif BAXJECT II: conserver dans l'emballage original à l'abri de la lumière.
ADVATE dans le système BAXJECT III: conserver la plaquette scellée dans l'emballage original à l'abri de la lumière.
Pendant la durée de conservation, le produit peut être sorti du réfrigérateur, dans le cas d'un traitement ambulatoire, pour une période maximale de 6 mois avant emploi et à une température ne devant pas dépasser 25 °C. Le cas échéant, la date de sortie du réfrigérateur doit être indiquée sur l'emballage original. Une fois la période de 6 mois est passée, ADVATE ne peut pas être remis au réfrigérateur, mais doit être éliminé.
Conserver hors de portée des enfants.
Remarques concernant la manipulation
Ce médicament doit être administré par voie intraveineuse après reconstitution .Toute fraction restante doit être éliminée de manière appropriée.
Avant l'administration, la solution reconstituée doit être inspectée toujours visuellement pour mettre en évidence la présence de particules en suspension ou d'une coloration anormale. Utiliser que des solutions claires et incolores.
ADVATE est fourni ou avec le dispositif pour la reconstitution BAXJECT II ou avec un système BAXJECT III prêt à l'emploi dans une plaquette scellée (le flacon contenant le lyophilisat et le flacon contenant l'eau pour préparations injectables sont préassemblés avec le système pour reconstitution).
Reconstitution avec le dispositif BAXJECT II
Pour la reconstitution, utiliser uniquement l'eau pour préparations injectables stérilisée et le nécessaire de reconstitution fournis dans le coffret.
Ne pas utiliser si le dispositif BAXJECT II, l'opercule ou l'emballage est endommagé ou présente des signes de détérioration.
Reconstitution: Utiliser une technique aseptique.
1.Amener les flacons d'ADVATE (Lyophilisat) et d'eau pour préparations injectables (Aqua ad iniectabilia) à une température comprise entre 15 °C et 25 °C.
2.Se laver soigneusement les mains à l'eau chaude et au savon.
3.Enlever les capsules de protection des flacons de lyophilisat et de solvant.
4.Nettoyer les bouchons avec une solution antiseptique. Disposer les flacons sur une surface plane.
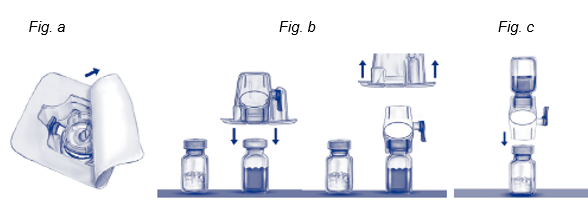
5.Ouvrir l'emballage de BAXJECT II en retirant l'opercule sans toucher l'intérieur (Fig. a).
6.Ne pas retirer le dispositif pour la reconstitution de l'emballage. Retourner l'emballage et insérer le perforateur en plastique dans le bouchon du flacon de solvant. Saisir l'emballage sur les côtés puis retirer l'emballage du dispositif BAXJECT II (Fig. b). Ne pas retirer le capuchon bleu du dispositif BAXJECT II.
7.Tourner le système, maintenant constitué de BAXJECT II et du flacon de solvant, sur lui-même de sorte que le flacon de solvant se trouve en haut.
8.Insérer le perforateur en plastique blanc de BAXJECT II dans le bouchon du flacon d'ADVATE. Le vide présent dans le flacon d'ADVATE aspirera le solvant (Fig. c).
9.Agiter doucement jusqu'à ce qu'ADVATE soit dissout complètement sinon le principe actif ne passera pas au travers du filtre du BAXJECT II. Le produit se dissout rapidement (en général en moins d'une minute). Après reconstitution, la solution doit être limpide, incolore et exempte de particules.
Reconstitution avec le système BAXJECT III
Ne pas utiliser si le couvercle n'est pas complètement scellé sur la plaquette
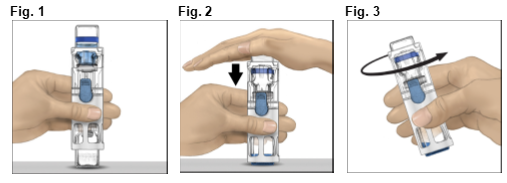
1.Laisser revenir la plaquette scellée (contient les flacons de lyophilisat et d'eau pour préparations injectables préassemblés avec le système pour reconstitution) à température ambiante (entre 15 °C et 25 °C).
2.Se laver soigneusement les mains à l'eau chaude et au savon.
3.Ouvrir l'emballage ADVATE en décollant le couvercle. Retirer le système BAXJECT III de la plaquette.
4.Placer ADVATE sur une surface plane avec le flacon de solvant en haut (Fig. 1). Le flacon de solvant porte une bande bleue. Ne retirer le capuchon bleu que lorsque vous serez invité à le faire, ultérieurement.
5.Tout en tenant ADVATE d'une main dans le système BAXJECT III, appuyer fermement sur le flacon de solvant de l'autre jusqu'à ce que le système soit entièrement replié et que le solvant s'écoule dans le flacon ADVATE (Fig. 2). N'incliner le système qu'une fois que le transfert est terminé.
6.Vérifier que le transfert de solvant est terminé. Agiter doucement jusqu'à ce que toute la poudre soit dissoute. Bien vérifier que la poudre ADVATE est complètement dissoute, sinon la totalité de la solution reconstituée ne passera pas au travers du filtre. Le produit se dissout rapidement (en général en moins de 1 minute). Après reconstitution, la solution doit être limpide, incolore et exempte de particules.
Administration: utiliser une technique aseptique.
1.Retirer le capuchon bleu du dispositif BAXJECT II/ BAXJECT III. NE PAS REMPLIR LA SERINGUE D'AIR. Connecter la seringue au dispositif BAXJECT II/ BAXJECT III.
2.Retourner le système (flacon d'ADVATE désormais en haut). Remplir la seringue de concentré en tirant lentement le piston en arrière.
3.Retirer la seringue.
4.Fixer le nécessaire d'administration à la seringue. Injecter par voie intraveineuse. La préparation peut être administrée à une vitesse maximale de 10 ml/minute. Le pouls doit être pris avant et pendant l'administration d'ADVATE. Si une augmentation importante du pouls apparaît, la diminution de la vitesse d'administration ou l'arrêt temporaire de l'injection permet généralement la disparition rapide des symptômes. (Voir également "Mise en garde et précautions" et "Effets indésirables").
Numéro d’autorisation56352 (Swissmedic)
PrésentationEmballages avec dispositif BAXJECT II
Chaque présentation d'ADVATE contient: 1 flacon contenant le lyophilisat, 1 flacon de solvant contenant 5 ml d'aqua ad iniectabilia, 1 BAXJECT II dispositif pour la reconstitution, 1 mini-nécessaire de perfusion, 1 seringue stérile de 10 ml à usage unique pour l'administration, 2 tampons d'alcool, 2 pansements rapides.
Emballages avec système BAXJECT III
Chaque présentation d'ADVATE contient: un système BAXJECT III prêt à l'emploi dans une plaquette scellée (le flacon de lyophilisat et le flacon contenant l'aqua ad iniectabilia
sont préassemblés avec le système pour reconstitution), 1 mini-nécessaire de perfusion, 1 seringue stérile de 10 ml à usage unique pour l'administration, 2 tampons d'alcool, 2 pansements rapides.
ADVATE 250 [B] Lyophilisat pour injection avec 250 UI de facteur VIII recombinant par flacon et un flacon de solvant contenant 2 ml d'aqua ad iniectabilia.
ADVATE 250 [B] Lyophilisat pour injection avec 250 UI de facteur VIII recombinant par flacon et un flacon de solvant contenant 5 ml d'aqua ad iniectabilia.
ADVATE 500 [B] Lyophilisat pour injection avec 500 UI de facteur VIII recombinant par flacon et un flacon de solvant contenant 2 ml d'aqua ad iniectabilia.
ADVATE 500 [B] Lyophilisat pour injection avec 500 UI de facteur VIII recombinant par flacon et un flacon de solvant contenant 5 ml d'aqua ad iniectabilia.
ADVATE 1000 [B] Lyophilisat pour injection avec 1000 UI de facteur VIII recombinant par flacon et un flacon de solvant contenant 2 ml d'aqua ad iniectabilia.
ADVATE 1000 [B] Lyophilisat pour injection avec 1000 UI de facteur VIII recombinant par flacon et un flacon de solvant contenant 5 ml d'aqua ad iniectabilia.
ADVATE 1500 [B] Lyophilisat pour injection avec 1500 UI de facteur VIII recombinant par flacon et un flacon de solvant contenant 2 ml d'aqua ad iniectabilia.
ADVATE 1500 [B] Lyophilisat pour injection avec 1500 UI de facteur VIII recombinant par flacon et un flacon de solvant contenant 5 ml d'aqua ad iniectabilia.
ADVATE 2000 [B] Lyophilisat pour injection avec 2000 UI de facteur VIII recombinant par flacon et un flacon de solvant contenant 5 ml d'aqua ad iniectabilia.
ADVATE 3000 [B] Lyophilisat pour injection avec 3000 UI de facteur VIII recombinant par flacon et un flacon de solvant contenant 5 ml d'aqua ad iniectabilia.
Titulaire de l’autorisationTakeda Pharma AG, 8152 Opfikon
Mise à jour de l’informationMars 2024
|


