Propriétés/EffetsCode ATC
A04AD12
Mécanisme d'action
L'aprépitant est un antagoniste sélectif à affinité élevée pour les récepteurs de la substance P neurokinine 1 (NK1). L'aprépitant ne présente qu'une très faible affinité ou aucune affinité pour d'autres sites sur des enzymes, des substances de transport, des canaux ioniques et des récepteurs (y compris les récepteurs de la dopamine et de la sérotonine) visés par les thérapies employées jusqu'ici pour les nausées et les vomissements induits par des cytostatiques (NVIC).
Pharmacodynamie
Le fosaprépitant, une prodrogue de l'aprépitant, est rapidement transformé en aprépitant lors d'administration intraveineuse.
Electrophysiologie cardiaque
Une dose unique de fosaprépitant 200 mg n'a eu aucun effet sur l'intervalle QTc.
Evaluation du degré d'occupation des récepteurs NK1 dans le cerveau à l'aide de la tomographie par émission de positons
Des études précliniques ont montré que les antagonistes du récepteur NK1 inhibent, par des mécanismes centraux, les vomissements induits par les effets cytotoxiques d'une chimiothérapie (p.ex. du cisplatine). Des études par tomographie par émission de positons (TEP) chez l'animal et l'être humain ont montré que l'aprépitant traverse la barrière hémato-encéphalique et qu'il occupe les récepteurs NK1 dans le cerveau. En outre, il a été constaté, lors d'études précliniques, que l'aprépitant possède un effet central prolongé, qu'il inhibe les phases aiguës et retardées des vomissements et qu'il renforce l'activité anti-émétique de l'antagoniste du récepteur 5-HT3 ondansétron et du corticostéroïde dexaméthasone sur les vomissements induits par le cisplatine.
Efficacité clinique
Chimiothérapie hautement émétisante (CHE)
Emend associé à l'ondansétron et à la dexaméthasone (schéma thérapeutique incluant l'aprépitant) agit contre les nausées et les vomissements aigus et retardés induits par les chimiothérapies hautement émétisantes (CHE), y compris le cisplatine.
Au cours de deux études comparatives multicentriques randomisées menées en double aveugle, un schéma thérapeutique incluant l'aprépitant (voir le tableau ci-dessous) a été comparé à une thérapie standard chez des patients sous chimiothérapie avec une dose de cisplatine >50 mg/m2 (dose moyenne de cisplatine 80,2 mg/m2). Parmi les 550 patients sous le schéma thérapeutique avec l'aprépitant, 42% étaient des femmes, 58% des hommes, 59% des Caucasiens, 3% des Asiatiques, 5% des Afro-américains, 12% des Sud-américains et 21% étaient pluri-raciaux. Les patients traités à l'aprépitant présentaient une moyenne d'âge de 56 ans (fourchette 14 à 84 ans). 170 patients étaient âgés de 65 ans et plus, et parmi eux, 29 patients étaient âgés de plus de 75 ans. Les patients (n = 1105) étaient attribués par randomisation soit au bras aprépitant (n = 550), soit au bras de thérapie standard (n = 555). Les schémas thérapeutiques sont définis dans le tableau ci-dessous.
Tableau 1
Schémas thérapeutiques
|
Traitement
|
Jour 1
|
Jours 2 à 4
| |
Aprépitant
|
Aprépitant 125 mg po
Dexaméthasone 12 mg po Ondansétron*
|
Aprépitant 80 mg po quotidiennement (jours 2 et 3)
Dexaméthasone 8 mg po quotidiennement (le matin)
| |
Traitement standard
|
Dexaméthasone 20 mg po
Ondansétron*
|
Dexaméthasone 8 mg po quotidiennement (le matin)
Dexaméthasone 8 mg po quotidiennement (le soir)
|
*Dans les études cliniques avec Emend, une dose de 32 mg d'ondansétron i.v. a été utilisée. Bien que cette dose a été utilisée dans les études cliniques, celle-ci n'est plus la dose recommandée, basé sur des conclusions récentes liées à la sécurité. Voir l'information professionnelle de l'ondansétron concernant le dosage en cours.
Dans le cadre de ces études, 95% des patients du groupe aprépitant ont reçu, en plus du cisplatine, un autre agent chimiothérapeutique. Les agents chimiothérapeutiques employés le plus fréquemment et le nombre de patients sous l'aprépitant étaient: l'étoposide (106), le fluorouracil (100), la gemcitabine (89), la vinorelbine (82), le paclitaxel (52), la cyclophosphamide (50), la doxorubicine (38), le docétaxel (11). L'effet antiémétique de l'aprépitant a été évalué au cours de la phase aiguë (0 à 24 heures après le traitement au cisplatine), la phase retardée (25 à 120 heures après le traitement au cisplatine) et sur l'ensemble (0 à 120 heures après le traitement au cisplatine) du premier cycle. Les critères de l'efficacité étaient:
Critère principal:
·Réponse complète, définie par l'absence d'épisode de vomissements et aucun emploi de médication à prendre en cas de besoin
Autres critères prédéfinis (secondaires et exploratoires):
·Protection complète, définie par l'absence d'épisode de vomissements, pas d'emploi de médication à prendre en cas de besoin et un score VAS maximal (Visual analog scale) <25 mm sur une échelle allant de 0 à 100 mm.
·Absence de vomissements, définie par l'absence d'épisode de vomissements, indépendamment d'une médication en cas de besoin.
·Pas de nausée (max. VAS <5 mm sur une échelle allant de 0 à 100 mm)
·Pas de nausée significative (max. VAS <25 mm sur une échelle allant de 0 à 100 mm).
Les tableaux 2 et 3 montrent un résumé des résultats de chacune des études.
Tableau 2
Taux de réponse des patients sous chimiothérapie hautement émétisante par groupe et phase de traitement lors de l'étude 1 – cycle 1
|
Critères
|
Schéma aprépitant
(N = 260)†
%
|
Traitement standard
(N = 261)†
%
|
Valeur p
| |
Critère principal
| |
Réponse complète
| |
Total‡
|
73
|
52
|
<0,001
| |
Autres critères (secondaires et exploratoires) prédéfinis
| |
Réponse complète
| |
Phase aiguë §
|
89
|
78
|
<0,001
| |
Phase retardée||
|
75
|
56
|
<0,001
| |
Protection complète
| |
Total
|
63
|
49
|
0,001
| |
Phase aiguë
|
85
|
75
|
0,005
| |
Phase retardée
|
66
|
52
|
<0,001
| |
Pas de vomissements
| |
Total
|
78
|
55
|
<0,001
| |
Phase aiguë
|
90
|
79
|
0,001
| |
Phase retardée
|
81
|
59
|
<0,001
| |
Pas de nausées
| |
Total
|
48
|
44
|
>0,050
| |
Phase retardée
|
51
|
48
|
>0,050
| |
Pas de nausée significative
| |
Total
|
73
|
66
|
>0,050
| |
Phase retardée
|
75
|
69
|
>0,050
|
† N: Nombre de patients (de plus de 18 ans) avec cisplatine, médication étudiée, avec au moins une évaluation de l'efficacité après le traitement.
‡ Total: 0 à 120 h après le traitement au cisplatine.
§ Phase aiguë: 0 à 24 h après le traitement au cisplatine.
|| Phase retardée: 25 h à 120 h après le traitement au cisplatine.
Visual analogue scale (VAS) échelle: 0 mm = pas de nausée; 100 mm = forme la plus sévère de nausées.
Le tableau 2 comporte des valeurs p nominales, non ajustées pour la multiplicité des mentions.
Tableau 3
Taux de réponse des patients sous chimiothérapie hautement émétisante par groupe et phase de traitement lors de l'étude 2 – cycle 1
|
Critères
|
Schéma aprépitant
(N = 261)†
%
|
Traitement standard
(N = 263)†
%
|
Valeur p
| |
Critère principal
| |
Réponse complète
| |
Total‡
|
63
|
43
|
<0,001
| |
Autres critères (secondaires et exploratoires) prédéfinis
| |
Réponse complète
| |
Phase aiguë§
|
83
|
68
|
<0,001
| |
Phase retardée||
|
68
|
47
|
<0,001
| |
Protection complète
| |
Total
|
56
|
41
|
<0,001
| |
Phase aiguë
|
80
|
65
|
<0,001
| |
Phase retardée
|
61
|
44
|
<0,001
| |
Pas de vomissements
| |
Total
|
66
|
44
|
<0,001
| |
Phase aiguë
|
84
|
69
|
<0,001
| |
Phase retardée
|
72
|
48
|
<0,001
| |
Pas de nausées
| |
Total
|
49
|
39
|
0,021
| |
Phase retardée
|
53
|
40
|
0,004
| |
Pas de nausée significative
| |
Total
|
71
|
64
|
>0,050
| |
Phase retardée
|
73
|
65
|
>0,050
|
† N: Nombre de patients (de plus de 18 ans) avec cisplatine, médication étudiée, avec au moins une évaluation de l'efficacité après le traitement.
1 Total: 0 à 120 h après le traitement au cisplatine.
§ Phase aiguë: 0 à 24 h après le traitement au cisplatine.
|| Phase retardée: 25 h à 120 h après le traitement au cisplatine.
Visual analogue scale (VAS) échelle: 0 mm = pas de nausée; 100 mm = forme la plus sévère de nausées.
Le tableau 3 comporte des valeurs p nominales, non ajustées pour la multiplicité des mentions.
Au cours des deux études, une fraction significativement plus élevée de patients sous le cycle 1 du traitement à l'aprépitant a présenté une réponse complète (critère principal), par rapport aux patients sous le traitement standard. Une différence statistiquement significative par rapport à la réponse complète en faveur du schéma thérapeutique à l'aprépitant a également été constatée lors de l'analyse séparée de la phase aiguë et de la phase retardée.
Au cours des deux études, le temps évalué jusqu'au premier vomissement après le début du traitement au cisplatine était plus long sous l'aprépritant et le délai jusqu'à l'apparition du premier vomissement était réduit dans le groupe sous l'aprépitant par rapport au groupe sous traitement standard, voir les courbes de Kaplan-Meier dans la Figure 1.
Fig. 1: Pourcentage de patients sous chimiothérapie hautement émétisante sans vomissements - cycle 1
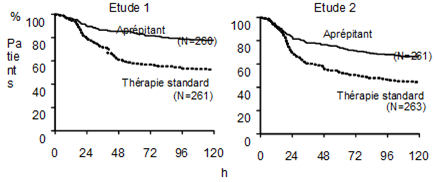
Valeur p <0,001 sur la base d'un test Log Rank pour l'étude 1 et l'étude 2: les valeurs p nominales n'ont pas été ajustées pour la multiplicité.
Rapports de patients sur l'efficacité: L'influence des nausées et des vomissements sur la vie quotidienne des patients a été mesurée durant le cycle 1 des deux études à l'aide d'un indice spécial (Functional Living Index-Emesis FLIE), une méthode reconnue destinée à évaluer les événements concernant les nausées et les vomissements rapportés par les patients. Des nausées et des vomissements minimaux ou l'absence de ces symptômes dans la vie quotidienne du patient sont définis par une valeur FLIE >108. Au cours des deux études, une fraction plus élevée de patients sous aprépitant n'a pas montré d'altération ou seulement une altération minime de la vie quotidienne par des nausées et des vomissements (étude 1: 74% contre 64%; étude 2: 75% contre 64%) mesurée sur la base de la valeur FLIE totale.
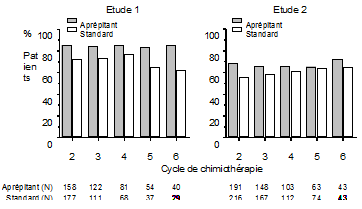
Cycles multiples: Au cours des mêmes 2 études cliniques, les patients ont poursuivi le traitement jusqu'à 5 cycles thérapeutiques supplémentaires. La fraction de patients sans vomissements et sans nausée significative est représentée, pour chaque groupe de traitement, dans la Figure 2. L'efficacité antiémétique s'est maintenue durant plusieurs cycles chez les patients ayant reçu l'aprépitant.
Fig. 2: Fraction de patients sous chimiothérapie hautement émétisante sans vomissements et sans nausée significative par groupe de traitement et par cycle
Chimiothérapie modérément émétisante (CME)
Au cours d'une étude randomisée menée en double aveugle, incluant 866 patients sous chimiothérapie [y compris cyclophosphamide 750 à 1500 mg/m2; ou cyclophosphamide 500 à 1500 mg/m2 et doxorubicine (≤60 mg/m2) ou épirubicine (≤100 mg/m2)] ayant reçu l'aprépitant en association avec un schéma ondansétron/dexaméthasone (voir sous «Posologie/Mode d'emploi»), cette association a été comparée à un traitement standard [placebo et ondansétron 8 mg par voie orale (2 fois par jour au jour 1 et toutes les 12 heures aux jours 2 et 3) ainsi que 20 mg de dexaméthasone orale au jour 1].
L'efficacité antiémétique d'Emend a été évaluée durant la phase aiguë (0 à 24 heures après la chimiothérapie), la phase retardée (25 à 100 heures après la chimiothérapie) et globalement (0 à 120 heures après la chimiothérapie) pendant le cycle 1. L'evaluation de l'efficacité était basée sur les points de mesure composites suivants: réponse complète (définie par l'absence d'épisode émétique et aucune utilisation d'un antiémétique supplémentaire en cas de besoin) et influence des nausées et vomissements sur la vie quotidienne.
Un résumé des principaux résultats d'études est présenté sur le tableau 4.
Tableau 4
Taux de réponse des patients sous chimiothérapie modérément émétisante par groupe et phase de traitement – cycle 1
|
Points de mesure composites
|
Schéma aprépitant*
(N = 433)†
%
|
Traitement standard**
(N = 424)†
%
|
Valeur p
| |
Réponse complète (pas de vomissements, pas de recours à un médicament de secours)
| |
Total‡
|
51
|
42
|
0,015
| |
Phase aiguë§
|
76
|
69
|
0,034
| |
Phase retardée||
|
55
|
49
|
0,064
| |
Pas d'influence sur la vie quotidienne (Functional Living Index-Emesis [FLIE] total score >108)
| |
Total
|
64
|
56
|
0,019
|
* Schéma aprépitant: Emend 125 mg oral au jour 1 et 80 mg oral au jour 2 et 3 plus ondansétron 8 mg oral deux fois au jour 1 plus dexaméthasone 12 mg oral au jour 1.
** Traitement standard: placebo plus ondansétron 8 mg oral (deux fois au jour 1 et toutes les 12 heures aux jours 2 et 3) plus déxamethasone 20 mg oral au jour 1.
† N: nombre de patients de l'analyse du critère principal réponse complète.
‡ Total: 0 à 120 heures après la chimiothérapie.
§ Phase aiguë: 0 à 24 heures après la chimiothérapie.
|| Phase retardée: 25 à 120 heures après la chimiothérapie.
Au cours de cette étude, un nombre statistiquement significativement plus élevé de patients ayant reçu le schéma thérapeutique à l'aprépitant (51%) a présenté une réponse complète (critère principal) durant l'ensemble de la phase de traitement par comparaison avec les patients sous traitement standard (42%). En plus, une fraction plus élevée de patients sous schéma thérapeutique à l'aprépitant a présenté une réponse complète durant les phases aiguës et retardées au cycle 1 par rapport aux patients sous traitement standard.
Au cours de cette étude, une fraction statistiquement significativement plus élevée sous le schéma thérapeutique à l'aprépitant au cycle 1 n'a pas présenté d'altération de la vie quotidienne par des nausées et des vomissements, en termes de score total FLIE >108, par comparaison avec les patients sous traitement standard.
Cycles suivants: au total, 744 patients ont participé à l'extension de l'étude avec des cycles multiples et ont reçu jusqu'à 4 cycles de chimiothérapie. L'efficacité du schéma thérapeutique à l'aprépitant s'est maintenue durant tous les cycles.
Une deuxième étude clinique multicentrique, randomisée, en double aveugle, par groupes parallèles, a comparé le schéma thérapeutique à l'aprépitant avec un traitement standard. 848 patients ont reçu une chimiothérapie incluant l'oxaliplatine, le carboplatine, l'épirubicine, l'idarubicine, l'ifosfamide, l'irinotécan, la daunorubicine, la doxorubicine, le cyclophosphamide i.v. (<1500 mg/m2) ou la cytarabine i.v. (>1 g/m2). Parmi les patients assignés par randomisation au schéma thérapeutique contenant de l'aprépitant, 76% étaient des femmes et 24% des hommes. Les patients sous schéma thérapeutique à l'aprépitant recevaient une chimiothérapie pour traiter différents types de cancer: 52% souffraient d'un cancer du sein, 21% d'un cancer gastro-intestinal (y compris cancer colorectal), 13% d'un cancer du poumon et 6% d'un cancer gynécologique. Le schéma thérapeutique à l'aprépitant était composé d'Emend (125 mg le jour 1, puis 80 mg par jour les jours 2 et 3), d'ondansétron oral (8 mg deux fois par jour le jour 1) et de dexaméthasone orale (12 mg le jour 1). Le traitement standard était composé d'un placebo, d'ondansétron oral (8 mg deux fois par jour le jour 1 et toutes les 12 heures les jours 2 et 3) et de dexaméthasone orale (20 mg le jour 1).
L'efficacité antiémétique d'Emend dans le cadre du 1er cycle de chimiothérapie a été évaluée pour la phase aiguë (0 à 24 h après le début de la perfusion chimiothérapeutique), la phase tardive (25 à 120 h après le début de la perfusion chimiothérapeutique) et l'ensemble des deux phases (0 à 120 h après l'administration de la chimiothérapie). L'efficacité a été évaluée sur la base des critères primaire et secondaires suivants: aucun vomissement pendant la période totale (0 à 120 h après la chimiothérapie), sécurité et tolérance du schéma thérapeutique à l'aprépitant pour les NVIC, réponse complète (définie comme absence de vomissements et de besoin de traitement antiémétique) pour la période totale (0 à 120 h après la chimiothérapie).
Le Tableau 5 donne un aperçu des principaux résultats de l'étude.
Tableau 5
Pourcentage des patients ayant reçu une chimiothérapie modérément émétisante
Taux de réponse par groupe et phase de traitement de l'étude 2, cycle 1
|
Critères
|
Schéma à l'aprépitant*
(N = 430)†
%
|
Traitement standard**
(N = 418)†
%
|
Valeur p‡
| |
Critère primaire
| |
Aucun vomissement
| |
Total§
|
76
|
62
|
<0,0001
| |
Critères secondaires principaux
| |
Réponse complète¶
| |
Total
|
69
|
56
|
0,0003
|
* Schéma à l'aprépitant: Emend par voie orale (125 mg le jour 1, puis 80 mg les jours 2 et 3) plus ondansétron oral (8 mg 2 fois par jour le jour 1) plus dexaméthasone orale (12 mg le jour 1).
** Traitement standard: placebo plus ondansétron oral 8 mg (2 fois par jour le jour 1, puis toutes les 12 h les jours 2 et 3) plus dexaméthasone orale 20 mg le jour 1.
† N = nombre de patients sous chimiothérapie et médication de l'étude, avec au moins une évaluation de l'efficacité après le traitement.
‡ Procédure de Hochberg pour ajuster la multiplicité lors de l'évaluation de la signification statistique pour les critères secondaires.
§ Total: 0 à 120 h après la chimiothérapie.
¶ Réponse complète = aucun vomissement, aucun besoin d'une médication de secours.
Dans cette étude, un pourcentage significativement (p <0,0001) plus élevé de patients sous schéma thérapeutique à l'aprépitant (76%) que de patients sous traitement standard (62%) a atteint le critère primaire (aucun vomissement) pour la période totale du cycle 1. En outre, un pourcentage plus élevé de patients sous schéma thérapeutique à l'aprépitant que de patients sous traitement standard a atteint une réponse complète pour la période totale (0 à 120 h) du cycle 1.
|


