CompositionPrincipes actifs
Fosamprenavir (sous forme de fosamprénavir calcique)
Excipients
Noyau du comprimé: cellulose microcristalline, croscarmellose sodique (correspond à 0,08 mg de sodium par comprimé), povidone (K30), stéarate de magnésium, silice colloïdale anhydre
Pelliculage: hypromellose, dioxyde de titane (E171), triacétine, oxyde de fer (III) (E172)
Indications/Possibilités d’emploiTelzir, associé au ritonavir faiblement dosé, est indiqué pour le traitement des adultes, adolescents et enfants pesant au moins 39 kg infectés par le Virus de l'Immunodéficience Humaine de type 1 (VIH-1) et s'utilise en association avec d'autres médicaments antirétroviraux.
Chez les adultes modérément prétraités par antirétroviraux, Telzir associé à de faibles doses de ritonavir n'a pas été aussi efficace que l'association lopinavir/ritonavir. Aucune étude comparative n'a été réalisée chez les enfants et les adolescents.
L'utilisation de Telzir associé à de faibles doses de ritonavir n'a pas été suffisamment étudiée chez les patients lourdement prétraités.
Chez les patients prétraités par inhibiteurs de protéase (IP), le choix de Telzir doit prendre en compte les résultats individuels des tests de résistance virale du patient et les traitements antérieurs (voir «Propriétés/Effets»).
Posologie/Mode d’emploi
|
Telzir ne doit être administré qu'avec de faibles doses de ritonavir (pour potentialiser la pharmacocinétique de l'amprénavir) et en association avec d'autres médicaments antirétroviraux. L'information professionnelle sur le ritonavir doit par conséquent être consultée préalablement à toute initiation de traitement par Telzir.
|
Le traitement doit être instauré par un médecin expérimenté dans la prise en charge de l'infection par VIH.
Telzir (fosamprénavir) est une prodrogue de l'amprénavir et ne doit pas être administré avec d'autres médicaments contenant de l'amprénavir.
Il faut expliquer au patient l'intérêt d'un strict respect du schéma posologique recommandé.
Il est déconseillé de dépasser les doses recommandées de fosamprénavir et de ritonavir décrites ci-dessous (voir «Mises en garde et précautions»).
Telzir est administré par voie orale. Telzir (comprimés pelliculés) associé au ritonavir peut être pris au cours ou en dehors des repas.
Posologie usuelle
Adultes (à partir de 18 ans)
Chez les patients naïfs de traitement antirétroviral et chez les patients prétraités, la posologie recommandée, en association avec d'autres antirétroviraux, est la suivante:
700 mg (1 comprimé) de Telzir deux fois par jour avec 100 mg de ritonavir (Norvir®) deux fois par jour.
Instructions posologiques particulières
Patients présentant des troubles de la fonction hépatique
Les comprimés Telzir ne doivent pas être utilisés chez les patients souffrant d'insuffisance hépatique modérée à sévère, car la réduction de la dose nécessaire ne peut être obtenue avec le comprimé.
Insuffisance hépatique légère (score de Child Pugh-Score de 5-6):
700 mg de Telzir 2 fois par jour
100 mg de ritonavir 1 fois par jour
Malgré l'ajustement de la posologie chez les patients adultes ayant une insuffisance hépatique, certains de ces patients peuvent présenter des concentrations plasmatiques d'amprénavir et de ritonavir plus élevées ou plus basses qu'attendues, en raison de la plus grande variabilité interindividuelle de la pharmacocinétique de l'amprénavir et du ritonavir chez ces patients. Les tests de la fonction hépatique doivent être effectués avant le début du traitement et par la suite, à intervalles réguliers.
Patients présentant des troubles de la fonction rénale
Aucun ajustement posologique initial n'est jugé nécessaire chez les patients souffrant de troubles de la fonction rénale (voir «Pharmacocinétique»).
Patients âgés (de plus de 65 ans)
La pharmacocinétique du fosamprénavir n'a pas été étudiée dans cette population de patients (voir «Pharmacocinétique»).
Enfants et adolescents (pesant ≥39 kg)
Il est possible d'administrer la posologie adulte aux enfants et aux adolescents, s'ils pèsent au moins 39 kg et qu'ils peuvent avaler un comprimé entier (voir «Pharmacocinétique»). Les capsules de ritonavir à 100 mg peuvent être administrées aux enfants et aux adolescents s'ils pèsent au moins 33 kg et qu'ils peuvent avaler une capsule entière.
Contre-indicationsHypersensibilité au fosamprénavir, à l'amprénavir, à l'un des excipients de Telzir ou au ritonavir.
Telzir ne doit pas être coadministré avec des médicaments substrats du cytochrome P450 3A4 (CYP3A4) ayant un spectre thérapeutique étroit. En cas d'administration simultanée, une inhibition compétitive du métabolisme de ces médicaments peut survenir, avec un risque d'événements indésirables graves et/ou compromettant le pronostic vital. Ces événements sont des troubles du rythme cardiaque (p.ex. avec terfénadine, astémizole, amiodarone, bépridil, quinidine, cisapride, pimozide), une hypotension (p.ex. avec l'α-bloquant alfuzosine), une sédation persistante ou une dépression respiratoire (p.ex. avec triazolam, midazolam, quétiapine), une vasoconstriction périphérique ou une ischémie (p.ex. avec dérivés de l'ergotamine) (voir «Interactions»).
Telzir ne doit pas être administré en association avec le sildénafil utilisé pour le traitement de l'hypertension artérielle pulmonaire (pour l'administration du fosamprénavir en association avec le sildénafil chez les patients souffrant d'une dysfonction érectile, voir les sections «Mises en garde et précautions» et «Interactions»). Il existe un risque accru d'effets indésirables sévères du sildénafil.
Telzir associé au ritonavir ne doit pas être coadministré avec des médicaments ayant un spectre thérapeutique étroit et fortement dépendants du métabolisme du cytochrome CYP2D6, tels que la flécaïnide et la propafénone (voir «Interactions»).
Telzir associé au ritonavir ne doit pas être coadministré avec la lurasidone, un médicament antipsychotique (voir «Interactions»).
La rifampicine ne doit pas être coadministrée avec Telzir (voir «Interactions»).
Les préparations à base de plantes contenant du millepertuis (Hypericum perforatum) ne doivent pas être utilisées au cours d'un traitement par Telzir, en raison du risque de diminution des concentrations plasmatiques et de l'activité clinique de l'amprénavir (voir «Interactions»).
Telzir associé au ritonavir ne doit pas être combiné avec les inhibiteurs de l'HMG-CoA réductase simvastatine et lovastatine dont le métabolisme est hautement dépendant du cytochrome 3A4. L'administration concomitante de Telzir et de ritonavir risque d'entraîner des concentrations élevées des inhibiteurs de l'HMG-CoA réductase et de provoquer ainsi une rhabdomyolyse. L'atorvastatine ne doit pas être administrée à des doses supérieures à 20 mg (voir «Interactions»).
Mises en garde et précautionsLes résultats des études d'observation ont montré qu'il n'y a pas de risque de transmission sexuelle du VIH, si la suppression virologique a été atteinte et maintenue. Toutefois, le risque de transmission sexuelle du VIH ne peut pas être exclu si le TAR prescrit n'est pas pris régulièrement et/ou si la suppression virologique n'a pas été atteinte et maintenue.
Le fosamprénavir contient un radical sulfamide. La possibilité de réaction de sensibilité croisée entre les médicaments de la classe des sulfamides et le fosamprénavir est inconnue. Au cours des études pivotales réalisées avec Telzir chez les patients recevant l'association fosamprénavir/ritonavir, il n'a pas été démontré d'augmentation du risque d'éruptions cutanées chez des patients ayant des antécédents d'allergie aux sulfamides, comparés à ceux qui ne présentaient pas cette allergie. Néanmoins, Telzir doit être administré avec prudence chez les patients ayant une allergie connue aux sulfamides.
L'administration concomitante de Telzir et de ritonavir à des doses supérieures à celles enregistrées a conduit chez quelques personnes à des valeurs de transaminases plus élevées et n'est donc pas recommandée.
Atteinte hépatique:
Associé au ritonavir, Telzir comprimés doivent être utilisés avec prudence et à une plus faible posologie chez les adultes atteints d'une insuffisance hépatique légère. Chez les patients atteints d'une insuffisance hépatique modérée ou sévère, Telzir comprimés ne doivent pas être utilisés (voir «Posologie/Mode d'emploi»). Les patients atteints d'une hépatite chronique B ou C et traités par une association antirétrovirale présentent un risque accru de développer des effets indésirables hépatiques sévères et potentiellement fatals. En cas d'administration concomitante d'un traitement antiviral de l'hépatite B ou C, veuillez consulter les informations professionnelles de ces médicaments.
Les patients présentant des troubles préexistants de la fonction hépatique (y compris une hépatite chronique active) ont, au cours d'un traitement par une association antirétrovirale, une fréquence plus élevée d'anomalies de la fonction hépatique et doivent faire l'objet d'une surveillance appropriée. Chez ces patients, en cas de signes d'aggravation de l'atteinte hépatique, l'interruption ou l'arrêt du traitement doit être envisagé.
Interactions médicamenteuses
L'administration concomitante de fosamprénavir associé ou non au ritonavir et d'autres antinéoplasiques métabolisés par le CYP3A (p.ex. dasatinib, nilotinib, ibrutinib, vinblastine et évérolimus) peut augmenter la concentration de ces médicaments et accroître le risque d'effets indésirables habituellement associés à ces principes actifs.
Veuillez vous référer aux informations professionnelles respectives de ces médicaments (voir «Interactions»).
L'administration concomitante de Telzir et d'halofantrine ou de lidocaïne (par voie systémique) n'est pas recommandée (voir «Interactions»).
Antiviraux d'action directe contre le virus de l'hépatite C (VHC): lorsque des antiviraux d'action directe (direct acting antiviral drugs, DAA) contre le virus de l'hépatite C sont métabolisés par voie du CYP3A4 ou sont des inducteurs ou inhibiteurs du CYP3A4, leur administration en association avec le fosamprénavir (avec ou sans ajout de ritonavir) peut influencer la concentration plasmatique par inhibition ou induction de l'activité du CYP3A4. Les conséquences possibles d'une telle interaction englobent:
·Des effets indésirables cliniquement significatifs dus à une exposition accrue au fosamprénavir/ritonavir ou aux médicaments co-administrés.
·Une réduction de l'efficacité thérapeutique du fosamprénavir/ritonavir ou des médicaments co-administrés et éventuellement le développement d'une résistance.
En raison du risque d'interactions, l'administration de fosamprénavir (avec ou sans ritonavir) en association avec des DAA anti-VHC qui sont métabolisés par voie du CYP3A4 ou qui sont des inducteurs ou inhibiteurs du CYP3A4 (p.ex. télaprévir, bocéprévir, siméprévir, paritaprévir) est déconseillée. Dans le cas d'un traitement concomitant de l'hépatite C par un DAA anti-VHC, veuillez consulter l'information professionnelle du médicament en question.
L'administration concomitante de Telzir et d'inhibiteurs de phosphodiésterase 5 (PDE5) (p.ex. sildénafil et vardénafil) chez des patients souffrant d'une dysfonction érectile n'est pas recommandée (voir «Interactions»).
L'amprénavir est métabolisé principalement par le cytochrome 3A4. L'administration concomitante de fosamprénavir et de ritonavir ou d'autres médicaments connus comme inducteurs du cytochrome 3A4 n'est pas recommandée, étant donné le risque d'échec thérapeutique et de développement accéléré d'une résistance. ll s'agit notamment de la carbamazépine, du phénobarbital, de la primidone et du topiramate (voir aussi «Contre-indications»). Aucune étude pharmacocinétique ou clinique, portant sur ces inducteurs du CYP3A4 n'a été effectuée (voir «Interactions»). L'administration concomitante de Telzir et ritonavir avec la fluticasone ou d'autres glucocorticostéroïdes métabolisés par l'intermédiaire du CYP3A4 n'est pas recommandée, à moins que le bénéfice thérapeutique éventuel l'emporte sur le risque d'effets stéroïdiens systémiques, y compris de maladie de Cushing et de suppression de la fonction surrénalienne (voir «Interactions»).
Une diminution de la posologie de rifabutine d'au moins 75% est recommandée en cas de coadministration avec Telzir et ritonavir. Une diminution supplémentaire peut s'avérer nécessaire (voir «Interactions»).
Dans une étude avec administration simultanée de fosamprénavir/ritonavir et d'un contraceptif oral, une élévation cliniquement significative du taux de transaminases a été observée chez 22% (7/32) des volontaires saines. En outre, les taux d'hormones ont été diminués, c'est pourquoi il est recommandé aux femmes en âge de procréer d'avoir recours à des méthodes contraceptives alternatives, non hormonales (préservatifs) (voir «Interactions»).
Aucune donnée n'est disponible concernant l'administration simultanée de fosamprénavir/ritonavir et d'œstrogènes et/ou de progestatifs utilisés pour le traitement hormonal substitutif. L'efficacité et la sécurité d'emploi de ces traitements ne sont pas établies lors de l'administration simultanée de fosamprénavir et de ritonavir.
Il est recommandé de surveiller les concentrations plasmatiques des médicaments immunosuppresseurs (ciclosporine, tacrolimus, rapamycine) en cas de coadministration avec Telzir (voir «Interactions»).
Il est recommandé de surveiller les concentrations plasmatiques des antidépresseurs tricycliques (p.ex. désipramine et nortriptyline) en cas de coadministration avec Telzir (voir «Interactions»).
Les patients recevant de la méthadone conjointement avec Telzir doivent être étroitement surveillés afin de détecter un éventuel syndrome de manque aux opiacés (voir «Interactions»).
Un contrôle renforcé de l'INR (International Normalised Ratio) est recommandé en cas d'administration de Telzir avec des anticoagulants oraux (voir «Interactions»).
Les médicaments réduisant l'acidité gastrique (antacides, inhibiteurs des récepteurs H2, inhibiteurs de la pompe à protons) conduisent à une diminution de la résorption du fosamprénavir de degré variable. Les données à disposition favorisent l'utilisation de l'ésoméprazole (voir «Interactions»).
Eruptions / réactions cutanées:
La plupart des patients ayant une éruption cutanée légère ou modérée peuvent poursuivre leur traitement par Telzir. Un traitement antihistaminique approprié (p.ex. dichlorhydrate de cétirizine) peut diminuer l'intensité du prurit et accélérer la résolution de l'éruption cutanée. Des réactions cutanées sévères et compromettant le pronostic vital, dont le syndrome de Stevens-Johnson, ont été rapportées chez moins de 1% des patients inclus dans le programme de développement clinique. Telzir doit être arrêté définitivement en cas d'éruption cutanée sévère, ou d'éruption cutanée d'intensité modérée associée à des symptômes systémiques ou à une atteinte muqueuse (voir «Effets indésirables»).
Patients hémophiles:
Des cas d'augmentation de saignements comprenant des hématomes cutanés spontanés et des hémarthroses ont été signalés chez des patients hémophiles de type A et B traités par des inhibiteurs de protéase (IP). Chez certains patients, l'administration du facteur VIII a été nécessaire. Dans plus de la moitié des cas rapportés, il a été possible de poursuivre le traitement par les inhibiteurs de protéase ou de le reprendre s'il avait été interrompu. Une relation causale a été évoquée, bien que le mécanisme d'action n'ait pas été élucidé. Les patients hémophiles doivent par conséquent être informés de la possibilité d'augmentation des saignements.
Hyperglycémie:
Des cas de survenue de diabète sucré, d'hyperglycémie ou d'aggravation de diabète sucré préexistant ont été rapportés chez des patients traités par des antirétroviraux comprenant des inhibiteurs de protéase. Chez certains de ces patients, l'hyperglycémie a été sévère et associée parfois à une acidocétose. De nombreux patients présentaient des pathologies associées ayant nécessité dans certains cas un traitement par des médicaments susceptibles de provoquer un diabète sucré ou une hyperglycémie.
Lipohypertrophie:
Le traitement par association antirétrovirale, y compris les schémas comportant un inhibiteur de la protéase, peut être associé à une augmentation de la graisse corporelle chez certains patients infectés par le VIH. Aucun lien de causalité n'a été établi.
Augmentation des lipides:
Le traitement par fosamprénavir avec le ritonavir a entraîné des augmentations des concentrations en triglycérides et en cholestérol. Le dosage des triglycérides et du cholestérol doit être effectué avant de débuter le traitement par Telzir, puis à intervalles réguliers tout au long du traitement. Les troubles lipidiques devront être pris en charge en clinique de manière appropriée.
Syndrome de restauration immunitaire:
Chez les patients infectés par le VIH et présentant un déficit immunitaire sévère au moment de l'instauration du traitement par une association antirétrovirale (ART), une réaction inflammatoire à des infections opportunistes asymptomatiques ou résiduelles peut se produire, entraînant des manifestations cliniques graves ou une aggravation des symptômes. De telles réactions ont été observées classiquement au cours des premières semaines ou des mois suivant l'instauration du traitement par une ART. Des exemples pertinents sont les rétinites à CMV, les infections mycobactériennes généralisées et/ou localisées, et les pneumopathies à Pneumocystis jiroveci (P. carinii). Tout symptôme inflammatoire doit être évalué et un traitement doit être instauré si nécessaire.
Des maladies auto-immunes (p.ex. maladie de Basedow, polymyosite et syndrome de Guillain-Barré) ont également été rapportées dans le cadre de la restauration immunitaire. Toutefois, le temps écoulé jusqu'à leur apparition est plus variable et peut atteindre de nombreux mois après le début du traitement. De plus, les manifestations de ces maladies peuvent être atypiques.
Ostéonécrose:
L'étiologie est considérée comme multifactorielle (incluant l'utilisation de corticoïdes, la consommation d'alcool, une immunosuppression sévère, un indice de masse corporelle élevé), cependant des cas d'ostéonécrose ont été rapportés en particulier chez des patients à un stade avancé de la maladie liée au VIH et/ou ayant un traitement par association d'antirétroviraux (ART) au long cours. Il est conseillé aux patients de solliciter un avis médical s'ils éprouvent des troubles articulaires et des arthralgies, une raideur articulaire ou des difficultés pour se mouvoir.
Sodium:
Ce médicament contient moins de 1 mmol (23 mg) de sodium par comprimé, c.-à-d. qu'il est essentiellement «sans sodium».
Interactions
|
Lors de la coadministration de fosamprénavir avec le ritonavir, le profil d'interaction médicamenteuse du ritonavir peut prédominer, car le ritonavir est un inhibiteur plus puissant du CYP3A4. Aussi est-il nécessaire de consulter l'intégralité de l'information professionnelle du ritonavir avant d'instaurer un traitement par Telzir et le ritonavir. Le ritonavir est également un inhibiteur du CYP2D6, mais dans une moindre mesure que pour le CYP3A4. Le ritonavir est un inducteur des cytochromes CYP3A4, CYP1A2, CYP2C9 et de la glucuronyl transférase.
De plus, l'amprénavir (métabolite actif du fosamprénavir) et le ritonavir, sont tous deux principalement métabolisés au niveau hépatique par le cytochrome CYP3A4. Par conséquent, tous les médicaments qui utilisent cette même voie métabolique ou qui modifient l'activité du cytochrome CYP3A4 peuvent entraîner des modifications des paramètres pharmacocinétiques de l'amprénavir et du ritonavir. De la même façon, l'administration de fosamprénavir avec le ritonavir peut également modifier les paramètres pharmacocinétiques d'autres substances actives qui suivent cette même voie métabolique.
|
La section ci-dessous donne des exemples de substrats, d'inhibiteurs ou d'inducteurs du CYP3A4 qui pourraient interagir avec le fosamprénavir lors d'une administration concomitante. Cette liste n'est pas exhaustive. Dans certains cas, la signification clinique des interactions éventuelles est inconnue ou n'a pas été étudiée. Les patients traités par le fosamprénavir en association avec ces médicaments doivent par conséquent être surveillés quant aux manifestations de toxicités associées à ces médicaments.
Associations contre-indiquées (voir «Contre-indications»):
- Substrats du CYP3A4 avec un spectre thérapeutique étroit
Telzir ne doit pas être administré simultanément avec des médicaments ayant un spectre thérapeutique étroit et étant des substrats du cytochrome P450-3A4 (CYP3A4). Leur administration concomitante peut entraîner une inhibition compétitive du métabolisme de ces substances, induisant ainsi une augmentation de leur concentration plasmatique et un risque de survenue d'effets indésirables graves et / ou compromettant le pronostic vital, tels qu'arythmies cardiaques (p.ex. amiodarone, astémizole, bépridil, cisapride, pimozide, quinidine, terfénadine), hypotension (p.ex. avec l'α-bloquant alfuzosine), sédation persistante ou dépression respiratoire (p.ex. midazolam, triazolam, quétiapine) de même que vasoconstriction périphérique ou ischémie (p.ex. ergotamine, dihydroergotamine).
Telzir ne doit pas être administré en association avec le sildénafil utilisé pour le traitement de l'hypertension artérielle pulmonaire (pour l'administration du fosamprénavir en association avec le sildénafil chez les patients souffrant d'une dysfonction érectile, voir les sections «Mises en garde et précautions» et «Interactions»). Il existe un risque accru d'effets indésirables sévères du sildénafil (voir «Contre-indications»).
- Substrats du CYP2D6 avec un spectre thérapeutique étroit
Telzir en association avec le ritonavir ne doit pas être coadministré avec les médicaments contenant des substances actives fortement dépendantes du métabolisme du CYP2D6 et pour lesquels une élévation des concentrations plasmatiques est associée à des effets indésirables graves et/ou pouvant compromettre le pronostic vital. Ces substances actives incluent la flécaïnide et la propafénone.
- Rifampicine
La rifampicine est un inducteur puissant du CYP3A4. Il a été montré qu'elle est responsable d'une diminution de 82% de l'ASC (Aire Sous la Courbe) de l'amprénavir, ce qui peut conduire à un échec virologique et au développement de résistances. Lors de tentatives d'augmentation de la dose d'autres inhibiteurs de protéase associés au ritonavir visant à compenser cette diminution de l'ASC de l'amprénavir, une fréquence très élevée d'altérations de la fonction hépatique a été observée. L'administration concomitante de rifampicine et de Telzir associé à de faibles doses de ritonavir est contre-indiquée (voir «Contre-indications»).
- Millepertuis (Hypericum perforatum)
L'administration concomitante d'amprénavir et de ritonavir avec des préparations à base de plantes contenant du millepertuis (Hypericum perforatum) risque d'entraîner une diminution des concentrations plasmatiques d'amprénavir et de ritonavir. Ceci est dû à l'effet inducteur du millepertuis sur les enzymes intervenant dans le métabolisme des médicaments. Par conséquent, les préparations à base de plantes contenant du millepertuis ne doivent pas être utilisées en association avec Telzir et le ritonavir. Chez les patients prenant déjà du millepertuis, les taux d'amprénavir et de ritonavir, et si possible la charge virale, doivent être vérifiés, et le traitement par le millepertuis arrêté. Les concentrations d'amprénavir et de ritonavir peuvent augmenter à l'arrêt du millepertuis. L'effet inducteur peut persister au minimum deux semaines après l'arrêt du millepertuis.
- Inhibiteurs de l'HMG-CoA réductase
Telzir avec le ritonavir ne doit pas être associé aux inhibiteurs de l'HMG-CoA réductase simvastatine et lovastatine, ces deux médicaments étant fortement dépendants du métabolisme du cytochrome 3A4. L'administration concomitante de Telzir associé au ritonavir risque d'augmenter les concentrations des inhibiteurs de l'HMG-CoA réductase et provoquer ainsi une rhabdomyolyse. L'atorvastatine ne doit pas être administrée à des doses supérieures à 20 mg.
Effet de TELZIR sur d'autres médicaments
Médicaments antirétroviraux:
- Inhibiteurs non nucléosidiques de la transcriptase inverse
Efavirenz: Aucune interaction cliniquement pertinente n'a été observée lors de la coadministration de 700 mg de fosamprénavir deux fois par jour et de 100 mg de ritonavir deux fois par jour avec l'éfavirenz (600 mg une fois par jour).
Névirapine: Lors de la coadministration de 700 mg de fosamprénavir et de 100 mg de ritonavir avec 200 mg de névirapine deux fois par jour, l'ASC et la Cmin d'amprénavir ont été diminuées de 11% et 19% respectivement, tandis que la Cmax est restée inchangée. L'ASC, la Cmax et la Cmin de névirapine ont été augmentées de respectivement 14%, 13% et 22%. Aucune adaptation posologique n'est nécessaire lors de la coadministration de 700 mg de fosamprénavir et de 100 mg de ritonavir avec 200 mg de névirapine deux fois par jour.
- Inhibiteurs nucléosidiques / nucléotidiques de la transcriptase inverse
L'amprénavir administré sans ritonavir a fait l'objet d'études d'interaction avec l'abacavir, la lamivudine et la zidovudine. Sur la base des données issues de ces études et en raison du faible impact attendu du ritonavir sur la pharmacocinétique des INTI, il est peu probable que la coadministration de fosamprénavir et de ritonavir avec ces médicaments altère significativement l'exposition aux substances actives coadministrées.
Didanosine: Aucune étude d'interaction utilisant Videx® EC Capsules n'a été réalisée. Les capsules ne contenant aucune substance tamponnée, une interaction significative lors de leur administration simultanée avec Telzir ne doit donc pas être envisagée.
Ténofovir: La coadministration de fosamprénavir/ritonavir et de ténofovir ne peut, à ce stade, faire l'objet de recommandation.
- Inhibiteurs de protéase
Lopinavir / ritonavir: Aucune recommandation ne peut être émise en cas de coadministration de Telzir/ritonavir avec lopinavir/ritonavir. Une surveillance étroite est cependant conseillée, car la tolérance et l'efficacité de cette association ne sont pas connues. La Cmax, l'ASC et la Cmin du lopinavir sont augmentées de respectivement 30%, 37% et 52% lorsque l'association lopinavir/ritonavir (400 mg / 100 mg deux fois par jour) est administrée avec 700 mg de fosamprénavir deux fois par jour et 100 mg de ritonavir deux fois par jour, durant deux semaines. La Cmax, l'ASC et la Cmin de l'amprénavir sont diminuées de respectivement 58%, 63% et 65%.
En cas de coadministration, pendant deux semaines, de lopinavir/ritonavir (533 mg/133 mg, deux fois par jour) avec du fosamprénavir (1400 mg, deux fois par jour), la Cmax, l'ASC et la Cmin du lopinavir ont été inchangées par rapport aux valeurs observées lors de l'administration de 400 mg de lopinavir et de 100 mg de ritonavir deux fois par jour. Toutefois, l'ASC et la Cmin de l'amprénavir ont été diminuées de respectivement 26% et 42%, alors que la Cmax n'a pas été significativement modifiée par rapport aux valeurs obtenues après administration de 700 mg de fosamprénavir deux fois par jour associés à 100 mg de ritonavir deux fois par jour.
Tipranavir / Ritonavir: Aucune étude d'interaction n'a été réalisée à ce jour avec le fosamprénavir et le tipranavir. Toutefois, la Cmax, l'ASC et la Cmin plasmatique de l'amprénavir ont été diminuées resp. de 39%, 44% et 55% lorsque le tipranavir/ritonavir (600 mg/100 mg deux fois par jour) a été administré pendant deux semaines en même temps que l'amprénavir/ritonavir (500 mg/100 mg deux fois par jour). La Cmax, l'ASC et la Cmin du tipranavir sont restées inchangées. Aucune recommandation posologique ne peut être faite concernant l'administration simultanée de fosamprénavir/ritonavir et de tipranavir/ritonavir. C'est pourquoi l'association de fosamprénavir et de tipranavir/ritonavir n'est pas recommandée.
Aucune étude d'interaction n'a été réalisée après administration concomitante de fosamprénavir/ritonavir avec les inhibiteurs de protéase suivants: indinavir, saquinavir, nelfinavir et atazanavir.
- Inhibiteurs d'intégrase:
Raltégravir: Lors de la coadministration de fosamprénavir/ritonavir 700/100 mg deux fois par jour et de raltégravir 400 mg deux fois par jour, la Cmin de l'amprénavir a été diminuée de 19 – 33% et la Cmin du raltégravir a été diminuée de 36 – 54%. La signification clinique de ces diminutions n'est pas connue.
Dolutégravir: La co-administration de fosamprénavir/ritonavir 700/100 mg deux fois par jour et de dolutégravir 50 mg une fois par jour n'a pas modifié la pharmacocinétique de l'amprénavir. L'ASC (0-t), la Cmax et la Cτ du dolutégravir étaient réduites respectivement de 35%, 24% et 49% lors de l'association avec le fosamprénavir/ritonavir. Sur la base des données sur les corrélations entre l'exposition et la réponse clinique, aucun ajustement de la dose de fosamprénavir ou de dolutégravir n'est recommandé. Des précautions sont nécessaires et une surveillance étroite est recommandée lorsque cette association est administrée chez les patients avec une résistance aux inhibiteurs d'intégrase.
- Médicaments anti-hépatite C:
Télaprévir: Lors d'une administration concomitante de fosamprénavir/ritonavir et de télaprévir, on observe à l'état d'équilibre des expositions réduites à l'amprénavir et au télaprévir. Le mécanisme de cette interaction est inconnu. Une administration concomitante de fosamprénavir/ritonavir et de télaprévir n'est pas recommandée.
- Antagonistes du CCR5:
Maraviroc: L'utilisation concomitante de fosamprénavir/ritonavir et de maraviroc n'est pas recommandée vu que l'on ne dispose pas de données fiables à ce sujet.
Antibiotiques / antifongiques:
Clarithromycine: En cas d'administration concomitante de clarithromycine et de l'association Telzir/ritonavir, une augmentation des taux de clarithromycine doit être envisagée. Toutefois, cette interaction n'a pas fait l'objet d'études. Aucune recommandation d'ajustement posologique ne peut être émise pour garantir une efficacité suffisante, de même qu'une bonne tolérance de l'association.
Érythromycine: Aucune étude pharmacocinétique associant le fosamprénavir et le ritonavir à l'érythromycine n'a été réalisée. Cependant, les taux plasmatiques des deux médicaments peuvent être augmentés en cas de coadministration.
Kétoconazole / itraconazole: L'administration concomitante de fosamprénavir à 700 mg associé au ritonavir à 100 mg deux fois par jour conjointement avec le kétoconazole à 200 mg une fois par jour a entraîné une augmentation des concentrations plasmatiques maximales (Cmax) du kétoconazole de 25% tout en augmentant les ASC(0-τ) jusqu'au 2,69e des valeurs observées lors de la prise journalière unique de 200 mg de kétoconazole seul. La Cmax, l'ASC et la Cmin de l'amprénavir sont restées inchangées. Il est déconseillé d'administrer de fortes doses de kétoconazole ou d'itraconazole (>200 mg/ jour) en association avec Telzir et le ritonavir.
Rifabutine: L'administration concomitante d'amprénavir et de rifabutine (300 mg une fois par jour) a entraîné une augmentation de la concentration plasmatique (ASC) de rifabutine de 200%. L'ASC0-48 de la rifabutine consécutive à une coadministration de doses réduites de rifabutine (150 mg tous les deux jours) et du fosamprénavir (700 mg deux fois par jour) associé au ritonavir (100 mg deux fois par jour) a été inchangée, la Cmax ayant diminué de 14%. Néanmoins, l'ASC(0-48) et la Cmax de la 25-O-désacétylrifabutine ont été augmentées d'un facteur 11 et 6 respectivement, ce qui pourrait entraîner une majoration des effets indésirables liés à la rifabutine, notamment des uvéites. Une comparaison historique à l'appui, la rifabutine ne semble pas réduire l'absorption de l'amprénavir (augmentation de l'ASC 1,35-fois, augmentation de la Cmax 1,36 fois, augmentation de la Cmin 1,17 fois). Sur la base de ces données, une réduction de 75% de la dose standard de rifabutine (soit jusqu'à 150 mg tous les deux jours) est recommandée lors de l'administration de Telzir avec le ritonavir. Une réduction posologique supplémentaire peut s'avérer nécessaire.
- Effet d'autres médicaments sur TELZIRMédicaments susceptibles de diminuer les concentrations plasmatiques d'amprénavir en cas de coadministration avec Telzir
Médicaments réduisant l'acidité gastrique (antiacides, inhibiteurs des récepteurs H2, inhibiteurs de la pompe à protons):
Une dépendance de l'absorption de la prodrogue fosamprénavir de l'acidité a été mise en évidence dans des études précliniques et cliniques. En cas de coadministration d'une dose unique de 1400 mg de fosamprénavir avec une dose unique de 30 ml de suspension d'un antiacide (équivalent à 2,75 g d'hydroxyde d'aluminium et 1,8 g d'hydroxyde de magnésium), l'ASC et la Cmax de l'amprénavir ont diminué respectivement de 18% et 35%, alors que la Cmin (C 12h) a été comparable. Des études de «dose multiple» réalisées avec les antiacides ne sont pas disponibles. Lors d'une utilisation de Telzir en même temps que des médicaments réduisant l'acidité gastrique, une élévation du pH intragastrique peut entraîner une diminution des concentrations plasmatiques de fosamprénavir. Telzir ne doit pas être pris au même moment que ces médicaments, mais 2 h avant ou 1 h après la prise de ces médicaments.
Une dose unique de 300 mg de ranitidine, administrée 1 h avant une dose unique de 1400 mg de fosamprénavir, a réduit l'ASC plasmatique d'amprénavir de 30% et la Cmax de 51%.
Après une administration répétée d'ésoméprazole 20 mg une fois par jour au même moment que la dose matinale de fosamprénavir 700 mg / ritonavir 100 mg deux fois par jour, la pharmacocinétique de l'ésoméprazole à l'état d'équilibre n'a pas été influencée. La coadministration d'ésoméprazole 20 mg une fois par jour avec le fosamprénavir 700 mg / ritonavir 100 mg deux fois par jour a entraîné une réduction significative de l'ASC plasmatique de l'amprénavir à 90,7% (84,3 à 97,7%). La Cmax de l'amprénavir a baissé de façon non significative à 95,3% (86,4 à 105%) et la Cmin a baissé de façon non significative à 92,7% (84,5 à 102%) (traitement de référence: fosamprénavir 700 mg / ritonavir 100 mg deux fois par jour sans traitement concomitant).
Sur la base de ces données, la coadministration de médicaments inhibant l'acidité gastrique chez les patients traités au fosamprénavir doit se faire avec prudence et reposer sur une indication justifiée. Les données favorisent l'utilisation d'ésoméprazole à la dose standard plutôt que d'antihistaminiques H2 ou d'antiacides. Chez les patients soumis à un traitement inhibiteur de l'acidité prolongé à l'ésoméprazole, le succès du traitement anti-VIH au fosamprénavir doit être surveillé étroitement au moyen de méthodes appropriées (par exemple PCR de l'ARN du VIH).
Anticonvulsivants:
Phénytoïne: Lors d'une administration concomitante de fosamprénavir (700 mg deux fois par jour) et de ritonavir (100 mg deux fois par jour) avec la phénytoïne (300 mg une fois par jour), l'ASC et la Cmin de l'amprénavir ont été augmentées de 20% et de 19% respectivement, la Cmax. étant sans changement. La phénytoïne a réduit de 29% l'ASC du ritonavir. La Cmax de ritonavir a baissé de 27%, la Cmin étant réduite de 36%. Les ASC, Cmax et Cmin de la phénytoïne ont été réduites de 22%, de 20% et de 29% respectivement. Par conséquent, lorsque l'association fosamprénavir/ritonavir est administrée avec la phénytoïne, un ajustement de la posologie fosamprénavir/ritonavir n'est pas nécessaire. Il est cependant recommandé de surveiller les concentrations plasmatiques de phénytoïne et d'augmenter la dose de phénytoïne si besoin.
L'administration concomitante d'autres anticonvulsivants, connus comme inducteurs enzymatiques (phénobarbital, primidone, carbamazépine et topiramate), avec le fosamprénavir n'a pas été étudiée, mais risque d'entraîner une diminution des taux plasmatiques d'amprénavir. Ces associations doivent être utilisées avec prudence (voir «Mises en garde et précautions»).
Dexaméthasone: peut induire le CYP3A4 et faire baisser les concentrations plasmatiques d'amprénavir.
- Médicaments dont les concentrations plasmatiques peuvent être augmentées en cas de coadministration avec Telzir
Autres médicaments avec un spectre thérapeutique étroit: La coadministration de certaines substances (p.ex. lidocaïne [par voie systémique] et halofantrine) avec Telzir peut entraîner des effets indésirables sévères. L'administration concomitante de ces substances n'est donc pas recommandée.
Benzodiazépines: L'administration concomitante de Telzir avec le midazolam ou le triazolam peut induire un effet sédatif prolongé ou une dépression respiratoire et est par conséquent contre-indiquée.
Antagonistes du calcium: amlodipine, diltiazem, félodipine, isradipine, nicardipine, nifédipine, nimodipine, nisoldipine et vérapamil. Les concentrations sériques de ces substances sont susceptibles d'augmenter, leur action et leur toxicité pouvant ainsi être renforcées (p.ex. hypotension, syncopes, etc.).
Inhibiteurs de PDE5: Compte tenu des données concernant le ritonavir et les autres inhibiteurs de protéase, les concentrations plasmatiques des inhibiteurs de PDE5 (p.ex. sildénafil et vardénafil) peuvent considérablement augmenter en cas de coadministration avec Telzir et le ritonavir, entraînant ainsi une augmentation du risque d'effets secondaires associés à l'inhibiteur de PDE5, y compris hypotension, troubles visuels et priapisme. L'administration concomitante d'inhibiteurs de PDE5 pour traiter une dysfonction érectile ou une hypertension artérielle pulmonaire n'est pas recommandée chez les patients sous fosamprénavir. L'administration concomitante de fosamprénavir est contre-indiquée chez les patients traités par le sildénafil pour une hypertension artérielle pulmonaire (voir «Contre-indications»).
Propionate de fluticasone (interaction avec le ritonavir): Dans une étude clinique dans laquelle des capsules dosées à 100 mg de ritonavir avaient été administrées deux fois par jour, conjointement avec 200 µg de propionate de fluticasone par voie intranasale (une fois par jour) sur 7 jours à des sujets, les taux plasmatiques du propionate de fluticasone ont significativement augmenté, alors que le cortisol endogène a diminué de quelque 86% (intervalle de confiance à 90%, 82 - 89%). Il faut s'attendre à de plus forts effets après inhalation du propionate de fluticasone.
Des effets stéroïdiens systémiques, y compris une maladie de Cushing et une suppression de la fonction surrénalienne, ont été signalés chez les patients ayant reçu du ritonavir conjointement avec du propionate de fluticasone, administré en inhalation ou par voie intranasale; ces effets pourraient également apparaître avec d'autres corticostéroïdes métabolisés par le P450 3A (p.ex. budénoside) (voir «Mises en garde et précautions»).
Pour cette raison, l'administration concomitante de Telzir et du ritonavir conjointement avec ces glucocorticostéroïdes devrait être évitée, à moins que le bénéfice thérapeutique potentiel l'emporte sur le risque d'apparition d'effets stéroïdiens systémiques.
Dans ce cas, une réduction des doses de glucocorticoïdes ou le passage à un glucocorticoïde qui n'est pas un substrat du CYP3A4 (p.ex. la béclométhasone) devra être envisagé et s'accompagner d'une surveillance étroite des effets locaux et systémiques. De plus, lors de l'arrêt des glucocorticoïdes, la diminution progressive de la posologie devra être réalisée sur une période plus longue. Les effets d'une exposition systémique élevée à la fluticasone sur les taux plasmatiques de ritonavir ne sont pas encore connus.
Inhibiteurs de l'HMG-CoA réductase: Dans le cas où un traitement par un inhibiteur de l'HMG-CoA réductase est indiqué, l'utilisation de la pravastatine ou de la fluvastatine est recommandée, car leur métabolisme ne dépend pas du CYP3A4, et des interactions médicamenteuses sont donc peu probables avec les inhibiteurs de protéase. Les inhibiteurs de l'HMG-CoA réductase dont le métabolisme est hautement dépendant du CYP3A4 (p.ex. lovastatine et simvastatine), sont susceptibles d'avoir des concentrations plasmatiques fortement augmentées en cas de coadministration de Telzir avec le ritonavir. L'augmentation des concentrations plasmatiques des inhibiteurs de l'HMG-CoA réductase pouvant provoquer une myopathie, y compris une rhabdomyolyse, l'association de la lovastatine ou de la simvastatine avec Telzir et le ritonavir n'est pas recommandée (voir «Contre-indications»). Aucun ajustement posologique de Telzir ni du ritonavir n'est nécessaire en cas de coadministration avec l'atorvastatine. L'atorvastatine ne doit cependant pas être utilisée à des doses supérieures à 20 mg/jour.
Les Cmax, ASC et Cmin de l'atorvastatine ont été augmentées à respectivement 284%, 253% et 173% lorsque l'atorvastatine (10 mg, une fois par jour pendant 4 jours) est administrée avec 700 mg de fosamprénavir (deux fois par jour) et 100 mg de ritonavir (deux fois par jour), pendant deux semaines. La Cmax, l'ASC et la Cmin de l'amprénavir ont été inchangées. Lors d'une administration simultanée de Telzir associé au ritonavir, les doses d'atorvastatine ne doivent pas dépasser 20 mg/jour, une surveillance attentive visant à dépister une éventuelle toxicité due à l'atorvastatine est donc requise.
Immunosuppresseurs: Une surveillance plus fréquente des concentrations thérapeutiques d'immunosuppresseurs est recommandée jusqu'à leur stabilisation. Les concentrations plasmatiques de la ciclosporine, de la rapamycine et du tacrolimus peuvent en effet être augmentées en cas d'administration concomitante du fosamprénavir associé au ritonavir.
Antidépresseurs tricycliques: Une surveillance attentive de l'efficacité et des effets indésirables des antidépresseurs tricycliques (par exemple désipramine et nortryptiline) est recommandée en cas d'administration concomitante de ces médicaments avec Telzir.
Médicaments antinéoplasiques:
L'administration concomitante de médicaments antinéoplasiques (p.ex. dasatinib, nilotinib, ibrutinib, vinblastine et évérolimus) métabolisés par le CYP3A et de fosamprénavir associé ou non au ritonavir peut augmenter les concentrations plasmatiques de ces médicaments antinéoplasiques et accroître le risque d'effets indésirables habituellement associé à ces médicaments antinéoplasiques. En cas de co-administration avec des médicaments antinéoplasiques métabolisés par le CYP3A, veuillez vous référer aux informations professionnelles respectives de ces médicaments.
Antipsychotiques:
Quétiapine: Du fait de l'inhibition du CYP3A4 par le fosamprénavir, une augmentation des concentrations de quétiapine est attendue. La co-administration de fosamprénavir et de quétiapine est contre-indiquée, car elle augmente la toxicité induite par la quétiapine. Une augmentation des taux plasmatiques de quétiapine peut entraîner un coma.
Lurasidone:
Lorsqu'une administration concomitante avec le fosamprénavir s'avère nécessaire, la dose de lurasidone doit être réduite. Veuillez vous référer à l'information professionnelle de la lurasidone en ce qui concerne l'utilisation concomitante avec des inhibiteurs modérés du CYP3A4.
L'administration concomitante de fosamprénavir associé au ritonavir et de lurasidone est contre-indiquée en raison du risque de réactions sévères et/ou mettant en jeu le pronostic vital (voir «Contre-indications»).
- Médicaments dont les taux plasmatiques peuvent être diminués en cas de coadministration avec Telzir:
Méthadone: L'administration simultanée de fosamprénavir à 700 mg et de ritonavir à 100 mg 2x jour avec la méthadone une fois par jour (≤200 mg), poursuivie sur 14 jours, a réduit de 18% et de 21% respectivement l'ASC(0-τ) et la Cmax de l'énantiomère (R-) actif de méthadone. La Cmin de la méthadone R a été réduite de 11%, le tmax étant ralenti de 1,75 h. L'ASC(0-τ) et la Cmax de l'énantiomère S inactif de méthadone se sont trouvées réduites de 43% chacune. La Cmin de la méthadone S a été réduite de 41%, le tmax étant ralenti de 0,85 h. Les comparaisons historiques à l'appui, la méthadone ne semble pas modifier la pharmacocinétique plasmatique de l'amprénavir. Sur la base de ces données, un ajustement posologique n'est pas nécessaire lorsque le fosamprénavir avec le ritonavir est administré en même temps que la méthadone. Pour plus de sûreté, les patients devraient être surveillés, afin de détecter d'éventuels symptômes de sevrage.
Paroxétine: La Cmax et l'ASC de la paroxétine étaient diminuées de 51% et 55% respectivement lorsque la paroxétine était administrée chez des volontaires sains à la dose de 20 mg, une fois par jour, en association avec fosamprénavir 700 mg / ritonavir 100 mg, deux fois par jour pendant 10 jours. Le mécanisme de cette interaction reste inconnu. Selon des données comparatives existantes, les paramètres pharmacocinétiques de l'amprénavir n'étaient pas modifiés par la paroxétine. Par conséquent, si la paroxétine est coadministrée avec du Telzir et du ritonavir, il est recommandé d'ajuster la dose de paroxétine en fonction de l'effet antidépresseur évalué cliniquement. De plus, les patients déjà traités avec une dose stable de paroxétine et qui commencent un traitement associant Telzir et ritonavir doivent être surveillés sur la base de la réponse au traitement antidépresseur.
Anticoagulants oraux: Un contrôle renforcé de l'INR (International Normalised Ratio) est recommandé lors de l'administration concomitante des anticoagulants du type de la coumarine ou d'autres anticoagulants oraux et de Telzir associé au ritonavir, du fait d'une possible diminution ou augmentation de leur effet antithrombotique.
Stéroïdes: L'administration simultanée de 700 mg de fosamprénavir deux fois par jour + 100 mg de ritonavir deux fois par jour et de Brevinor® (éthinylestradiol (EE) 0,035 mg / noréthistérone (NE) 0,5 mg) une fois par jour a diminué l'ASC(0-τ) plasmatique et la Cmax de l'EE resp. de 37% et 28%, ainsi que l'ASC(0-τ), la Cmax et la Cτ du NE resp. de 34%, 38% et 26%. L'administration simultanée de Brevinor® n'a pas entraîné de modification significative des paramètres pharmacocinétiques de l'amprénavir à l'état d'équilibre; toutefois, l'ASC(0-τ) et la Cmax du ritonavir ont augmenté de 45% et 63% par rapport aux données historiques chez des femmes traitées par fosamprénavir/ritonavir seul. Outre la diminution de l'exposition aux contraceptifs hormonaux, l'administration simultanée de fosamprénavir/ritonavir et de Brevinor® a provoqué une augmentation cliniquement significative des taux de transaminases chez 22% (7/32) des volontaires saines, ce qui doit être considéré comme un indice d'atteinte hépatocellulaire. Il est donc recommandé aux femmes en âge de procréer d'avoir recours à des méthodes contraceptives alternatives, non hormonales (préservatifs), car la contraception peut être diminuée (voir «Mises en garde et précautions»).
Parallèlement, des nausées, une diarrhée, des exanthèmes et des interruptions des études à cause d'effets indésirables (34% lors de l'association de fosamprénavir/ritonavir et d'un contraceptif vs 5% avec un contraceptif seul) ont été rapportés plus fréquemment.
Effets potentiels sur les substrats de la glycoprotéine P:
Le fosamprénavir, prodrogue de l'amprénavir, est rapidement converti en amprénavir à l'intérieur ou à proximité de la muqueuse intestinale. L'amprénavir est un activateur puissant du récepteur central PXR (pregnane X receptor) servant, entre autres, de médiateur lors de l'induction du cytochrome 3A4 (métabolisation augmentée) et lors de l'induction de la glycoprotéine P (excrétion augmentée, p.ex. dans l'intestin, pompe à efflux). Pourtant, l'amprénavir est lui-même substrat et inhibiteur de la glycoprotéine P. Le ritonavir, inhibiteur du cytochrome 3A4, ne parvient à inhiber l'induction de la glycoprotéine P que de façon incomplète, de sorte qu'une élimination accélérée de substrats de la glycoprotéine P, tels que la digoxine, peut intervenir, malgré le ritonavir, le cas échéant. Les recherches cliniques portant sur ces interactions font défaut. En cas de comédication faisant appel aux médicaments connus comme substrats de la glycoprotéine P (p.ex. la digoxine, l'azithromycine), il faut procéder à une surveillance médicamenteuse (Drug Monitoring) (p.ex. la digoxine) ou rechercher des signes cliniques d'un échec thérapeutique (p.ex. l'azithromycine).
Grossesse, allaitementGrossesse
Chez les rates et les lapines gravides, aucun effet majeur n'a été observé sur le développement embryofœtal (voir «Données précliniques»). Dans ces études, l'exposition systémique à l'amprénavir (ASC) a été comparable (rates) ou inférieure (lapines) à l'exposition thérapeutique chez les patients traités par Telzir dans des études cliniques. Étant donné la faible exposition chez les lapines, il n'a pas été possible de déterminer avec précision la toxicité potentielle de Telzir sur le développement.
Un passage transplacentaire faible à modéré de l'amprénavir a été observé après l'administration de FPV/RTV 700/100 mg deux fois par jour à des femmes enceintes (voir «Pharmacocinétique»). Il n'existe que des données cliniques limitées concernant l'emploi du fosamprénavir en association avec d'autres antirétroviraux pendant la grossesse chez l'être humain. Les données limitées concernant l'emploi du fosamprénavir pendant la grossesse, issues de l'Antiretroviral Pregnancy Registry (APR) et de rapports de cas, sont insuffisantes pour tirer des conclusions sur le risque de malformations congénitales et de fausses couches, associé au médicament (voir Études cliniques).
Telzir n'est pas indiqué pendant la grossesse et ne doit être administré à la femme enceinte que si les bénéfices thérapeutiques escomptés sont supérieurs aux risques potentiels encourus par le fœtus.
Allaitement
Étant donné le risque d'un passage du VIH dans le lait maternel, les femmes infectées par le VIH ne doivent pas allaiter leur nourrisson.
Des produits dérivés de l'amprénavir ont été retrouvés dans le lait de la rate. Une toxicité sur le développement a été observée chez les jeunes rats exposés à l'amprénavir et au fosamprénavir avant et après la naissance (voir «Données précliniques»).
Les données issues des expérimentations animales suggèrent que l'amprénavir peut être excrété dans le lait maternel chez l'être humain. Aucune information n'est disponible sur la transmission et les effets de l'amprénavir sur l'enfant allaité et l'action de ce médicament sur la production de lait.
Effet sur l’aptitude à la conduite et l’utilisation de machinesAucune étude n'a été réalisée concernant l'effet de l'association Telzir / ritonavir sur l'aptitude à conduire des véhicules ou à utiliser des machines. L'évaluation de l'aptitude du patient à conduire un véhicule ou à utiliser des machines doit tenir compte du profil des effets indésirables liés à Telzir (voir «Effets indésirables»).
Effets indésirablesLa sécurité du fosamprénavir a été étudiée chez 755 patients de plus de 18 ans au cours d'essais cliniques contrôlés de phases II et III. Deux études pivotales de phase III ont permis d'établir la sécurité de l'administration de fosamprénavir associé à de faibles doses de ritonavir: APV30002 (n = 322) réalisée chez des patients naïfs de traitement antirétroviral et recevant 1400 mg de fosamprénavir une fois par jour en association avec 200 mg de ritonavir, dans le cadre d'une trithérapie incluant l'abacavir et la lamivudine; APV30003 réalisée chez des patients prétraités par inhibiteurs de protéase et recevant du fosamprénavir en association avec le ritonavir, soit en une prise par jour (1400 mg / 200 mg) (n = 106), soit en deux prises par jour (700 mg / 100 mg) (n = 106), en association avec deux inhibiteurs actifs de la transcriptase inverse (ITI).
Le profil d'effets indésirables a été similaire dans toutes les études, qu'il s'agisse des patients adultes naïfs de traitement antirétroviral (APV30002) ou des patients adultes prétraités par inhibiteurs de protéase (posologie en deux prises par jour, APV30003).
Ci-après, les effets indésirables sont listés par système MedDRA, classe d'organe et par fréquence absolue. Les fréquences sont définies selon les catégories suivantes: très fréquents (≥1/10), fréquents (≥1/100 à < 1/10), occasionnels (≥1/1000 à <1/100), rares (≥1/10 000 à <1/1000) et très rares (<1/10 000), y compris les cas isolés.
Les catégories de fréquence pour les effets suivants ont été calculées sur la base des études cliniques et des données de post-commercialisation.
La plupart des effets indésirables ci-dessous ont été rapportés lors de deux grandes études cliniques réalisées chez l'adulte, dans lesquelles les effets indésirables observés étaient d'intensité au moins modérée (grade 2 ou plus) survenant chez au moins 2% des patients et rapportés par les investigateurs comme étant imputables aux médicaments utilisés dans le cadre des essais.
Troubles de la circulation sanguine et lymphatique
Patients hémophiles: Des cas d'augmentation des saignements spontanés ont été signalés chez des patients hémophiles traités par inhibiteurs de protéase (voir «Mises en garde et précautions»).
Troubles du système immunitaire
Syndrome de Restauration Immunitaire: Chez les patients infectés par le VIH et présentant un déficit immunitaire sévère au moment de l'instauration du traitement par une association d'antirétroviraux, une réaction inflammatoire à des infections opportunistes asymptomatiques ou résiduelles peut se produire (voir «Mises en garde et précautions»).
Troubles du métabolisme et de la nutrition
Très fréquents: hypercholestérolémie (11%) (voir «Mises en garde et précautions»)
Fréquents: Hypertriglycéridémie (voir «Mises en garde et précautions»)
Troubles métaboliques: On a constaté, chez les patients infectés par le VIH et traités par association antirétrovirale, des anomalies métaboliques, telles que l'hypertriglycéridémie, l'hypercholestérolémie, l'insulinorésistance, l'hyperglycémie et l'hyperlactatémie (voir «Mises en garde et précautions»).
Hyperglycémie: L'apparition d'un diabète sucré, d'une hyperglycémie ou une exacerbation d'un diabète sucré préexistant ont été signalées chez des patients traités par des antirétroviraux inhibiteurs de protéase (voir «Mises en garde et précautions»).
Troubles du système nerveux
Fréquents: céphalées, vertiges, paresthésie orale
Troubles cardiaques
Occasionnels: infarctus du myocarde
Troubles gastro-intestinaux
Très fréquents: diarrhée (13%)
Fréquents: selles molles, nausées, vomissements, douleurs abdominales
Troubles cutanés et des tissus sous-cutanés
Fréquents: éruption cutanée (voir le texte ci-dessous «Eruptions / réactions cutanées»)
Occasionnels: angio-œdème (œdème de Quincke)
Rares: syndrome de Stevens-Johnson
Éruptions / réactions cutanées:Des éruptions cutanées érythémateuses ou maculo-papuleuses, avec ou sans prurit, peuvent apparaître pendant le traitement. Elles disparaissent en général spontanément sans qu'il soit nécessaire d'arrêter le traitement par l'association fosamprénavir/ritonavir. Des éruptions cutanées sévères ou compromettant le pronostic vital, dont le syndrome de Stevens-Johnson, ont été signalées chez moins de 1% des patients inclus dans le programme de développement clinique. L'association fosamprénavir/ritonavir doit être supprimée de façon définitive à l'apparition d'une éruption cutanée grave ou d'une éruption cutanée modérée associée à des symptômes systémiques ou à une atteinte muqueuse (voir «Mises en garde et précautions»).
Le traitement par association antirétrovirale qui comportait un inhibiteur de la protéase a été associé à une augmentation de la graisse corporelle (lipohypertrophie) chez certains patients infectés par le VIH (voir «Mises en garde et précautions»).
Affections musculosquelettiques
Rhabdomyolyse: Une élévation de la CPK, des myalgies, des myosites et, rarement, des rhabdomyolyses ont été signalées sous traitement par inhibiteurs de protéase, notamment en association avec les analogues nucléosidiques.
Ostéonécrose: Des cas d'ostéonécrose ont été rapportés, en particulier chez des patients présentant des facteurs de risque connus, un stade avancé de la maladie liée au VIH ou un traitement par association d'antirétroviraux au long cours. Leur fréquence de survenue n'est pas connue (voir «Mises en garde et précautions»).
Troubles rénaux et urinaires
Occasionnels: calculs urinaires
Troubles généraux et réactions au site d'administration
Fréquents: fatigue
Investigations (anomalies de degré 3 ou 4)
Très fréquents: élévation des triglycérides (11%)
Fréquents: augmentation des ALAT, ASAT, de la lipase sérique.
Enfants et adolescents: Le profil d'effets indésirables chez les enfants et les adolescents est basé sur les données de sécurité de l'étude APV29005 dans laquelle 54 patients infectés par le VIH-1, âgés de 6 à 18 ans, ont reçu du fosamprénavir potentialisé par le ritonavir (deux prises par jour) et associé à des inhibiteurs nucléosidiques de la transcriptase inverse.
Globalement, le profil de sécurité d'emploi chez ces 54 enfants et adolescents était similaire à celui observé dans la population adulte.
Dans l'étude APV20003, une dose 1 fois par jour de fosamprénavir et de ritonavir a été étudiée chez l'enfant (posologie non autorisée). Les effets indésirables liés au traitement étaient plus fréquents dans l'étude APV20003 (52%) où les sujets recevaient le traitement fosamprénavir/ritonavir en une prise par jour comparé à l'étude APV29005 (39%) où les sujets recevaient le traitement fosamprénavir/ritonavir en deux prises par jour.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageIl n'existe pas d'antidote connu pour Telzir. L'intérêt de la dialyse péritonéale ou de l'hémodialyse sur l'élimination d'amprénavir n'est pas connu. En cas de surdosage, le patient doit être surveillé afin de détecter une éventuelle toxicité (voir «Effets indésirables») et un traitement standard approprié doit être instauré, si nécessaire.
Propriétés/EffetsCode ATC
J05AE07
Classe pharmacothérapeutique: inhibiteur de protéase (IP)
Mécanisme d'action
Le fosamprénavir est rapidement transformé en amprénavir in vivo par des phosphatases cellulaires ou sériques. L'amprénavir est un inhibiteur compétitif de la protéase du VIH-1. L'amprénavir se lie au site actif de la protéase du VIH-1 et prévient ainsi la transformation des précurseurs polyprotéiniques gag et gag-pol viraux, conduisant à la formation de particules virales immatures non infectieuses.
Pharmacodynamique
Le fosamprénavir présente peu ou pas d'activité antivirale in vitro. L'activité antivirale in vitro observée avec le fosamprénavir est due à la présence de faibles quantités d'amprénavir. L'activité antivirale in vitro de l'amprénavir contre le VIH-1 IIIB a été évaluée sur des lignées cellulaires lymphoblastiques infectées à la fois de façon aiguë et chronique (MT-4, CEM-CCRF, H9) et sur des lymphocytes sanguins périphériques. La concentration inhibitrice 50% (IC50) de l'amprénavir est comprise entre 0,012 et 0,08 µM pour les cellules infectées de façon aiguë et de 0,41 µM pour les cellules infectées de façon chronique (1 µM = 0,50 µg/ml). In vitro, l'amprénavir a montré une activité anti-VIH-1 synergique en association avec les inhibiteurs nucléosidiques de la transcriptase inverse (INTI) suivants: abacavir, didanosine et zidovudine, ainsi que l'inhibiteur de protéase saquinavir. Une activité anti-VIH-1 additive a été observée en association avec l'indinavir, le nelfinavir et le ritonavir. La relation entre l'activité anti-VIH-1 in vitro de l'amprénavir et l'inhibition de la réplication du VIH-1 chez l'homme n'a pas encore été définie.
La coadministration de ritonavir et de fosamprénavir augmente l'ASC plasmatique de l'amprénavir d'environ 2 fois et la concentration plasmatique Cτ,ss de 4 à 6 fois, par rapport aux valeurs obtenues après administration de fosamprénavir seul. L'administration de 700 mg de fosamprénavir deux fois par jour et de 100 mg de ritonavir deux fois par jour conduit à des concentrations plasmatiques résiduelles d'amprénavir (moyenne géométrique Cmin plasmatique = 1,74 µg/ml – étude APV30003 chez les patients prétraités) supérieures à la valeur médiane d'IC50 (0,008 µg/ml [0,001 – 0,144]) mesurée dans cette étude.
Résistance
Des isolats de VIH-1 ayant une sensibilité réduite à l'amprénavir ont été sélectionnés in vitro au cours de tests de passages en série. Une sensibilité réduite à l'amprénavir a été associée à la présence d'un virus ayant développé des mutations I50V ou I84V ou V32I+I47V ou I54M.
Chez 32 patients n'ayant jamais été traités par des antirétroviraux, en échec virologique après avoir reçu 1400 mg de fosamprénavir associés à 200 mg de ritonavir une fois par jour, ou présentant une réplication virale persistante, aucune résistance virale génotypique ou phénotypique à l'amprénavir n'a été retrouvée (étude APV30002). Un pourcentage significativement plus élevé de patients traités par le nelfinavir a développé des mutations primaires et/ou secondaires sur la protéase [nelfinavir: 27/54 (50%)] (p<0,001).
Dans les isolats viraux issus des patients prétraités par un inhibiteur de protéase, en échec virologique après avoir reçu 1400 mg de fosamprénavir associé à 200 mg de ritonavir une fois par jour, ou 700 mg de fosamprénavir associés à 100 mg de ritonavir deux fois par jour (étude APV30003), ou bien présentant une réplication virale persistante, le développement d'une résistance à l'amprénavir a été retrouvé. Dans le groupe fosamprénavir/ritonavir, 58% (19/33) des patients ont acquis des mutations primaires et/ou secondaires sur la protéase par rapport à 25% (7/28) des patients dans le volet lopinavir/ritonavir. Les mutations suivantes, associées à une résistance à l'amprénavir, se sont développées seules ou en association: V32I, M46I/L, I47V, I50V, I54L/M et I84V.
Résistance croisée
Les données actuellement disponibles sont trop limitées pour permettre de déterminer un seuil phénotypique cliniquement pertinent pour l'association fosamprénavir/ritonavir.
Les résistances croisées entre l'amprénavir et les inhibiteurs de la transcriptase inverse sont peu probables, leurs cibles enzymatiques étant différentes.
L'utilisation de Telzir en monothérapie n'est pas recommandée, du fait du risque d'apparition rapide de virus résistants.
Efficacité clinique
L'expérience clinique repose essentiellement sur deux études ouvertes réalisées, par rapport au nelfinavir, chez les patients adultes naïfs de traitement antirétroviral (étude APV30002) et, par rapport à l'association lopinavir/ritonavir, chez les patients adultes prétraités par antirétroviraux (étude APV30003). Dans les deux études, le fosamprénavir a été utilisé en association à de faibles doses de ritonavir.
Patients adultes naïfs de traitement antirétroviral
Dans l'étude APV30002 réalisée chez des patients n'ayant jamais reçu d'antirétroviraux, le traitement par le fosamprénavir (1400 mg), une fois par jour, avec de faibles doses de ritonavir (200 mg) associé, en tant qu'élément d'une trithérapie, à l'abacavir (300 mg, deux fois par jour) et à la lamivudine (150 mg, deux fois par jour) a montré, après une durée de 48 semaines, une efficacité similaire à celle du nelfinavir (1250 mg), administré deux fois par jour en association avec l'abacavir et la lamivudine (300 et 150 mg, deux fois par jour).
La non-infériorité du fosamprénavir/ritonavir par rapport au nelfinavir a été démontrée sur la base du pourcentage de patients ayant une charge virale ARN VIH-1< 400 copies/ml après 48 semaines (critère d'évaluation principal). Dans l'analyse en ITT (rebond ou arrêt qualifié d'échec), 69% (221 / 322) des patients recevant du fosamprénavir associé au ritonavir ont atteint une charge virale ARN VIH-1< 400 copies/ml comparée à 68% (221 / 327) des patients recevant du nelfinavir. À la 48e semaine, le taux plasmatique médian d'ARN VIH-1 a diminué respectivement de 3,1 log10 copies/ml et 3,0 log10 copies/ml dans les volets Telzir / ritonavir et nelfinavir.
À l'inclusion, le taux médian de CD4 était bas dans les deux groupes de traitement (170 cellules/mm3 au total). À 48 semaines, ces taux ont augmenté de manière comparable dans les deux volets de traitement, fosamprénavir/ritonavir: + 203 cellules/mm3 et nelfinavir: + 207 cellules/mm3.
Les données précédentes démontrent qu'une seule prise par jour de fosamprénavir (1400 mg), associé au ritonavir (200 mg), chez des patients n'ayant jamais reçu d'antirétroviraux, présente une efficacité comparable à celle du nelfinavir, administré en deux prises par jour. Toutefois, la preuve de l'efficacité dans cette population de patients ne se base que sur une seule étude ouverte versus nelfinavir. Une autre étude clinique est prévue pour renforcer cette preuve de l'efficacité. Aussi, par prudence, pour une prise en charge thérapeutique optimale de cette population, l'administration biquotidienne de fosamprénavir/ritonavir permettant une augmentation des concentrations résiduelles d'amprénavir est recommandée (voir «Posologie/Mode d'emploi»).
Patients adultes prétraités par antirétroviraux
Dans une étude randomisée ouverte (APV30003), réalisée chez des patients prétraités par inhibiteurs de protéase et en échec virologique (d'un ou deux IP), l'association fosamprénavir/ritonavir (700 / 100 mg deux fois par jour ou 1400 / 200 mg une fois par jour) n'a pas démontré sa non-infériorité au lopinavir/ritonavir en ce qui concerne la suppression virale du taux plasmatique de l'ARN VIH-1 mesurée par l'aire moyenne sous la courbe moins la valeur initiale (AAUCMB ) sur les 48 semaines de traitement (critère d'évaluation principal). Les résultats étaient en faveur du volet lopinavir/ritonavir, comme détaillés ci-dessous.
Dans cette étude, tous les patients étaient en échappement virologique après un traitement associé antérieur comprenant un inhibiteur de protéase (échec défini par une charge virale ARN VIH-1 jamais inférieure à 1000 copies/ml après au moins 12 semaines consécutives de traitement, ou par une suppression initiale de la charge virale ARN VIH-1 suivie d'un rebond ≥1000 copies/ml). Cependant, seuls 65% des patients recevaient un traitement comprenant un IP à l'inclusion.
La majorité des patients inclus était modérément prétraitée par antirétroviraux. La durée médiane de l'exposition préalable aux INTI était de 257 semaines pour les patients recevant l'association fosamprénavir/ritonavir deux fois par jour (79% avaient préalablement reçu ≥3 INTI) et 210 semaines pour les patients recevant l'association lopinavir/ritonavir (64% avaient préalablement reçu ≥3 INTI). La durée médiane d'exposition préalable aux IP était de 149 semaines pour les patients recevant l'association fosamprénavir/ritonavir deux fois par jour (49% avaient préalablement reçu ≥2 IP) et 130 semaines pour les patients recevant l'association lopinavir/ritonavir (40% avaient préalablement reçu ≥2 IP).
Les valeurs moyennes d'AAUCMB (log10 copies/ml) dans la population en ITT (E) (analyse observée) à 48 semaines sont présentées dans le tableau ci-dessous:
APV30003: valeurs (log10 copies/ml) de baisse de la charge virale plasmatique (ARN VIH-1) moyenne, exprimée par l'aire sous la courbe (AAUCMB) moins valeurs initiales à la 48e semaine, par strate de randomisation dans la population en ITT (E) (analyse observée)
|
Strate de charge virale plasmatique ARN VIH-1
|
Analyse observée
FPV/RTV BID
N=107
Moyenne (n)
|
Analyse observée
LPV/RTV BID
N=103
Moyenne (n)
|
Analyse observée
Différence moyenne
(97,5% KI)
FPV/RTV BID vs
LPV/RTV BID
| |
1000 – 10 000 copies/ml
|
-1,53 (41)
|
-1,43 (43)
|
-0,104
(-0,550, 0,342)
| |
> 10 000 – 100 000 copies/ml
|
-1,59 (45)
|
-1,81 (46)
|
0,216
(-0,213, 0,664)
| |
> 100 000 copies /ml
|
-1,38 (19)
|
-2,61 (14)
|
1,232
(0,512, 1,952)
| |
Population totale
|
-1,53 (105)
|
-1,76 (103)
|
0,244
(-0,047, 0,536)
|
Légende: FPV/RTV BID: fosamprénavir avec ritonavir 2 fois par jour, LPV/RTV BID: lopinavir/ritonavir 2 fois par jour
Concernant le pourcentage de patients ayant une charge virale indétectable, les résultats ont montré une tendance en faveur du volet lopinavir/ritonavir: 58% dans le volet fosamprénavir/ritonavir, deux fois par jour versus 61% dans le volet lopinavir/ritonavir (ARN VIH-1 plasmatique < 400 copies/ml) ou 46% versus 50% (ARN VIH-1 plasmatique < 50 copies/ml) à la 48e semaine (critère d'évaluation secondaire) dans l'analyse en intention de traiter (RD=F).
Chez les patients avec une charge virale élevée à l'inclusion (> 100 000 copies/ml), 7/14 (50%) des patients dans le groupe lopinavir/ritonavir et 6/19 (32%) des patients dans le groupe fosamprénavir/ritonavir avaient une charge virale indétectable (seuil à 400 copies/ml).
Le traitement par fosamprénavir/ritonavir (deux prises par jour) et par lopinavir/ritonavir (deux prises par jour) a montré, au cours des 48 semaines de traitement, une amélioration immunologique comparable, mesurée par la variation médiane du taux de CD4 (par rapport à la valeur initiale): fosamprénavir/ritonavir (deux fois par jour) = +81 cellules/mm3; lopinavir/ritonavir (deux fois par jour) = +91 cellules/mm3).
Les données sont insuffisantes pour recommander l'utilisation de l'association fosamprénavir/ritonavir chez les patients lourdement prétraités.
Grossesse
Le fosamprénavir a été évalué dans le cadre de l'Antiretroviral Pregnancy Registry auprès de 162 femmes, pendant la grossesse et le post-partum. Il y a eu 146 naissances vivantes; 125 expositions pendant le premier trimestre de la grossesse et 36 expositions pendant les deuxième et troisième trimestres de la grossesse; 4 cas de malformations congénitales ont été rapportés chez les enfants nés vivants. Il n'existe cependant pas d'études adéquates et bien contrôlées chez la femme enceinte et la sécurité d'emploi du fosamprénavir n'est pas établie pendant la grossesse chez l'être humain.
Sécurité et efficacité en pédiatrie
Enfants de plus de 6 ans et adolescents (pesant au moins 25 kg)
Le fosamprénavir en comprimé ou suspension buvable potentialisé par le ritonavir et associé avec des INTI a été évalué chez des enfants et adolescents n'ayant jamais été traités par des inhibiteurs de protéase et chez des enfants et adolescents ayant été prétraités par des inhibiteurs de protéase.
Le bénéfice dans cette tranche d'âge a principalement été étudié dans l'étude APV29005, étude en ouvert de 48 semaines évaluant les profils de pharmacocinétique, la sécurité d'emploi et l'activité antivirale du fosamprénavir associé au ritonavir, administré en deux fois par jour, chez des patients âgés de 2 à 18 ans, n'ayant jamais été traités par des inhibiteurs de protéase ou ayant été prétraités par des inhibiteurs de protéase. Les résultats à 24 semaines de traitement sont rapportés ci-dessous.
Dans l'étude APV29005 ont été recrutés 25 patients âgés de 6 à 11 ans (dont la majorité recevait un traitement fosamprénavir/ritonavir à la dose de 18/3 mg/kg deux fois par jour (Telzir suspension n'est plus autorisée) ou le schéma posologique de l'adulte en comprimés) et 29 patients âgés de 12 à 18 ans (dont la majorité recevait un traitement selon le schéma posologique de l'adulte). Globalement, 27 (50%) n'avaient jamais été traités par un IP, dont 9 n'avaient jamais été traités par des antirétroviraux et 27 (50%) avaient été prétraités par un IP. L'exposition préalable aux INTI était importante, avec une durée médiane de 421 semaines chez les sujets n'ayant jamais été traités par IP et de 389 semaines chez les sujets prétraités par IP. La durée médiane d'exposition préalable aux IP était de 239 semaines. Les patients avaient à l'inclusion une médiane de 4,6 log10 copies/ml d'ARN VIH-1 (dont 33% avaient plus de 100 000 copies/ml à l'inclusion) et un pourcentage médian de CD4+ de 18% (dont 39% avaient moins de 15% de CD4+ à l'inclusion).
Sur les 24 semaines de traitement, 70% (19/27) des patients n'ayant jamais été traités par un inhibiteur de protéase et 56% (15/27) des patients prétraités par un inhibiteur de protéase ont atteint et maintenu une charge virale <400 copies/ml (ITT(E), TLOVR).
Dans la population ITT(E) (analyse observée) à la semaine 24, le pourcentage médian de CD4+ a augmenté de 8% chez les sujets n'ayant jamais été traités par un IP et de 4% chez les sujets prétraités par IP.
Jusqu'à la 48e semaine de traitement, 70% (19/27) des patients n'ayant jamais été traités par des inhibiteurs de la protéase et 59% (16/27) des patients prétraités par des inhibiteurs de la protéase ont atteint un ARN VIH-1 plasmatique <400 copies/ml (ITT(E), TLOVR) (voir tableau ci-dessous).
Ces données ont été confirmées par l'étude support APV20003, dans laquelle cependant un schéma posologique non autorisé, avec 1 prise par jour, a été utilisé.
APV29005: Aperçu des répondeurs avec un ARN VIH-1 plasmatique < 400 copies/ml et < 50 copies/ml dans la population ITT (E) (TLVR)
|
Groupe d'âge
|
Moment de l'étude
|
Évolution des répondeurs
ARN VIH-1 plasmatique
< 400 copies/ml
|
Évolution des répondeurs
ARN VIH-1 plasmatique
< 50 copies/ml
| |
6 – 11 ans (N=25)
|
Début de l'étude
|
0 / 25
|
0 / 25
| |
|
Semaine 2
|
3 / 25 (12%)
|
0 / 25
| |
|
Semaine 4
|
7 / 25 (28%)
|
0 / 25
| |
|
Semaine 8
|
10 / 25 (40%)
|
2 / 25 (8%)
| |
|
Semaine 12
|
12 / 25 (48%)
|
6 / 25 (24%)
| |
|
Semaine 16
|
12 / 25 (48%)
|
9 / 25 (36%)
| |
|
Semaine 24
|
14 / 25 (56%)
|
11 / 25 (44%)
| |
|
Semaine 36
|
14 / 25 (56%)
|
11 / 25 (44%)
| |
|
Semaine 48
|
14 / 25 (56%)
|
11 / 25 (44%)
| |
12 – 18 ans (N=29)
|
Début de l'étude
|
0 / 29
|
0 / 29
| |
|
Semaine 2
|
4 / 29 (14%)
|
0 / 29
| |
|
Semaine 4
|
13 / 29 (45%)
|
4 / 29 (14%)
| |
|
Semaine 8
|
20 / 29 (69%)
|
6 / 29 (21%)
| |
|
Semaine 12
|
24 / 29 (83%)
|
9 / 29 (31%)
| |
|
Semaine 16
|
24 / 29 (83%)
|
11 / 29 (38%)
| |
|
Semaine 24
|
24 / 29 (83%)
|
13 / 29 (45%)
| |
|
Semaine 36
|
23 / 29 (79%)
|
18 / 29 (62%)
| |
|
Semaine 48
|
21 / 29 (72%)
|
20 / 29 (69%)
|
PharmacocinétiqueAprès administration orale, le fosamprénavir est rapidement et quasi intégralement hydrolysé en amprénavir et en un phosphate anorganique avant d'atteindre la circulation systémique. La transformation du fosamprénavir en amprénavir semble intervenir surtout dans l'épithélium intestinal.
Après administration concomitante de fosamprénavir et de ritonavir, les propriétés pharmacocinétiques de l'amprénavir ont été évaluées chez les volontaires sains et chez les patients infectés par le VIH. Aucune différence significative n'a été observée entre ces deux groupes.
Absorption
Le pic des concentrations plasmatiques d'amprénavir est atteint environ 2 heures après administration unique de fosamprénavir. Les valeurs de l'ASC du fosamprénavir représentent généralement moins de 1% par rapport à celles observées avec l'amprénavir. Chez l'homme, la biodisponibilité absolue du fosamprénavir n'a pas été établie.
Après administration orale répétée de doses équivalentes de fosamprénavir et d'amprénavir, les valeurs de l'ASC de l'amprénavir se sont révélées similaires. Toutefois, après administration de fosamprénavir, les valeurs de Cmax ont été d'environ 30% inférieures et celles de la Cmin d'environ 28% supérieures.
Après administration orale répétée de fosamprénavir (700 mg deux fois par jour) et de ritonavir (100 mg deux fois par jour), l'amprénavir a été rapidement absorbé avec une Cmax plasmatique moyenne d'amprénavir à l'état d'équilibre de 6,08 µg/ml (IC à 95% [5,38-6,86]), atteinte approximativement 1,5 heure (Tmax) après administration (moyenne géométrique (IC à 95%). La Cmin (trough) plasmatique de l'amprénavir à l'état d'équilibre a été de 2,12 µg/ml (1,77 à 2,54) en moyenne géométrique, l'ASC0-τ étant de 39,6 h•µg/ml (34,5 à 45,3).
Dans une étude comparative réalisée chez des sujets, le fosamprénavir (FPV) (700 mg 2 fois par jour sur 14 jours), administré avec ou sans ritonavir (RTV), a été comparé à l'amprénavir (APV) (600 mg 2 fois par jour), avec ou sans ritonavir (100 mg 2 fois par jour). Cela a permis d'établir les courbes suivantes des taux plasmatiques d'amprénavir, représentant tant la relation entre l'amprénavir et le fosamprénavir que l'effet obtenu par l'administration supplémentaire du ritonavir:
APV10022: concentrations plasmatiques moyennes de l'amprénavir
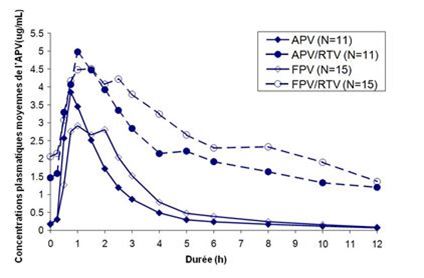
L'administration de fosamprénavir sous forme de comprimés avec un repas riche en graisses (repas riche en graisses standard: 967 kcal, 67 grammes de lipides, 33 grammes de protéines, 58 grammes de glucides) n'a pas modifié les paramètres pharmacocinétiques (Cmax ou ASC) de l'amprénavir comparée à la prise à jeun de cette forme galénique. La prise des comprimés avec un repas riche en graisses a entraîné une augmentation significative du t½ (+29,6%) et du tmax (32,6%). Les comprimés pelliculés de Telzir peuvent être pris pendant ou en dehors des repas.
La prise d'amprénavir conjointement avec du jus de pamplemousse n'a pas été associée à des modifications significatives des paramètres pharmacocinétiques de l'amprénavir.
Distribution
Après administration de Telzir, le volume apparent de distribution de l'amprénavir est d'environ 430 litres (6 l/kg pour un poids corporel de 70 kg), laissant supposer un large volume de distribution avec une libre pénétration de l'amprénavir dans les tissus à partir de la circulation systémique. Cette valeur est diminuée d'environ 40% lorsque Telzir est coadministré avec le ritonavir, probablement en raison d'une augmentation de la biodisponibilité de l'amprénavir.
Dans les études in vitro, la liaison de l'amprénavir aux protéines est d'environ 90%. L'amprénavir est lié à l'alpha-1 glycoprotéine acide (AAG) et à l'albumine, avec une plus grande affinité pour l'AAG. Une diminution des concentrations d'AAG a été observée au cours du traitement antirétroviral. Cette modification entraîne une diminution de la concentration plasmatique totale du principe actif. Toutefois, la quantité d'amprénavir libre, qui représente la fraction active, n'est vraisemblablement pas modifiée.
Chez l'homme, la pénétration de l'amprénavir dans le liquide céphalorachidien est négligeable. Il semble que l'amprénavir pénètre dans le sperme, bien que les concentrations y soient inférieures aux concentrations sanguines.
Métabolisme
Après administration orale, le fosamprénavir est rapidement et quasi intégralement hydrolysé en amprénavir et phosphate anorganique au fur et à mesure de son absorption à travers l'épithélium intestinal. L'amprénavir est essentiellement métabolisé par le foie, moins de 1% étant éliminé sous forme inchangée dans les urines. L'amprénavir est métabolisé principalement par le cytochrome P450 3A4. Le métabolisme de l'amprénavir est inhibé par le ritonavir, inhibition intervenant par le CYP3A4 et provoquant une augmentation des concentrations plasmatiques de l'amprénavir. De plus, l'amprénavir est également un inhibiteur de l'enzyme CYP3A4, bien que cette activité soit moins importante que celle du ritonavir. Par conséquent, les médicaments inducteurs, inhibiteurs ou substrats du CYP3A4 doivent être utilisés avec prudence en cas de coadministration avec Telzir / ritonavir (voir «Contre-indications» et «Interactions»).
Élimination
Après administration de Telzir, la demi-vie d'élimination de l'amprénavir est de 7,7 heures. Lorsque Telzir est administré conjointement avec le ritonavir, la demi-vie d'élimination de l'amprénavir augmente, atteignant 15 à 23 heures.
L'élimination de l'amprénavir intervient principalement par le métabolisme hépatique, avec moins de 1% du principe actif excrété sous forme inchangée dans les urines et aucune présence d'amprénavir décelable dans les fèces. Environ 14% de la dose administrée d'amprénavir sont éliminés sous forme de métabolites dans les urines et 75% dans les fèces.
Cinétique pour certains groupes de patients
Troubles de la fonction hépatique
Le fosamprénavir est une prodrogue qui est transformée en amprénavir actif chez l'être humain. Le métabolisme hépatique constitue la principale voie d'élimination de l'amprénavir et du ritonavir.
La pharmacocinétique plasmatique de l'amprénavir a été évaluée dans une étude chez des patients adultes infectés par le VIH et atteints d'une insuffisance hépatique (Child Pugh A, B et C) et a été comparée à celles de patients témoins infectés par le VIH et présentant une fonction hépatique normale. Les patients ont reçu un traitement associant le fosamprénavir et le ritonavir pendant 2 semaines; chez les patients insuffisants hépatiques, la dose de ritonavir a été réduite à 100 mg une fois par jour.
Les patients atteints d'une insuffisance hépatique légère ont présenté, par rapport aux patients ayant un foie sain, une augmentation de la Cmax de 17%, une augmentation de l'ASC(0-τ) de 22%, ainsi que des concentrations minimales comparables.
Les patients atteints d'une insuffisance hépatique modérée ont présenté, par rapport aux patients ayant une fonction hépatique normale, une augmentation de l'ASC de 70% et des concentrations minimales également comparables.
Chez les patients ayant une insuffisance hépatique sévère (score de Child-Pugh de 10-13), l'administration d'une dose réduite de fosamprénavir de 300 mg deux fois par jour, associée à 100 mg de ritonavir une fois par jour, a entraîné une diminution de 19% de la Cmax plasmatique d'amprénavir, une diminution de 23% de l'ASC(0-τ) et une diminution de 38% de la Cτ, mais une Cτ d'amprénavir plasmatique libre similaire à celle observée chez les patients ayant une fonction hépatique normale et recevant le schéma posologique standard de 700 mg de fosamprénavir / 100 mg de ritonavir deux fois par jour. Chez les patients ayant une insuffisance hépatique sévère, malgré l'ajustement de la posologie du ritonavir, la Cmax du ritonavir, la concentration plasmatique moyenne (Cavg) et la Cτ du ritonavir ont été augmentées de 64%, 40% et 38% respectivement par rapport aux valeurs attendues chez les patients ayant une fonction hépatique normale et recevant le schéma posologique standard de 700 mg de fosamprénavir / 100 mg de ritonavir deux fois par jour.
Troubles de la fonction rénale
Les patients atteints de troubles de la fonction rénale n'ont pas fait l'objet d'études spécifiques. Moins de 1% de la dose thérapeutique d'amprénavir administrée est éliminé sous forme inchangée dans les urines. La clairance rénale du ritonavir est également négligeable. L'influence des troubles de la fonction rénale sur l'élimination de l'amprénavir et du ritonavir devrait donc être minimale.
Patients âgés
La pharmacocinétique du fosamprénavir en association avec le ritonavir n'a pas été étudiée chez les patients âgés de plus de 65 ans.
Enfants et adolescents:
Dans une étude clinique étudiant la pharmacocinétique du fosamprénavir chez des enfants et adolescents infectés par le VIH, huit sujets âgés de 12 à 18 ans ont reçu la dose adulte standard de fosamprénavir comprimé, 700 mg deux fois par jour (associé au ritonavir à la dose de 100 mg deux fois par jour). Comparé aux données historiques obtenues chez les adultes ayant reçu le fosamprénavir/ritonavir à la dose de 700/100 mg deux fois par jour, les sujets âgés de 12 à 18 ans avaient une ASC(0-24) plasmatique d'amprénavir inférieure de 20%, une Cmax inférieure de 23% et une Cmin inférieure de 20%. Les enfants âgés de 6 à 11 ans (n=9) recevant le fosamprénavir/ritonavir à la dose de 18/3 mg/kg deux fois par jour avaient une ASC(0-24) supérieure de 26% et une Cmax et une Cmin similaires comparé aux données historiques obtenues chez les adultes ayant reçu le fosamprénavir/ritonavir à la dose de 700/100 mg deux fois par jour.
L'étude APV20002 est une étude de phase II de 48 semaines, en ouvert, destinée à évaluer la pharmacocinétique, la sécurité d'emploi, la tolérance et l'activité antivirale du fosamprénavir avec ou sans ritonavir chez des enfants âgés de 4 semaines à moins de 2 ans. Comparé aux données historiques obtenues chez les adultes ayant reçu le fosamprénavir/ritonavir à la dose de 700/100 mg deux fois par jour, il a été observé dans un sous-groupe de 5 sujets âgés de 6 mois à moins de 24 mois recevant le fosamprénavir/ritonavir à la dose de 45/7 mg/kg deux fois par jour que malgré une augmentation d'un facteur 5 environ des doses de fosamprénavir et de ritonavir sur la base d'une posologie en mg/kg, l'ASC(0-τ) plasmatique du fosamprénavir était inférieure d'environ 48%, la Cmax de 26% et la Cτ de 29% chez les enfants. Aucune recommandation de posologie ne peut être faite chez les enfants de moins de 2 ans et Telzir en association avec le ritonavir est déconseillé dans cette population (voir «Posologie/Mode d'emploi»).
Grossesse
La pharmacocinétique de l'amprénavir (APV) a été évaluée chez des femmes enceintes traitées par FPV/RTV 700/100 mg deux fois par jour pendant le deuxième trimestre (n=6) ou le troisième trimestre (n=9) de la grossesse et pendant le post-partum. L'exposition à l'APV a été inférieure de 25-35% pendant la grossesse. Les moyennes géométriques de l'APV (IC à 95%) et les taux de Cmin étaient de 1,31 (0,97; 1,77) pour le deuxième trimestre, de 1,34 (0,95; 1,89) pour le troisième trimestre et de 2,03 (1,46; 2,83) μg/ml pour le post-partum. Ces valeurs étaient situées dans la plage des valeurs observées chez les patientes non enceintes recevant différents schémas thérapeutiques contenant FPV/RTV. Un passage transplacentaire faible à modéré a été observé. Cette conclusion a reposé sur le ratio des moyennes par moindres carrés (IC à 95%) de la concentration sanguine de l'APV dans le cordon ombilical du fœtus sur la concentration dans le plasma maternel périphérique de 0,27 (0,24; 0,30).
Données précliniquesLa toxicité du fosamprénavir s'est révélée similaire à celle de l'amprénavir et est apparue pour des expositions plasmatiques à l'amprénavir inférieures à celles atteintes chez l'homme après traitement par l'association fosamprénavir/ritonavir aux doses recommandées.
Dans les études de toxicité à des doses répétées, administrées à des rats et des chiens adultes, le fosamprénavir a provoqué des troubles gastro-intestinaux (salivation, vomissements et selles molles à liquides) et des troubles hépatiques (augmentation du poids du foie, élévation de l'activité des enzymes hépatiques sériques et altérations microscopiques, incluant une nécrose hépatocytaire).
Par ailleurs, une forte dépendance de l'absorption du fosamprénavir au pH a été observée chez le chien. Une diminution du pH gastrique s'est traduite par une biodisponibilité nettement plus importante après administration orale.
Mutagénicité
Une batterie standard de tests réalisés in vitro et in vivo n'a pas révélé d'activité mutagène ou génotoxique du fosamprénavir. Ces essais comprenaient notamment des tests de mutation inverse bactérienne (Ames), des tests du lymphome de souris, des tests de micronoyaux chez le rat et des tests d'aberrations chromosomiques sur lymphocytes humains.
Carcinogénicité
Dans le cadre d'études de carcinogénicité à long terme, le fosamprénavir a été administré par voie orale pendant une durée allant jusqu'à 104 semaines à une posologie de 250, 400 ou 600 mg/kg PC/jour à des souris et à une posologie de 300, 825 ou 2250 mg/kg PC/jour à des rats. Les expositions atteintes à ces dosages ont correspondu à 0,1 à 0,3 fois (chez la souris) ou à 0,3 à 0,7 fois (chez le rat) l'exposition humaine à une dose quotidienne de 1400 mg de fosamprénavir et de 200 mg de ritonavir. Il en a résulté une augmentation de la fréquence des adénomes et des carcinomes hépatocellulaires à toutes les posologies chez les souris mâles et une augmentation de la fréquence des adénomes hépatocellulaires et des carcinomes folliculaires de la thyroïde à toutes les posologies chez le rat mâle et aux posologies de 825 et 2250 mg/kg PC/jour chez le rat femelle. La portée des résultats hépatocellulaires chez les rongeurs est incertaine pour l'être humain. Cependant, il ne ressort aucun élément des études cliniques ou des rapports d'expérience plaidant en faveur d'une significativité clinique de ces résultats. Dans les études avec administration répétée de fosamprénavir chez le rat, les effets ont ressemblé à ceux d'une induction enzymatique entraînant une prédisposition aux néoplasmes thyroïdiens chez le rat, mais non chez l'être humain. Par ailleurs, les autres effets également constatés seulement chez le rat ont été une hyperplasie cellulaire interstitielle aux posologies de 825 et 2250 mg/kg PC/jour et des adénocarcinomes de l'endomètre utérin à une posologie de 2250 mg/kg PC/jour. L'incidence des résultats positifs dans l'endomètre a été faiblement supérieure à celle chez les contrôles, mais a été dans la fourchette normale pour les rats femelles. La portée des résultats sur les adénocarcinomes de l'endomètre utérin chez le rat est incertaine, mais il ne ressort des études cliniques ou les rapports d'expérience aucun élément plaidant en faveur d'une significativité clinique de ces résultats.
Toxicité sur la reproduction
Au cours des études de toxicité sur la reproduction, réalisées avec le fosamprénavir chez le rat, la fertilité des mâles n'a pas été affectée. Cependant, chez les femelles gravides, une diminution du poids de l'utérus, du nombre de corps jaunes ovariens et des sites d'implantation utérins a été observée. Chez les rates et les lapines gravides, aucun effet majeur n'a été observé sur le développement embryo-fœtal. Toutefois, le nombre d'avortements a été augmenté. Chez le lapin, l'exposition systémique après l'administration d'une dose élevée s'est révélée être seulement 0,3 fois supérieure à celle retrouvée chez l'homme après l'administration de la dose clinique maximale. La toxicité de l'amprénavir sur le développement n'a, par conséquent, pas pu être totalement déterminée. Chez les rats exposés au fosamprénavir avant et après la naissance, des anomalies du développement physique et fonctionnel ainsi qu'une diminution de la croissance ont été observées chez les jeunes rats. Le taux de survie des jeunes rats a été diminué. De plus, une diminution du nombre de sites d'implantation par portée et une augmentation de la durée de gestation ont été observées lorsque les jeunes rats ont été accouplés une fois leur maturité atteinte.
Remarques particulièresStabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques particulières concernant le stockage
Conserver le récipient bien fermé, au-dessous de 30°C et hors de portée des enfants.
Numéro d’autorisation56'707 (Swissmedic)
PrésentationComprimés pelliculés à 700 mg: flacon de 60 comprimés, A
Titulaire de l’autorisationViiV Healthcare GmbH, 3053 Münchenbuchsee
Mise à jour de l’informationJuillet 2023
|

