CompositionPrincipe actif: mémantine sous forme de chlorhydrate de mémantine.
Excipients
Solution
Conserv.: sorbate de potassium (E202); sorbitol, eau distillée.
Forme galénique et quantité de principe actif par unitéSolution
1 g de solution contient 10 mg de chlorhydrate de mémantine (correspondant à 8,31 mg de mémantine). Chaque activation de la pompe doseuse permet de délivrer 0,5 ml (0,5 g) de solution contenant 5 mg de chlorhydrate de mémantine, soit 4,16 mg de mémantine.
Indications/Possibilités d’emploiTraitement symptomatique des patients atteints d'une forme modérée à sévère de la maladie d'Alzheimer (Mini-Mental State Examination (MMSE) valeurs comprises entre 3 et 19 inclus).
Posologie/Mode d’emploiLe traitement doit être initié et supervisé par un médecin expérimenté dans le diagnostic et le traitement de la maladie d'Alzheimer au stade démentiel. La disponibilité d'un auxiliaire de soins, chargé de surveiller la prise du médicament par le patient, doit être assurée avant de pouvoir commencer le traitement. Le diagnostic doit être établi selon les critères en vigueur.
Adultes
La dose quotidienne maximale est de 20 mg (2 ml de solution, ce qui correspond à quatre activations de la pompe doseuse) par jour. Pour réduire le risque d'effets indésirables, la dose d'entretien est atteinte par une progression posologique de 5 mg (0,5 ml de solution, soit une activation de la pompe doseuse) par semaine au cours des trois premières semaines de traitement.
Titration de la dose
Semaine 1 (jour 1 à 7): 0,5 ml de solution, soit une activation de la pompe doseuse, par jour.
Semaine 2 (jour 8 à 14): 1 ml de solution, soit deux activations de la pompe doseuse, par jour.
Semaine 3 (jour 15 à 21): 1,5 ml de solution, soit trois activations de la pompe doseuse, par jour.
Semaine 4 (jour 22 à 28): 2 ml de solution, soit quatre activations de la pompe doseuse, par jour.

Dose d'entretien
À partir de la quatrième semaine, le traitement peut être poursuivi à la dose d'entretien recommandée de 20 mg par jour (2 ml de solution, soit quatre activations de la pompe doseuse par jour).
La solution peut être prise pendant ou en dehors des repas.
Personnes âgées
Sur la base des études cliniques, la dose recommandée pour les patients de plus de 65 ans est de 20 mg (2 ml de solution, soit quatre activations de la pompe doseuse) par jour, comme décrit ci-dessus.
Enfants et adolescents de moins de 18 ans
Axura n'est pas destiné à une utilisation chez l'enfant et l'adolescent de moins de 18 ans compte tenu de l'absence de données concernant la sécurité et l'efficacité chez cette population.
Insuffisance rénale
Aucune adaptation de la dose n'est nécessaire chez les patients présentant une fonction rénale légèrement diminuée (clairance de la créatinine de 50 à 80 ml/min). Chez les patients présentant une insuffisance rénale modérée (clairance de la créatinine de 30 à 49 ml/min), la dose quotidienne doit être de 10 mg (1 ml de solution, soit deux activations de la pompe doseuse). En cas de bonne tolérance pendant au moins 7 jours, il est possible d'augmenter la dose à 20 mg (2 ml de solution, soit quatre activations de la pompe doseuse) par jour selon le schéma de titration standard. Chez les patients présentant une insuffisance rénale sévère (clairance de la créatinine de 5 à 29 ml/min), la dose doit être de 10 mg (1 ml de solution, soit deux activations de la pompe doseuse) par jour.
Insuffisance hépatique
Aucune adaptation de la dose n'est nécessaire chez les patients présentant une insuffisance hépatique légère à modérée (Child-Pugh A et Child-Pugh B). Aucune donnée relative à l'utilisation de la mémantine chez les patients présentant une insuffisance hépatique sévère n'est disponible.
L'utilisation d'Axura n'est pas recommandée en cas d'insuffisance hépatique sévère.
Contre-indications·Hypersensibilité au principe actif ou à l'un des excipients.
·Prise concomitante de produits contenant du dextrométhorphane, un antagoniste du N-méthyl-D-aspartate (NMDA) intégré dans de nombre produits contre la toux.
Mises en garde et précautionsSur la base de considérations pharmacologiques et compte tenu de rapports de cas isolés, une prudence particulière est recommandée chez les patients épileptiques, les patients ayant des antécédents de convulsions ou chez les patients présentant des facteurs de risque d'épilepsie.
L'association aux antagonistes du N-méthyl-D-aspartate (NMDA) tels que l'amantadine ou la kétamine doit être évitée. En effet, ces composés agissent au niveau des mêmes récepteurs que la mémantine et par conséquent, les effets indésirables (essentiellement liés au système nerveux central) peuvent être plus fréquents ou plus prononcés (voir aussi «Interactions»).
Certains facteurs susceptibles d'augmenter le pH de l'urine (voir aussi «Pharmacocinétique») peuvent exiger une surveillance plus étroite du patient, car un pH urinaire alcalin diminue l'élimination de la mémantine. Ces facteurs incluent des modifications radicales du régime alimentaire, p.ex. le passage d'un régime carnivore à un régime végétarien, ou l'ingestion massive de médicaments neutralisant l'acide gastrique. De plus, le pH de l'urine peut également augmenter lors d'une acidose tubulaire rénale (ATR) ou d'une infection sévère des voies urinaires due à des bactéries de l'espèce Proteus.
Dans la majorité des essais cliniques, les patients avec infarctus du myocarde récent, insuffisance cardiaque congestive non compensée (NYHA III-IV) ou hypertension artérielle non contrôlée étaient exclus. Par conséquent, les données disponibles sont limitées et les patients présentant ces pathologies doivent être étroitement surveillés.
Aucune étude d'interaction pharmacocinétique n'est disponible et les données sur la sécurité lors de l'association de la mémantine à des neuroleptiques, benzodiazépines et antidépresseurs sont limitées. Il faut donc tenir compte d'éventuelles interactions.
InteractionsÉtant donné les effets pharmacologiques et le mode d'action de la mémantine, les interactions suivantes sont possibles:
·Les effets de la L-dopa, des agonistes dopaminergiques et des anticholinergiques sont susceptibles d'être augmentés lors d'un traitement associé avec des antagonistes NMDA tels que la mémantine. Les effets des barbituriques et des neuroleptiques peuvent quant à eux être diminués. L'association de mémantine au dantrolène ou baclofène, des agents antispastiques, peut modifier les effets de ces deux médicaments, rendant éventuellement un ajustement posologique nécessaire.
·L'association de mémantine et d'amantadine doit être évitée en raison du risque de psychose pharmacotoxique. Les deux composés sont des antagonistes NMDA chimiquement proches. Cela concerne peut-être aussi la kétamine et le dextrométhorphane (voir «Mises en garde et précautions» et «Contre-indications»). Un rapport de cas publié fait aussi état du risque potentiel de psychose pharmacotoxique lors de l'association de mémantine et de phénytoïne.
·Une interaction est également possible entre la mémantine et d'autres médicaments tels que cimétidine, ranitidine, procaïnamide, quinidine, quinine et nicotine qui utilisent le même système de transport cationique rénal que l'amantadine, conduisant ainsi à une augmentation potentielle des taux plasmatiques.
·Les taux sériques d'hydrochlorothiazide (HCT) peuvent être diminués lorsque la mémantine est administrée avec l'HCT ou toute association en contenant.
Dans des études pharmacocinétiques portant sur une prise unique chez des sujets jeunes et en bonne santé, aucune interaction significative entre la mémantine et le glibenclamide/la metformine ou le donépézil n'a été observée. Dans une étude clinique portant sur des sujets jeunes et en bonne santé, aucun effet significatif de la mémantine sur la pharmacocinétique de la galantamine n'a été observé.
·Depuis la commercialisation d'Axura, des cas isolés d'augmentation de l'INR ont été rapportés chez des patients traités simultanément par la warfarine. Bien qu'aucun lien de causalité n'ait pu être établi, une surveillance étroite du taux de prothrombine ou de l'INR est recommandée chez les patients traités simultanément par des anticoagulants oraux.
Lors d'études in vitro, la mémantine n'a pas inhibé les CYP 1A2, 2A6, 2C9, 2D6, 2E1, 3A ni la monooxygénase à flavine, l'hydrolase époxyde ou la sulfatation.
Grossesse/AllaitementGrossesse
Aucune donnée clinique sur l'administration de mémantine durant la grossesse n'est disponible. L'expérimentation animale indique un potentiel de réduction de la croissance intra-utérine à des niveaux d'exposition identiques ou légèrement supérieurs à l'exposition humaine (voir aussi «Données précliniques»). Le risque potentiel pour l'être humain demeure inconnu. La mémantine ne doit pas être utilisée durant la grossesse, sauf en cas de nécessité absolue.
Allaitement:
On ignore si la mémantine est excrétée dans le lait maternel humain. Toutefois, étant donné la lipophilie de la substance, le passage est probable. Les femmes qui prennent de la mémantine doivent s'abstenir d'allaiter.
Effet sur l’aptitude à la conduite et l’utilisation de machinesLa maladie d'Alzheimer modérée à sévère altère généralement l'aptitude à conduire des véhicules et à utiliser des machines. De plus, la mémantine pouvant modifier les facultés de réaction, il convient d'inviter les patients ambulatoires à prendre des précautions particulières avant de conduire un véhicule ou d'utiliser une machine.
Effets indésirablesDans des essais cliniques menés chez des patients atteints de démence légère à sévère et dont 1784 ont reçu de la mémantine et 1595 un placebo, la fréquence globale des effets indésirables sous mémantine n'a pas différée de celle observée sous placebo. Les effets indésirables étaient en général d'intensité légère à modérée. Les effets indésirables les plus fréquents avec une incidence supérieure dans le groupe sous mémantine par rapport au groupe sous placebo étaient les suivants: vertiges (6,3% contre 5,6%), céphalées (5,2% contre 3,9%), constipation (4,6% contre 2,6%), somnolence (3,4% contre 2,2%) et hypertension (4,1% contre 2,8%).
Les effets indésirables présentés ci-après ont été relevés au cours d'études cliniques et depuis la commercialisation de la mémantine.
Au sein de chaque groupe de fréquence, les effets indésirables sont présentés suivant un ordre décroissant de gravité.
Les effets indésirables sont répertoriés par classes de systèmes organiques en appliquant les conventions suivantes:
très fréquent (≥1/10), fréquent (≥1/100, <1/10), occasionnel (≥1/1'000, <1/100), rare (≥1/10'000, <1/1'000), très rare (<1/10'000, y compris les cas isolés), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Infections
Occasionnel: infections fongiques.
Troubles psychiatriques
Fréquent: somnolence.
Occasionnel: confusion, hallucinations (les hallucinations ont été observées principalement chez des patients atteints de la maladie d'Alzheimer à un stade avancé).
Fréquence inconnue: réactions psychotiques*.
La maladie d'Alzheimer est associée à des cas de dépression, de pensées suicidaires et de suicide. Depuis la commercialisation, de tels événements ont été rapportés chez des patients sous Axura.
Système immunitaire
Fréquent: réactions d'hypersensibilité au médicament.
Troubles du système nerveux
Fréquent: vertiges, troubles de l'équilibre.
Occasionnel: trouble de la marche.
Très rare: convulsions.
Troubles cardiaques
Occasionnel: insuffisance cardiaque.
Troubles vasculaires
Fréquent: hypertension artérielle.
Occasionnel: thrombose veineuse/thromboembolie.
Troubles respiratoires
Fréquent: dyspnée.
Troubles gastro-intestinaux
Fréquent: constipation.
Occasionnel: vomissements.
Fréquence inconnue: pancréatite*.
Troubles hépatobiliaires
Occasionnel: élévation des tests de la fonction hépatique.
Fréquence inconnue: hépatite*.
Troubles généraux
Fréquent: céphalées.
Occasionnel: fatigue.
* Rapports de cas isolés depuis la commercialisation.
SurdosageLes données concernant le surdosage au cours des essais cliniques et du suivi de pharmacovigilance après commercialisation sont limitées.
Symptômes: Des surdosages relativement importants (200 mg et 105 mg/jour pendant 3 jours, respectivement) ont été associés soit aux seuls symptômes de fatigue, faiblesse et/ou diarrhée, soit à l'absence de symptômes.
Dans les cas de surdosages inférieurs à 140 mg ou dont la dose est inconnue, les patients ont présenté des troubles du système nerveux central (confusion, sensation ébrieuse, somnolence, vertige, agitation, agressivité, hallucination et troubles de la marche) et/ou des troubles gastro-intestinaux (vomissements et diarrhées).
Dans le cas le plus extrême de surdosage, le patient a survécu à la prise orale totale de 2000 mg de mémantine et présenté des troubles du système nerveux central (10 jours de coma suivis d'une diplopie et d'une agitation). Le patient a reçu un traitement symptomatique et des plasmaphérèses. Il a guéri sans séquelles permanentes.
Dans un autre cas de surdosage important, le patient a également survécu et guéri. Ce patient avait reçu 400 mg de mémantine par voie orale et a présenté des troubles du système nerveux central tels qu'hyperactivité motrice, psychose, hallucinations visuelles, abaissement du seuil convulsif, somnolence, stupeur et perte de connaissance.
Traitement: En cas de surdosage, le traitement doit être symptomatique. Aucun antidote spécifique en cas d'intoxication ou de surdosage n'est disponible. Des moyens de prise en charge habituels pour éliminer le principe actif tels que lavage gastrique, charbon activé (interruption d'un potentiel cycle entéro-hépatique), acidification des urines, diurèse forcée doivent être utilisés en fonction des besoins.
En cas de signes et de symptômes d'hyperstimulation générale du système nerveux central (SNC), un traitement symptomatique sous étroite surveillance doit être envisagé.
Aucune donnée concernant la dialyse n'est disponible.
Propriétés/EffetsCode ATC: N06DX01
Pharmacodynamie
La preuve est de plus en plus établie que le dysfonctionnement de la neurotransmission glutamatergique, en particulier au niveau des récepteurs NMDA, contribue à la fois à l'expression des symptômes et à la progression de la maladie dans la démence neurodégénérative.
La mémantine est un antagoniste voltage-dépendant non compétitif des récepteurs NMDA d'affinité modérée. La mémantine module les effets de taux toniques élevés pathologiques de glutamate qui pourraient aboutir à un dysfonctionnement neuronal.
Efficacité clinique
Définition des abréviations utilisées
ADAS-cog = Alzheimer Disease Assessment Scale (pour l'évaluation des fonctions cognitives).
ADCS-ADLsev = Alzheimer's Disease Cooperative Study – Activities of Daily Living (pour les activités quotidiennes).
CIBIC-plus = Clinician's Interview Based Impression of Change (pour l'impression clinique globale).
LOCF = Last Observation Carried Forward (la dernière observation reportée).
MMSE = Mini-Mental-Status-Examination (score total du mini-mental test).
SIB = Severe Impairment Battery (pour la cognition).
Études en monothérapie
Un total de 252 patients ambulatoires ont étés inclus dans l'étude pivotale en monothérapie menée chez des patients atteints d'une forme modérée à sévère de la maladie d'Alzheimer (scores totaux MMSE de 3 à 14 au début de l'étude). L'étude a montré les effets bénéfiques d'un traitement par mémantine comparé au placebo après une période de traitement de 6 mois (analyse des cas observés pour CIBIC-plus: p= 0,025; ADCS-ADLsev: p= 0,003; SIB: p= 0,002).
Un total de 403 patients ont été inclus dans l'étude pivotale en monothérapie visant à évaluer la mémantine pour le traitement des patients atteints d'une forme légère à modérée de la maladie d'Alzheimer (scores totaux MMSE de 10 à 22 au début de l'étude). Comparés aux patients sous placebo, les patients traités par de la mémantine ont montré, de manière statistiquement significative, un effet supérieur sur les paramètres primaires ADAS-cog (p= 0,003) et CIBIC-plus (p= 0,004) à semaine 24 (LOCF). Dans une autre étude en monothérapie de la maladie d'Alzheimer de forme légère à modérée, un total de 470 patients ont été randomisés (score total MMSE de 11 à 23 au début de l'étude). L'analyse primaire définie de façon prospective n'a pas mis en évidence de différence significative entre la mémantine et le placebo concernant le critère primaire d'efficacité à la semaine 24.
Une méta-analyse des patients atteints d'une forme modérée à sévère de la maladie d'Alzheimer (score total MMSE <20) à partir de six études de phase III, contrôlées par placebo sur une durée de six mois (y compris les études sur la mémantine en monothérapie et les études chez des patients recevant une dose stable d'un inhibiteur de l'acétylcholinestérase) a montré un effet statistiquement significatif en faveur du traitement avec mémantine dans les domaines cognitif, global et fonctionnel.
Chez les patients, dont le cours de la maladie s'est aggravé simultanément dans les trois domaines, la mémantine a contribué de manière statistiquement significative à prévenir l'aggravation: deux fois plus de patients sous placebo ont présenté une aggravation dans l'ensemble des trois domaines par rapport aux patients traités par la mémantine (21% vs 11%, p <0,0001).
Études avec le donépézil
Lors d'une autre étude contrôlée par placebo menée pendant 6 mois chez des patients atteints d'une forme modérée à sévère de la maladie d'Alzheimer, l'adjonction de la mémantine à un traitement préexistant par donépézil a apporté un avantage significatif.
Dans cette étude de phase III avec groupes parallèles, en double aveugle et contrôlée par placebo, 403 patients présentant une forme modérée à sévère de la maladie d'Alzheimer ont reçu pendant 6 mois soit 20 mg par jour de mémantine soit un placebo en plus d'un traitement par donépézil. Le critère d'inclusion était un traitement préexistant par donépézil à une posologie stable pendant au moins 6 mois. Les critères primaires d'efficacité incluaient la cognition (SIB) ainsi qu'une évaluation fonctionnelle (ADCS-ADLsev), résultats selon l'analyse LOCF (last observation carried forward). L'évaluation globale a été faite à partir du CIBIC-plus.
Après les 6 mois définissant la durée du traitement, l'association mémantine+donépézil a fait preuve d'une supériorité statistiquement significative par rapport à l'association placebo+donépézil sur les critères primaires d'efficacité SIB et ADCS-ADLsev, ainsi que sur le CIBIC-plus: analyse LOCF (last observation carried forward) pour SIB: p <0,001; ADCS-ADLsev: p= 0,028; CIBIC-plus: p= 0,027. Résultats selon l'analyse OC (observed cases) pour SIB: p <0,001; ADCS-ADLsev: p= 0,020; CIBIC-plus: p= 0,028.
PharmacocinétiqueAbsorption
La mémantine présente une biodisponibilité absolue d'environ 100%. Le Tmax se situe entre 3 et 8 heures. Rien n'indique que la prise de nourriture influence sur l'absorption de la mémantine,
Linéarité
Les études chez des volontaires ont montré une pharmacocinétique linéaire dans l'intervalle de dose allant de 10 à 40 mg.
Distribution
Des doses quotidiennes de 20 mg conduisent à des concentrations plasmatiques de mémantine à l'état d'équilibre comprises entre 70 et 150 ng/ml (0,5 à 1 µmol) avec d'importantes variations interindividuelles. Avec des doses quotidiennes de 5 à 30 mg, le rapport moyen entre le liquide céphalo-rachidien et le sérum se situe à 0,52. Le volume de distribution s'élève à environ 10 l/kg. Environ 45% de la mémantine est liée aux protéines plasmatiques.
Métabolisme
Chez l'homme, environ 80% des produits apparentés à la mémantine sont présents dans le sang sous forme inchangée. Les principaux métabolites chez l'homme sont le N-3,5-diméthyl-gludantan, le mélange isomère de 4- et 6-hydroxy-mémantine, ainsi que le 1-nitroso-3,5-diméthyl-adamantane. Aucun de ces métabolites ne présente d'activité antagoniste NMDA. Aucun métabolisme catalysé par le cytochrome P 450 n'a été détecté dans les études in vitro.
Dans une étude avec administration par voie orale de mémantine marquée au 14C, 84% de la dose en moyenne a été retrouvée dans les 20 jours, dont plus de 99% par excrétion rénale.
Élimination
La mémantine est éliminée de manière monoexponentielle avec un t½ terminal de 60 à 100 heures. Chez les volontaires présentant une fonction rénale normale, la clairance totale (Cltot) s'élève à 170 ml/min/1,73 m2. Une partie de la clairance rénale totale se fait par sécrétion tubulaire.
Une réabsorption tubulaire a également lieu dans le rein, probablement par l'intermédiaire des protéines assurant le transport des cations.
Le taux d'élimination rénale de la mémantine peut être réduit par un facteur de 7 à 9 dans l'urine alcaline (voir aussi «Mises en garde et précautions»). L'alcalinisation de l'urine peut résulter de modifications radicales du régime alimentaire, p.ex. du passage d'un régime carnivore à un régime végétarien, ou de l'ingestion massive de médicaments neutralisant l'acide gastrique.
Cinétique pour certains groupes de patients
Chez les volontaires âgés présentant une fonction rénale normale ou réduite (clairance de la créatinine comprise entre 50-100 ml/min/1,73 m2), une corrélation significative a été observée entre la clairance de la créatinine et la clairance rénale totale de la mémantine (voir aussi «Posologie/Mode d'emploi»).
Relation pharmacocinétique/pharmacodynamique
Après l'administration quotidienne de 20 mg de mémantine, le taux dans le liquide céphalo-rachidien (LCR) correspond à la valeur ki de la mémantine (ki = constante d'inhibition pour la liaison au récepteur NMDA) et s'élève à 0,5 µmol dans le cortex frontal humain.
Données précliniquesLes études à court terme chez le rat ont montré que la mémantine, comme les autres antagonistes NMDA, induit une vacuolisation et une nécrose du tissu nerveux (lésions d'Olney), toutefois uniquement à des doses aboutissant à des pics sériques très élevés. Une ataxie et d'autres signes précliniques ont précédé la vacuolisation et la nécrose. Ces effets n'ont pas été observés dans les études au long cours menées chez les rongeurs, ni chez d'autres animaux. La pertinence clinique de ces observations est inconnue.
Des modifications oculaires ont été observées de manière inconstante (soit sans persistance dans toutes les études) lors d'études de toxicité à doses répétées chez les rongeurs et le chien, mais pas chez le singe. Les examens ophtalmologiques spécifiques réalisés durant les études cliniques sur la mémantine n'ont révélé aucune modification oculaire.
Un trouble de l'équilibre des phospholipides dans les macrophages pulmonaires causé par l'accumulation de mémantine dans les lysosomes a été observé chez les rongeurs. Cet effet est connu pour d'autres médicaments dotés de propriétés amphiphiles cationiques. Il existe vraisemblablement un lien entre cette accumulation et la vacuolisation observée dans les poumons. Cet effet a été observé uniquement à de fortes doses chez les rongeurs. La pertinence clinique de ces observations est inconnue.
Aucune génotoxicité n'a été observée suite aux études standards de la mémantine. Aucun signe d'un effet carcinogène ne s'est manifesté dans les études au long cours chez la souris et le rat. La mémantine ne s'est pas avérée tératogène chez le rat et le lapin, même à des doses toxiques pour l'animal mère. De plus, aucun effet indésirable de la mémantine sur la fertilité n'a été observé. Chez le rat, un retard de la croissance du fœtus a été constaté à des niveaux d'exposition identiques ou légèrement supérieurs à ceux atteints chez l'homme après une administration thérapeutique.
Remarques particulièresInfluence sur les méthodes de diagnostic
Aucune influence de la mémantine sur les méthodes de diagnostic n'est connue.
Conservation
Solution: Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage. Après ouverture, le contenu du flacon doit être utilisé dans un délai de 3 mois.
Remarques concernant le stockage
Tenir hors de la portée des enfants.
Solution
Conserver dans l'emballage original, à une température ne dépassant pas 30 °C.
Conserver et transporter le flacon, avec la pompe doseuse fixée, uniquement en position verticale.
Remarques concernant la manipulation
Solution: Avant la première utilisation, la pompe doseuse doit être vissée sur le flacon.
Pour enlever le bouchon à vis du flacon, il convient de le tourner dans le sens inverse des aiguilles d'une montre et de le dévisser complètement.
Fig. 1
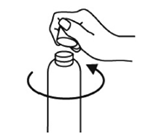
Mise en place de la pompe doseuse sur le flacon:
La pompe doseuse doit être extraite de son emballage plastique (Fig. 2) puis positionnée sur le flacon en y glissant avec précaution le tube en plastique creux. La pompe doseuse doit ensuite être maintenue sur l'encolure du flacon et vissée dans le sens des aiguilles d'une montre, jusqu'à ce qu'elle soit fermement fixée (Fig. 3). Conformément à l'emploi qui en est prévu, la pompe doseuse doit être vissée une fois seulement en début d'utilisation et ne plus être dévissée par la suite.
Fig. 2

Fig. 3

Utilisation de la pompe doseuse pour doser:
La tête de la pompe doseuse a deux positions et peut être facilement tournée soit dans le sens de la flèche (sens inverse des aiguilles d'une montre - position déverrouillée), soit dans le sens inverse de la flèche (sens des aiguilles d'une montre - position verrouillée). La tête de la pompe doseuse ne doit pas être pressée vers le bas en position verrouillée. La solution ne peut être délivrée qu'en position déverrouillée. À cet effet, il faut tourner la tête de la pompe doseuse d'environ un huitième de tour dans le sens de la flèche, jusqu'à sentir une résistance (Fig. 4).
Fig. 4

La pompe doseuse est ainsi prête à l'emploi.
Préparation de la pompe doseuse:
Lors de la première utilisation, le tube de la pompe renferme encore de l'air, raison pour laquelle la pompe doseuse ne délivre pas la quantité correcte de solution buvable. Pour y remédier, il convient d'amorcer la pompe doseuse en actionnant complètement sa tête vers le bas cinq fois de suite, jusqu'à ce que de la solution apparaisse visiblement (Fig. 5).
Fig. 5

La solution ainsi délivrée doit être jetée. À la prochaine pression complète de la tête de la pompe doseuse vers le bas (ce qui équivaut à une activation de la pompe), la dose adéquate est alors dispensée (1 pression sur la pompe est équivalente à 0,5 ml de solution buvable et contient 5 mg de chlorhydrate de mémantine, la substance active, Fig. 6).
Fig. 6

Utilisation correcte de la pompe doseuse:
Le flacon doit être placé sur une surface horizontale plane, p.ex. sur une table, et ne doit être utilisé qu'en position verticale. Placer un verre avec un peu d'eau ou une cuillère sous le bec verseur de la pompe et presser la tête de la pompe doseuse vers le bas, d'un mouvement ferme, mais calme et continu (pas trop lentement), jusqu'à la butée (Fig. 7 et Fig. 8).
Fig. 7
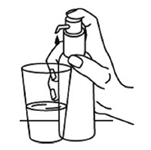
Fig. 8
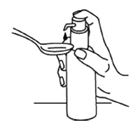
La tête de la pompe doseuse peut ensuite être relâchée et la pompe est alors prête pour la prochaine pression.
La pompe doseuse ne doit être utilisée qu'avec la solution de chlorhydrate de mémantine contenue dans le flacon fourni et n'est pas destinée à un usage avec d'autres substances ou d'autres flacons. Si au cours de son utilisation, la pompe doseuse ne fonctionne pas comme décrit dans les présentes instructions, le patient doit consulter son médecin traitant ou un pharmacien. La pompe doseuse doit être verrouillée après utilisation (en tournant la tête de la pompe dans le sens inverse de la flèche).
Numéro d’autorisation56926 (Swissmedic).
PrésentationSolution:
Flacon en verre marron (classe hydrolytique III) fournis avec une pompe doseuse et contenant 100 g de solution buvable. [B]
Titulaire de l’autorisationMerz Pharma (Suisse) SA, 4123 Allschwil.
Mise à jour de l’informationOctobre 2015.
|









