CompositionPrincipes actifs
Insulinum Glulisinum DCI (3BLys-29BGlu-humanum insulinum analogum, GT), 100 Unités/ml.
Excipients
(Quantité par 1 ml) Trometamolum, Natrii chloridum, Polysorbatum 20 (E432), Metacresolum 3,15 mg, Aqua q.s. ad solutionem pro 1 ml, Natrii hydroxidum (E524), Acidum hydrochloridum (E507). Certains de ces excipients contiennent du sodium, quantité totale de sodium: 1,97 mg/ml.
L'insuline glulisine est un analogue de l'insuline, obtenue par génie génétique, au moyen d'Escherichia coli.
Indications/Possibilités d’emploiDiabète sucré chez les adultes, les adolescents et enfants âgés de 4 ans et plus lorsqu'une thérapie à base d'insuline est nécessaire.
Posologie/Mode d’emploiApidra est un analogue recombinant de l'insuline, équipotent à l'insuline humaine soluble. Apidra possède un délai d'action plus rapide et une durée d'action plus courte que l'insuline humaine soluble.
Afin d'assurer la traçabilité des médicaments biotechnologiques, il convient de documenter pour chaque traitement le nom commercial et le numéro de lot.
Posologie usuelle
Apidra doit être injecté un peu avant (0 à 15 min.) ou immédiatement après le repas.
La posologie d'Apidra doit être déterminée individuellement.Patients présentant des troubles de la fonction hépatique
Les troubles hépatiques peuvent réduire les besoins en insuline du patient (voir sous «Pharmacocinétique»).
Patients présentant des troubles de la fonction rénale
Les troubles rénaux peuvent réduire les besoins en insuline du patient (voir sous «Pharmacocinétique»).
Enfants et adolescents
On dispose de peu de données chez les enfants de moins de 8 ans. L'administration d'Apidra chez les enfants de moins de 4 ans n'a pas été étudiée.
Schéma d'administration
Apidra devrait être administré selon un schéma thérapeutique impliquant une insuline à plus longue durée d'action ou un analogue basal de l'insuline, ou peut être utilisé avec des antidiabétiques oraux.
Mode d'administration
Les cartouches d'Apidra conviennent uniquement aux injections sous-cutanées à partir d'un stylo réutilisable (AllStar PRO et JuniorSTAR).
Apidra SoloStar, stylo pré-rempli, convient uniquement aux injections sous-cutanées.
Si l'administration par seringue, injection intraveineuse ou pompe à perfusion est nécessaire, il faut utiliser un flacon d'Apidra.
Usage sous-cutané
Apidra est injecté par voie sous-cutanée, ou administré en perfusion sous-cutanée continue par pompe.
Injection par voie sous-cutanée
Apidra doit être administré en injection sous-cutanée dans la paroi abdominale, la cuisse, le haut du bras, ou administré par perfusion continue dans la paroi abdominale. Comme pour toutes les insulines, il convient de varier le site d'injection au sein de la zone d'injection pour chaque nouvelle injection afin de réduire ou d'éviter des risques de lipodystrophie et d'amyloïdose cutanée (voir les sections «Mises en garde et précautions» et «Effets indésirables»).
Comme pour toutes les insulines, l'absorption et par conséquent le début et la durée d'action peuvent être influencés par le site d'injection, l'exercice physique et d'autres facteurs.
Mélange avec d'autres insulines
Lorsqu'Apidra est mélangé à des insulines humaines NPH, Apidra doit être d'abord aspiré dans la seringue. Il faut procéder à l'injection immédiatement après le mélange. On ne dispose pas de données sur le mélange de l'insuline glulisine à d'autres préparations d'insuline que l'insuline humaine NPH. Apidra ne doit pas être mélangé à d'autres préparations d'insuline, à l'exception de l'insuline humaine NPH.
Perfusion sous-cutanée continue à l'aide d'une pompe
Apidra peut être administré par perfusion sous-cutanée continue d'insuline (CSII) à l'aide d'une pompe à perfusion adaptée pour la perfusion d'insuline avec les cathéters et réservoirs appropriés. Les patients qui utilisent un système CSII doivent recevoir des instructions détaillées sur l'utilisation du système de pompe.
Le set de perfusion et le réservoir utilisés avec Apidra doivent être remplacés au moins toutes les 48 heures, dans des conditions aseptiques. Ces instructions peuvent différer des instructions générales du manuel de la pompe. Il est important que les patients suivent les instructions spécifiques à Apidra lors de son utilisation. Le non-respect de ces instructions peut conduire à de graves effets indésirables. En cas d'utilisation avec une pompe à perfusion d'insuline, Apidra ne doit être ni dilué, ni mélangé à d'autres insulines.
Les patients qui utilisent Apidra au moyen d'un système CSII doivent également disposer d'un autre système de délivrance d'insuline, pour parer à une éventuelle panne de la pompe (voir «Interactions»).
Voie intraveineuse
Apidra peut également être administré par voie intraveineuse, uniquement par des professionnels de la santé.
Apidra ne doit pas être mélangé avec une solution de glucose ni une solution de Ringer ni avec toute autre insuline.
Contre-indicationsHypersensibilité vis-à-vis de la substance ou de l'un des excipients conformément à la composition.
Mises en garde et précautionsLes cartouches d'Apidra ne doivent être utilisées qu'avec les stylos réutilisables suivants:
·JuniorSTAR qui délivre Apidra par palier de 0.5 unité
·AllStar PRO qui délivre Apidra par palier de 1 unité
Les cartouches d'Apidra ne devraient pas être utilisées avec un autre stylo car la précision de dosage n'a été établie qu'avec les stylos précités.
Le passage du patient à une autre préparation d'insuline ne doit avoir lieu que sous contrôle médical strict. Lors de changement de préparation, de type ou d'espèce d'insuline (origine animale, humaine, analogue de l'insuline) et/ou de méthode de fabrication, une modification posologique pourra être requise. Une adaptation des antidiabétiques oraux administrés simultanément peut également être nécessaire.
Les patients doivent avoir pour instruction de varier constamment les sites d'injection à chaque administration afin de réduire le risque de développer une lipodystrophie et une amyloïdose cutanée. Il existe un risque potentiel de retard dans l'absorption de l'insuline et d'aggravation du contrôle de la glycémie après des injections d'insuline aux sites présentant ces réactions. Il a été signalé qu'un changement soudain du site d'injection vers une zone non touchée pouvait entraîner une hypoglycémie. Il est recommandé de surveiller la glycémie après le changement de site d'injection et d'envisager un ajustement de la dose des médicaments antidiabétiques.
Hypoglycémie
Le moment d'apparition d'une hypoglycémie dépend du profil d'action de l'insuline utilisée et peut par conséquent varier lors d'un changement du schéma thérapeutique.
Une adaptation posologique peut également s'avérer nécessaire si les patients augmentent leur activité physique ou s'ils changent leurs horaires habituels de repas. Une hypoglycémie peut apparaître plus tôt après l'administration d'Apidra qu'après l'administration d'insuline humaine soluble.
Les maladies concomitantes peuvent modifier les besoins en insuline.
Pour le diabétique traité à l'insuline, il existe en principe un risque d'hypoglycémie bénigne ou grave. Ces phénomènes se présentent en particulier au début du traitement, lors d'un changement de médicament, d'injections irrégulières, de repas irréguliers, ainsi que plus généralement lors de diabète mal ou non équilibré (fortes fluctuations de la glycémie). Le patient doit être informé de ce risque d'hypoglycémie, et que le risque est majoré lors d'une absorption d'alcool.
En outre, les patients ayant déjà été atteints d'hypoglycémie sévère présentent un risque accru de récidive.
Afin de prévenir l'hypoglycémie, il y a lieu de recommander au patient de se munir constamment de sucre de raisin, de sucre en morceaux ou équivalents. Il doit aussi porter sur lui sa carte de diabétique.
Dans certaines situations, comme notamment lors du passage de l'insuline animale à l'insuline humaine, les symptômes d'alarme de l'hypoglycémie peuvent être atténués (cf. «Effets indésirables»).
Le passage à une autre préparation insulinique ou un changement de posologie ne devrait avoir lieu que sous contrôle strict du médecin et selon ses instructions.
Les β-bloquants peuvent réduire ou masquer les symptômes d'alerte courants de l'hypoglycémie.
La consommation d'alcool peut augmenter le risque d'hypoglycémie (inhibition de la gluconéogenèse hépatique). Il convient de prendre en compte, que la teneur en hydrates de carbone des boissons alcoolisées pourrait aussi entraîner une augmentation de la glycémie.
La consommation de marijuana est susceptible de réduire la tolérance au glucose. (D'autres substances illégales n'ont pas été étudiées; autres interactions cf «Interactions»!).
Hypokaliémie
L'hypokaliémie est parmi les effets cliniques indésirables potentiels des insulinothérapies, particulièrement en cas d'administration par voie intraveineuse (par exemple traitement de l'acidocétose diabétique). Cependant l'hypokaliémie n'a pas été identifiée comme un risque de sécurité lors des études cliniques ou lors de la surveillance post-marketing d'Apidra. Cet effet clinique indésirable potentiel peut être pertinent chez les patients qui sont sous traitement avec des médicaments baissant le taux de potassium, perdant du potassium pour d'autres causes (par exemple diarrhée), ou traités pour une acidocétose diabétique.
Afin d'éviter la transmission de maladies, chaque stylo à insuline réutilisable ou prêt à l'emploi, ne doit être utilisé que par une seule personne.
Perfusion sous-cutanée continue d'insuline
Le dysfonctionnement de la pompe à insuline ou du matériel de perfusion ou bien des erreurs de manipulation peuvent rapidement entraîner une hyperglycémie, une cétose ou une acidocétose diabétique. L'identification rapide et la correction des causes de l'hyperglycémie, de la cétose ou de l'acidocétose diabétique sont nécessaires.
Des cas d'acidocétose diabétique ont été rapportés lorsqu'Apidra a été administré en perfusion sous-cutanée continue à l'aide d'une pompe. La plupart de ces cas étaient liés à des erreurs de manipulation ou à une défaillance de la pompe.
Dans ces circonstances, des injections sous-cutanées temporaires d'Apidra peuvent être nécessaires. Les patients utilisant un traitement en perfusion sous-cutanée continue d'insuline à l'aide d'une pompe doivent être formés à s'administrer de l'insuline par injection et d'avoir un autre système de délivrance d'insuline en cas de défaillance de la pompe (voir «Posologie/Mode d'emploi»).
Ce médicament contient moins de 1 mmol (23 mg) de sodium par 100 unités (1 ml), c.-à-d. qu'il est essentiellement «sans sodium».
InteractionsInteractions pharmacodynamiques
1.Le besoin en insuline peut être réduit en présence de substances qui améliorent l'efficacité de l'insuline (en augmentant la sensibilité à l'insuline), qui stimulent la sécrétion insulinique, qui inhibent la gluconéogenèse hépatique ou qui modifient l'absorption intestinale du glucose. En présence d'une quantité inchangée d'insuline, il existe de ce fait un risque accru d'hypoglycémie en cas de prise simultanée de:antidiabétiques oraux; alcool; IEC (p.ex. captopril et enalapril); antiarythmiques tels que le disopyramide; α-bloquants et clonidine; inhibiteurs de la recapture de la sérotonine; fenfluramine; IMAO; antidépresseurs tricycliques; salicylates et (rarement) autres AINS; fibrates; tétracyclines; pentamidine (hypoglycémie, parfois suivie d'une hyperglycémie); antimalariens (quinine, chloroquine, méfloquine); sulfonamides (p.ex. cotrimoxazol); cimétidine et ranitidine.
2.Le besoin en insuline peut être augmenté lors de l'utilisation des substances ou groupes de substances suivants:Contraceptifs oraux et autres composés oestrogéniques ou progestatifs; corticostéroïdes et ACTH; hormone de croissance (somatotropine); danazol; hormones thyroïdiennes; sympathicomimétiques (particulièrement les agonistes β2 tels que ritodrine, salbutamol, terbutaline, mais également certains sympathicomimétiques α-sélectifs, ainsi que non-sélectifs telle l'épinéphrine); diazoxide; acide nicotinique et ses dérivés; chlorpromazine (surtout à doses élevées) et autres dérivés de la phénothiazine; diurétiques (p.ex. diurétiques à base de thiazide, d'indapamide et de furosémide); substances antirétrovirales; substances immunosuppressives (ciclosporine, tacrolimus, sirolimus), tels que antipsychotiques atypiques (clozapine et olanzapine).
3.L'efficacité de l'insuline peut être accrue ou réduite, en fonction de la dose, lors de l'utilisation des substances suivantes:Dérivés d'octréotide, dérivés salicylés, sels de lithium (rarement).Les β-bloquants peuvent aggraver l'insulinorésistance mais aussi, dans certains cas, entraîner une hypoglycémie. Il existe en outre un risque de diminution ou de masquage des symptômes d'alerte de l'hypoglycémie.
Grossesse, allaitementGrossesse
On dispose d'un nombre limité de données sur les femmes enceintes (279 grossesses rapportées) exposées à Apidra. Ces données n'ont pas indiqué de problème de sécurité avec l'utilisation de ce médicament pendant la grossesse ou d'effets défavorables sur le fœtus ou le nouveau-né. Il n'existe cependant pas de données provenant d'études cliniques contrôlées concernant l'utilisation d'Apidra chez la femme enceinte.
L'expérimentation animale n'a mis en évidence aucune différence entre Apidra et l'insuline humaine en ce qui concerne la gestation, le développement embryonnaire/fœtal, l'accouchement ou le développement post-natal (voir sous «Données précliniques»).
Chez les patientes atteintes d'un diabète préexistant ou de diabète gestationnel, un bon contrôle métabolique durant toute la grossesse est particulièrement important. Les besoins en insuline peuvent diminuer durant le premier trimestre et augmentent généralement pendant le deuxième et le troisième trimestre. Immédiatement après l'accouchement, les besoins en insuline diminuent rapidement (risque accru d'hypoglycémie). Une surveillance étroite de la glycémie est donc particulièrement importante.
Allaitement
On ignore si Apidra est excrété dans le lait maternel. Une adaptation de la dose d'insuline et du régime alimentaire peuvent s'avérer nécessaires chez les femmes qui allaitent leur enfant.
Effet sur l’aptitude à la conduite et l’utilisation de machinesLa capacité des patients à se concentrer et à réagir peut être diminuée en cas d'hypoglycémie ou d'hyperglycémie ou, par exemple, en cas de troubles visuels. Cela peut représenter un risque dans des situations où ces facultés sont de première importance (par exemple la conduite automobile ou l'utilisation de machines).
Les patients doivent être informés des précautions à prendre afin d'éviter toute hypoglycémie pendant la conduite d'un véhicule, en particulier si les signes précurseurs d'hypoglycémie sont diminués ou absents ou si les épisodes hypoglycémiques sont fréquents. Dans de telles circonstances, la capacité à la conduite de véhicules ou à l'utilisation de machines doit être évaluée.
Effets indésirablesDes erreurs de médication ont été rapportées où d'autres insulines, en particulier des insulines à action prolongée ont été administrées accidentellement à la place de l'insuline glulisine.
Au cours des études cliniques, aucune différence cliniquement significative entre l'insuline glulisine et les substances de comparaison (insuline à courte durée d'action) en termes de fréquences totales d'effets indésirables n'a été trouvée. Les effets indésirables observés étaient connus pour cette classe de substance et sont par conséquent communs aux insulines.
Les effets indésirables sont rangés par classe de système d'organes de la classification MedDRA et par fréquence selon la convention suivante: très fréquent ≥1/10, fréquent ≥1/100 à <1/10, peu fréquent ≥1/1000 à <1/100, rare ≥1/10 000 à <1/1000, très rares <1/10 000, fréquence inconnue (ne peut être estimée sur la base des données disponibles).
|
Classes de systèmes d'organes MedDRA
|
Très fréquent
|
Fréquent
|
Peu fréquent
|
Rare
|
Fréquence inconnue
| |
Troubles du métabolisme et de la nutrition
|
Hypoglycémie
|
|
|
|
Hyperglycémie
| |
Affection de la peau et du tissu sous-cutané
|
|
Réaction au site d'injection
Réactions d'hypersensibilité locale
|
|
Lipodystrophie
|
Amyloïdose cutanée
| |
Troubles généraux et anomalies au site d'administration
|
|
|
Réactions d'hypersensibilité systémique
|
|
|
Description d'effets indésirables spécifiques et informations complémentaires
Troubles du métabolisme et de la nutrition
Hypoglycémie
Une hypoglycémie, un effet indésirable fréquent (hypoglycémie grave) ou très fréquent de toute insulinothérapie, peut survenir si les doses d'insuline sont supérieures aux besoins. Les épisodes d'hypoglycémies sévères, surtout s'ils sont répétés, peuvent entraîner des lésions neurologiques. Les épisodes d'hypoglycémie prolongée ou sévère peuvent engager le pronostic vital.
Les symptômes d'une hypoglycémie (baisse du taux de glucose sanguin au-dessous de 2-3 mmol/l) sont:
Des signes neurovégétatifs: sueurs, sensation de faim, tremblements (dits symptômes d'alarme neurovégétatifs), pâleur, palpitations, céphalées. Des signes neuroglycopéniques: troubles de la concentration, modification du comportement (entre autres agitation, nervosité, agressivité, état confusionnel), troubles de la conscience, de la coordination, de la vue et de la parole. Ceux-ci peuvent aller jusqu'à l'étourdissement, la somnolence et même la perte de connaissance. L'hypoglycémie peut aussi provoquer des crises épileptiques ou se manifester comme un ictus cérébral, accompagné p.ex. d'hémiparésie (en général passagère), d'aphasie et de signe de Babinski positif.
Signes d'alarme atténués/modifiés: Les signes d'alarme de l'hypoglycémie peuvent être modifiés et les symptômes neurovégétatifs l'accompagnant peuvent être perçus de façon atténuée ou retardée, en particulier lors de traitement visant des taux de glycémie basse (p.ex. traitement selon le principe dose basal-bolus par injections répétées), lors de diabète ancien (éventuellement accompagné de polynévrite), ou lors de changement d'insuline. Ce phénomène a également été observé par des patients lors du passage de l'insuline animale à l'insuline humaine, comme d'ailleurs lors d'autres changements de préparation.
Veuillez donc informer le diabétique traité à l'insuline et son entourage que l'hypoglycémie peut se déclarer de manière soudaine et d'abord par des signes neuroglycopéniques tels que: troubles de la concentration, agitation, troubles du comportement et de la conscience, d'où le risque de négliger de prendre du sucre à temps.
Le passage à une autre préparation insulinique ne devrait avoir lieu que sous contrôle médical strict et selon des instructions précises. De même le schéma de traitement ne doit être modifié qu'après entretien avec le médecin ou selon ses indications.
Sont à considérer entre autres comme causes de l'hypoglycémie: repas omis, vomissements, diarrhée, effort physique inhabituel, surdosage d'insuline, maladies endocriniennes telles qu'insuffisance surrénalienne, hypothyroïdie etc.
Thérapie de l'hypoglycémie: cf. «Surdosage».
Après chaque hypoglycémie grave, il convient de rééquilibrer le diabète. Par conséquent, il faut recommander au patient d'informer le médecin de chaque hypoglycémie grave subie.
Hyperglycémie
Une élévation de la glycémie, une hyperglycémie, une acidocétose et des états hyperosmolaires peuvent survenir par exemple si les doses d'insuline sont trop faibles par rapport aux apports glucidiques, si l'effet de l'insuline a diminué (p.ex. du fait de mauvaises conditions de conservation), si l'exercice physique a été réduit, si la sensibilité à l'insuline a diminué du fait d'un stress émotionnel ou physique (p.ex. à la suite d'un traumatisme, d'une intervention chirurgicale, d'infections fébriles ou d'autres pathologies), ou si des médicaments ayant un effet hyperglycémiant sont administrés conjointement (cf. «Interactions»).
Des cas d'acidocétose diabétique ont été rapportés lorsqu'Apidra a été administré en perfusion sous-cutanée continue à l'aide d'une pompe. La plupart de ces cas étaient liés à des erreurs de manipulation ou à une défaillance de la pompe.
Dans ces circonstances, des injections sous-cutanées temporaires d'Apidra peuvent être nécessaires. Les patients utilisant un traitement par perfusion sous-cutanée continue d'insuline à l'aide d'une pompe doivent être formés à l'administration par injection de l'insuline et avoir un autre système de délivrance d'insuline à disposition en cas de défaillance de la pompe (voir «Mises en garde et précautions»).
Les signes et symptômes d'un déséquilibre métabolique hyperglycémique sont: soif, polyurie, glycosurie, acétonurie, fatigue, sécheresse cutanée, érythème facial, anorexie, hypotension artérielle et tachycardie. Une acidocétose doit toujours être évoquée, surtout en cas de symptômes tels que vomissements, douleurs abdominales, respiration rapide et profonde, somnolence et coma. Une hyperglycémie sévère ou une acidocétose peut devenir alarmante au point de menacer le pronostic vital. Selon la disponibilité de l'insuline, l'acidocétose peut se développer en quelques heures ou quelques jours. Dès l'identification des signes et symptômes potentiels d'une hyperglycémie ou acidocétose, la glycémie et l'acétonurie doivent être mesurées et, si nécessaire, le traitement mis en route sans délai.
Affections de la peau et du tissu sous-cutané
Comme pour les autres insulinothérapies, des réactions allergiques locales peuvent se manifester fréquemment au niveau du site d'injection sous la forme de rougeurs, de gonflements et/ou de démangeaisons. Ces légères réactions régressent généralement en l'espace de quelques jours ou semaines. Elles peuvent être associées à d'autres facteurs que l'insuline, p.ex. des irritations provoquées par des produits pour le nettoyage de la peau ou une mauvaise technique d'injection.
Comme pour toute insulinothérapie, une lipodystrophie et une amyloïdose cutanée peuvent occasionnellement survenir au niveau du site d'injection retardant l'absorption d'insuline. Le fait de changer constamment le site d'injection entre chaque injection peut contribuer à réduire ou éviter ces réactions (voir les sections «Posologie/Mode d'emploi» et «Mises en garde et précautions»).
Troubles généraux et anomalies au site d'administration
Les réactions allergiques systémiques sont moins fréquentes, mais potentiellement plus graves, comme les allergies généralisées à l'insuline, pouvant s'accompagner de réactions cutanées (y compris prurit) sur l'ensemble du corps, un souffle court, une respiration sifflante, une chute de la pression artérielle, une accélération du pouls ou une transpiration. Les cas graves d'allergies généralisées, y compris de réactions anaphylactiques, peuvent menacer le pronostic vital.
Anticorps
Lors d'une étude avec des diabétiques du type 1 (n=333), la concentration des anticorps anti-insuline capables d'une réaction croisée (anticorps réagissant aussi bien avec l'insuline humaine qu'avec l'insuline glulisine) restait proche de la valeur initiale durant les six premiers mois chez les patients traités à l'insuline glulisine. Durant les six mois d'après, une baisse de la concentration d'anticorps a été observée. Au cours d'une étude avec des diabétiques du type 2 (n=411), une hausse comparable de la concentration des anticorps anti-insuline à réaction croisée a été observée durant les neuf premiers mois chez les patients traités à l'insuline glulisine et chez les patients traités à l'insuline humaine. Ensuite, la concentration d'anticorps a baissé chez les patients traités à l'insuline glulisine et est restée inchangée chez les patients sous l'insuline humaine. Aucune corrélation entre la concentration des anticorps anti-insuline à réaction croisée et les modifications du taux de HbA1c, de la dose d'insuline ou de la fréquence des hypoglycémies n'a été notée.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageIl n'existe pas de définition spécifique d'un surdosage d'insuline, étant donné que la concentration sérique de glucose résulte d'une interaction complexe entre le taux d'insuline, la disponibilité du glucose et d'autres processus métaboliques. Les hypoglycémies peuvent apparaître lorsque l'activité de l'insuline est trop élevée par rapport à l'absorption de nourriture et à la dépense d'énergie.
Signes et symptômes
Les signes et symptômes d'une hypoglycémie sont décrits dans «Description de certains effets indésirables – Hypoglycémie».
Traitement
Les surdosages d'insuline doivent être traités comme suit:
Les épisodes légers à modérés d'hypoglycémie peuvent normalement être compensés par l'administration orale de glucides. Une adaptation de la dose des médicaments, des habitudes alimentaires et de l'activité physique peut être nécessaire.
Les épisodes hypoglycémiques sévères avec coma, crises convulsives ou troubles neurologiques peuvent être traités par des administrations intramusculaires/sous-cutanées de glucagon ou par administration intraveineuse d'une solution concentrée de glucose. Des prises répétées de glucides et une surveillance peuvent être nécessaires, étant donné qu'une hypoglycémie peut réapparaître après une rémission clinique apparente.
Propriétés/EffetsCode ATC
A10AB06
Mécanisme d'action
Le principal effet de l'insuline et des analogues de l'insuline, y compris de l'insuline glulisine, est la régulation du métabolisme glycémique. Les insulines entraînent une baisse de la glycémie en stimulant l'absorption périphérique de glucose, en particulier par la musculature squelettique et le tissu adipeux, ainsi qu'en inhibant la gluconéogenèse dans le foie. L'insuline inhibe la lipolyse dans les cellules adipeuses, inhibe la protéolyse et augmente la synthèse protéique.
Race et genre
Au cours d'études cliniques réalisées chez des adultes, des analyses de sous-groupes n'ont montré aucune différence en termes d'innocuité et d'efficacité de l'insuline glulisine entre les différentes origines ethniques et les deux sexes.
Pharmacodynamique
L'insuline glulisine présente, lors d'une administration par voie sous-cutanée, une entrée en action plus rapide et une durée d'action plus courte que l'insuline humaine soluble.
L'effet hypoglycémiant de l'insuline glulisine intervient 10 à 20 minutes après l'injection sous-cutanée. Après administration intraveineuse, un début d'activité plus rapide et une plus courte durée d'action, ainsi qu'un pic d'activité plus intense ont été observés en comparaison à l'administration par voie sous-cutanée. Lors d'une administration intraveineuse, l'insuline glulisine et l'insuline humaine soluble sont équipotentes, c'est-à-dire qu'une unité d'insuline glulisine exerce le même effet hypoglycémiant qu'une unité internationale d'insuline humaine.
|
Chez les diabétiques du type 1, lorsque l'insuline glulisine était administrée 2 minutes avant le repas et l'insuline humaine soluble 30 minutes avant le repas, par voie sous-cutanée, à une dose de 0.15 Unités/kg (v. fig.) leurs profils hypoglycémiants étaient très similaires.
|
|
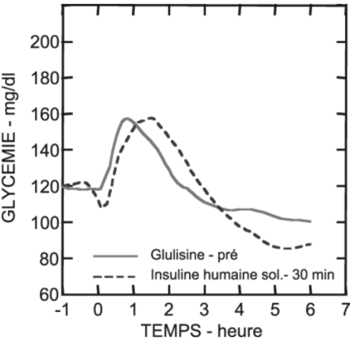
|
Efficacité clinique
Diabète de Type 1 – Adultes
Dans le cadre d'une étude clinique de phase III, de 26 semaines, l'insuline glulisine et l'insuline Lispro ont été comparées, les deux injectées par voie sous-cutanée (0 à 15 minutes) peu avant un repas, à des patients atteints de diabète sucré de type 1, utilisant l'insuline glargine à titre d'insuline basale. L'insuline glulisine était comparable à l'insuline Lispro en ce qui concerne le contrôle glycémique, ce qui se reflétait dans la modification de l'hémoglobine glycosylée (mesurée en termes de taux HbA1c) entre la valeur initiale et la valeur à la fin de l'étude. On a observé que les glycémies contrôlées par les patients étaient comparables. Contrairement à l'insuline Lispro, l'insuline glulisine n'a pas nécessité de hausse de la dose basale d'insuline.
Une étude clinique de phase III, de 12 semaines, réalisée avec des patients atteints de diabète sucré de type 1, ayant reçu l'insuline glargine sous la forme de traitement basal, indique que l'administration d'insuline glulisine postprandiale immédiate est d'une efficacité comparable à celle obtenue lors de l'administration d'insuline glulisine préprandiale immédiate (0 à 15 minutes), ou comparable à l'administration préprandiale d'insuline humaine soluble (30 à 45 minutes).
Diabète de type 1 – Pédiatrie
Une étude clinique de phase III sur 26 semaines a comparé l'insuline glulisine et l'insuline lispro, toutes deux injectées par voie sous-cutanée peu avant un repas (0-15 minutes) chez des enfants (4-5 ans: n=9; 6-7 ans: n=32; 8-11 ans: n=149) et des adolescents (12-17 ans: n=382) diabétiques de type 1 utilisant l'insuline glargine ou la NPH comme insuline basale. L'insuline glulisine s'est avérée comparable à l'inuline lispro en termes de contrôle glycémique, comme démontré par les variations de l'hémoglobine glyquée (exprimée en équivalent HbA1c) entre le début et la fin de l'étude et par les valeurs de glycémies recueillies par auto-surveillance.
Diabète sucré de type 2 – Adultes
Au cours d'une étude clinique de phase III, de 26 semaines, ayant été suivie d'une étude de prolongation portant sur la sécurité/l'innocuité durant 26 semaines, de l'insuline glulisine injectée par voie sous-cutanée (0 à 15 minutes avant un repas) a été comparée à l'insuline humaine soluble (30 à 45 minutes avant un repas) chez des patients atteints de diabète sucré de type 2, utilisant en plus de l'insuline NPH à titre d'insuline basale. L'indice de masse corporelle (IMC) des patients s'élevait à 34,55 kg/m2. En ce qui concerne la modification de la valeur HbA1c entre la valeur de début de l'étude et après six mois (–0,46% pour l'insuline glulisine et 0,3% pour l'insuline humaine soluble, p=0,0029) ainsi qu'entre entre la valeur de début de l'étude et après 12 mois (–0,23% pour l'insuline glulisine et –0,13% pour l'insuline humaine soluble, différence non significative), l'insuline glulisine et l'insuline humaine soluble étaient comparables. Dans le cadre de cette étude, la majorité des patients (79%) mélangeait leur insuline d'action rapide avec de l'insuline NPH immédiatement avant l'injection et 58% des patients utilisaient, au moment de la randomisation, des médicaments hypoglycémiants oraux. On a demandé aux patients de maintenir la même posologie.
PharmacocinétiqueAbsorption
Pour l'insuline glulisine, une absorption plus rapide a été obtenue grâce au remplacement de l'acide aminé asparagine par la lysine en position B3 et de la lysine par l'acide glutamique en position B29.
|
Le profil pharmacocinétique chez des personnes saines et des diabétiques (type 1 et type 2) a montré qu'après l'administration de 0.15 Unités/kg, l'absorption d'insuline glulisine est deux fois plus rapide que l'absorption de l'insuline humaine soluble et sa concentration maximale est également deux fois plus élevée. Sous l'insuline glulisine, la Tmax était de 55 min. et la Cmax de 82 μUnités/ml, et sous l'insuline humaine soluble, la Tmax était de 82 min. et la Cmax était de 46 μUnités/ml (voir fig.).
|
|
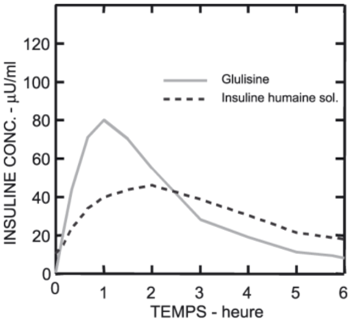
|
Après administration sous-cutanée d'insuline glulisine dans diverses régions du corps, les profils pharmacocinétiques étaient similaires, avec une absorption légèrement plus rapide dans la paroi abdominale que dans le haut du bras ou la cuisse.
La biodisponibilité absolue de l'insuline glulisine après injection sous-cutanée est de 70% environ, indépendamment du site d'injection (paroi abdominale 73%, haut du bras 71%, cuisse 69%).
Distribution
L'administration en bolus intraveineux de l'insuline glulisine aboutit à une plus forte exposition systémique en comparaison à l'injection sous-cutanée, avec un Cmax plus élevé d'environ 40 fois.
La distribution et l'élimination de l'insuline glulisine et de l'insuline humaine soluble après administration intraveineuse sont similaires; les volumes de distribution s'élèvent à 13 l pour l'insuline glulisine et à 22 l pour l'insuline humaine soluble, et les demi-vies sont respectivement de 13 min. et 18 min.
Métabolisme
Pas de données disponibles.
Élimination
Après administration sous-cutanée, l'insuline glulisine est éliminée plus rapidement que l'insuline humaine soluble et les demi-vies sont respectivement de 42 min et 86 min.
Cinétique pour certains groupes de patients
Troubles de la fonction hépatique
Aucune étude clinique n'a été réalisée chez des patients atteints d'insuffisance hépatique. En raison de la diminution de la capacité à réaliser la gluconéogenèse et de la diminution du métabolisme insulinique, les besoins en insuline peuvent être diminués chez les patients présentant une insuffisance hépatique.
Troubles de la fonction rénale
Au cours d'une étude clinique réalisée avec des patients non diabétiques, ayant couvert une large fourchette de la fonction rénale (CrCl >80 ml/min., 30-50 ml/min., <30 ml/min.), les propriétés d'action rapide de l'insuline glulisine se sont généralement maintenues. Chez les patients atteints d'une insuffisance rénale modérée ou sévère, la clairance de l'insuline glulisine était inférieure à celle observée chez des sujets sains. Les besoins en insuline peuvent être diminués lors d'insuffisance rénale.
Obésité
L'entrée en action plus rapide et la durée d'action plus courte de l'insuline glulisine et de l'insuline Lispro par rapport à l'insuline humaine soluble s'est également maintenue chez les non-diabétiques obèses. L'entrée en action rapide s'est mieux maintenue avec l'insuline glulisine qu'avec l'insuline Lispro.
Enfants et adolescents
Les propriétés pharmacocinétiques et pharmacodynamiques de l'insuline glulisine par rapport à l'insuline humaine soluble, administrée par voie sc. 2 min. avant le repas, ont été examinées chez 10 enfants (7 à 11 ans) et 10 adolescents (12 à 16 ans). Dans les deux sous-groupes pédiatriques, l'insuline glulisine a permis une absorption plus rapide, une durée de séjour plus courte dans la circulation sanguine et une meilleure baisse du taux de glucose que l'insuline humaine soluble.
Données précliniquesLes données précliniques n'ont pas démontré de résultats de toxicité, à l'exception de ceux associés à l'activité pharmacodynamique hypoglycémiante (hypoglycémie), et n'étaient pas différents de ceux pour l'insuline humaine soluble.
Remarques particulièresTenir hors de la portée des enfants.
Incompatibilités
Usage sous-cutané
On ne dispose d'aucune donnée sur la possibilité de mélanger l'insuline glulisine à d'autres préparations d'insuline, à l'exception de l'insuline NPH.
Lorsqu' Apidra est administré à l'aide d'une pompe à insuline, il ne peut pas être perfusé en même temps qu'un autre produit.
Usage intraveineux
Apidra est incompatible avec les solutions de glucose 5% et de Ringer et, par conséquent, ne doit pas être utilisé avec ces solutions. L'utilisation d'autres solutions n'a pas été étudiée.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Durée de conservation pour l'administration intraveineuse
L'insuline glulisine pour l'administration intraveineuse à une concentration de 1 unité/ml est stable à température ambiante pendant 48 heures.
Stabilité après ouverture
Une fois entamés, les flacons, les cartouches et les stylos prêt à l'emploi peuvent être utilisés pendant 4 semaines. C'est pourquoi Il est recommandé de noter sur l'étiquette du flacon, de la cartouche ou du stylo prêt à l'emploi, la date de la première utilisation.
Remarques particulières concernant le stockage
·Avant ouverture, conserver les flacons, cartouches et stylos prêts à l'emploi d'Apidra dans l'emballage d'origine, au réfrigérateur (2-8°C), et s'assurer que le récipient n'entre pas en contact direct avec le compartiment à glace ou les éléments réfrigérants. Ne pas congeler! Conserver dans leur emballage d'origine de manière à protéger le contenu de la lumière.
·Après ouverture, les récipients peuvent être conservés à température ambiante (15-25°C) ne dépassant pas 25°C, au maximum pendant 4 semaines. Ensuite il faut les jeter. Conserver dans l'emballage d'origine à l'abri de la lumière, mais ne plus les replacer au réfrigérateur et ne pas les congeler.
Remarques concernant la manipulation
Usage sous-cutané
Examinez Apidra avant emploi. Ne l'utilisez que si la solution est limpide et incolore et qu'elle ne contient pas de particules visibles. Comme Apidra est une solution, elle ne doit pas être agitée ou mélangée avant.
Avant l'emploi du SoloStar ou du stylo d'insuline réutilisable, les remarques concernant la manipulation, inscrites sur la notice d'emballage, doivent être lues avec attention. Les appareils d'injection doivent être utilisés conformément aux remarques sur la manipulation.
Apidra SoloStar permet de doser l'insuline à des paliers de 1 Unités jusqu'à une dose unique maximale de 80 Unités.
Le SoloStar doivent être tenu à température ambiante (15-25°C) pendant 1 à 2 heures avant le premier emploi. Les bulles d'air présentes dans la cartouche doivent être éliminées avant l'injection. Le mode d'emploi du SoloStar doit être suivi scrupuleusement. Les SoloStars vides ne doivent pas être réutilisés et doivent être éliminés conformément aux prescriptions.
Les cartouches sont destinées à être utilisées avec les stylos à insuline réutilisables (AllStar PRO et JuniorSTAR). Avant de placer la cartouche dans le stylo réutilisable, elle doit être tenue à température ambiante (15-25°C) pendant 1-2 heures. Les bulles d'air doivent être éliminées de la cartouche avant l'injection (voir le mode d'emploi du stylo). Le mode d'emploi du stylo doit être suivi scrupuleusement. Si le stylo est endommagé ou ne fonctionne pas parfaitement (suite à un défaut mécanique), ce-dernier doit être jeté et un nouveau stylo doit être utilisé. Les cartouches vides ne doivent pas être remplies à nouveau.
Usage intraveineux
En perfusion intraveineuse, Apidra doit être utilisé à une concentration de 1 unité/ml d'insuline glulisine dans une solution pour perfusion de chlorure de sodium à 9 mg/ml (0,9%), avec ou sans 40 mmol/l de chlorure de potassium, en utilisant des poches plastiques pour perfusion obtenues par coextrusion de polyoléfine/polyamide et disposant d'un tuyau pour perfusion. La solution d'insuline glulisine pour utilisation intraveineuse, à une concentration de 1 unité/ml, est stable à température ambiante pendant 48 heures.
Après dilution pour usage intraveineux, il faut contrôler visuellement avant l'administration que la solution ne contienne pas de particules en suspension.
Ne jamais utiliser la solution si elle est devenue trouble ou si elle contient des particules; utilisez-la seulement si elle est limpide et incolore.
Apidra est incompatible avec les solutions de glucose 5% et de Ringer et, par conséquent, ne doit pas être utilisé avec ces solutions. L'utilisation d'autres solutions n'a pas été étudiée.
Numéro d’autorisation57013, 58056 (Swissmedic).
PrésentationCartouches à 3 ml pour stylos d'insuline réutilisables AllStar PRO et JuniorSTAR: 5 (B)
Flacons à 10 ml: 1 (B)
SoloStar (stylo prêt à l'emploi) à 3 ml: 5 (B)
Titulaire de l’autorisationsanofi-aventis (suisse) sa, 1214 Vernier/GE.
Mise à jour de l’informationSeptembre 2022
|


