CompositionPrincipes actifs
Eplerenonum.
Excipients
Comprimé pelliculé à 25 mg d'éplérénone: lactosum monohydricum (35.7 mg), cellulosum microcristallinum, carmellosum natricum (corresp. 0.8 mg natrium), hypromellosum, natrii laurilsulfas (corresp. 0.07 mg natrium), talcum, magnesii stearas, titanii dioxidum, macrogolum 400, polysorbatum 80, ferrum oxydatum flavum, ferrum oxydatum rubrum.
Teneur en sodium par comprimé pelliculé: 0.87 mg.
Comprimé pelliculé à 50 mg d'éplérénone: lactosum monohydricum (71.4 mg), cellulosum microcristallinum, carmellosum natricum (corresp. 1.59 mg natrium), hypromellosum, natrii laurilsulfas (corresp. 0.14 mg natrium), talcum, magnesii stearas, titanii dioxidum, macrogolum 400, polysorbatum 80, ferrum oxydatum flavum, ferrum oxydatum rubrum.
Teneur en sodium par comprimé pelliculé: 1.73 mg.
Indications/Possibilités d’emploiL'éplérénone est indiquée:
·en complément à un traitement standard incluant des bêtabloquants, pour réduire le risque de mortalité et de morbidité cardiovasculaires chez le patient stable présentant une dysfonction ventriculaire gauche (FEVG ≤40%) et des signes cliniques d'insuffisance cardiaque après un infarctus du myocarde récent;
·en complément à un traitement standard optimal pour réduire le risque de mortalité et de morbidité d'origine cardiovasculaire chez le patient atteint d'insuffisance cardiaque (chronique) de classe II selon la NYHA et de dysfonction ventriculaire gauche systolique (FEVG ≤30%) (voir «Propriétés/Effets»).
Posologie/Mode d’emploiL'éplérénone peut être prise indépendamment des repas. Les doses de 25 mg et 50 mg sont disponibles pour adapter la posologie individuelle. Il convient de prendre une dose par jour. La dose maximale journalière est de 25 mg ou 50 mg (voir «Instructions posologiques particulières»).
Posologie usuelle
Un traitement par éplérénone ne doit pas être instauré chez les patients présentant une kaliémie supérieure à 5.0 mmol/l ou un TFGe (taux de filtration glomérulaire estimé) <30 ml/min/1.73 m2 (voir «Contre-indications»).
La kaliémie doit être mesurée avant l'initiation du traitement par éplérénone, pendant la première semaine de traitement, le premier mois après le début du traitement ainsi qu'après chaque ajustement de la posologie. Par la suite, la kaliémie sera contrôlée périodiquement selon les besoins. Cela s'applique surtout aux patients âgés, aux patients diabétiques et aux patients présentant une altération de la fonction rénale.
La posologie de l'éplérénone doit être toujours vérifiée en fonction du potassium sérique (voir Tableau 1).
Posologie usuelle chez les patients présentant un TFGe ≥50 ml/min/1.73 m2
Les patients atteints d'une insuffisance cardiaque de classe II selon la NYHA ainsi que les patients atteints d'une insuffisance cardiaque après un infarctus du myocarde qui présentent un potassium sérique ≤5 mmol/l doivent recevoir une dose initiale de 25 mg, administrée 1x par jour. En fonction du potassium sérique (voir Tableau 1), la dose doit être augmentée à la dose cible de 50 mg, administrée 1x par jour, dans les 4 semaines suivant le début du traitement.
La dose maximale chez ces patients est de 50 mg/jour.
Chez les patients qui ont présenté un infarctus du myocarde, le traitement doit être instauré 3 à 14 jours après l'événement.
Instructions posologiques particulières
Patients présentant des troubles de la fonction hépatique
Aucune adaptation de la posologie initiale n'est nécessaire chez les patients présentant une insuffisance hépatique légère à modérée. Cependant, en raison d'une exposition systémique plus importante à l'éplérénone chez les patients ayant une insuffisance hépatique légère à modérée, un contrôle fréquent et régulier de la kaliémie est recommandé, en particulier chez le patient âgé (voir «Mises en garde et précautions»).
L'utilisation de l'éplérénone est contre-indiquée chez les patients présentant une insuffisance hépatique sévère (Child-Pugh C) (voir «Contre-indications»).
Tableau 1: Adaptations posologiques après le début du traitement
|
Kaliémie (mmol/l)
|
Modification de la posologie
|
Adaptation posologique
| |
<5.0
|
Augmentation
|
Passer de la pause thérapeutique à 25 mg tous les 2 jours.
Passer de 25 mg tous les 2 jours à 25 mg 1x par jour.
Passer de 25 mg une fois par jour à 50 mg 1x par jour sauf chez:
les patients présentant un TFGe compris entre 30 et 49 ml/min/1.73 m2
les patients prenant un inhibiteur faible à modéré du CYP3A4.
| |
5.0-5.4
|
Maintien
|
Pas d'adaptation posologique.
| |
5.5-5.9
|
Diminution
|
Passer de 50 mg 1x par jour à 25 mg 1x par jour.
Passer de 25 mg 1x par jour à 25 mg tous les 2 jours.
Passer de 25 mg tous les 2 jours à une pause thérapeutique.
| |
≥6.0
|
Pause thérapeutique
|
Recommencer par 25 mg tous les 2 jours dès que le potassium est <5.0 mmol/l.
|
Patients présentant des troubles de la fonction rénale
Patients atteints d'une insuffisance rénale modérée (TFGe compris entre 30 et 49 ml/min/1.73 m2)
Les patients atteints d'une insuffisance cardiaque de classe II selon la NYHA qui présentent un potassium sérique ≤5 mmol/l doivent recevoir une dose initiale de 25 mg tous les 2 jours. Celle-ci doit être augmentée à la dose cible de 25 mg/jour dans les 4 semaines suivant le début du traitement en fonction du potassium sérique (voir le Tableau 1). La dose maximale est de 25 mg/jour.
On ne dispose d'aucune expérience chez les patients atteints d'une insuffisance cardiaque après un infarctus du myocarde et présentant une clairance de la créatinine <50 ml/min. La prudence est recommandée lors de l'utilisation de l'éplérénone chez ces patients.
Patients atteints d'une insuffisance rénale sévère (TFGe <30 ml/min/1.73 m2)
L'utilisation de l'éplérénone est contre-indiquée chez ces patients.
L'éplérénone n'est pas dialysable.
Patients âgés
Dans l'étude EMPHASIS-HF, n=330 patients de ≥75 ans ont été traités par l'éplérénone. La dose thérapeutique y a été adaptée à la fonction rénale (voir «Propriétés/Effets»). Les patients âgés ont présenté un risque accru d'hyperkaliémie en comparaison des patients plus jeunes. Un contrôle particulièrement régulier du potassium sérique est recommandé.
Enfants et adolescents
Aucune donnée n'est disponible sur l'utilisation de l'éplérénone chez les enfants et les adolescents de moins de 18 ans. En conséquence, l'utilisation dans ce groupe de patients n'est pas recommandée.
Patients recevant des inhibiteurs du CYP3A4
La dose maximale d'éplérénone est de 25 mg/jour chez les patients recevant simultanément des inhibiteurs faibles à modérés du CYP3A4.
La prise concomitante d'inhibiteurs forts du CYP3A4 et d'éplérénone est contre-indiquée (voir «Contre-indications»).
Contre-indications·Hypersensibilité à l'éplérénone ou à l'un des excipients conformément à la composition.
·Tous les patients présentant une kaliémie >5.0 mmol/l avant l'instauration du traitement.
·Tous les patients présentant une insuffisance rénale sévère (TFGe <30 ml/min/1.73 m²).
·Tous les patients présentant une insuffisance hépatique sévère (Classe Child-Pugh C).
·Tous les patients recevant des diurétiques d'épargne potassique (par ex. spironolactone) ou des inhibiteurs puissants du CYP3A4 (tels que l'itraconazole, le kétoconazole, le ritonavir, le nelfinavir, la clarithromycine) (voir «Interactions»).
·Patients hypertendus traités avec des préparations/des produits de substitution au sel contenant du potassium.
·Association de l'éplérénone avec une double inhibition du système rénine-angiotensine-aldostérone existante (inhibiteur de l'ECA PLUS antagoniste des récepteurs de l'angiotensine II).
Mises en garde et précautionsHyperkaliémie
En raison du mécanisme d'action de l'éplérénone, des hyperkaliémies peuvent survenir. En conséquence, la kaliémie doit être contrôlée chez tous les patients lors de l'instauration du traitement et lors d'une adaptation posologique. De plus, un contrôle régulier est recommandé chez les patients présentant un risque accru d'hyperkaliémie (patients atteints d'insuffisance rénale, de diabète, patients âgés). Le traitement par éplérénone sera interrompu lorsque la kaliémie atteint des valeurs ≥6.0 mmol/l (voir «Posologie/Mode d'emploi»).
Le risque d'hyperkaliémie peut être augmenté si l'éplérénone est utilisée en association avec un inhibiteur de l'ECA ou un antagoniste des récepteurs de l'angiotensine. L'association d'un inhibiteur de l'ECA et d'un antagoniste des récepteurs de l'angiotensine ne doit pas être utilisée conjointement avec l'éplérénone (voir «Contre-indications» et «Interactions»).
Insuffisance rénale
Chez les patients présentant une insuffisance rénale, y compris une microalbuminurie diabétique, la kaliémie doit être contrôlée régulièrement. Après l'instauration du traitement, la dose sera ajustée en fonction de la kaliémie (voir Tableau 1 sous «Posologie/Mode d'emploi»). Le risque d'hyperkaliémie augmente avec la diminution de la fonction rénale. Les patients présentant un taux de filtration glomérulaire estimé (TFGe) <30 ml/min/1.73 m² ne doivent pas être traités par l'éplérénone. Bien que les données issues de l'étude EPHESUS sur les patients souffrant de diabète de type 2 et de microalbuminurie soient limitées, une incidence accrue de l'hyperkaliémie a été observée chez ce petit nombre de patients. C'est pourquoi ces patients seront traités avec précaution. L'éplérénone n'est pas éliminée par hémodialyse (voir «Posologie/Mode d'emploi» et «Contre-indications»).
Insuffisance hépatique
Chez des patients présentant une insuffisance hépatique légère à modérée (Child-Pugh A et B), aucune augmentation de la kaliémie au-dessus de 5.5 mmol/l n'a été observée. Un contrôle fréquent et régulier de la kaliémie est toutefois recommandé, notamment chez les patients âgés. L'utilisation de l'éplérénone n'a pas été étudiée chez les patients présentant une insuffisance hépatique sévère (Child-Pugh C) (voir «Posologie/Mode d'emploi» et «Contre-indications»).
Anti-inflammatoires non stéroïdiens (AINS)
L'administration simultanée d'autres substances d'épargne potassique et d'AINS a provoqué une baisse de l'effet antihypertenseur ainsi qu'une hyperkaliémie chez les patients présentant une insuffisance rénale (voir «Interactions»).
Inducteurs du CYP3A4
L'administration d'éplérénone avec des inducteurs puissants du CYP3A4 n'est pas recommandée (voir «Interactions»).
Autres médicaments
Le lithium, la ciclosporine et le tacrolimus doivent être évités pendant un traitement par l'éplérénone (voir «Interactions»).
Alpha-bloquants, amifostine, triméthoprime, inhibiteurs de l'ECA et antagonistes des récepteurs de l'angiotensine II (voir ci-dessus: «Hyperkaliémie»), antidépresseurs tricycliques, neuroleptiques, baclofène, glucocorticoïdes, tétracosactide (voir «Interactions»).
Excipients revêtant un intérêt particulier
Les comprimés pelliculés Inspra à 25 mg et à 50 mg contiennent du lactose monohydraté en tant qu'excipient (respectivement 35.7 et 71.4 mg par comprimé). Les patients présentant une intolérance au galactose, un déficit total en lactase ou un syndrome de malabsorption du glucose et du galactose (maladies héréditaires rares) ne devraient pas prendre ce médicament.
Les comprimés pelliculés d'Inspra à 25 mg et à 50 mg contiennent moins de 1 mmol (23 mg) de sodium par comprimé (respectivement 0.87 et 1.73 mg), c.-à-d. qu'ils sont essentiellement «sans sodium».
InteractionsInteractions pharmacocinétiques
Des études in vitro montrent que l'éplérénone n'est pas un inhibiteur des isoenzymes des CYP1A2, CYP2C19, CYP2C9, CYP2D6 ou CYP3A4. L'éplérénone n'est ni un substrat ni un inhibiteur de la glycoprotéine P.
Inhibiteurs du CYP3A4
·Inhibiteurs puissants du CYP3A4: en raison d'une interaction pharmacocinétique, l'utilisation concomitante d'éplérénone avec des inhibiteurs puissants du CYP3A4 tels que le kétoconazole, l'itraconazole, le ritonavir, le nelfinavir ou la clarithromycine est contre-indiquée (voir «Contre-indications»).
·Inhibiteurs faibles à modérés du CYP3A4: l'administration concomitante d'érythromycine, de saquinavir, d'amiodarone, de diltiazem, de vérapamil ou de fluconazole a provoqué des interactions pharmacocinétiques significatives avec une augmentation de l'ASC allant jusqu'à un facteur 2. En conséquence, la posologie de l'éplérénone ne doit pas dépasser 25 mg/jour en cas d'association à des inhibiteurs faibles à modérés du CYP3A4.
Inducteurs du CYP3A4
L'administration simultanée de millepertuis (inducteur puissant du CYP3A4) et d'éplérénone a provoqué une diminution de 30% de l'ASC de l'éplérénone. Une diminution plus importante de l'ASC de l'éplérénone peut survenir avec des inducteurs du CYP3A4 plus puissants comme la rifampicine. En raison d'un risque de diminution de l'efficacité de l'éplérénone, l'utilisation simultanée de puissants inducteurs du CYP3A4 (rifampicine, carbamazépine, phénytoïne, phénobarbital, millepertuis) et d'éplérénone n'est pas recommandée.
Substrats du CYP3A4
Les résultats d'études pharmacocinétiques avec des substrats de test du CYP3A4, tels que le midazolam et le cisapride, n'ont pas montré d'interactions pharmacocinétiques significatives lorsque ces principes actifs ont été utilisés simultanément à l'éplérénone.
Digoxine
L'ASC de la digoxine augmente de 16% (intervalle de confiance à 90%: 4-30%) en cas d'administration concomitante avec l'éplérénone. La prudence est de rigueur si le taux de digoxine est proche de la limite supérieure thérapeutique.
Warfarine
La prudence est de rigueur si le taux de warfarine se situe près de la limite supérieure thérapeutique.
Interactions pharmacodynamiques
Diurétiques d'épargne potassique, préparations/produits de substitution au sel contenant du potassium
En raison du risque accru d'hyperkaliémie, l'éplérénone ne doit être administrée à aucun patient recevant d'autres diurétiques d'épargne potassique, ni à aucun patient hypertendu recevant des préparations/produits de substitution au sel contenant du potassium (voir «Contre-indications» et «Mises en garde et précautions»). Les diurétiques d'épargne potassique peuvent aussi accentuer l'effet des médicaments antihypertenseurs et des autres diurétiques.
Inhibiteurs de l'ECA, antagonistes des récepteurs de l'angiotensine (ARA)
Le risque d'hyperkaliémie peut être augmenté si l'éplérénone est utilisée en association avec un inhibiteur de l'ECA ou un antagoniste des récepteurs de l'angiotensine. Une surveillance stricte des taux sériques de potassium et de la fonction rénale est notamment recommandée chez les patients présentant une altération préexistante de la fonction rénale. La triple association d'un inhibiteur de l'ECA et d'un antagoniste des récepteurs de l'angiotensine avec l'éplérénone ne doit pas être utilisée (voir «Contre-indications» et «Mises en garde et précautions»).
Lithium
Aucune étude d'interaction médicamenteuse n'a été conduite avec le lithium et l'éplérénone. Cependant, chez des patients recevant du lithium en même temps que des diurétiques et des inhibiteurs de l'ECA, une toxicité du lithium a été rapportée. L'administration concomitante d'éplérénone et de lithium doit être évitée. Si cette association s'avère nécessaire, les concentrations plasmatiques en lithium doivent être étroitement surveillées (voir «Mises en garde et précautions»).
Ciclosporine, Tacrolimus
La ciclosporine et le tacrolimus peuvent entraîner des troubles de la fonction rénale et majorer le risque d'hyperkaliémie. L'utilisation concomitante d'éplérénone et de ciclosporine ou de tacrolimus doit être évitée. Si l'administration de la ciclosporine et du tacrolimus s'avère indispensable durant un traitement par l'éplérénone, un contrôle étroit de la kaliémie et de la fonction rénale est recommandé (voir «Mises en garde et précautions»).
Anti-inflammatoires non stéroïdiens (AINS)
Un traitement par AINS peut entraîner une insuffisance rénale aiguë en agissant directement sur la filtration glomérulaire, en particulier chez les patients à risque (patients âgés et/ou patients déshydratés). Les patients recevant de l'éplérénone et des AINS doivent être correctement hydratés et leur fonction rénale contrôlée avant l'initiation du traitement.
Triméthoprime
L'administration concomitante de triméthoprime et d'éplérénone augmente le risque d'hyperkaliémie. Une surveillance de la kaliémie et de la fonction rénale doit être effectuée en particulier chez les patients atteints d'insuffisance rénale et chez les patients âgés.
Alpha-bloquants (par ex. alfuzosine)
L'association d'alpha-bloquants et d'éplérénone comporte le risque d'accentuer l'effet hypotenseur et/ou une hypotension orthostatique. Un contrôle clinique de l'hypotension orthostatique est recommandé lors d'un traitement concomitant par des alpha-bloquants.
Antidépresseurs tricycliques, neuroleptiques, amifostine, baclofène
Il existe un risque potentiel de majoration des effets antihypertenseurs et d'hypotension orthostatique si ces médicaments sont associés à l'éplérénone.
Glucocorticoïdes, tétracosactide
L'administration simultanée de ces médicaments et de l'éplérénone peut vraisemblablement diminuer l'effet antihypertenseur (rétention sodique et hydrique).
Grossesse, allaitementGrossesse
Les données sur l'utilisation de l'éplérénone durant la grossesse sont insuffisantes. L'éplérénone ne doit pas être administrée durant la grossesse, sauf en cas de nécessité absolue.
Allaitement
On ignore si l'éplérénone passe dans le lait maternel après administration orale. Ne pas allaiter en cas d'indication stricte pour l'utilisation de l'éplérénone.
Effet sur l’aptitude à la conduite et l’utilisation de machinesDes vertiges ou des syncopes peuvent survenir au cours du traitement. La prudence est donc de rigueur lors de la conduite automobile ou l'utilisation de machines, jusqu'à la connaissance de la réponse individuelle au traitement.
Effets indésirablesL'incidence globale des effets indésirables et les taux d'interruptions dues aux effets indésirables rapportés dans le cadre de l'utilisation de l'éplérénone ont été similaires à ceux observés sous placebo, aussi bien au cours de l'étude EPHESUS qu'au cours de l'étude EMPHASIS-HF. L'effet indésirable le plus fréquemment signalé dans l'étude EPHESUS et l'étude EMPHASIS-HF était l'hyperkaliémie avec un taux d'incidence de respectivement 3.4% et 8.7% sous éplérénone.
Les effets indésirables sont classés par système d'organe et fréquence absolue. Les fréquences sont définies de la manière suivante: très fréquents (≥1/10), fréquents (≥1/100 à <1/10), occasionnels (≥1/1000 à <1/100), rares (≥1/10'000 à <1/1000), très rares (<1/10'000).
Infections et infestations
Fréquents: infection.
Occasionnels: pyélonéphrite, pharyngite.
Affections hématologiques et du système lymphatique
Occasionnels: éosinophilie.
Affections endocriniennes
Occasionnels: hypothyroïdie.
Troubles du métabolisme et de la nutrition
Fréquents: hyperkaliémie, déshydratation.
Occasionnels: hypercholestérolémie, hypertriglycéridémie, hyponatrémie.
Affections psychiatriques
Occasionnels: insomnie.
Affections du système nerveux
Fréquents: vertiges, syncope.
Occasionnels: céphalées, hypoesthésie.
Affections cardiaques
Fréquents: infarctus du myocarde.
Occasionnels: fibrillation auriculaire, insuffisance ventriculaire gauche.
Affections vasculaires
Fréquents: hypotension.
Occasionnels: hypotension orthostatique, thrombose artérielle de la jambe.
Affections respiratoires, thoraciques et médiastinales
Fréquents: toux.
Affections gastro-intestinales
Fréquents: diarrhée, nausée, constipation.
Occasionnels: flatulences, vomissements.
Affections hépatobiliaires
Occasionnels: cholécystite.
Affections de la peau et du tissu sous-cutané
Fréquents: prurit.
Occasionnels: hyperhidrose.
Affections musculosquelettiques et du tissu conjonctif
Fréquents: crampes musculaires, douleurs musculo-squelettiques.
Occasionnels: dorsalgie.
Affections du rein et des voies urinaires
Fréquents: troubles de la fonction rénale.
Troubles généraux
Occasionnels: asthénie, malaise.
Investigations
Fréquents: urée sanguine augmentée.
Occasionnels: créatinine sérique augmentée, diminution de la valeur de l'EGFR (epidermal growth factor receptor), taux de glycémie augmenté.
Dans l'étude EPHESUS, un nombre plus important de cas d'accident vasculaire cérébral a été observé dans le groupe des sujets âgés (≥75 ans) (éplérénone 4.9%, placebo 3.1%, p=0.10). Dans l'étude EMPHASIS-HF, le nombre d'accidents vasculaires cérébraux observés chez les patients âgés (≥75 ans) a été de n=9 (2.7%) dans le groupe éplérénone et de n=8 (2.4%) dans le groupe placebo.
Effets indésirables identifiés après la mise sur le marché
Expériences post-marketing
Depuis la mise sur le marché, les effets indésirables suivants ont également été observés:
Affections de la peau et du tissu sous-cutané: angioœdème, rash.
Affections des organes de reproduction et du sein: gynécomastie.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageAucun cas d'effets indésirables liés à un surdosage d'éplérénone n'a été rapporté chez l'être humain jusqu'ici. La manifestation la plus probable d'un surdosage chez l'être humain est une hypotension et une hyperkaliémie. L'éplérénone ne peut pas être éliminée par hémodialyse. Toutefois, elle se lie de manière importante au charbon activé. En cas d'hypotension symptomatique, un traitement symptomatique doit être instauré. En cas de survenue d'une hyperkaliémie, les mesures de traitement usuelles doivent être mises en œuvre.
Propriétés/EffetsCode ATC
C03DA04
Mécanisme d'action
Voir «Pharmacodynamique».
Pharmacodynamique
L'éplérénone présente une sélectivité relative dans sa fixation aux récepteurs minéralocorticoïdes humains recombinants en comparaison de sa fixation aux récepteurs humains recombinants aux glucocorticoïdes, à la progestérone et aux androgènes. L'éplérénone empêche la fixation de l'aldostérone.
Efficacité clinique
L'éplérénone a été évaluée dans l'étude «Eplerenone Post-Acute Myocardial Infarction Heart Failure Efficacy and Survival Study» (EPHESUS). EPHESUS est une étude multicentrique, en double aveugle et contrôlée par placebo, menée chez n=6632 patients (moyenne du suivi: 16 mois) ayant eu un infarctus du myocarde aigu, présentant une dysfonction ventriculaire gauche (avec une fraction d'éjection ventriculaire gauche [FEVG] ≤40%) et des signes cliniques d'insuffisance cardiaque. L'inclusion des patients après randomisation dans l'étude EPHESUS a eu lieu dans les 3 à 14 jours suivant la pose du diagnostic d'infarctus du myocarde. La durée moyenne jusqu'à l'inclusion était de 7 jours. En raison du risque cardiovasculaire accru associé au diabète, les patients diabétiques présentant une dysfonction ventriculaire gauche et sans symptômes d'insuffisance cardiaque ont été inclus dans l'étude; 10% de la population de l'étude remplissait ce critère. En plus d'un traitement standard, les patients ont reçu de l'éplérénone ou un placebo à une dose initiale de 25 mg une fois par jour, avec augmentation de la posologie en l'espace de 4 semaines jusqu'à la dose d'entretien de 50 mg une fois par jour si la kaliémie était <5.0 mEq/l. Pendant l'étude, les patients ont reçu un traitement standard comportant de l'aspirine (92%), des inhibiteurs de l'ECA (90%), des bêtabloquants (83%), des dérivés nitrés (72%), des diurétiques de l'anse (66%) ou des inhibiteurs de la HMG-CoA réductase (60%).
Dans l'étude EPHESUS, les critères primaires d'évaluation étaient la mortalité toutes causes confondues et un critère combiné de mortalité cardiovasculaire ou d'hospitalisation d'origine cardiovasculaire. 14.4% des patients recevant l'éplérénone et 16.7% des patients recevant le placebo sont décédés (toutes causes confondues), alors que 26.7% des patients recevant l'éplérénone et 30.0% des patients recevant le placebo ont présenté le critère combiné de mortalité cardiovasculaire ou d'hospitalisation d'origine cardiovasculaire. Ainsi, dans l'étude EPHESUS, l'éplérénone a réduit le risque de mortalité toutes causes confondues de 15% (réduction du risque absolu 2.3%, RR 0.85; intervalle de confiance à 95%, 0.75-0.96; p=0.008; NNT: 43) en comparaison du placebo, essentiellement en réduisant la mortalité cardiovasculaire. Le risque de mortalité cardiovasculaire ou d'hospitalisation d'origine cardiovasculaire a été réduit de 13% avec l'éplérénone (réduction du risque absolu 3.3%; RR 0.87; intervalle de confiance à 95%, 0.79-0.95; p=0.002; NNT: 31).
L'efficacité clinique d'un traitement par éplérénone a été démontrée essentiellement lorsque les patients étaient <75 ans. Les bénéfices du traitement chez les patients ≥75 ans sont incertains. La classification fonctionnelle de NYHA s'est améliorée ou est restée stable (p<0.001) pour une proportion significativement plus élevée de patients traités par éplérénone (n=2'372 patients, 75.3%) par rapport au groupe placebo (n=2242 patients, 71.3%).
Figure 1: Rapport des risques pour toutes les causes de mortalité par sous-groupe
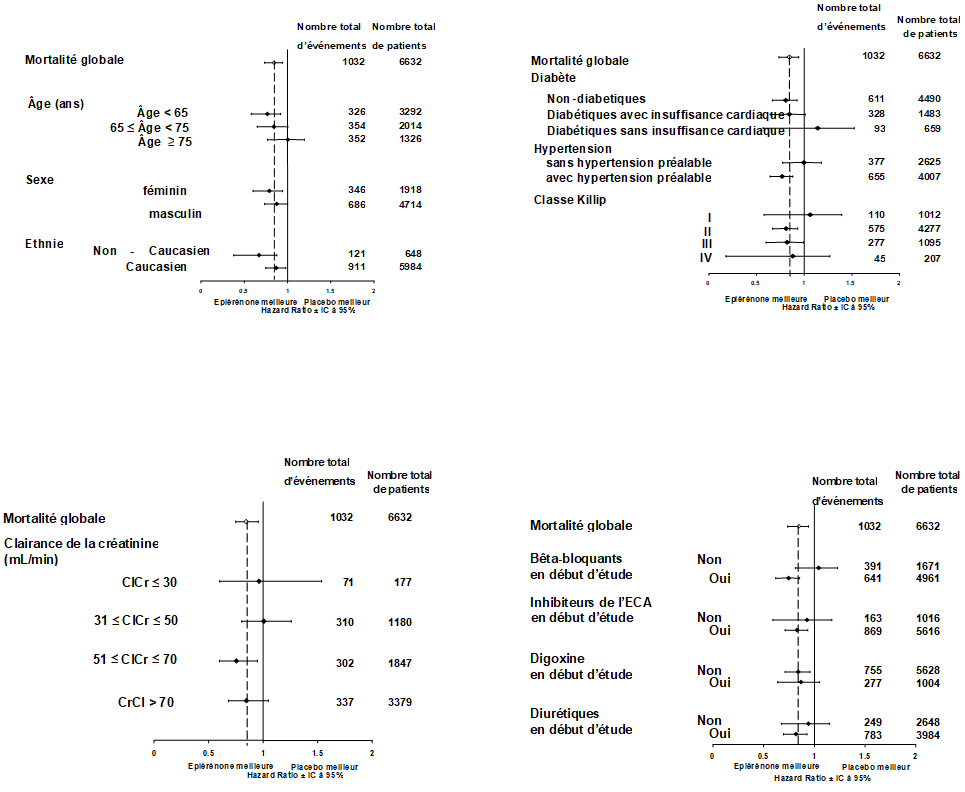
Dans l'étude EMPHASIS-HF (Eplerenone in Mild Patients Hospitalization and Survival Study in Heart Failure), l'éplérénone a été évaluée en complément à un traitement standard chez des patients présentant une insuffisance cardiaque systolique et des symptômes légers (classe fonctionnelle II selon la NYHA). Aucun patient des classes fonctionnelles III et IV selon la NYHA n'a été évalué dans l'étude.
Les patients inclus dans l'étude avaient ≥55 ans et présentaient une fraction d'éjection ventriculaire gauche (FEVG) ≤30% ou une FEVG ≤35% et en plus une durée du QRS >130 msec. En outre, les participants à l'étude devaient soit avoir été hospitalisés dans les 6 mois précédents pour une cause cardiovasculaire (CV), soit présenter un taux plasmatique de BNP ≥250 pg/ml ou un taux de pro-BNP ≥500 pg/ml (hommes) ou ≥750 pg/ml (femmes). Le traitement par l'éplérénone a été commencé à la posologie de 25 mg une fois par jour, posologie qui a été augmentée à 50 mg une fois par jour après 4 semaines dans la mesure où les taux sériques de potassium étaient <5.0 mmol/l et le TFGe ≥50 ml/min. Comme alternative, si le taux de filtration glomérulaire estimé était compris entre 30 et 49 ml/min/1.73 m2, le traitement par l'éplérénone a été commencé à la posologie de 25 mg tous les 2 jours, posologie qui a pu être augmentée à 25 mg une fois par jour.
Les médicaments cardiovasculaires les plus fréquemment associés à l'éplérénone ou au placebo chez l'ensemble des n=2737 participants à l'étude ont été des diurétiques (85%), des inhibiteurs de l'ECA (78%), des antagonistes des récepteurs de l'angiotensine II (19%), des bêtabloquants (87%), des médicaments antithrombotiques (88%), des hypolipémiants (63%) et des alcaloïdes de la digitale (27%). La FEVG moyenne était de 26% et la durée moyenne du QRS était d'environ 122 msec. La plupart des patients (83.4%) avaient été hospitalisés pour des causes cardiovasculaires dans les 6 derniers mois précédant la randomisation et env. 50% pour une insuffisance cardiaque. Environ 20% des patients étaient pourvus d'un défibrillateur implanté ou bénéficiaient d'un traitement de resynchronisation cardiaque.
Le critère d'évaluation principal (décès d'origine cardiovasculaire ou hospitalisation pour insuffisance cardiaque) a été observé chez n=249 patients (18.3%) du groupe éplérénone et chez n=356 patients (25.9%) du groupe placebo (RR 0.63, IC à 95%, 0.54-0.74; p<0.001). Ce résultat a été cohérent dans tous les sous-groupes étudiés.
Le critère d'évaluation secondaire, à savoir la mortalité toutes causes confondues, a été observé chez n=171 patients (12.5%) du groupe éplérénone et chez n=213 patients (15.5%) du groupe placebo (RR 0.76; IC à 95%, 0.62-0.93; p=0.008). Un décès d'origine cardiovasculaire a été rapporté chez n=147 patients (10.8%) du groupe éplérénone et chez n=185 patients (13.5%) du groupe placebo (RR 0.76; IC à 95%, 0.61-0.94; p=0.01).
Une hyperkaliémie (taux sérique de potassium >5.5 mmol/l) a été rapportée au cours de l'étude chez n=158 patients (11.8%) du groupe éplérénone et chez n=96 patients (7.2%) du groupe placebo (p<0.001). Une hypokaliémie, définie comme un taux sérique de potassium <4.0 mmol/l, est survenue plus rarement avec l'éplérénone qu'avec le placebo (38.9% avec l'éplérénone en comparaison de 48.4% avec le placebo, p<0.0001).
PharmacocinétiqueAbsorption
La biodisponibilité absolue de l'éplérénone est de 69%. Les concentrations plasmatiques maximales sont atteintes environ 1.5-2 h après la prise orale d'éplérénone. L'absorption au niveau de la partie terminale de l'iléon et du côlon a lieu avec un retard de 3 à 4 h. Les pics plasmatiques (Cmax) et l'aire sous la courbe (ASC) sont proportionnels à la dose dans l'intervalle de doses allant de 10 mg à 100 mg, et moins proportionnels aux doses supérieures à 100 mg. L'absorption n'est pas influencée par les aliments.
Distribution
La liaison de l'éplérénone aux protéines plasmatiques est d'environ 50% et a lieu essentiellement avec l'alpha 1-glycoprotéine acide. Le volume de distribution apparent à l'état d'équilibre est estimé à 42-90 l. L'éplérénone ne se fixe pas de manière préférentielle sur les hématies.
Métabolisme
L'éplérénone est métabolisée principalement par le cytochrome P450 (CYP) 3A4. Aucun métabolite actif de l'éplérénone n'a été identifié dans le plasma humain.
Élimination
La demi-vie d'élimination se situe entre 4-6 h. La clairance plasmatique apparente est d'environ 10 l/h. L'état d'équilibre est atteint en 2 jours. Moins de 5% d'une dose d'éplérénone sont retrouvés sous forme inchangée dans les urines et les fèces. Après une dose orale unique d'éplérénone radiomarquée, environ 32% de la dose sont excrétés dans les fèces et environ 67% dans les urines.
Cinétique pour certains groupes de patients
Âge, sexe et race
La pharmacocinétique de l'éplérénone n'était pas significativement différente entre les hommes et les femmes. À l'état d'équilibre, des augmentations de la Cmax (22%) et de l'ASC (45%) ont été observées chez les personnes âgées par rapport aux volontaires plus jeunes (18 à 45 ans). À l'état d'équilibre, la Cmax a été inférieure de 19% et l'ASC de 26% chez les sujets à la peau noire (voir «Posologie/Mode d'emploi»).
Troubles de la fonction hépatique
La pharmacocinétique de l'éplérénone à la posologie de 400 mg a été étudiée chez des patients atteints d'insuffisance hépatique modérée (Child-Pugh B) et comparée à celle de volontaires sains. La Cmax à l'état d'équilibre était augmentée de 3.6% et l'ASC de 42% (voir «Posologie/Mode d'emploi»).
Troubles de la fonction rénale
sains, l'ASC à l'état d'équilibre était augmentée de 38% et la Cmax de 24% chez les patients atteints d'insuffisance rénale sévère, et diminuées de 26% et 3% respectivement chez les patients sous hémodialyse. Aucune corrélation entre la clairance plasmatique de l'éplérénone et la clairance de la créatinine n'a été observée. L'éplérénone n'est pas éliminée par hémodialyse (voir «Mises en garde et précautions»).
Insuffisance cardiaque
La pharmacocinétique de l'éplérénone à la posologie de 50 mg a été étudiée chez des patients souffrant d'insuffisance cardiaque (classification II-IV de la NYHA). Par rapport aux volontaires sains d'âge, de poids et de sexe identiques, l'ASC à l'état d'équilibre était augmentée de 38% et la Cmax de 30% chez les patients atteints d'insuffisance cardiaque. Conformément à ces résultats, une analyse pharmacocinétique de population basée sur un sous-ensemble de patients de l'étude EPHESUS a montré que la clairance de l'éplérénone chez les patients atteints d'insuffisance cardiaque était similaire à celle de volontaires âgés sains.
Données précliniquesLes investigations précliniques de sécurité pharmacologique, de toxicité en administration répétée, de génotoxicité, de carcinogénicité et de toxicité pour la reproduction n'ont pas révélé de risque particulier pour l'homme.
Les études menées chez le rat et le lapin n'ont pas montré d'effet tératogène. Toutefois, une baisse du poids corporel et une augmentation des résorptions fœtales ainsi qu'une augmentation des avortements (perte après nidation) ont été observées chez les lapines à la plus haute dose appliquée. Le risque potentiel pour l'être humain est inconnu.
Des données précliniques montrent que l'éplérénone et/ou ses métabolites sont présents dans le lait maternel des rates.
Dans les études de toxicologie en administration répétée menées chez le rat et le chien, une atrophie de la prostate a été observée à des niveaux d'exposition de plusieurs fois supérieurs aux niveaux d'exposition clinique. Les modifications de la prostate n'étaient pas accompagnées de conséquences fonctionnelles délétères. La signification clinique de ces résultats est incertaine.
Remarques particulièresStabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques particulières concernant le stockage
Conserver à température ambiante (15-25 °C) et hors de portée des enfants.
Numéro d’autorisation57147 (Swissmedic).
PrésentationInspra 25 mg: emballages de 30 et 100 comprimés pelliculés. [B]
Inspra 50 mg: emballages de 30 et 100 comprimés pelliculés. [B]
Titulaire de l’autorisationViatris Pharma GmbH, 6312 Steinhausen.
Mise à jour de l’informationMars 2024.
Version 102 F
|

